Zahnärztliche Behandlung nach der Honeymoon-Phase
Barbe
Aktuelle epidemiologische Erhebungen gehen für Deutschland von etwa 300.000 bis 400.000 erkrankten Patienten aus. Weltweit wird bereits von einer zu erwartenden Parkinson-Pandemie gesprochen [de Lau and Breteler, 2006; Dorsey and Bloem, 2018]. Da Morbus Parkinson mit Einschränkungen und Problemen hinsichtlich der Mundgesundheit einhergeht, werden Zahnärzte und ihre Praxisteams künftig bei der zahnärztlichen Behandlung vermehrt mit der Erkrankung und deren Management in Kontakt kommen. Daher ist es von Vorteil, wenn sie sich mit den Besonderheiten der Erkrankung an sich, aber auch mit den Auswirkungen auf die Mundgesundheit auseinandersetzen.
Definition der Erkrankung
Morbus Parkinson ist eine chronisch fortschreitende Erkrankung, charakterisiert durch das Absterben Dopamin-produzierender Nervenzellen in der Substantia nigra, einer Struktur des Mittelhirns [Lang and Lozano, 1998]. Sie beginnt meist zwischen dem 60. und dem 65. Lebensjahr, kann aber in Einzelfällen bereits vor dem 40. Lebensjahr auftreten („Young-onset Parkinson‘s disease). Charakterisiert ist die Erkrankung durch die motorischen Kardinalsymptome Rigor (Muskelsteifigkeit), Bradykinese (verlangsamte Bewegungen) bis hin zur Akinese (Bewegungslosigkeit), Tremor (Zittern) und posturale Instabilität (Haltungsstabilität) [Lees et al., 2009]. Viel Beachtung fanden in den vergangenen Jahren auch die nicht-motorischen Symptome wie beispielsweise Depression, Apathie, Schlafstörungen und erektile Dysfunktion [Shulman et al., 2002; Chaudhuri and Schapira, 2009].
Die Vielzahl der unterschiedlichen Symptome hat neben der offensichtlichen großen Auswirkung auf das Allgemeinbefinden und die Organisation des Alltags der Betroffenen und ihrer Angehörigen auch Einfluss auf die Fähigkeit zur Mundhygiene, die Organisation des Besuchs der Zahnarztpraxis und die praktische zahnärztliche Behandlung und Therapieplanung. Neben den motorischen Einschränkungen (insbesondere in den späteren Krankheitsphasen), die das Zähneputzen erschweren, können Probleme wie fehlende Selbstwahrnehmung, kognitive oder Antriebsstörungen einer optimalen häuslichen Mundhygiene zusätzlich entgegenstehen.
Therapiemöglichkeiten
Unterschieden werden kann zwischen einer prämotorischen und einer motorischen Krankheitsphase. In der prämotorischen Phase, das heißt vor Ausbruch der Kardinalsymptome, klagen viele Patienten über Riechdefizite, Schlafstörungen oder Verdauungsprobleme [Braak et al., 2005]. Diese sogenannten Frühsymptome treten lange vor den typischen motorischen Auffälligkeiten auf.
Zu Beginn der motorischen Phase gibt es zunächst eine in der Regel gut zu therapierende Zeitspanne von etwa sieben bis zehn Jahren, „Honeymoon-Phase“ genannt. Aus klinischer Erfahrung unterscheidet sich die zahnärztliche Therapieplanung und Behandlung in dieser Zeitspanne wenig von der eines gesunden gleichaltrigen Patienten. Es besteht ein gutes Ansprechen auf die Parkinson-Medikation, die Symptome werden fast vollständig kompensiert und die Patienten fühlen sich nur minimal beeinträchtigt. Therapeutisch werden initial zumeist L-Dopa (über 70-jährige Patienten) oder Dopaminagonisten (jüngere Patienten) eingesetzt, im Verlauf stehen auch andere Substanzgruppen zur Verfügung, zum Beispiel COMT- oder MAO-Hemmer. Die medikamentöse Therapie unterdrückt die Symptome und stellt keine kausale Therapie dar. Wichtig für die zahnärztliche Behandlung ist bei der Therapie mit L-Dopa-haltigen Mitteln, dass nur Lokalanästhetika ohne Adrenalinzusätze verwendet werden (wie Mepivacain). L-Dopa beziehungsweise das daraus entstehende Dopamin sensibilisiert die Herzmuskulatur gegenüber Adrenalin, was bei Adrenalin-haltiger Lokalanästhesie dann häufiger zu Herzrhythmusstörungen führen kann.
Nach der Honeymoon-Phase kommt es zu einer deutlichen Verschlechterung der Symptome mit Wirkschwankungen [Stocchi et al., 2010] und zu einem gehäuften Auftreten von kognitiv-mnestischen Defiziten und gegebenenfalls auch zu psychiatrischen Symptomen. Auch für die zahnärztliche Behandlung stellt dieser Übergang von der Honeymoon-Phase zur Phase mit vermehrten Wirkschwankungen einen Wendepunkt dar.
Der Übergang in diese Phase ist oft nicht vorherzusehen und kann relativ rasch erfolgen, mit einer drastischen Verschlechterung der Mundhygienefähigkeit und einem negativen Einfluss auf die Mundgesundheit. Eigene Untersuchungen zeigen, dass die Häufigkeit der mundgesundheitsspezifischen Symptome wie Mundtrockenheit, vermehrter Speichelfluss (Drooling) oder Schluckstörungen (Dysphagie) nach etwa acht Jahren deutlich ansteigt [Barbe, Heinzler et al., 2017].
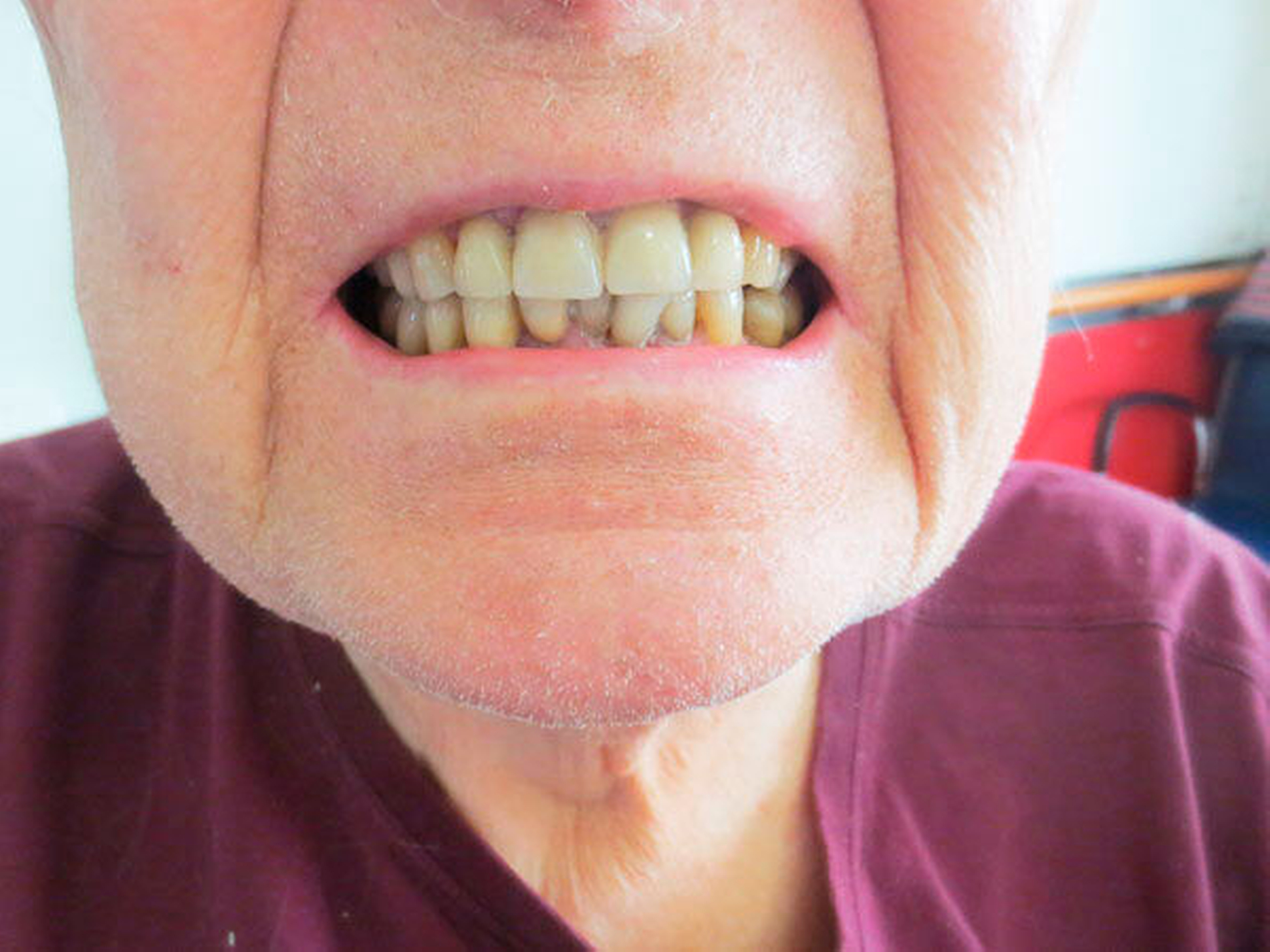
Mit dem Beginn der späteren Krankheitsphasen können die Erreichbarkeit der Praxis, die mögliche Dauer der Therapiesitzungen und die Lagerung auf dem Behandlungsstuhl schwieriger werden. Es bietet sich an, gerade in diesem Zeitraum etwa bei der Recall-Planung kürzere Intervalle und kürzere Termine in Erwägung zu ziehen und auch die Frequenz von PZR und zahnärztlicher Untersuchung zu erhöhen [Muller et al., 2011], selbst wenn noch kein akutes zahnmedizinisches Problem vorliegt. Sicher spielt auch eine Rolle, dass bei der Selbstwahrnehmung der Patienten die Mundhöhle häufig – verständlicherweise – ein untergeordnetes Problem darstellt, insbesondere im Zusammenspiel mit der Verschlechterung der anderen Symptome, die einen Hauptteil der Aufmerksamkeit beanspruchen [Barbe, Heinzler et al., 2017]. Hier kann ein geschultes Praxisteam helfen, im Rahmen von häufiger Remotivation auch die Angehörigen für die Probleme zu sensibilisieren. In diversen Arbeiten konnte gezeigt werden, dass Parkinsonpatienten häufiger als die Normalbevölkerung insbesondere an unbehandelter Karies und Parodontitis sowie an Mundgeruch leiden [Hanaoka and Kashihara, 2009; Pradeep et al., 2015; Barbe, Deutscher et al., 2017], zudem treten gehäuft das Burning-Mouth-Syndrom, Kauprobleme und Bruxismus auf [Clifford and Finnerty, 1995; Zlotnik et al., 2015] (Abbildung 1).
Auch die Kaufunktion ist in den späteren Krankheitsphasen oftmals gestört, da die Kiefermobilität und die Geschwindigkeit der Kieferbewegungen im Rahmen der motorischen Symptomatik reduziert sind. Rigidität, die eingeschränkte Mobilität von Kiefer und Zunge sowie gegebenenfalls Zittern des Kiefers verhindern den optimalen Kauprozess sowie den Schluckakt [Bakke et al., 2011]. Die Patienten zeigen häufig Probleme hinsichtlich des Prothesenhalts, außerdem treten oft Druckstellen im Zusammenhang mit der prothetischen Versorgung auf, wobei der Verlust der neuromuskulären Kontrolle einer der Hauptfaktoren für den eingeschränkten Prothesenhalt ist [Clifford and Finnerty, 1995; Nakayama et al., 2004]. Die eingeschränkte Kaufunktion in Kombination mit Prothesen-bedingten Beschwerden trägt zu den Ernährungs- und Schluckbeschwerden maßgeblich bei [Lorefalt et al. 2006].
Tiefe Hirnstimulation: Wenn die Therapie mit L-Dopa im Verlauf zu Wirkschwankungen führt, können andere Therapien eingesetzt werden, um die Symptome weiterhin bestmöglich zu unterdrücken. Hier haben sich die Tiefe Hirnstimulation als operatives Verfahren sowie die Apomorphin- oder Duodopapumpe als invasive Therapieoptionen etabliert [Pedrosa and Timmermann, 2013].
In späteren Krankheitsphasen ist die größte Herausforderung, einen konstanten Wirkspiegel der Parkinson-Medikamente herzustellen und damit die motorischen Schwankungen und/oder Dyskinesien möglichst gering zu halten. Bei der Apomorphinpumpe wird der Dopaminagonist subkutan appliziert, wobei der Wirkspiegel im Plasma in weniger als zehn Minuten erreicht wird. Hierbei stehen zwei verschiedene Methoden zur Verfügung: entweder die subkutane Apomorphininjektion bei Bedarf (APO-Pen) oder die kontinuierliche Injektion durch die Pumpe. Bei der Duodopapumpe wird L-Dopa durch eine PEG kontinuierlich in den Dünndarm abgegeben.
In den vergangenen Jahren hat sich zunehmend das operative Therapieverfahren der Tiefen Hirnstimulation etabliert. Durch eine hochfrequente elektrische Reizung im Zielgebiet kann die Nervenzellaktivität im erkrankten Hirnareal reversibel blockiert werden. Für die dauerhafte elektrische Reizung wird eine Stimulationselektrode meist bi-hemisphärisch in das Zielgebiet implantiert und mit einem Generator verbunden. Dieser wird unterhalb des Schlüsselbeins eingesetzt, das Schrittmachersystem wird mithilfe eines Programmiergeräts telemetrisch eingestellt. So kann durch eine Veränderung der elektrischen Parameter die Wirkung verstärkt oder abgeschwächt werden [Pedrosa and Timmermann, 2013] (Abbildung 2).
Für die zahnärztliche Behandlung ist zu beachten, dass bei Parkinsonpatienten mit Tiefer Hirnstimulation die Möglichkeit schwerwiegender neurologischer Komplikationen nach Diathermieanwendung besteht, wodurch dies während der Behandlung kontraindiziert erscheint [Nutt et al., 2001; Roark et al., 2008].
Ebenso kann die Nutzung elektrischer Kauter in einem Komponentenversagen des Stimulators enden, aber das THS-System kann für die Dauer der Zahnarztbehandlung durch den Neurologen ausgeschaltet werden, was aber wieder mit einer Zunahme der motorischen Symptome verbunden ist.
###more### ###title###
###title### ###more###
Speichelfluss und Schlucken
Die Patienten leiden häufig sowohl an subjektiver (Xerostomie) als auch an objektiver (Hyposalivation) Mundtrockenheit [Barbe, Heinzler et al., 2017], was die Lebensqualität negativ beeinflusst (Abbildung 3). Die genauen Mechanismen hierfür sind noch ungeklärt, eigene, noch nicht veröffentlichte Untersuchungen deuten darauf hin, dass die Dopaminagonisten eine maßgebliche Rolle bei der Entstehung der Mundtrockenheit spielen. Dies wird möglicherweise unterstützt durch eine krankheitsbedingte autonome Dysfunktion. Die Auswirkungen der Mundtrockenheit auf die Mundgesundheit, Diagnosefindung und Therapiemöglichkeiten sind ausführlich beschrieben. So stehen verschiedenste Produkte wie Mundspüllösungen, Mundgele, Zahnpasten und Mundsprays sowie Speichelersatz zur Verfügung, die den Patienten symptomatische Linderung verschaffen sollen. Hierbei zeigt die klinische Erfahrung, dass sich die Auswahl der Produkte durch Behandler und Patient maßgeblich nach dem Geschmack und dem Preis richtet und zum jetzigen Zeitpunkt aus Patientensicht häufig nur eine eher kurzfristige Hilfestellung bietet (etwa vor Terminen, bei denen viel gesprochen werden muss). Es besteht also dringender Entwicklungsbedarf hinsichtlich sozial-verträglicher Darreichungsformen für die dauerhafte Anwendung, die auch die patientenbezogenen Bedürfnisse und Präferenzen stärker mit einbezieht.
Viele Patienten mit Morbus Parkinson leiden unter dem sogenannten Drooling, was bedeutet, dass der Speichel insbesondere in den späteren Krankheitsphasen ungewollt aus dem Mund läuft, was häufig zum sozialen Rückzug der Betroffenen führt (Abbildung 4). Drooling trägt zur Entstehung von perioraler Dermatitis und Halitosis bei und kann die Mundhygienefähigkeit zusätzlich reduzieren. Zudem besteht ein höheres Risiko für Atemwegsinfektionen („stille Aspiration“) [Srivanitchapoom et al., 2014]. Untersuchungen konnten zeigen, dass dieses Symptom nicht durch eine Überproduktion von Speichel, sondern eher durch im Krankheitsverlauf auftretende Schluckbeschwerden und eine eingeschränkte Gesichtsmuskelkontrolle verursacht wird (Pseudohypersalivation) [Fasano et al., 2015].
Verwirrend mag erscheinen, dass die Patienten trotz des scheinbaren Speichelüberflusses in Form des Droolings gleichzeitig an einer Mundtrockenheit leiden können. Vermutlich werden die auftretenden Schluckbeschwerden durch die bestehende Mundtrockenheit noch verstärkt, was zu einer komplizierten Interaktion der Symptome Drooling, Mundtrockenheit und Dysphagie führt. Dysphagie ist assoziiert mit Gewichtsverlust, Malnutrition, Dehydrierung und erhöhten Mortalitätsraten aufgrund auftretender Aspirationspneumonien. Parkinsonpatienten wechseln im Krankheitsverlauf oft von normaler Ernährung hin zu weichen Speisen und eher flüssig-klebrigen Nahrungsmitteln. Hierdurch verändert sich der Nährwert, aber auch der Einfluss auf die Mundgesundheit [Pace and McCullough, 2010; Ortega et al., 2015]. Hier sind oftmals der Zahnarzt und das Praxisteam die ersten Ansprechpartner, die diesen Einfluss erkennen und dann präventiv agieren können. Darüber hinaus können weitere Maßnahmen initiiert werden, wie zum Beispiel die Überweisung zu einem spezialisierten Logopäden. Ist der Patient bereits wegen Dysphagie in therapeutischer Behandlung, kann es hilfreich sein, mit dem Therapeuten Rücksprache zu halten, um das klinische Bild des Betroffenen besser einschätzen zu können. Hier können zum Beispiel Hinweise zum Speichelmanagement des Betroffenen sowie die Auskunft zur individuellen Gefahr von laryngealer Penetration oder Aspiration gegeben werden. Aus dem therapeutischen Kontext heraus können Hilfen für den Patienten im Rahmen der zahnärztlichen Behandlung benannt werden (Lagerung/Kopfposition, spezifische verbale Instruktion, möglichst kurze orale Stimulation und mehr).
Häufig unterschätzt wird der Einfluss des Drooling und der Dysphagie auf die praktische Behandlungsdurchführung. Hier kann das Team bereits vorab darauf achten, dass der Patient nicht zu tief gelagert wird und der Kopf auf eine Seite geneigt ist, damit der Speichel problemlos ablaufen kann, um eine mögliche Aspiration zu verhindern. Eine erfahrene Stuhlassistenz ist in diesen Fällen sicher hilfreich und kann bereits bei der Planung berücksichtigt werden.
Zahnärztliche Behandlung
Eigene Befragungen bei 100 Parkinson-Patienten ergaben, dass die Befragten ihre zahnärztliche Versorgung und Betreuung grundsätzlich als gut einschätzen und damit sehr zufrieden sind [Barbe et al., 2016]. Dennoch zeigte sich noch Verbesserungsbedarf bei der Beratungs- und Informationsqualität hinsichtlich der krankheitsspezifischen Symptome Mundtrockenheit und Drooling. Somit kann insbesondere im Hinblick auf die steigende Zahl an Senioren eine gute Vorbereitung und Sensibilisierung aller mit Senioren in Kontakt kommenden Praxismitarbeiter nur von Vorteil sein. Als Wegweiser für die Praxisplanung kann der „Gerostomatologische Wohlfühlfaktor“ dienen, der sich unter anderem durch die gute Erreichbarkeit, fehlende Stolperfallen sowie die Bereitstellung von seniorengerechten Hilfsmitteln auszeichnet [Nitschke et al., 2015]. Eine vorausschauende Terminvergabe kann die Behandlung für alle Beteiligten deutlich erleichtern: 60 bis 90 Minuten nach Einnahme der Parkinson-Medikamente wirken diese am effektivsten. Eine ruhige Atmosphäre hilft, Unsicherheiten und Aufregung zu vermeiden, da sonst häufig Hyperkinesien ausgelöst werden können. Da in der Fülle der Beschwerden die Mundgesundheit bei Patienten und Angehörigen häufig eine untergeordnete Rolle spielt, sollten Behandler und ihre Teams proaktiv nach den Parkinson-spezifischen Einschränkungen der Mundgesundheit und Hygienefähigkeit fragen, dies kann gegebenenfalls mit regelmäßig zu aktualisierenden Fragebögen geschehen. Diese sollten die Hauptsymptome Mundhygienefähigkeit, Zuckerkonsum/Ernährung, Speichelprobleme, Dysphagie, Depressionen, kognitive Probleme sowie Veränderungen in der sozialen Versorgungssituation abdecken. Diese Information ermöglicht ein präventionsorientiertes Vorgehen, das dazu beitragen kann, die Mundgesundheit und damit die Lebensqualität möglichst lange zu erhalten.
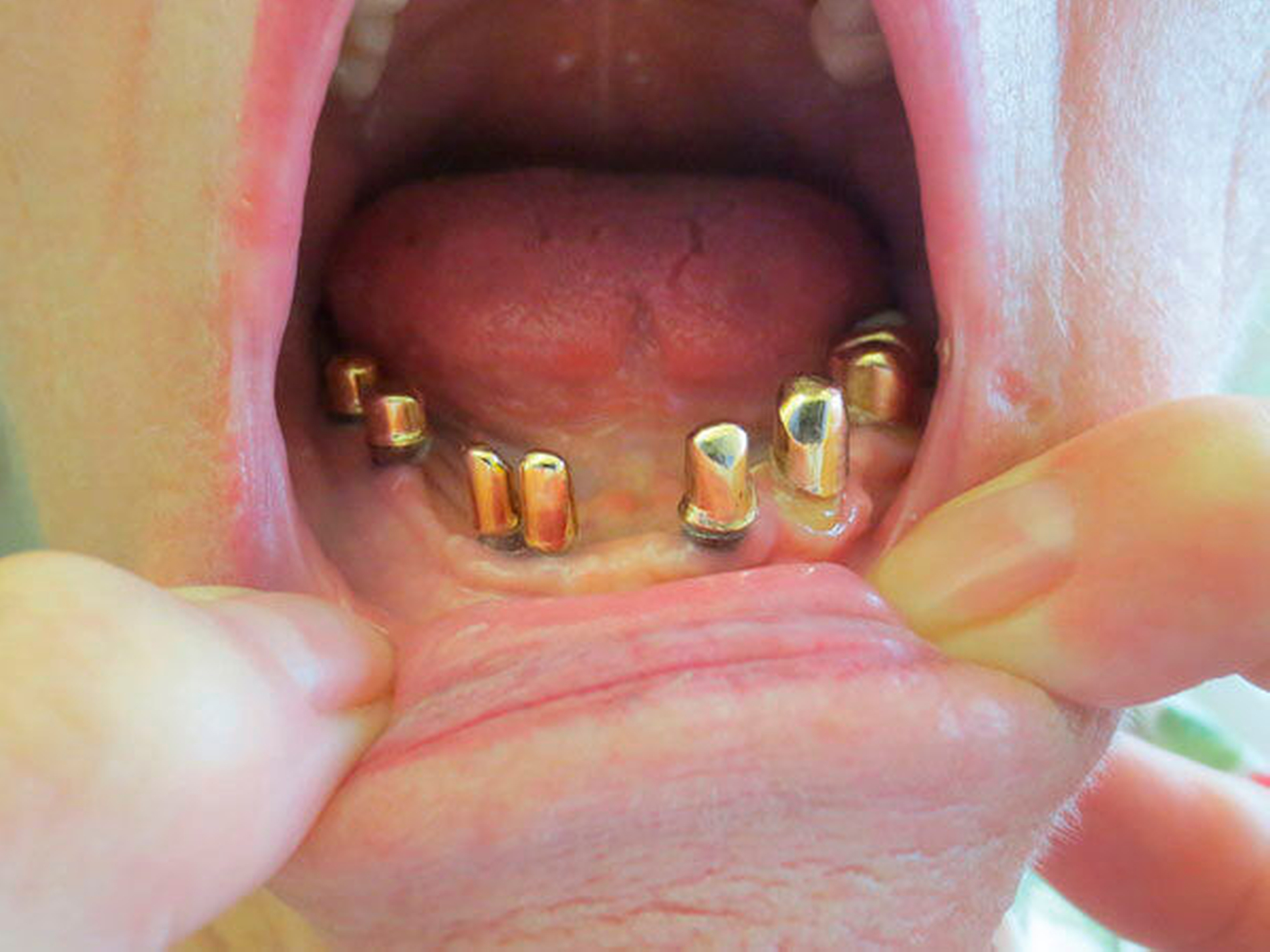
Behandlungsplanung, genaue Dauer und Anzahl der Termine sollten mit den Patienten und den Angehörigen transparent kommuniziert werden. Therapieentscheidungen und die Organisation der Termine brauchen häufig die Mithilfe von Angehörigen, ebenso können diese frühzeitig Rückmeldung über mögliche Veränderungen im Krankheitsverlauf geben [Muller, 2014]. Bei der Herstellung neuer Prothesen sollte Wert darauf gelegt werden, dass diese auch für spätere Krankheitsphasen praktikabel sind, sowohl für die Patienten selbst als auch für die Angehörigen und Pflegekräfte, die die Versorgung erwartbar übernehmen werden (Abbildung 5).
Barbe
Zahnmedizinische funktionelle Kapazität
Die zahnmedizinische funktionelle Kapazität stellt ein oralgeriatrisches Erhebungsinstrument dar, das neben dem Nutzen bei wissenschaftlichen Betrachtungen auch für den speziellen Patienten im Praxisalltag gut anwendbar ist und zur Prüfung der Belastbarkeit älterer Patienten bei der zahnärztlichen Behandlung, seiner Mundhygienefähigkeit und der mundgesundheitsbezogenen Eigenverantwortlichkeit eingesetzt werden kann. Dieses Erhebungsinstrument kann auch dem Praxisteam helfen, die Patienten und deren Belastbarkeit in Bezug auf die zahnmedizinische Behandlung einfach und schnell zu evaluieren und die geplante Therapie dementsprechend individuell anzupassen [Jordan et al., 2014; Nitschke, 2016].
Wichtig ist hierbei, wie beschrieben, eine kontinuierliche Anpassung der Hilfsmittel und Empfehlungen an die aktuellen, sich verändernden Fähigkeiten der Patienten, insbesondere unter Einbeziehung der Angehörigen beziehungsweise Pflegekräfte. Elektrische Zahnbürsten, Griffhilfen oder Dreikopfzahnbürsten und weitere speziell für Senioren mit manuellen Einschränkungen entwickelte Produkte stellen Möglichkeiten zur Optimierung der häuslichen Mundpflege dar, des Weiteren gibt es zahlreiche Produkte, die die zahnärztliche Behandlung vereinfachen können [Spatzier, 2017]. Eine individuelle und risikoorientierte Recallplanung hilft dabei, sich unter Umständen rapide verschlechternde Bedingungen nicht zu übersehen.
Fazit
Parkinson-Patienten haben ein erhöhtes Risiko für eine eingeschränkte Mundgesundheit, insbesondere in späteren Krankheitsphasen.
Der Übergang von früher zu später Krankheitsphase kann plötzlich auftreten. Regelmäßige und engmaschige Recalltermine können helfen, diese Übergänge nicht zu verpassen.
Die komplizierte Interaktion der Symptome Mundtrockenheit, Drooling und Dysphagie stellt eine große Herausforderung hinsichtlich Behandlungsplanung und Therapie für den behandelnden Zahnarzt dar, ein Hinzuziehen von anderen Fachdisziplinen (wie Logopädie) ist in vielen Fällen sinnvoll.
Die individuelle Behandlungsplanung im Sinne des gerostomatologischen Wohlfühlfaktors kann helfen, die Behandlung für alle Seiten so angenehm wie möglich zu gestalten, und kann helfen, Komplikationen zu vermeiden (Lagerung, Lokalanästhetika, Interaktionen mit Tiefer Hirnstimulation).
Auch wenn die Mundgesundheit in der Selbst-/Wahrnehmung der Patienten und der Angehörigen eine eher untergeordnete Rolle im Vergleich zur Primärerkrankung spielt, ist es die Aufgabe des Zahnarztes und des Teams, möglichst frühzeitig präventiv tätig zu sein und die Mundgesundheit und damit auch die mundgesundheitsbezogene Lebensqualität bestmöglich zu erhalten.
Dr. Dr. Greta BarbeFachbereich ParodontologieSpezialistin Seniorenzahnmedizin (APW) Leitung AG SeniorenzahnmedizinPoliklinik für Zahnerhaltung und Parodontologie, Uniklinik KölnKerpener Str. 3250931 Kölnanna.barbe@uk-koeln.de
Prof. Dr. Michael NoackDirektor der Poliklinik für Zahnerhaltung und Parodontologie, Uniklinik KölnKerpener Str. 3250931 Köln
###more### ###title### Literaturliste ###title### ###more###
Literaturliste
Bakke, M., S. L. Larsen, C. Lautrup and M. Karlsborg (2011). „Orofacial function and oral health in patients with Parkinson‘s disease.“ Eur J Oral Sci 119(1): 27–32.
Barbe, A. G., N. Bock, S. H. Derman, M. Felsch, L. Timmermann and M. J. Noack (2016). „Self-assessment of oral health, dental health care and oral health-related quality of life among Parkinson‘s disease patients.“ Gerodontology.
Barbe, A. G., D. H. C. Deutscher, S. H. M. Derman, M. Hellmich and M. J. Noack (2017). „Subjective and objective halitosis among patients with Parkinson‘s disease.“ Gerodontology.
Barbe, A. G., A. Heinzler, S. Derman, M. Hellmich, L. Timmermann and M. J. Noack (2017). „Hyposalivation and xerostomia among Parkinson‘s disease patients and its impact on quality of life.“ Oral Dis 23(4): 464–470.
Braak, H., U. Rub, E. N. Jansen Steur, K. Del Tredici and R. A. de Vos (2005). „Cognitive status correlates with neuropathologic stage in Parkinson disease.“ Neurology 64(8): 1404–1410.
Chaudhuri, K. R. and A. H. Schapira (2009). „Non-motor symptoms of Parkinson‘s disease: dopaminergic pathophysiology and treatment.“ Lancet Neurol 8(5): 464–474.
Clifford, T. and J. Finnerty (1995). „The dental awareness and needs of a Parkinson‘s disease population.“ Gerodontology 12(12): 99–103.
de Lau, L. M. and M. M. Breteler (2006). „Epidemiology of Parkinson‘s disease.“ Lancet Neurol 5(6): 525–535.
Dorsey, E. R. and B. R. Bloem (2018). „The Parkinson Pandemic-A Call to Action.“ JAMA Neurol 75(1): 9–10.
Fasano, A., N. P. Visanji, L. W. Liu, A. E. Lang and R. F. Pfeiffer (2015). „Gastrointestinal dysfunction in Parkinson‘s disease.“ Lancet Neurol 14(6): 625–639.
Hanaoka, A. and K. Kashihara (2009). „Increased frequencies of caries, periodontal disease and tooth loss in patients with Parkinson‘s disease.“ J Clin Neurosci 16(10): 1279–1282.
Jordan, R. A., C. Bodechtel, K. Hertrampf, T. Hoffmann, T. Kocher, I. Nitschke, U. Schiffner, H. Stark, S. Zimmer, W. Micheelis and D. V. S. I. Group (2014). „The Fifth German Oral Health Study (Funfte Deutsche Mundgesundheitsstudie, DMS V) – rationale, design, and methods.“ BMC Oral Health 14: 161.
Lang, A. E. and A. M. Lozano (1998). „Parkinson‘s disease. First of two parts.“ N Engl J Med 339(15): 1044–1053.
Lees, A. J., J. Hardy and T. Revesz (2009). „Parkinson‘s disease.“ Lancet 373(9680): 2055–2066.
Lorefalt, B., A. K. Granerus and M. Unosson (2006). „Avoidance of solid food in weight losing older patients with Parkinson‘s disease.“ J Clin Nurs 15(11): 1404–1412.
Muller, F. (2014). „Interventions for edentate elders--what is the evidence?“ Gerodontology 31 Suppl 1: 44–51.
Muller, T., R. Palluch and J. Jackowski (2011). „Caries and periodontal disease in patients with Parkinson‘s disease.“ Spec Care Dentist 31(5): 178–181.
Nakayama, Y., M. Washio and M. Mori (2004). „Oral health conditions in patients with Parkinson‘s disease.“ J Epidemiol 14(5): 143–150.
Nitschke, I. (2016). Krankheits- und Versorgungsprävalenzen bei Älteren Senioren (75– bis 100-Jährige): Zahnmedizinische funktionelle Kapazität. Fünfte Deutsche Mundgesundheitsstudie (DMS V). Köln, Institut der Deutschen Zahnärzte (IDZ), Deutscher Zahnärzte Verlag DÄV.
Nitschke, I., A. Stillhart and J. Kunze (2015). „Utilization of dental services in old age.“ Swiss Dent J 125(4): 433–447.
Nutt, J. G., V. C. Anderson, J. H. Peacock, J. P. Hammerstad and K. J. Burchiel (2001). „DBS and diathermy interaction induces severe CNS damage.“ Neurology 56(10): 1384–1386.
Ortega, O., O. Sakwinska, S. Combremont, B. Berger, J. Sauser, C. Parra, S. Zarcero, J. Nart, S. Carrion and P. Clave (2015). „High prevalence of colonization of oral cavity by respiratory pathogens in frail older patients with oropharyngeal dysphagia.“ Neurogastroenterol Motil 27(12): 1804–1816.
Pace, C. C. and G. H. McCullough (2010). „The association between oral microorgansims and aspiration pneumonia in the institutionalized elderly: review and recommendations.“ Dysphagia 25(4): 307–322.
Pedrosa, D. J. and L. Timmermann (2013). „Review: management of Parkinson‘s disease.“ Neuropsychiatr Dis Treat 9: 321–340.
Pradeep, A. R., S. P. Singh, S. S. Martande, A. P. Raju, T. Rustagi, D. K. Suke and S. B. Naik (2015). „Clinical evaluation of the periodontal health condition and oral health awareness in Parkinson‘s disease patients.“ Gerodontology 32(2): 100–106.
Roark, C., S. Whicher and A. Abosch (2008). „Reversible neurological symptoms caused by diathermy in a patient with deep brain stimulators: case report.“ Neurosurgery 62(1): E256; discussion E256.
Shulman, L. M., R. L. Taback, A. A. Rabinstein and W. J. Weiner (2002). „Non-recognition of depression and other non-motor symptoms in Parkinson‘s disease.“ Parkinsonism Relat Disord 8(3): 193–197.
Spatzier, H. N., Ina ( 2017). „Hilfsmittel und Produkte für die Zahnmedizin.
IDSUpdate.“ Zeitschrift für Senioren-Zahnmedizin 5(2): 86–89.
Srivanitchapoom, P., S. Pandey and M. Hallett (2014). „Drooling in Parkinson‘s disease: a review.“ Parkinsonism Relat Disord 20(11): 1109–1118.
Stocchi, F., P. Jenner and J. A. Obeso (2010). „When do levodopa motor fluctuations first appear in Parkinson‘s disease?“ Eur Neurol 63(5): 257–266.
Zlotnik, Y., Y. Balash, A. D. Korczyn, N. Giladi and T. Gurevich (2015). „Disorders of the oral cavity in Parkinson‘s disease and parkinsonian syndromes.“ Parkinsons Dis 2015: 379482.
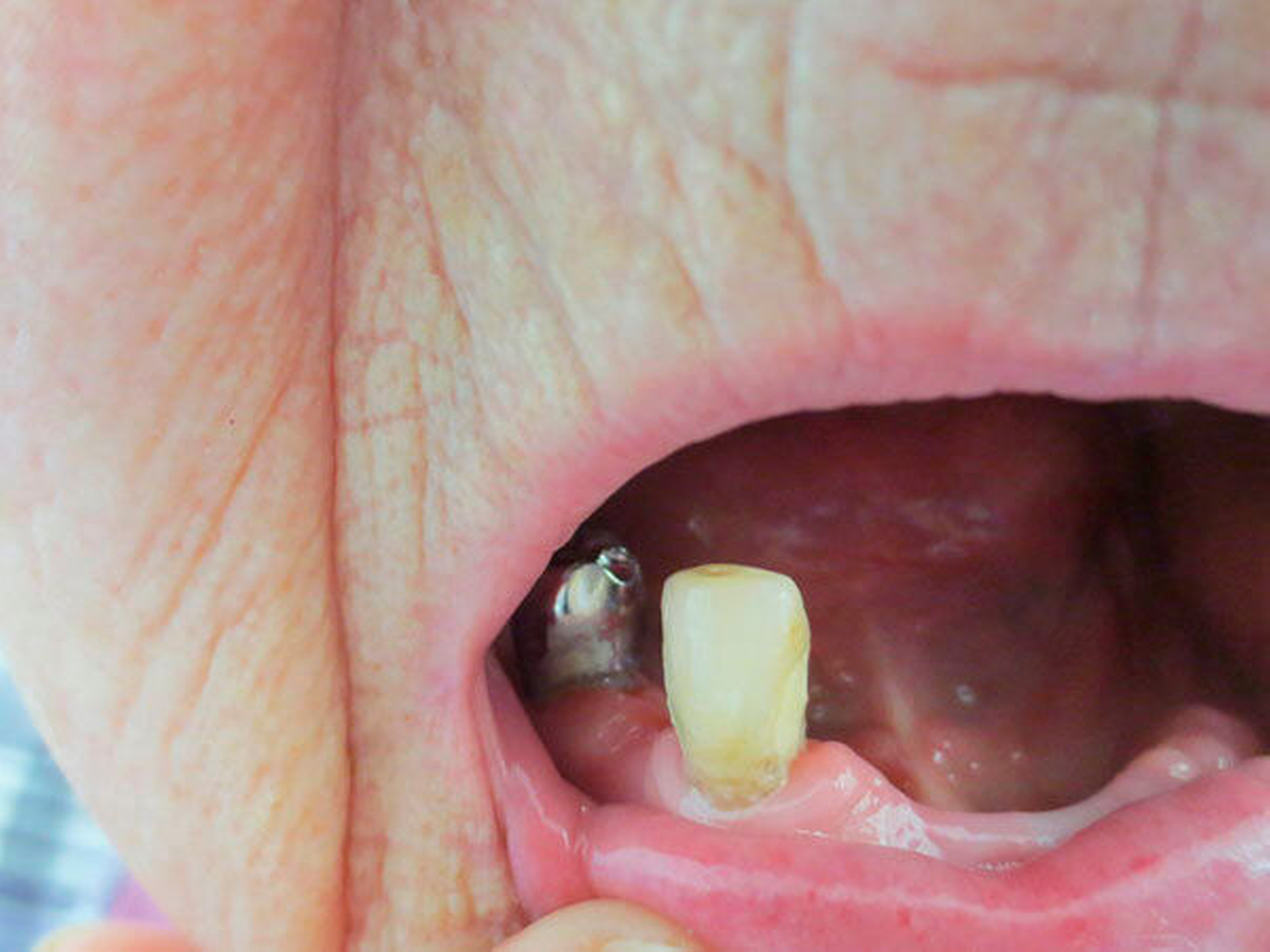
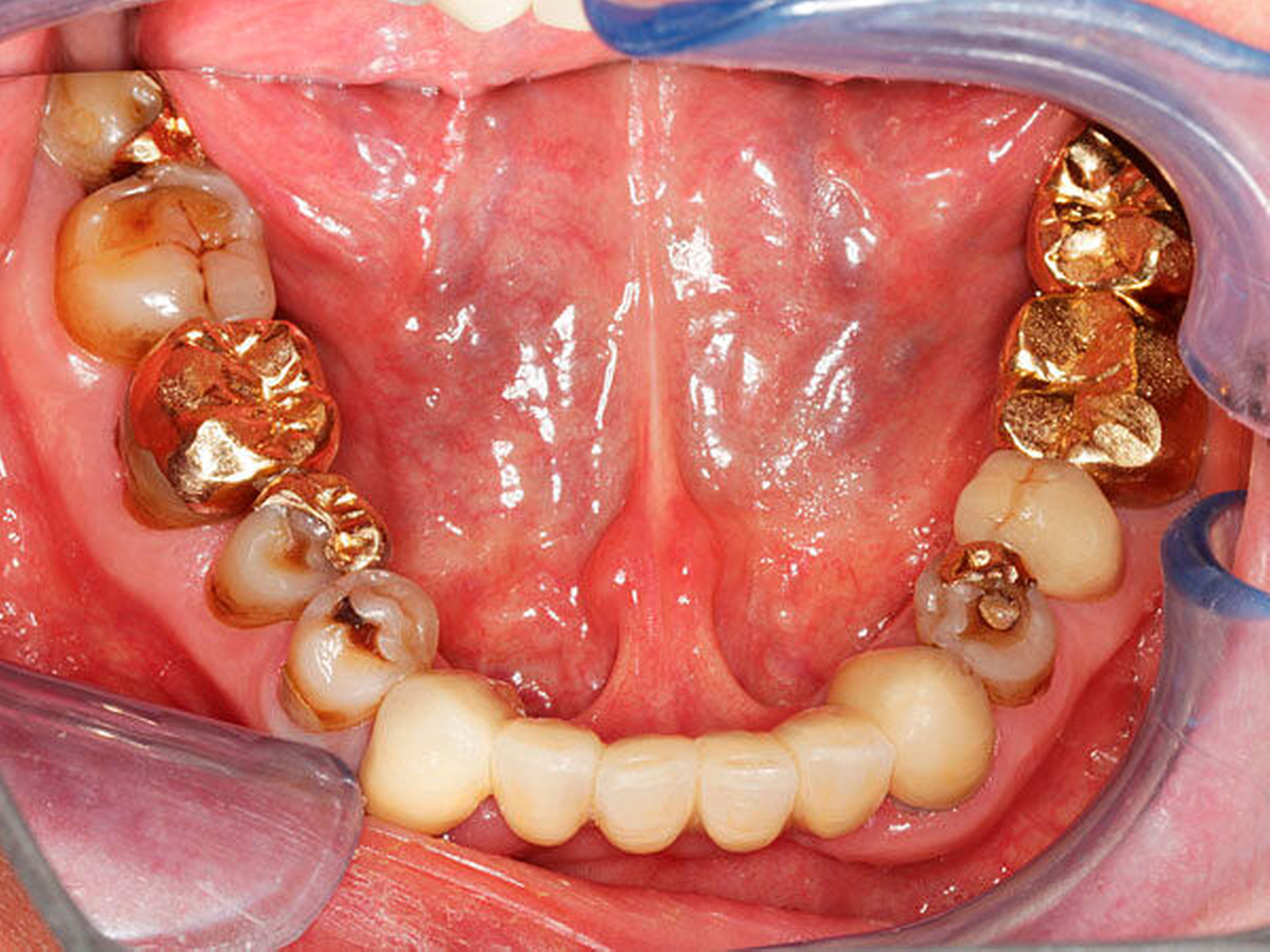
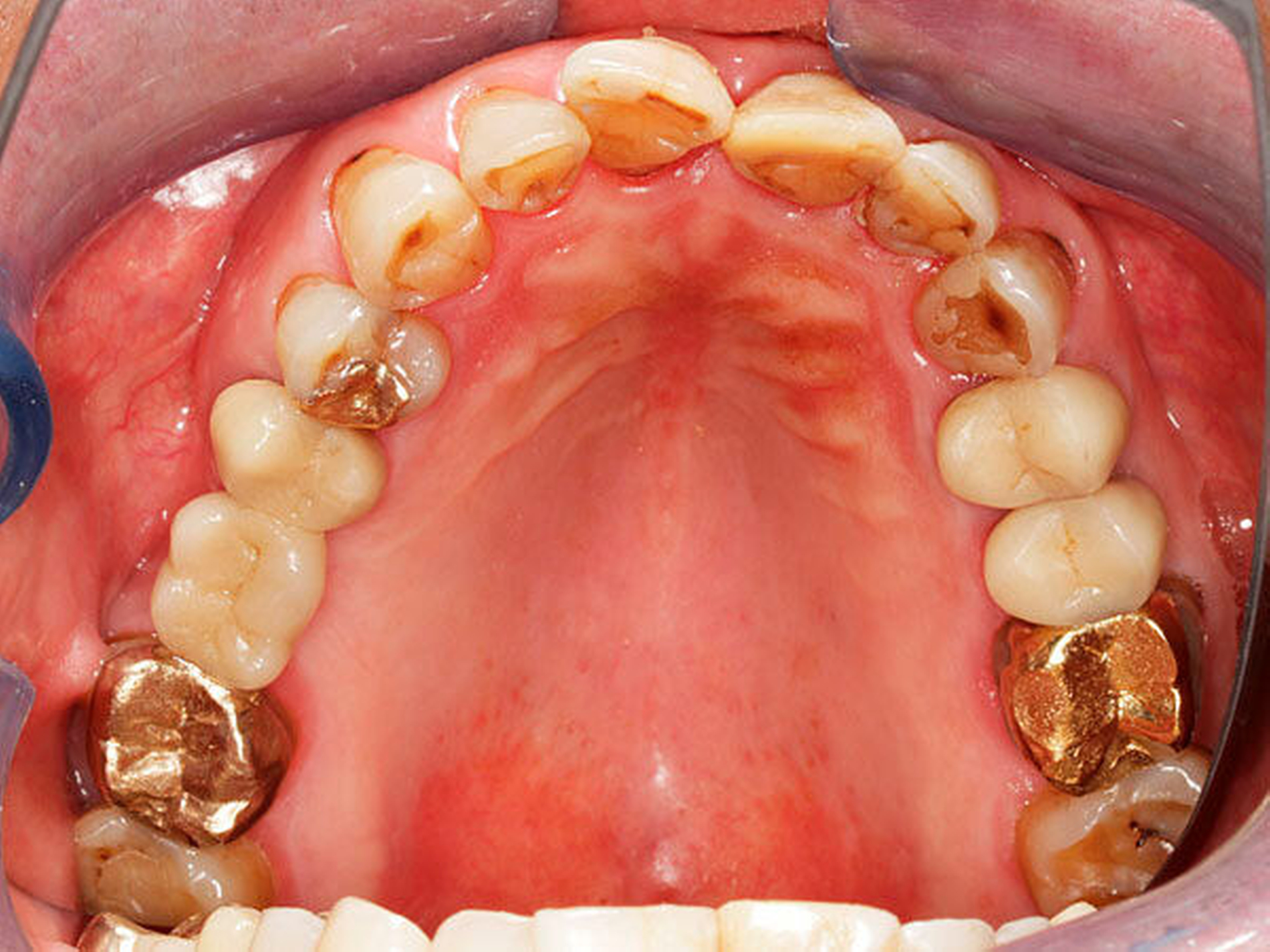
Abbildung 1: Beispielhafte Bilder von Patientinnen mit Morbus Parkinson (zwischen elf und 15 Jahre nach Erstdiagnose) mit unterschiedlichen zahnmedizinischen Problemen wie Hyposalivation, Bruxismus, reduzierte Zahnzahl sowie mit einer Einschränkung der häuslichen Mundhygienefähigkeit und dem resultierenden beeinträchtigten Hygienezustand
Alle Fotos: Barbe
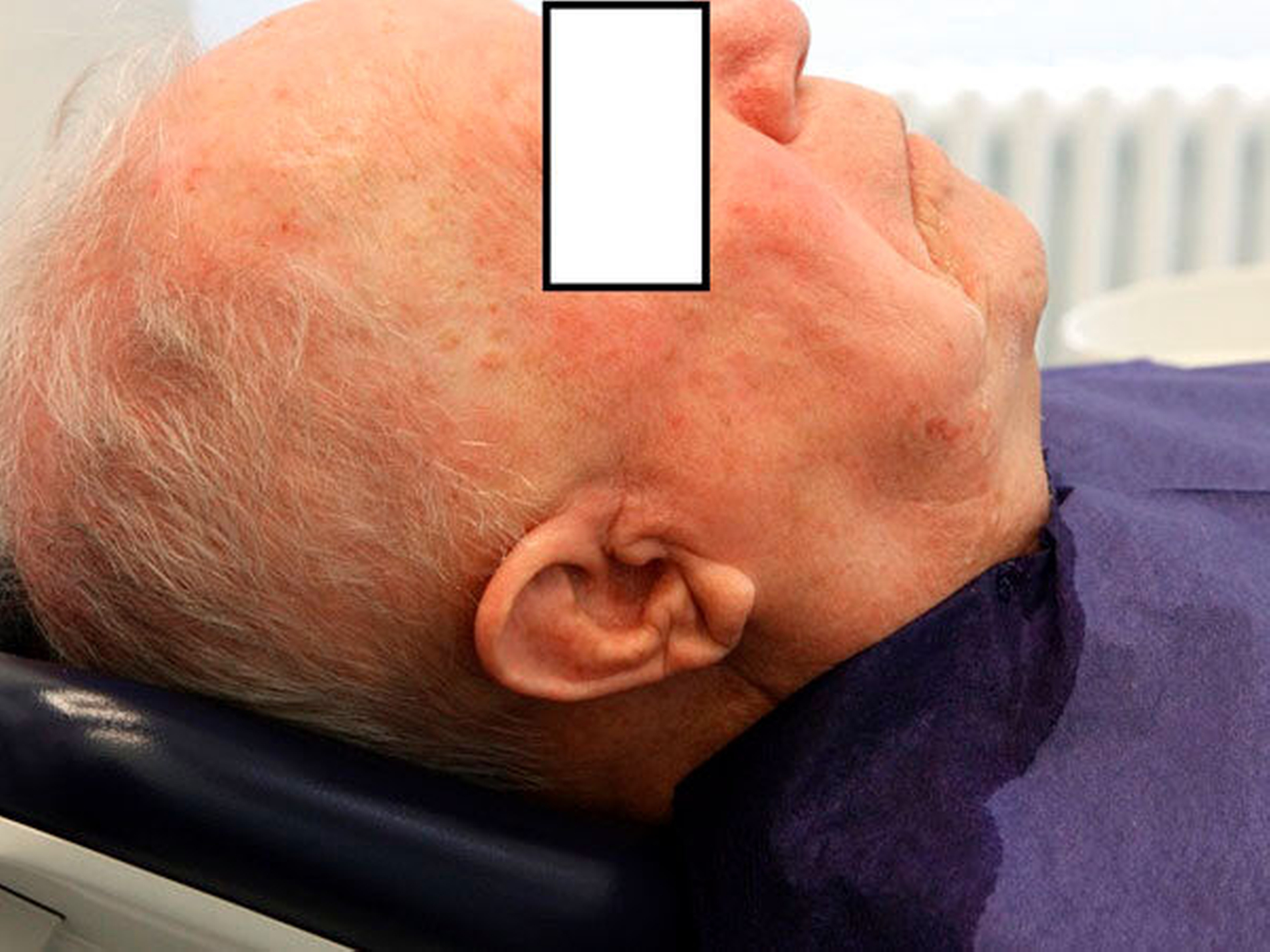
Abbildung 2: Beispielhafte Darstellung der Tiefen Hirnstimulation
Quelle: © Medtronic
Abbildung 3: Mundhöhle eines Patienten mit Morbus Parkinson (elf Jahre nach Erstdiagnose) mit starker Mundtrockenheit
Abbildung 4: Patient mit leichter Hypomimie mit Drooling wenige Minuten nach Behandlungsbeginn: Sichtbar sind der über den rechten Mundwinkel herauslaufende Speichel und die beginnende periorale Dermatitis am rechten Mundwinkel.
Abbildung 5: Umfangreiche prothetische Versorgung, die die Patientin aufgrund mangelnder Kraft und Geschicklichkeit nur mithilfe ihrer Angehörigen herausnehmen und säubern kann: In Kenntnis, dass in Deutschland mit einem starken Anstieg etwa der Zahlen der von Demenz, neurodegenerativen Erkrankungen oder Multimorbiditäten betroffenen Personen gerechnet werden kann, sollte im Sinne einer präventiven vorausschauenden Betreuung bei der Planung und Neuanfertigung von Zahnersatz immer auch darauf geachtet werden, diesen langfristig praktikabel zu gestalten, gegebenenfalls auch für pflegende Angehörige oder Pflegekräfte in Hinblick auf die Fremd-Nachsorgekompetenz. Hierbei kann auch der Hinweis auf Hilfsmittel wie Eingliederungshilfen hilfreich sein.
Foto: Uniklinik Köln
Foto: Uniklinik Köln