Mundgesundheitsrisiken nach der Brustkrebstherapie
In Deutschland wird Brustkrebs bei Frauen mit einer jährlichen Neuerkrankungszahl von 70.000 Fällen diagnostiziert, nur etwa 1 Prozent der Fälle betrifft Männer. Immer noch sterben in Deutschland 18.000 Frauen jährlich an Brustkrebs. Ihr Lebenszeitrisiko beträgt 12,8 Prozent, bezogen auf die weibliche Gesamtpopulation liegt die Neuerkrankungsrate bei 0,3 Prozent [S3-Leitlinie Mammakarzinom, 2019]. Dank der modernen und individualisierten Tumortherapie haben sich die Überlebenschancen für die Betroffenen in den vergangenen zehn Jahren deutlich verbessert. Laut einer Prognose des Deutschen Krebsregisters für das Jahr 2018 können Brustkrebspatientinnen mit einer relativen 5-Jahres-Überlebensrate von 86 bis 90 Prozent sowie einer 10-Jahres-Überlebensrate von 81 bis 83 Prozent rechnen [Krebs in Deutschland, 2017].
Therapieoptionen des Mammakarzinoms
Bei etwa zwei Dritteln der Brustkrebspatientinnen finden sich hormonabhängige Tumoren und bei circa 20 Prozent exprimiert die Zelloberfläche einen HER2-Rezeptor. Zehn Prozent weisen das sogenannte triple-negative-Mammakarzinom auf, das Östrogen-negativ, Progesteron-negativ und HER2-negativ ist, was die Therapieoptionen und gleichsam die Prognose einschränkt.
Je nach Tumorstadium – lokal begrenzt oder fortgeschritten und fernmetastasiert und abhängig von sogenannten molekularen beziehungsweise intrinsischen Subtypen – wird heutzutage in interdisziplinären Tumorkonferenzen ein individualisiertes Therapiekonzept für die jeweilige Patientin erarbeitet. Die Säulen der Therapie des Mammakarzinoms sind die Chirurgie, die Radio- und Chemotherapie sowie die Antihormontherapien.
Chirurgische Therapie
Wird ein kurativer Ansatz verfolgt, stellt die chirurgische Entfernung des Tumorgewebes einen integralen Teil der Therapie dar. Während früher oftmals vergleichsweise invasive chirurgische Eingriffe mit kompletter Mastektomie der betroffenen Mamma erfolgten, erlauben heute eine verbesserte Diagnostik und chirurgische Techniken eine minimalinvasive brusterhaltende Entfernung (BET) des Tumorgewebes. Ferner hat sich die Sentinel-Lymph-Node-Technik (SLNE) als Standardtherapie etabliert. Hier wird der im Abflussgebiet der Lymphflüssigkeit nächstgelegene Lymphknoten (Wächterlymphknoten) identifiziert und auf Absiedelungen von Krebszellen untersucht. Bei nicht befallenen Wächterlymphknoten kann dann, bei gleicher Mortalität, jedoch mit einer deutlichen Reduktion der Morbidität, auf eine weitere Ausräumung der axillären Lymphknoten (Axilladissektion) verzichtet werden.
Radiotherapie
Die Radiotherapie stellt einen wesentlichen Teil des Behandlungsspektrums bei brusterhaltender Therapie dar, wobei alle Subtypen unabhängig von tumorspezifischen oder patientenbezogenen Prognosefaktoren für die Strahlentherapie indiziert sind. Oft folgt die Strahlentherapie im unmittelbaren Anschluss an einen chirurgischen Eingriff und ist die Maßnahme mit dem höchsten Evidenzgrad, um ein Lokalrezidiv zu vermeiden. Aktuelle Studien belegen, dass durch die Radiotherapie von zehn möglichen Rezidiven acht verhindert werden können [Kunkler et al., 2015; Fyles et al., 2004].
Die Strahlentherapie wird entweder in Hypofraktionierung (Gesamtdosis ungefähr 40 Gy in 15 oder 16 Fraktionen in etwa drei bis fünf Wochen) oder in konventioneller Fraktionierung (Gesamtdosis circa 50 Gy in 25 bis 28 Fraktionen in fünf bis sechs Wochen) durchgeführt. Eine Boost-Bestrahlung des Tumorbettes (10–16 Gy) erfolgt bei entsprechender Indikation ebenfalls. Bei brusterhaltender Therapie stellen die Brust beziehungsweise die Resektionsränder sowie die Thoraxwand das Zielvolumen dar.
Prinzipiell gilt, dass die Strahlentherapie zeitnah nach der Operation durchgeführt werden soll. Erhält die Patientin zusätzlich eine Chemotherapie, empfiehlt sich ein sequenzielles Vorgehen, während die Hormontherapie simultan zur Bestrahlung erfolgen kann. Typische Nebenwirkungen sind lokale Hautrötungen/Irritationen in den bestrahlten Arealen, ferner werden oftmals Erschöpfungszustände angegeben. Als Spätkomplikationen können merkliche Hautalterungen sowie Basaliome, Spinaliome sowie das Angiosarkom auftreten.
Da das Gesicht beziehungsweise die Speicheldrüsen nicht im Bestrahlungsfeld und fernab möglicher Streustrahlung liegen, werden im Kopf-Hals-Bereich kaum strahlungsinduzierte Nebenwirkungen angegeben.
Chemotherapie
Die Entscheidung zur adjuvanten oder neoadjuvanten Chemotherapie basiert immer auf einer Risiko-Nutzen-Entscheidung, bei der das Alter der Patientinnen, das Tumorstadium sowie der molekulare Subtyp mit einbezogen werden. Besteht die Indikation für eine zytostatische Therapie, wird sie entweder vor der Operation (neoadjuvant) oder drei bis sechs Wochen nach der Operation (adjuvant), jedoch immer vor der Bestrahlung durchgeführt.
Die Zytostatika-Applikation erfolgt im Rahmen von Zyklen, also in sich wiederholenden Intervallen, zum Beispiel einmal die Woche, alle zwei Wochen oder alle drei bis vier Wochen [Giordano et al., 2018]. Klinische Studien konnten zeigen, dass die kombinierte Verabreichung von Chemotherapeutika effektiver ist als die Gabe eines Chemotherapeutikums alleine. Im Rahmen von klinisch etablierten, evidenzbasierten Protokollen werden zwei, häufiger drei Zytostatika miteinander kombiniert, wobei diese entweder simultan oder sequenziell appliziert werden können. In der Klinik häufig angewandte Konzepte sind beispielsweise die Kombination von Anthracyclin und Taxan gegebenenfalls zusätzlich mit einem Platinderivat oder einer zielgerichteten Antikörpertherapie.
Zu den Nebenwirkungen der Chemotherapeutika zählen Übelkeit und Erbrechen, Appetitlosigkeit, Erschöpfung, Haarausfall, Mundschleimhautentzündungen (Abbildung 1), Geschmacks- und Geruchsstörungen sowie Neutropenien. Durch die starke Schädigung der Darmschleimhaut werden in der Folge zusätzlich Nährstoffe deutlich schlechter verwertet, und es kann zur Mangelernährung kommen. Viele der genannten Nebenwirkungen klingen nach dem Absetzen der Chemotherapie langsam ab, jedoch sind auch Spätfolgen wie Herzmuskelschädigungen, Neuropathien sowie Leukämien beschrieben worden.
Die Nervenschädigungen, die unmittelbar während der Krebstherapie oder verzögert mit unterschiedlichen Anzeichen und Ausprägungen auftreten können, umfassen Missempfindungen oder auch Taubheitsgefühle verstärkt in Händen und Füßen. Sind vermehrt die Hände betroffen, kann dies zu Behinderungen bei feinmotorischen, oft alltäglichen Aktivitäten führen. Bei einer Fußbeteiligung können die Patientinnen unter Gangstabilität und Gleichgewichtsstörungen mit vermehrter Sturzgefahr leiden.
Endokrine Therapie
Sollten die Brustkrebszellen Hormonrezeptoren exprimieren (Östrogen- und Progesteronrezeptoren), wird zusätzlich immer auch eine endokrine „antihormonelle Therapie“ für meist fünf Jahre empfohlen. Bei einem erhöhten Risikoprofil kann eine Verlängerung der Therapie um weitere zwei bis fünf Jahre erfolgen. Die endokrine Therapie kann parallel zur Bestrahlung, nicht jedoch während der Chemotherapie durchgeführt werden. Bei prämenopausalen Patientinnen ohne ausgeprägtes Risikoprofil wird Tamoxifen, ein selektiver Östrogenrezeptor-Modulator, empfohlen. Postmenopausalen Patientinnen kann eine Kombination aus Tamoxifen für zwei bis drei Jahre, gefolgt von einem Aromatasehemmer (Switch Therapie) oder primär ein Aromatasehemmer (upfront Therapie), empfohlen werden. Typische Nebenwirkungen beider Therapieoptionen sind Wechseljahresbeschwerden wie Hitzewallungen, Trockenheit und Juckreiz in der Scheide sowie Haut-und Haarveränderungen. Bei Tamoxifen können zusätzlich Sehstörungen (Grauer Star, Netzhauttrübungen), ein vermehrter Aufbau der Gebärmutterschleimhaut und venöse Thrombosen auftreten. Bei den Aromatasehemmern stehen Beschwerden des Bewegungsapparats (Osteoporose, Arthralgien, Myalgien) im Vordergrund.
Intraorale Nebenwirkungen
Chemotherapie
Von allen Therapiemöglichkeiten zeigt die Chemotherapie für die orale Gesundheit die meisten Nebenwirkungen. Zu den typischen Nebenwirkungen zählen entzündliche Veränderungen aller Schleimhäute – somit sind die Mundhöhle, das Parodont sowie der Rachenbereich einschließlich der Speiseröhre in besonderer Weise betroffen [Van Sebille et al., 2015; Thorpe et al., 2013; Cidon, 2018; Johnston, 2011; Hong et al., 2018; Greene et al., 1994]. Entzündliche Schleimhautprozesse werden bei 20 bis 40 Prozent aller Zytostatika-Applikationen beschrieben, wobei die Mundschleimhäute bereits in frühen Therapiestadien Entzündungszeichen aufweisen [Lalla et al., 2014].
Mögliche orale Folgekomplikationen nach Chemotherapie sind Xerostomie, Geschmacksirritationen, Beschwerden bei der Nahrungsaufnahme mit konsekutivem Gewichtsverlust sowie parodontale Probleme mit erhöhten Plaque- und Entzündungswerten sowie in der Phase der Neutropenie auch Candidabefall [Wilberg et al., 2014]. Die Ausprägung des Nebenwirkungsspektrums ist von der Art des verwendeten Medikaments abhängig.
Die Arbeitsgruppe um Adeel et al. untersuchte 358 Brustkrebspatientinnen, die jeweils vier Zyklen unterschiedlicher Chemotherapieregime erhielten (Doxorubicin oder Docetaxel in Kombination mit Cyclophosphamid) [Adeel et al., 2019]. Während unter der Therapie von Docetaxel und Cyclophosphamid weniger Mundschleimhautveränderungen, Gewichtsreduktionen und Schwindel beobachtet wurden, rief die Kombination von Doxorubicin und Cyclophosphamid weniger Muskelschmerzen, Neuropathien, Anämien und Geschmacksirritationen hervor. Geschmacksstörungen, die unter Therapie oftmals auftreten, schränken die Lebensqualität der Patientinnen deutlich ein und erschweren mitunter eine ausgewogene Nahrungsaufnahme [De Vries et al., 2017; Speck et al., 2013]. Die Patientinnen konsultieren mit diesem Beschwerdebild oftmals ihren Hauszahnarzt, deshalb ist es hilfreich zu wissen, dass es vor allem zu Beginn der Therapie zu einer signifikanten Geschmacksverschlechterung kommt, die sich aber gegen Ende der Behandlung oftmals wieder verbessert [Boltong et al., 2014].
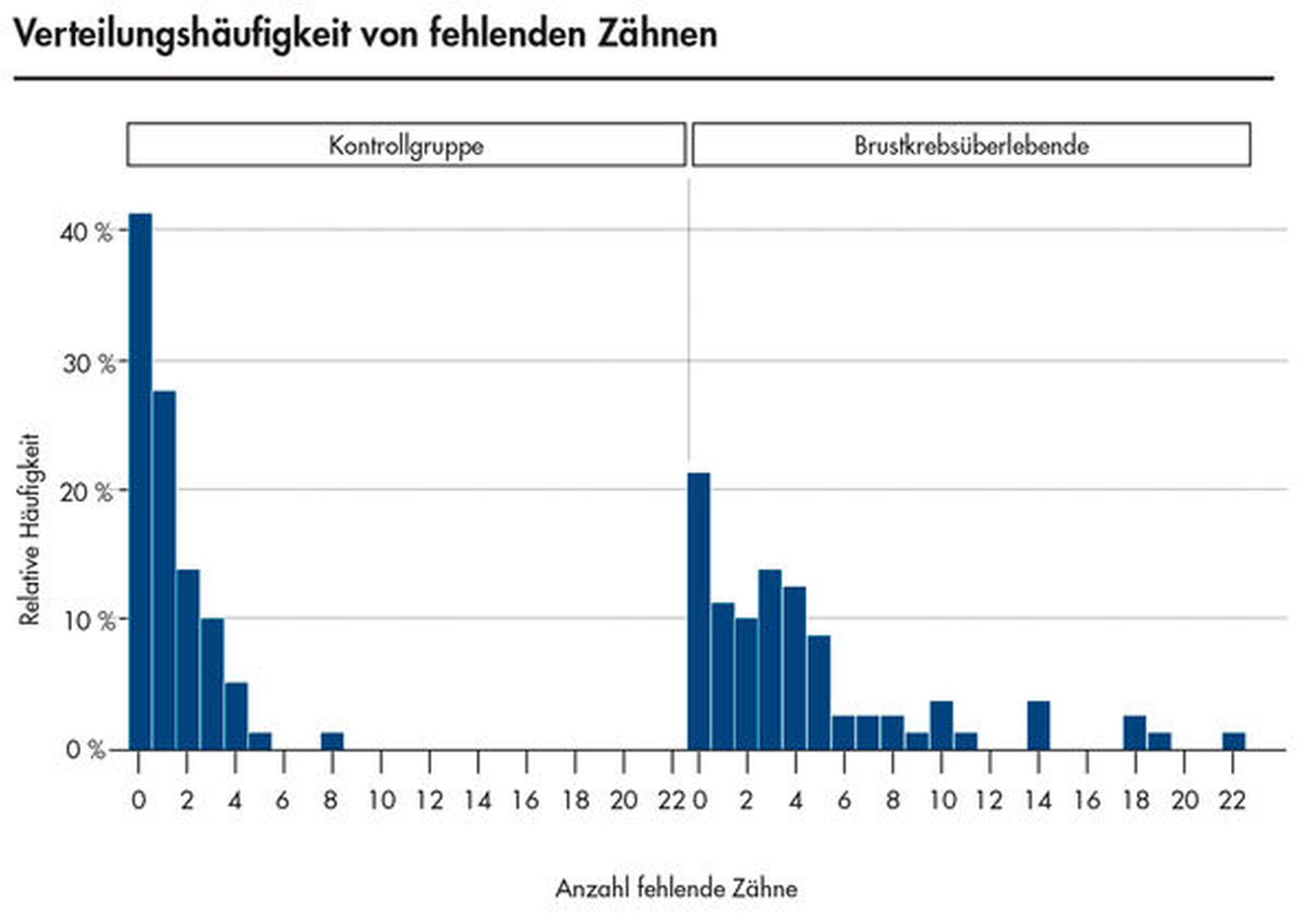
In einer eigenen Studie wurde der Mundgesundheitszustand von 80 postmenopausalen Brustkrebspatientinnen, die eine kombinierte Radio- und Chemotherapie erhielten (Patientinnen mit Antihormontherapie wurden aus der Studie ausgeschlossen), untersucht und mit gleichaltrigen gesunden Frauen verglichen [Willershausen et al., 2019]. Die zahnärztliche Befundung umfasste neben der Ermittlung der Kariesfrequenz und des PSI-Werts auch eine radiologische Untersuchung, die eine differenzierte Bewertung der endodontischen Situation und der Diagnostik möglicher apikaler Herde dieser Patientinnen zuließ. Es zeigte sich, dass bei Brustkrebsüberlebenden im Vergleich zu den Kontrollpersonen eine reduzierte Gesamtdentition vorlag (Abbildung 2), ein Ergebnis, das auch von anderen Autoren beschrieben wurde [Amodio et al., 2014].
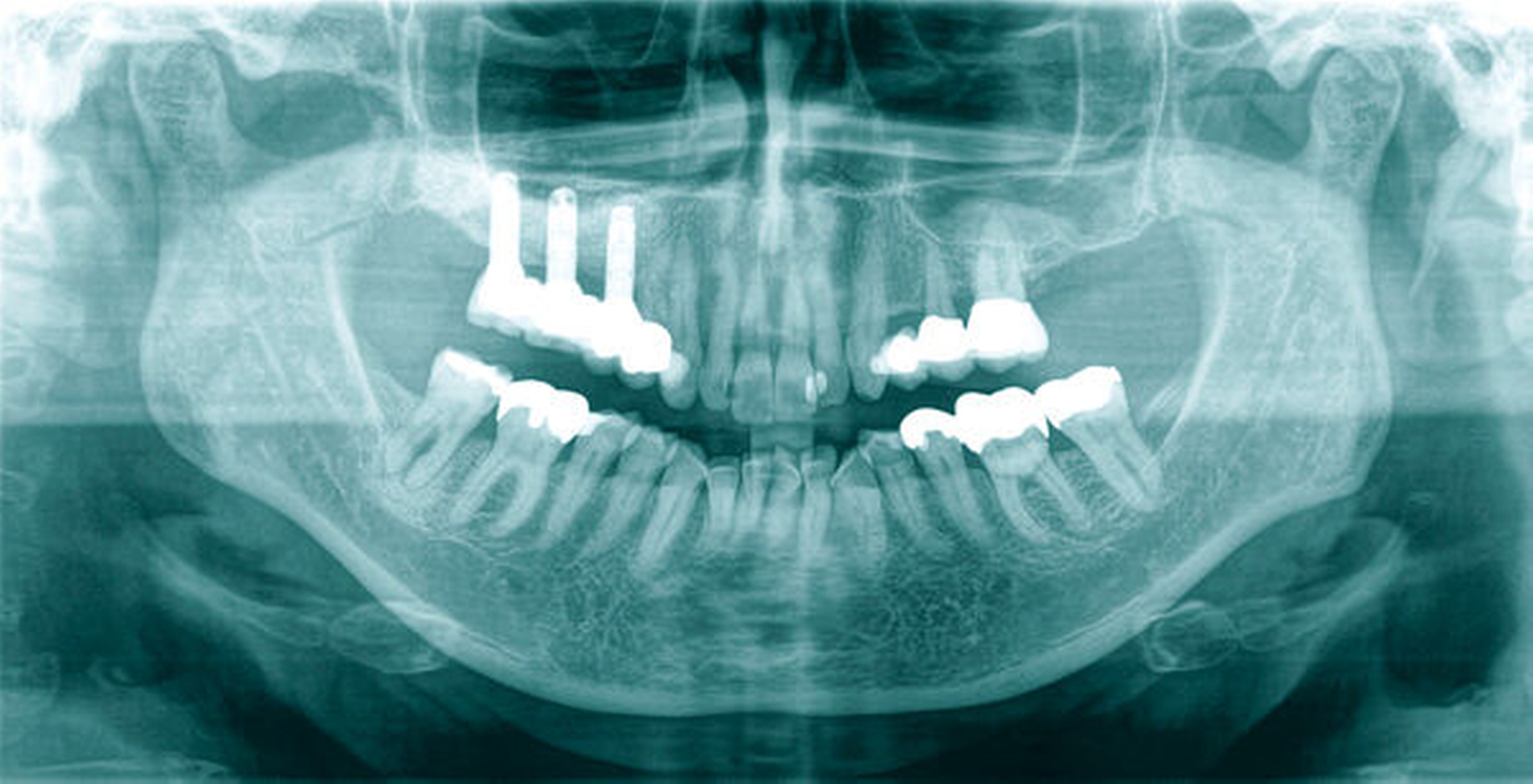
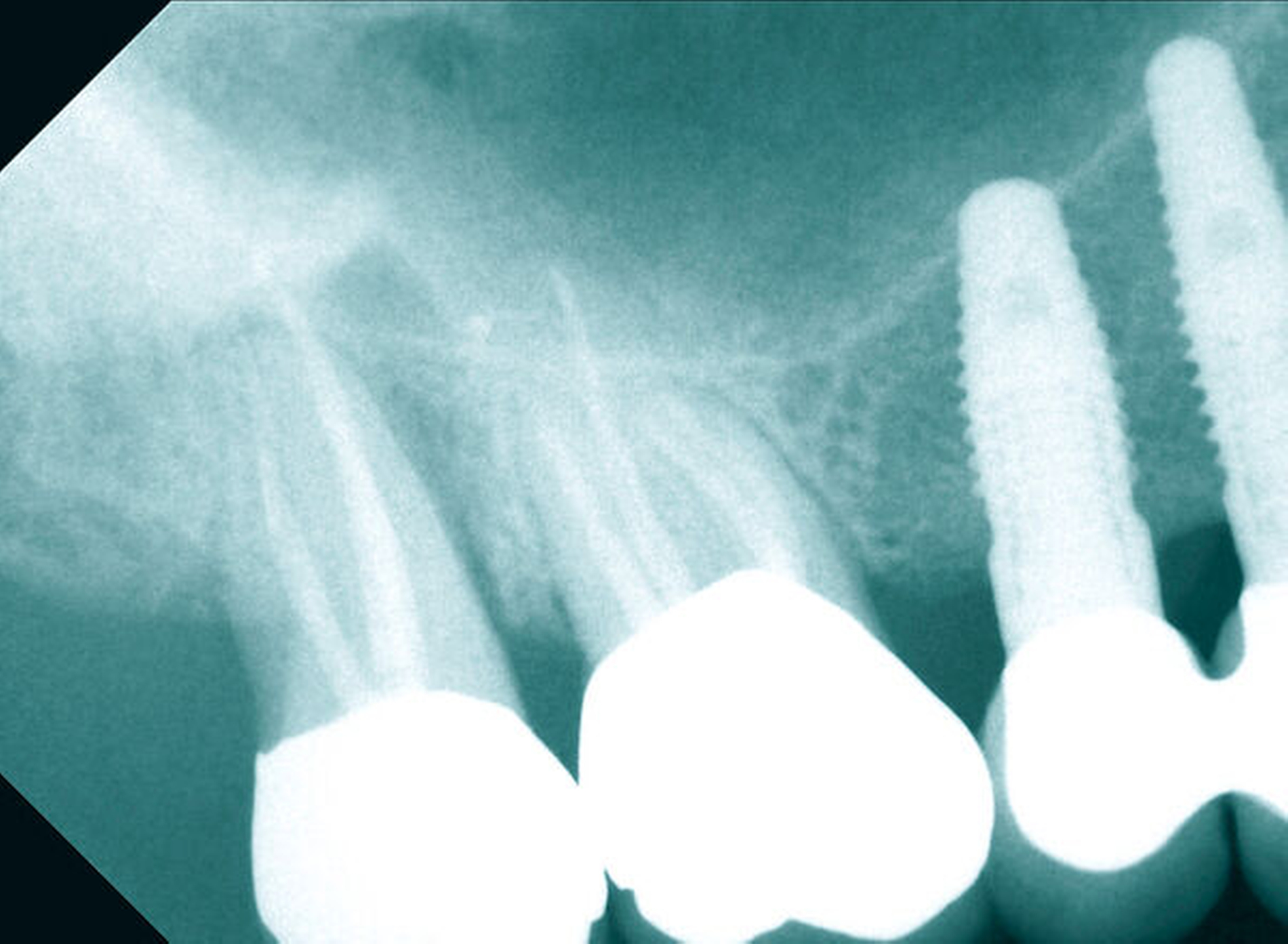
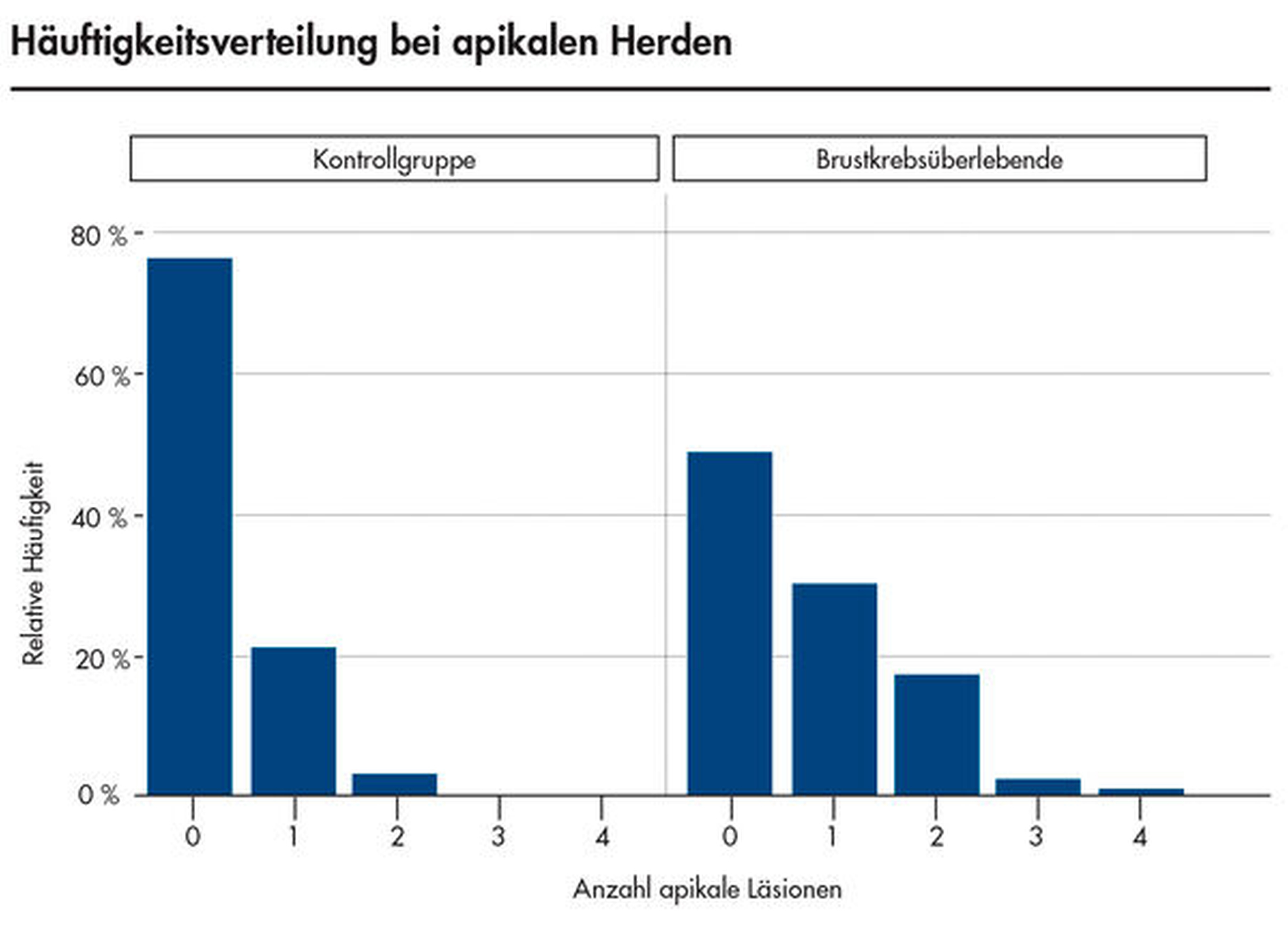
Neu ist allerdings die Erkenntnis, dass Brustkrebsüberlebende im Vergleich zu den Kontrollpersonen – bei gleicher Anzahl wurzelkanalbehandelter Zähne – signifikant mehr apikale Läsionen endodontischen Ursprungs aufwiesen (Abbildungen 3 bis 5). Obgleich die Kausalität dieses Befunds noch nicht eindeutig geklärt ist, spielt vermutlich eine Rolle, dass Zytostatika die Homöostase der ausbalancierten oralen Mikroflora stören und das orale Mikrobiom in Richtung eines komplexen und potenziell pathogeneren Keimspektrums verschieben [Napenas et al., 2010; Cidon, 2018; Nihei et al., 2018]. Eine intraorale Dysbalance, einhergehend mit einer erhöhten Anzahl pathogener Keime, kann in Folge die Virulenz bestehender bakterieller Prozesse erhöhen (Abbildungen 4 und 5).
Die vermehrte Anzahl apikaler Läsionen bei den Brustkrebsüberlebenden in unserer Studie könnte womöglich eine Folge der veränderten, pathogeneren oralen Flora bei gleichzeitiger Zytostatika-induzierter Immunsuppression sein [Willershausen et al., 2019]. Ferner können Neuropathien, als häufige Nebenwirkung von Chemotherapien, auch pulpale Gewebsstrukturen mitbeeinflussen, so dass sich Vitalitätsverluste der Pulpa mit Bildung chronischer apikaler Entzündungsprozesse möglicherweise partiell auf diesen Mechanismus zurückführen lassen. Nicht nur die Entstehung apikaler Läsionen scheint in diesem Patientinnenkollektiv begünstigt, vielmehr verschlechtert die Grunderkrankung beziehungsweise deren Therapie womöglich auch den Erfolg endodontischer Maßnahmen, was letztlich zu einem erhöhten Zahnverlust führen kann.
In unserer Studie wurde sowohl bei den Tumorüberlebenden als auch bei der Kontrollgruppe der OHIP-14-Fragebogen als etabliertes Messinstrument der mundgesundheitsbezogenen Lebensqualität sowie der HADS-D-Fragebogen zur Erfassung möglicher depressiver Symptomatik erhoben. Während der OHIP-Wert bei beiden Gruppen vergleichbar war, zeigten die Tumorpatientinnen signifikant mehr depressive Symptomatik (HADS-D-Score) als die Kontrollgruppe. Statistisch korrelierte ein hoher HADS-D-Score mit der Anzahl der fehlenden Zähne. Ein Zusammenhang zum Bildungsstand oder zum Alter der Patientinnen konnte jedoch nicht gefunden werden. Es ist statistisch belegt, dass depressive Patienten eine ungünstigere Mundgesundheit mit höherer Kariesfrequenz, kompromittiertem parodontalem Zustand sowie vermehrtem Zahnverlust aufweisen, so dass diese eine intensivere zahnärztliche Betreuung benötigen [Pareira et al., 2015; Alkan et al., 2015; Jardim et al., 2019].
Endokrine Therapie
Da eine immer größere Anzahl von Frauen mittels endokriner Therapie behandelt wird, ist es wichtig, die typischen intraoralen Nebenwirkungen dieses Behandlungsregimes zu kennen. Während eine Chemotherapie langfristig die Gesamtzahnzahl reduziert und das Auftreten von endodontischen Läsionen begünstigt, stehen unter endokriner Therapie insbesondere parodontale Probleme mit erhöhten Taschentiefen, Blutungsneigung und Attachmentverlusten im Vordergrund [Muthular et al., 2019; Lo-Fo-Wong et al., 2016; Taichmann et al., 2015; 2016, 2018; Eagle et al., 2016].
Taichmann et al. beobachteten bei 29 postmenopausalen Brustkrebsüberlebenden nach Antihormontherapie einen erhöhten Attachmentverlust, Blutung auf Sondierung, erhöhte Lockerungsgrade und eine verminderte Speichelflussrate [Taichmann et al., 2015]. Im Vergleich zu 29 gleichaltrigen gesunden Kontrollpersonen konnte aber keine Verminderung der Anzahl der Zähne festgestellt werden. Eagle et al. überprüften über einen Zeitraum von 18 Monaten den parodontalen Gesundheitszustand von postmenopausalen Brustkrebspatientinnen [Eagle et al., 2016]. Auch hier wurden Brustkrebsüberlebende nach Antihormontherapie zahnärztlich untersucht und mit einer gesunden Kontrollgruppe verglichen. Es zeigte sich, dass die Tumorpatientinnen mit Anti-Hormontherapie im Vergleich zur Kontrollgruppe im Laufe der Beobachtungszeit eine signifikant erhöhte gingivale Blutungsneigung, vermehrte Plaqueanlagerungen sowie erhöhte Attachmentverluste aufwiesen. Der mundgesundheitsbezogene Fragebogen (OHRQoL) machte auch sichtbar, dass die Brustkrebspatientinnen einen viel schlechteren Mundgesundheitsscore aufwiesen. Auch der OHOP-14 belegte insbesondere zu Therapiebeginn eine verminderte mundgesundheitsbedingte Lebensqualität mit erhöhter depressiver Symptomatik – was sich nachweislich negativ auf die Mundhygiene und die Zahngesundheit auswirkt.
Fazit und Prophylaxeempfehlungen
Brustkrebserkrankungen zählen zu den führenden malignen Karzinomen bei Frauen und werden mittels Chirurgie, Radio- und/oder systemischer Therapie behandelt. Insbesondere die systemischen Therapieformen wie Chemo- und Anti-Hormontherapie gehen mit Veränderungen der oralen Flora sowie einer konsekutiv erhöhten Prädisposition intraoraler Entzündungsprozesse einher und bedürfen daher intensiver zahnärztlicher Kontrollen sowie individualisierter Prophylaxekonzepte.
Vor Beginn der oftmals langwierigen Therapiezyklen sollte eine umfassende zahnärztliche Untersuchung mit Erfassung des PA-Status sowie eine radiologische Untersuchung zur Abklärung möglicher apikaler Läsionen erfolgen. Notwendige zahnärztliche Behandlungen, beispielsweise Zahn- und Taschenreinigung sowie endodontische Behandlungen, sollten ebenfalls vor möglicher Immunsuppression durch Chemotherapie durchgeführt werden.
Chemotherapie führt oftmals zu Appetitlosigkeit, Geschmacksstörungen, Schluckbeschwerden und einer schmerzenden, empfindlichen Mundschleimhaut. Für die tägliche Mundhygiene sollten folglich sehr weiche Zahnbürsten sowie milde Zahnpasten und Mundspüllösungen zur Anwendung kommen. Eine Befeuchtung der trockenen, gereizten Mundschleimhaut mit milden Kräuterextrakten kann zur deutlichen Linderung der Beschwerden führen. Die Irritationen der Mundschleimhaut klingen in der Regel nach Abschluss der Therapie rasch und meist folgenlos ab.
Häufige Nebenwirkungen einer Therapie mit Zytostatika sind Neuropathien. Daher sollten zahnärztliche Untersuchungen vor und während der Therapie gerade auch Vitalitätsmessungen umfassen. Bei entsprechender Indikation sollte ferner eine engmaschige radiologische Überwachung zum Ausschluss apikaler Herde (LEOs, LPOs) und zur Prävention von endodontisch bedingten Entzündungsprozessen mit Fistelgängen oder Abszess-Bildung durchgeführt werden.
Generell empfehlen sich engmaschige zahnärztliche Kontrollen mit parodontaler und endontischer Diagnostik in einem Zeitraum von bis zu fünf Jahren nach erfolgter Therapie sowie individualisierte Prophylaxekonzepte.
Prof. Dr. med. dent Lina Gölz
Zahnklinik 3, Kieferorthopädie Universitätsklinikum Erlangen
Glücksstr. 11, 91054 Erlangen
Dr. rer. nat. Irene Schmidtmann
Institut für medizinische Biometrie, Epidemiologie und Information, Universitätsmedizin Mainz
Obere Zahlbacherstr. 69, 55131 Mainz
OÄ Dr. med. Kathrin Stewen
Klinik und Poliklinik für Geburtshilfe und Frauengesundheit, Universitätsmedizin Mainz
Langenbeckstr. 1, 55131 Mainz
Prof. Dr. med. dent. Dipl.-Chem. Brita Willershausen
Mediplus MVZ GmbH
Haifa-Allee 20, 55128 Mainz
Dr. med. Dr. med. dent. Ines Willershausen
Zahnklinik 3, Kieferorthopädie Universitätsklinikum Erlangen
Glücksstr. 11, 91054 Erlangen
Literaturliste
Adeel M, Asif M, Faisal MN, Chaudary MH, Malik MS, Khalid M. Comparative study of adjuvant chemotherapeutic efficacy of docetaxel plus cyclophosphamide and doxorubicin plus cyclophosphamide in female breast cancer. Cancer Manag Res 2019; 11: 727-739.
Alkan A, Cakmak O, Yilmaz S, Cebi T, Gurgan C. Relationship Between Psychological Factors and Oral Health Status and Behaviours. Oral Health & Preventive Dentistry. 2015; 13: 331-339.
Amodio J, Palioto DB, Carrara HH, Tiezzi DG, Andrade JM, Reis FJ . Oral health after breast cancer treatment in postmenopausal women. Clinics (Sao Paulo, Brasil). 2014; 69: 706-708.
Boltong A, Aranda S, Keast R, Wynne R, Francis PA, Chirgwin J, Gough K, A prospective cohort study of the effects of adjuvant breast cancer chemotherapy on taste function, food liking, appetite and associated nutritional outcomes. PLoS One. 2014 Jul 31;9(7):e103512. doi: 10.1371/journal.pone.0103512. eCollection 2014.
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018 Nov;68(6):394-424.
Cidon EU. Chemotherapy induced oral mucositis: prevention is possible. Chin Clin 2018 Feb;7(1):6. doi: 10.21037/cco.2017.10.01. Epub 2017 Nov 3.
Deutsche Krebsgesellschaft https://www.krebsgesellschaft.de (deutsches krebsreg.2017 )
Eagle I, Benavides E, Eber R, Kolenic G, Jung Y, Van Poznak C, Taichmann LS. Periodontal health in breast cancer patients on aromatase inhibitors versus postmenopausal controls: a longitudinal analysis. J Clin Periodontol. 2016 Aug;43(8):659-67. doi: 10.1111/jcpe.12562. Epub 2016 May 19.
Fyles, A.W., McCready DR, Manchul LA, Trudeau ME, Merante P, Pintilie M, Weir LM, Olivotto IA. Tamoxifen with or without breast irradiation in women 50 years of age or older with early breast cancer. New England Journal of Medicine, 2004. 351(10): p. 963-970)
Giordiano SH, Elias AD, Gradishar WJ. NCCN Guidelines Updates: Breast Cancer. J Natl Compr Canc Netw. 2018 May; 16(5S): 605-610.
Greene D, Nail LM, Fieler VK, Dudgeon D, Jones LS. A comparison of patient-reported side effects among three chemotherapy regimens for breast cancer. Cancer Practice. 1994; 2: 57-62.
Götzsche PC, Jörgensen KJ. Screening for breast cancer with mammography. Cochrane Database Syst. Rev. 2013, Jun 4;(6):CD001877. doi: 10.1002/14651858.CD001877.
Hong CHL, Hu S, Haverman T, Stokman M, Napenas JJ, Bos-den Braber J, Gerber E, Geuke M. Vardas E, Waltimo T, Jensen SB, Saunders D. A systemic review of dental disease management in cancer patients. Support Care Cancer 2108; 26: 155-174.
Interdisziplinäre S3 Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms. Leitlinienprogramm Onkologie (Hrsg) 2018
Jardim LC, Flores PT, do Carmo Dos Santos Araujo M, Chiesa J, de Moraes CMB, Antoniazzi RP. Oral health–related quality of life in breast cancer survivors . Support Care cancer 2019; Apr 13. doi:10.1007/s00520-019-04792-3. [Epub ahead of print]
Johnston SR. The role of chemotherapy and targeted agents in patients with metastatic breast cancer. European Journal of Cancer. 2011; 47 Suppl 3: S38-47. Kunkler, I.H., Williams LJ, Jack