Spontane Weichgaumenperforation als Hauptsymptom einer chronischen systemischen Erkrankung (M. Wegener)
Ein 47-jähriger, sonst gesunder Mann stellte sich im MKG-chirurgischen Notdienst der Uniklinik Aachen vor. Bei ihm habe sich vor ein paar Stunden ein Loch im Gaumen gebildet, so dass er nun nicht mehr trinken und essen könne. Einige Tage zuvor habe er an derselben Stelle eine Blase gespürt, die nun geplatzt sei.
Anamnestisch waren ein Nikotinkonsum mit 20 PY, gelegentlicher Alkoholkonsum sowie ein lumbales Facettensyndrom mit Facettengelenkinfiltration bekannt. Ansonsten waren bei dem Patienten keine chronischen allgemeinen oder infektiösen Erkrankungen bekannt. Die Dauermedikation zur Linderung der Rückenschmerzen war auf Tilidin und Ibuprofen beschränkt. Von Beruf ist der Mann Maler, jedoch zum damaligen Zeitpunkt arbeitsuchend gemeldet. Auf eine gezielte Nachfrage berichtete er, seit circa anderthalb Jahren beim Schnäuzen regelmäßig blutige Borken bemerkt zu haben. In den letzten sechs Monaten fühle er sich abgeschlagen, schläfrig und habe keinen Appetit. Er habe ungewollt zehn Kilogramm abgenommen und schwitze phasenweise nachts so stark, dass er die Wäsche wechseln müsse.
Bei der klinischen Untersuchung zeigte sich ein altersentsprechendes, jedoch sanierungsbedürftiges Gebiss und eine circa 1 cm x 0,5 cm große, glatt begrenzte Perforation im hinteren Drittel des Hartgaumens, ohne Anhalt für frische Blutung. Bei der Nasenspiegelung ließ sich ebenfalls keine frische Blutung feststellen, doch es bestand eine fortgeschrittene Destruktion im Bereich vom Nasenseptum und der Nasenmuscheln beidseits. Die sichtbaren Schleimhäute intranasal waren gerötet, verkrustet und fibrinbelegt. Die regionalen Lymphknoten waren indolent und nicht vergrößert. Differenzialdiagnostisch kamen primär folgende Zustände infrage: sinunasales Karzinom, Schleimhaut- und Drüsen-assoziierte Malignome, extranodales Lymphom, M. Wegener, Lues oder Drogenmissbrauch.
Diagnostik, Behandlung und klinischer Verlauf
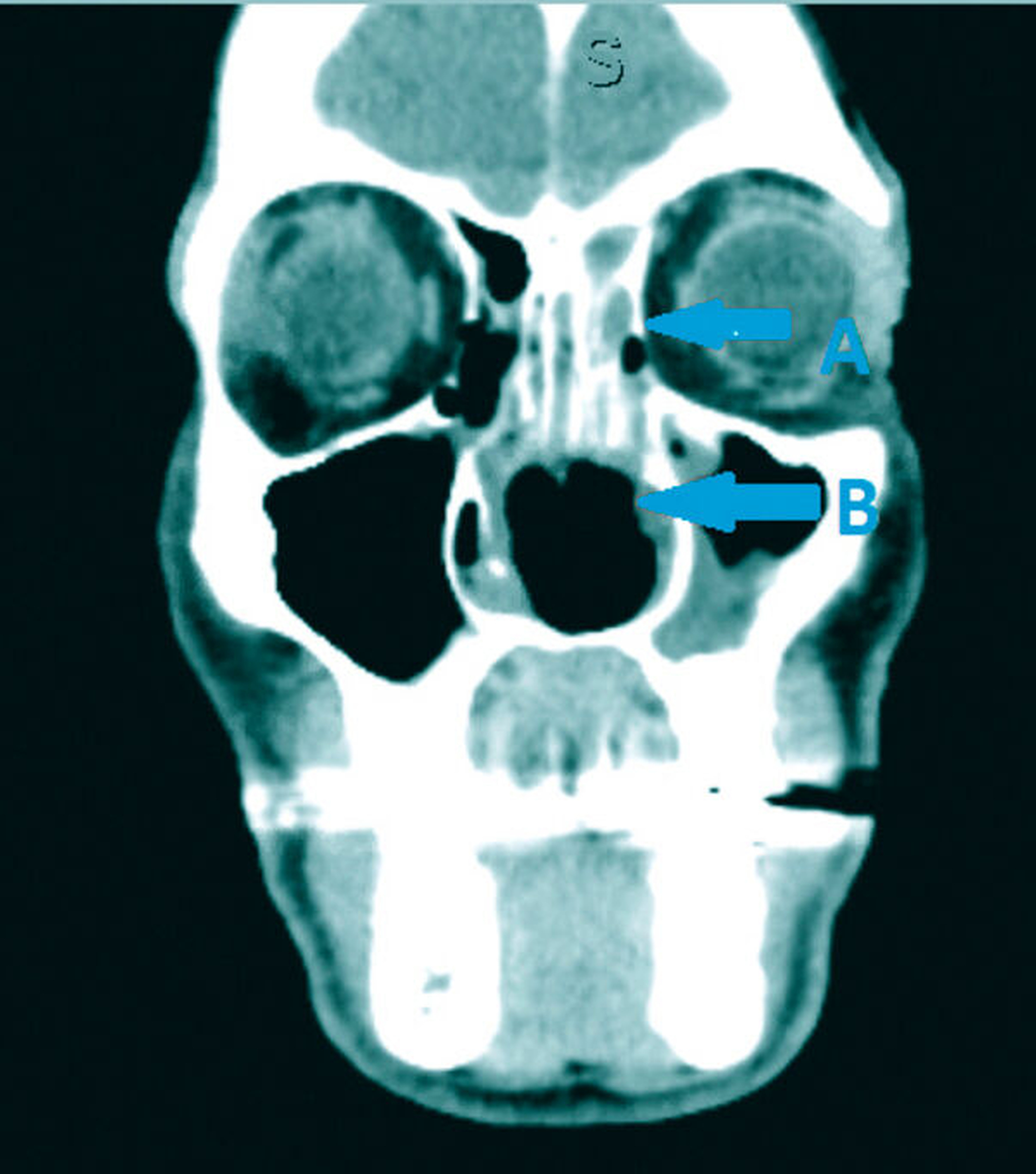
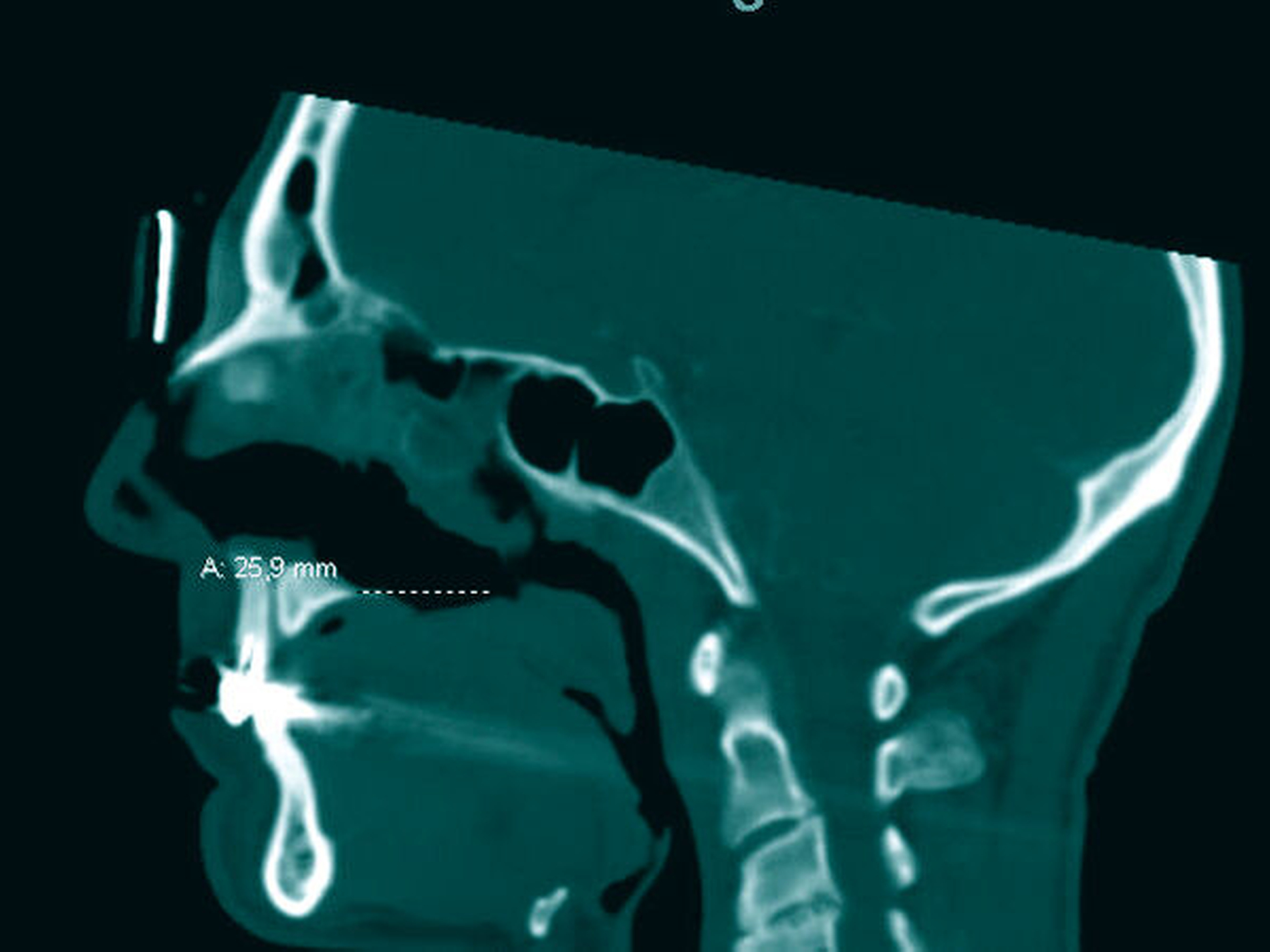
Es folgten eine Blutabnahme mit Routinelabor und Serologie (Lues, HIV, Hepatitis C) sowie eine Alginatabformung zur Herstellung einer Tiefziehschiene. Der Patient wurde zur weiteren Planung und Schieneneingliederung am Folgetag einbestellt. Nach einer raschen CT-Untersuchung mit Kontrastmittel Kopf/Hals (Abbildungen 1 bis 3) erfolgte eine endoskopische Rhinoskopie mit bioptischer Sicherung in ITN unter stationären Bedingungen.
CT-Befund Kopf/Hals: Weichteil-dichte Raumforderung im Bereich der linksseitigen Ethmoidalzellen, vollständige Verlegung des Sinus frontalis links sowie teilweise Verlegung rechtsseitig; zirkuläre Schleimhautschwellung in beiden Sinus maxillaris bei ausgedehnter Destruktion von Nasenseptum, Nasenmuscheln, der medialen Sinuswände und des Hartgaumens sowie subtotal verlegte linke Mastoidzellen bei regelrechter Belüftung vom Mittelohr beiderseits.
Aufgrund einer starken lokalen Entzündungsreaktion kam es intraoperativ zur mäßigen diffusen Blutung, die mit einer Salbentamponade gut gestillt werden konnte. Die Tamponade konnte am zweiten postoperativen Tag entfernt und der Patient nachblutungsfrei bis zur Besprechung des histopathologischen Befunds entlassen werden.
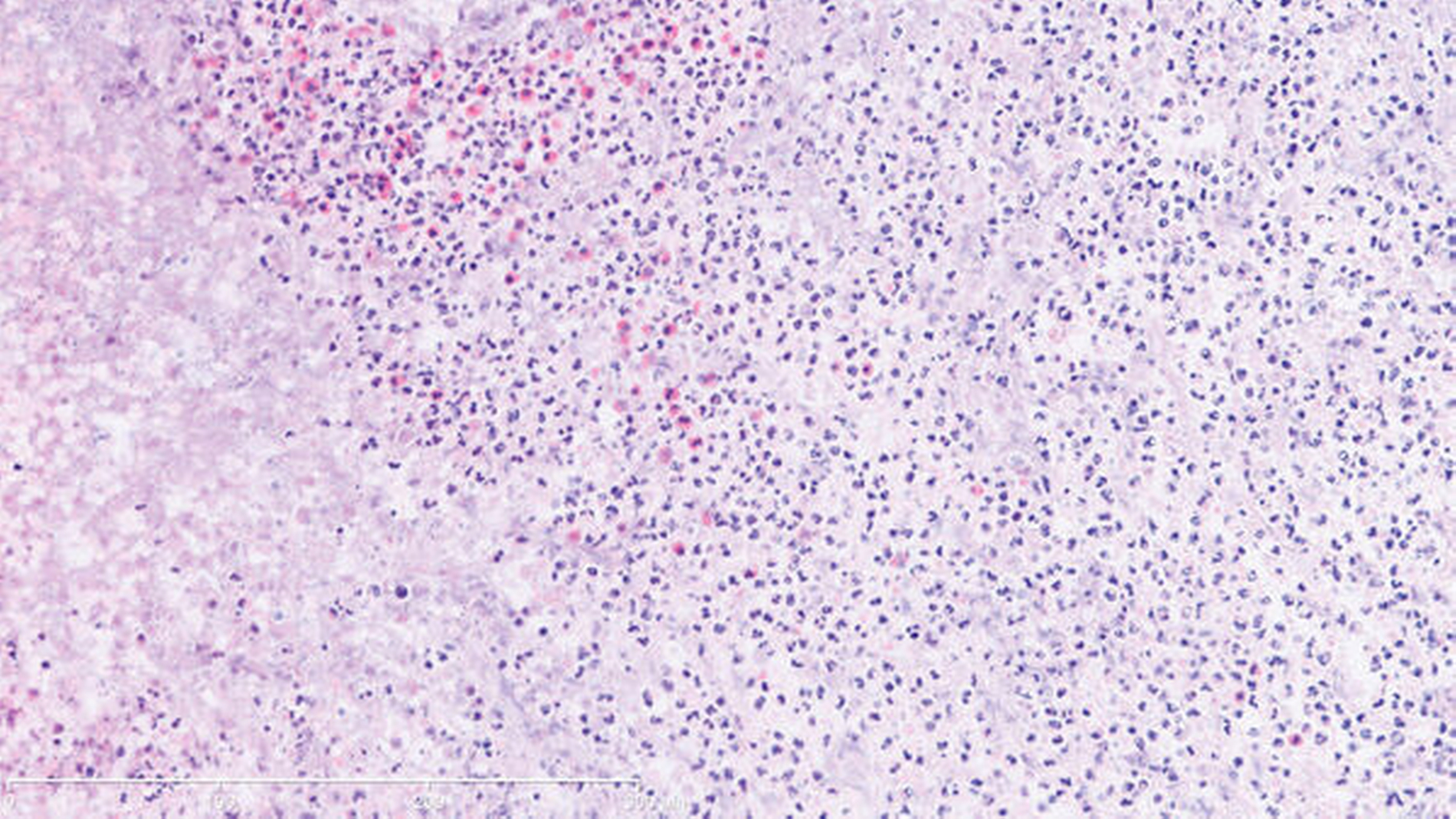
Bei der Besprechung am zehnten postoperativen Tag war der Patient beschwerdefrei. Eine orale Ernährung war mit der Tiefziehschiene suffizient möglich. Die histologische Untersuchung von mehreren intranasalen Proben ergab keinen Anhalt für eine solide Neoplasie oder für ein Lymphom. Es zeigte sich eine teils chronische, teils fokal floride Entzündung mit Ulzeration und Nekrosen, außerdem eine deutliche Eosinophile. Granulome oder eine eindeutige Vaskulitis lagen nicht vor (Abbildung 4). Bei negativer Infektionsserologie, unauffälligen Routinelaborwerten (nur leichter CRP-Anstieg 32,5 mg/l – Norm < 5 mg/l) und einem hochgradigen klinischen und histologischen Verdacht auf M. Wegener wurde der Patient zunächst in die heimatnahe Klinik für internistische Rheumatologie zur weiteren Abklärung und systemischen Therapie überwiesen. Der chirurgische Defektverschluss mittels Palatoplastik wurde in Rücksprache mit den internistischen Kollegen nach Einleitung der Remissionsinduktion und Ausschleichen der entsprechenden Medikamente in circa sechs Monaten geplant.
Trotz der suffizienten oralen Ernährung kam es bis zur Therapieeinleitung zu einem weiteren Gewichtsverlust von 7 kg und zu einer Verschlechterung des Allgemeinzustands, weswegen die weitere internistische Abklärung unter stationären Bedingungen stattfand. Neben der umfassenden körperlichen Untersuchung, Blutuntersuchung und Sammelurin, erfolgten eine Computertomografie vom Thorax/Abdomen und ein MRT Kopf/Hals. Außer dem Nachweis von c-ANCA (Anti-Neutrophile z(c)ytoplasmatische Antikörper) 1:320 (Norm 1:< 10) und Proteinase 3 (PR3)-AK 58.0 (Norm < 2) sowie eines 5 mm messenden soliden Rundherds im apikalen Lungenoberlappen rechts ergaben sich dabei keine neuen pathologischen Befunde. Die Nierenfunktion war stets unbeeinträchtigt. Der Rundherd wurde als Manifestation der Systemerkrankung gewertet. Die Diagnose lautete: PR3-ANCA-assoziierte Granulomatose mit Polyangitis (früher M. Wegener).
In der Klinik für internistische Rheumatologie wurden wöchentliche Infusionen mit Rituximab 700 mg (himärer monoklonaler Antikörper gegen das Oberflächenantigen CD20 der B-Lymphozyten), Prednisolon 10 mg p.o. 1–0–1 sowie Dekristol 20.000 I.E. wöchentlich verordnet.
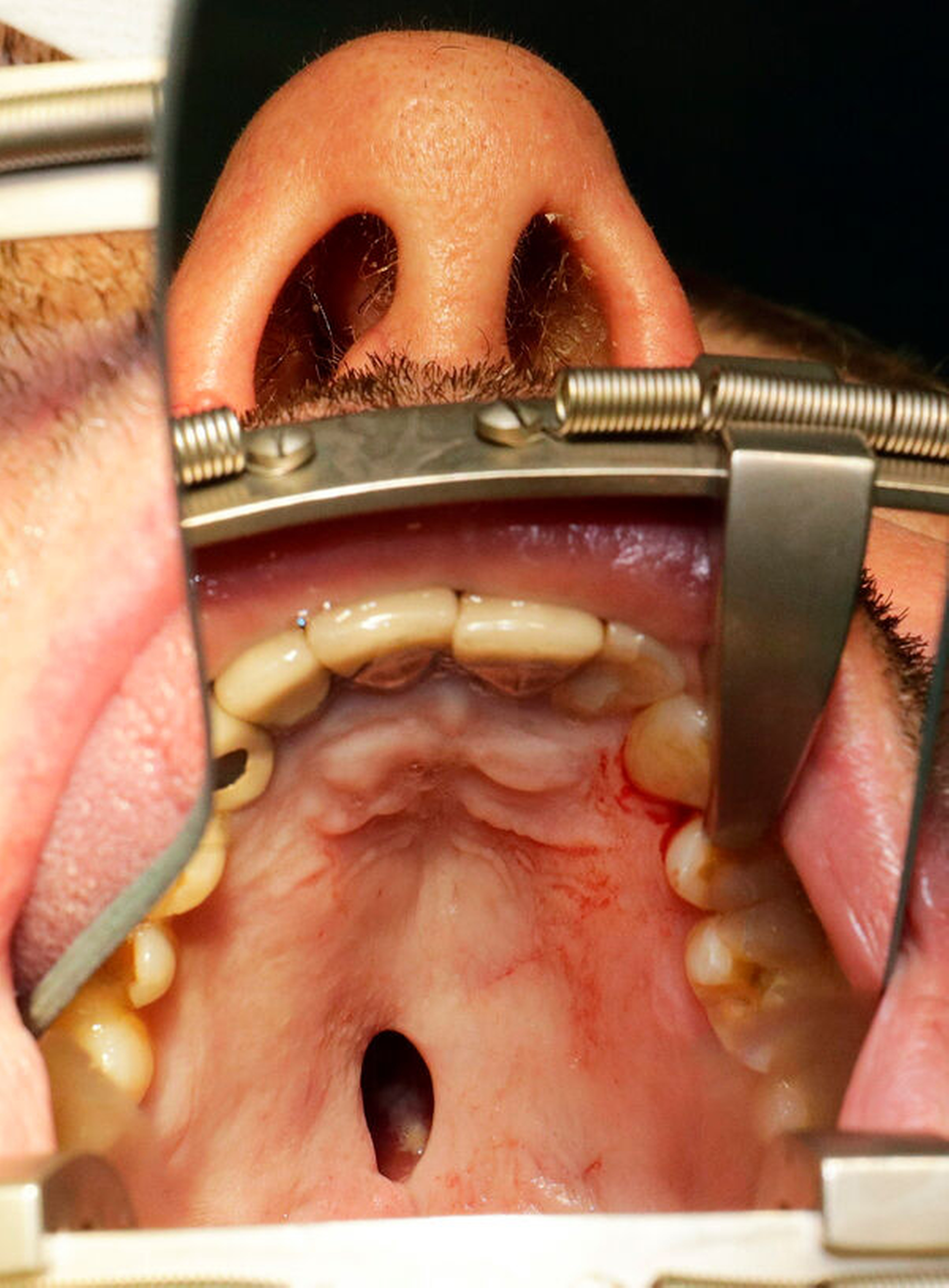
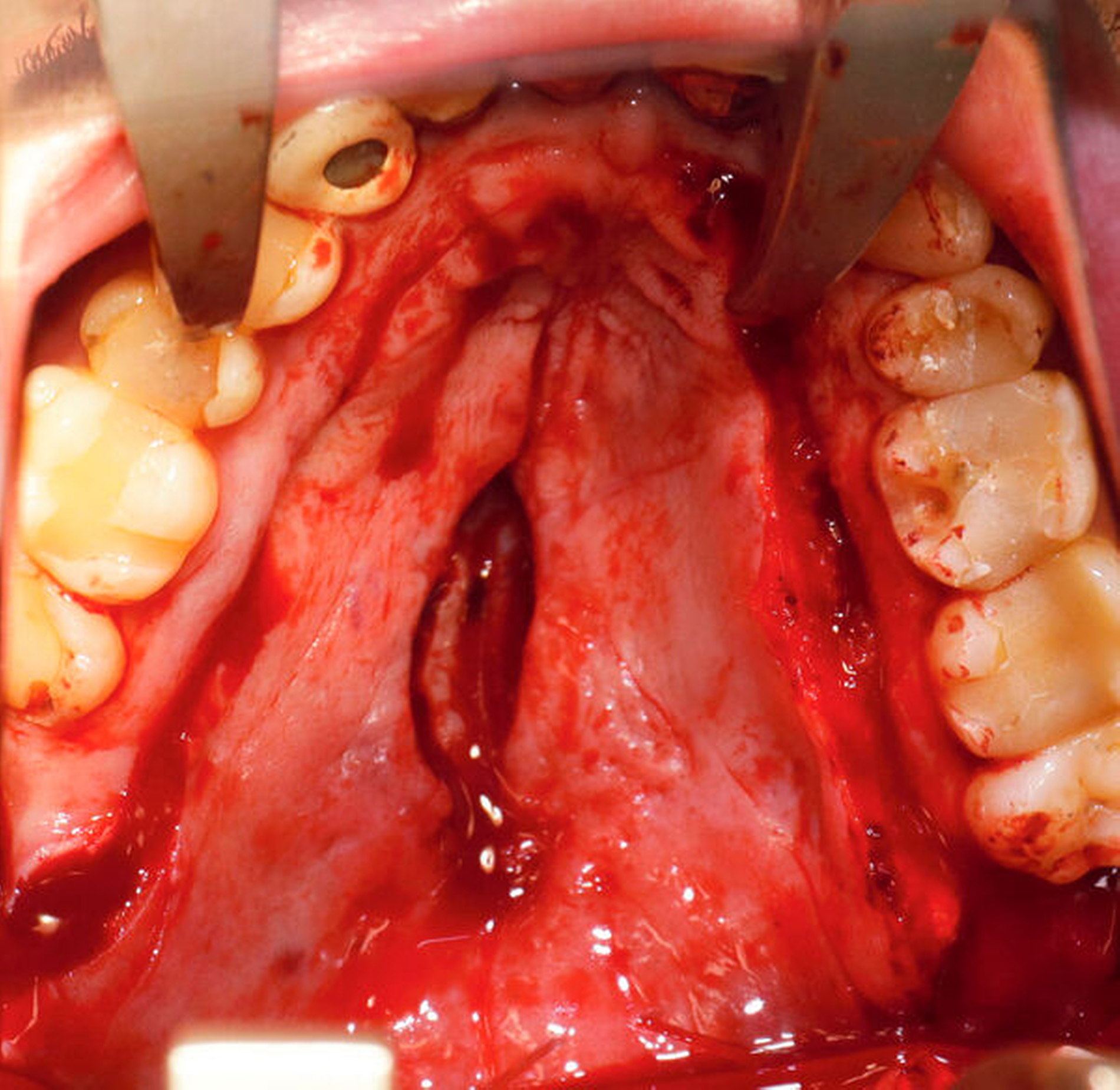
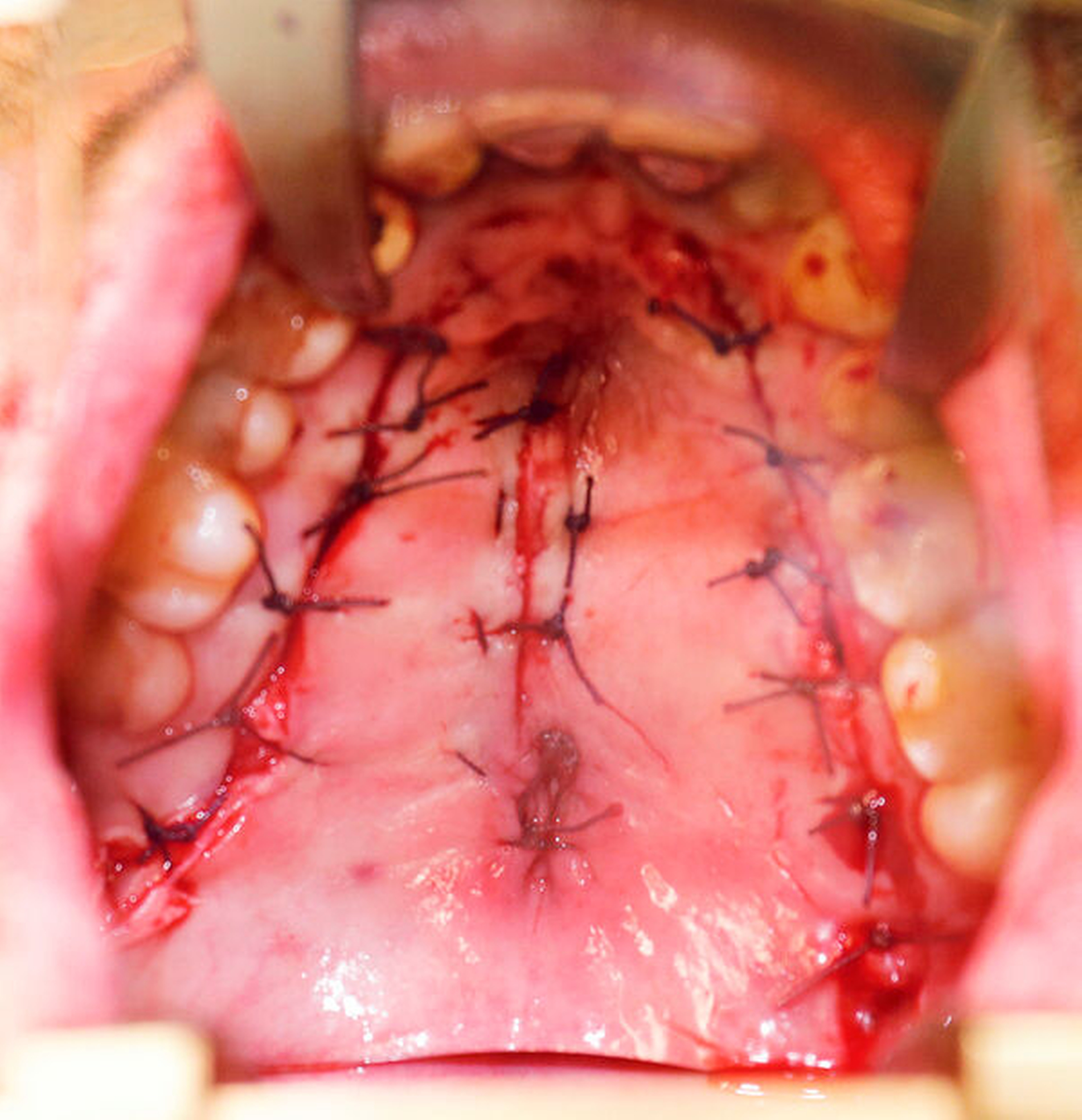
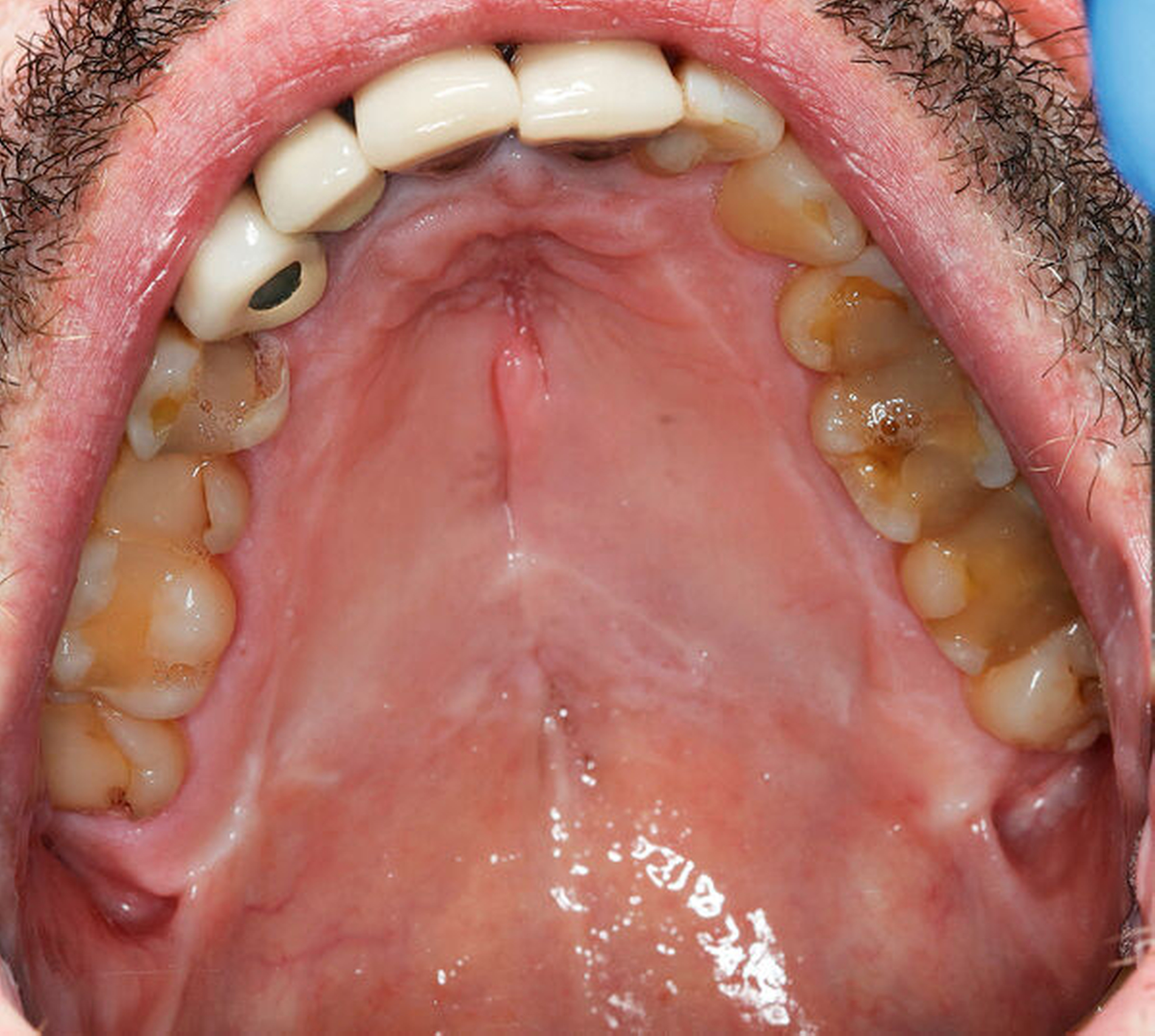
Nach vier Monaten konnten die internistische Therapie unter Remission bei einer deutlichen Besserung des Allgemeinzustands ausgeschlichen und der operative Defektverschluss geplant werden. Die zweischichtige Palatoplastik führten wir in oraler Intubationsnarkose unter stationären Bedingungen durch (Abbildungen 5–7).
Am dritten postoperativen Tag wurde der Patient mit stadiengerechter Wundsituation in die ambulante Nachsorge entlassen. Es wurde flüssig-breiige Kost für zwei Wochen empfohlen, sowie ein striktes Schnäuz- und Nikotinverbot für drei Wochen ausgesprochen. Die intraoralen Fäden wurden am 14. postoperativen Tag entfernt.
Diskussion
Granulomatose mit Vaskulitis (M. Wegener) ist eine klar abgrenzbare klinisch-pathologische Entität, die durch nekrotisierende Vaskultis der vorwiegend kleinen und mittelgroßen Arterien und Venen mit ulzerierenden, nicht verkäsenden Granulomen des unteren und des oberen Respirationstrakts (Nase, NNH, Mittelohr, Oropharynx, Lunge) in Verbindung mit Nierenbefall (Glomerulonephritis) gekennzeichnet ist. Die relativ seltene Krankheit hat eine Prävalenz von 5:100.000, wobei die weiße Bevölkerung bei gleicher Geschlechtsverteilung deutlich häufiger betroffen zu sein scheint. Die Krankheit kann in jedem Alter auftreten, wobei nur 15 Prozent der Betroffenen unter 19 Jahren und Kinder ganz selten betroffen sind. Das mittlere Manifestationsalter liegt in der vierten Lebensdekade.
Beschwerden auf dem HNO-Gebiet (therapieresistente Entzündung der Nasennebenhöhlen, eitrig blutige Nasensekretion oder Schleimhautulzerationen) kündigen mit bis zu 70 Prozent den Krankheitsbeginn an. Die fortschreitende Destruktion des Nasenseptums kann bis zur Sattelnasendeformität führen. Zweithäufig treten Lungenbeschwerden wie Husten, Dyspnoe, Hämoptysen und thorokales Unbehagen auf. Die fortschreitende Lungenbeteiligung kann zu Bronchialstenose und Atelektasenbildung führen. In Zusammenschau mit der B-Symptomatik (Fieber, Nachtschweiß, Gewichtverlust) kann differenzialdiagnostisch schnell ein Lungenmalignom infrage kommen. Im Krankheitsverlauf kommen sowohl unspezifische Gelenkschmerzen, Hautläsionen (Papeln, Bläschen, palpable Purpura, Ulzera, subkutane Knötchen) und Augenbeteiligung (Konjunktivitis, Dakryozystitis, Vaskulitis der Ziliargefäße, Bulbusprotrusion durch intraorbitale Raumforderung) als auch die sehr häufige Nierenbeteiligung hinzu. Im Endeffekt hat die rasch fortschreitende renale Symptomatik unbehandelt die hohen Mortalitätsraten durch Nierenversagen zur Folge.
Laborchemische Untersuchungen zeigen außer der stark beschleunigten Blutsenkungsgeschwindigkeit keine eindeutigen Befunde. Lediglich die Erhöhung von c-ANCA mit Anti-Proteinase-3-Zielantigen in Zusammenschau mit den klinischen, radiologischen (CT-Thorax) und histologischen (Biopsie von NNH, Lunge, Niere) Befunden erlauben die sichere Diagnosestellung. Eine c-ANCA-Erhöhung findet man letztendlich nur in bis zu 50 Prozent der Fälle im Initialstadium und erst im fortgeschrittenen Stadium in 95 Prozent der Fälle. Darüber hinaus findet man falsch positive c-ANCA-Werte durchaus bei bestimmten Infektionen (zum Beispiel Hepatitis C) und neoplastischen Prozessen. Während die Lungen- und Nierenbiopsien im generalisierten Stadium meist ganz typische histologische Befunde mit Granulombildung und Vaskulitis liefern, sind die Proben aus den Nasenhaupt- und Nebenhöhlen im lokal begrenzten Initialstadium häufig nicht repräsentativ und durch eine floride, einschmelzende Entzündung mit Nekrosen gekennzeichnet. Differenzialdiagnostisch sollte M. Wegener von einer anderen, jedoch mit 1:1.000.000 deutlich selteneren Vaskulitis (Goodpasture-Syndrom) abgegrenzt werden. Dabei kommt es vordergründig zum direkten Nieren- und Lungenbefall [Suttorp et al., 2016].
Abhängig von der Gesamtsituation und der klinischen Manifestation erfolgt die Induktion der Remission mit Ciclophosphamid (Zytostatikum) oder Rituximab in Kombination mit Glukokortikoiden. Anschließend wird eine Erhaltungstherapie zum Beispiel mit Methotrexat (Zytostatikum/Folsäureantagonist), Glukokortikoiden oder auch Rituximab bis zu 24 Monate empfohlen. Trotz eines im Regelfall guten initialen Ansprechens kommt es bei der Hälfte der Betroffenen zu Rezidiven, die wiederum gut zu behandeln wären. Aufgrund der Tatsache, dass die Autoantikörper bei den Patienten häufig dauerhaft erhöht bleiben, ist für die Diagnosestellung eines Rezidivs bei der erneuten Beschwerdezunahme nicht nur eine Laboruntersuchung, sondern meist ein erneutes komplettes Staging erforderlich.
Dr. Dr. Evgeny Goloborodko
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie,
Universitätsklinikum RWTH Aachen
Pauwelsstr. 30, 52074 Aachen
Dr. med. dent. Nina Wagenknecht
Klinik für Mund-, Kiefer- und Gesichtschirurgie,
Universitätsklinikum RWTH Aachen
Pauwelsstr. 30, 52074 Aachen
Prof. Dr. Dr. Ali Modabber
Klinik für Mund-, Kiefer- und Gesichtschirurgie,
Universitätsklinik RWTH Aachen
Pauwelsstr. 30, 52074 Aachen
Dr. med. Katharina Lindemann-Docter
Klinik für Pathologie,
Universitätsklinikum RWTH Aachen
Pauwelsstr. 30, 52074 Aachen
Prof. Dr. Dr. Frank Hölzle
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie,
Universitätsklinikum RWTH Aachen
Pauwelsstr. 30, 52074 Aachen
Fazit für die Praxis
Abgeschlagenheit, Schläfrigkeit, Appetitlosigkeit, Gewichtsverlust – im weitesten Sinn die B-Symptomatik – stellen einen häufigen Symptomkomplex dar. Die Ursachen können mannigfaltig sein – von Depressionen bis Malignomen, über Autoimmun- und endokrinologische Erkrankungen. Nur die erfassbaren Organbeschwerden können zu einer sicheren Diagnostikplanung und Diagnosestellung verhelfen.
ANCA-assoziierte Vaskulitiden repräsentieren zwar eine relativ seltene Erkrankungsgruppe des rheumatoiden Kreises, die ersten Organmanifestationen entstehen meistens jedoch im Bereich des oberen und des unteren Respirationstrakts.
Die Überweisung zu spezialisierten Fachärzten, beispielsweise auf dem Gebiet der Mund-Kiefer-Gesichtschirurgie, beschleunigt die Einleitung von Diagnostik und Therapie.
Literaturliste
Schirmer, J.H., Aries, P.M., de Groot, K. et al. S1-Leitlinie Diagnostik und Therapie der ANCA-assoziierten Vaskulitiden. Z Rheumatol 76, 77–104 (2017).
Suttorp N, Möckel M, Siegmund B et al., Hrsg. Harrisons Innere Medizin. 19. Auflage. ABW Wissenschaftsverlag; 2016. Teil 15, Abschnitt 2, Kap. 385