Erstbeschreibung eines zystisch transformierten Plattenepithelkarzinoms der Parotis
Immer wieder sieht sich der niedergelassene Zahnarzt mit Pathologien konfrontiert, die nicht unmittelbar in sein Gebiet fallen. Nicht selten kommt es im Rahmen eines Zahnarztbesuchs zur Erstdiagnose eines Tumors der kleinen und großen Speicheldrüsen. Aufgrund der Vielzahl möglicher Differenzialdiagnosen ist hier eine ausführliche klinische und eine anschließende bildgebende Diagnostik von großer Bedeutung. Insbesondere maligne sollten von benignen Prozessen unterschieden und entsprechende Therapieentscheidungen getroffen werden. Anhand des vorliegenden Falls wird deutlich, welche Bedeutung dem niedergelassenen Zahnarzt als erstem Ansprechpartner für den Patienten und der anschließenden korrekten Einschätzung und Organisation der Weiterbehandlung zukommt.
Kasuistik
Ein 81-jähriger Mann stellte sich mit einer seit drei Wochen progredienten, indolenten Raumforderung präaurikulär links in der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz vor. Klinisch zeigte sich ein nicht druckdolenter Befund von palpatorisch 2 cm x 2 cm Größe im Bereich der linken Glandula parotidea (Abbildung 1). Der Patient beklagte weder eine typische Okklusionssymptomatik (Schmerzen vor und während der Nahrungsmittelaufnahme, typisch für einen Verschluss des Speicheldrüsengangs bei Sialolithiasis), noch eine Xerostomie (zum Beispiel im Rahmen eines Sjögren-Syndroms).
Die Raumforderung sei innerhalb der vergangenen drei Wochen entstanden und nehme immer wieder an Volumen ab und zu. In der enoralen Untersuchung zeigten sich keinerlei Auffälligkeiten im Sinne eines geröteten Ausführungsgangs, von Pus oder eines über den Verlauf des Ductus parotideus palpatorischen Steins. Auf Massage der Drüse entleerte sich regelrecht Speichel über den Ausführungsgang. Abseits der lokalen Symptomatik berichtete der Patient lediglich über kleinere chirurgische Eingriffe in der Vorgeschichte, eine Hypothyreose und einen Nikotinabusus von 50 Packungsjahren.
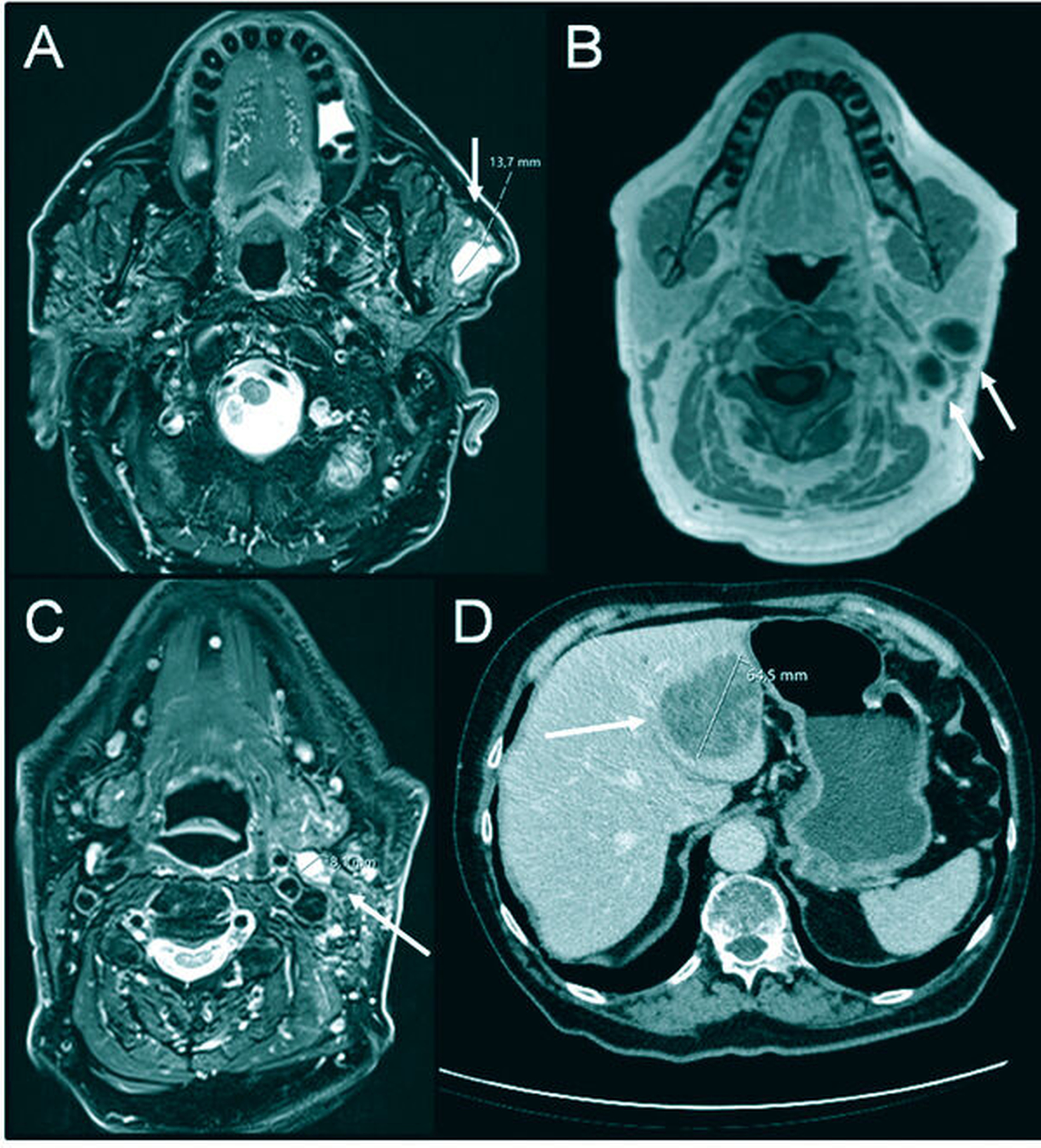
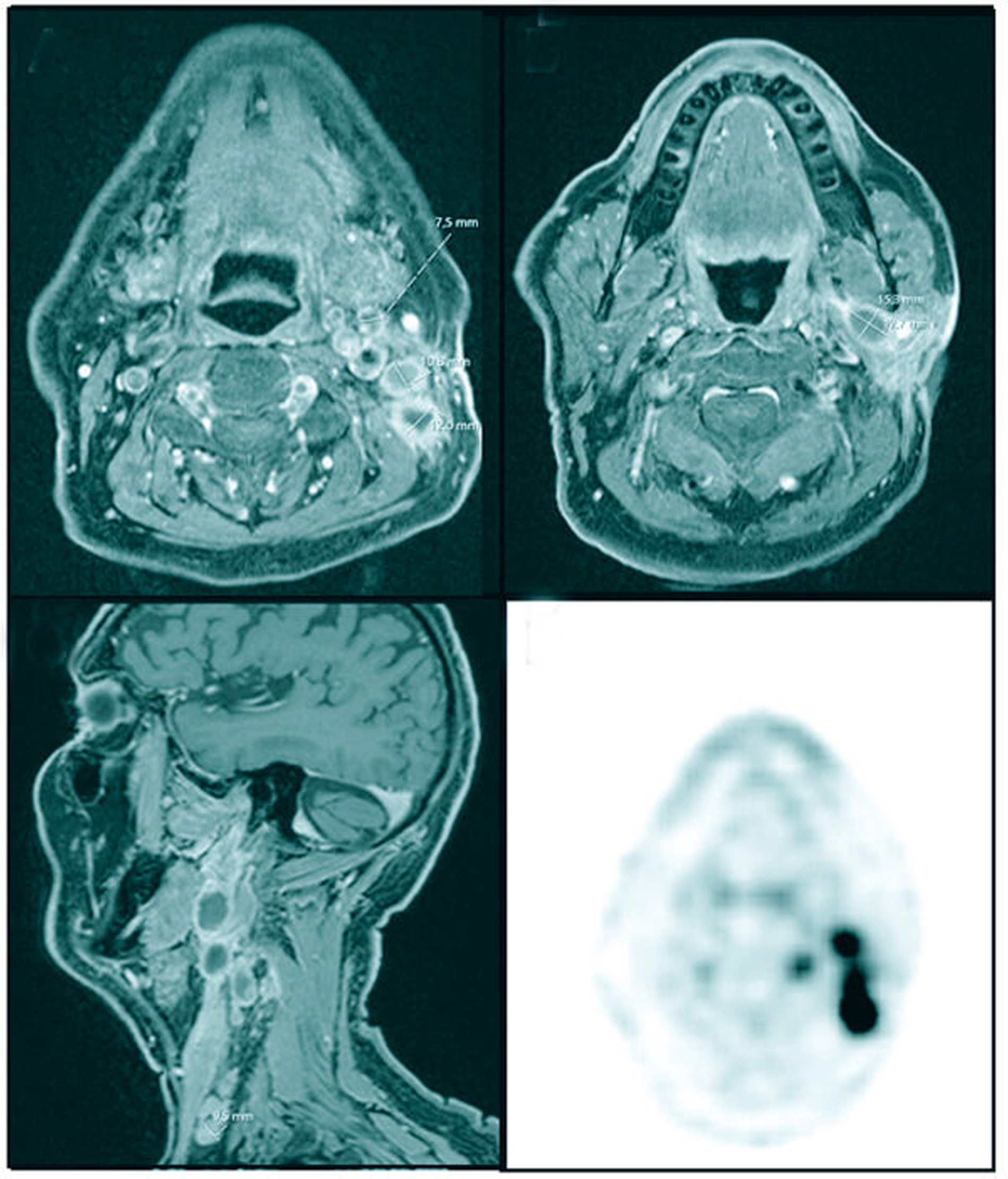
Aufgrund der klinisch nicht eindeutig zuzuordnenden Pathologie wurde zur weiteren Diagnostik eine Sonografie durchgeführt. Hier zeigte sich ein zystisch imponierender Befund von 1,7 cm x 1,5 cm mit dorsalem Schallschatten. Eine Magnetresonanztomografie (MRT) des Kopfes und Halses schloss sich zur radiologischen Korrelation und zum Ausschluss einer Multilokularität oder eines malignen Befunds an. Sie zeigte eine hyperintense ovuläre homogene T2-Signalintensitätsanhebung im oberflächlichen anterioren Lappen der Glandula parotis links mit einem Durchmesser von 14 mm und einer nodulären randständigen Kontrastmittelanreicherung, so dass ein maligner Befund vermutet werden musste (Abbildung 2). Einige weitere ovuläre T2-Signalintensitätsanhebungen befanden sich außerdem dorsocaudal der Glandula parotis in Level II A und B sowie in Level V. In Anbetracht des radiologischen Befunds wurde der Verdacht auf ein Malignom der Glandula parotis links mit Lymphknotenmetastasen im Level II A und B sowie suspekten Lymphknoten in Level V A links gestellt.
Biopsie und Enukleation
Aufgrund des klinisch und radiologisch uneindeutigen Befunds wurde die Indikation zur Probenentnahme gestellt. Hierbei sind grundsätzlich zwei Optionen möglich und anhand deren Vor- und Nachteile mit dem Patienten zu besprechen. Eine Stanzbiopsie als wenig invasive Methode mit höherer Fehleranfälligkeit aufgrund der geringen und gegebenenfalls nicht ausreichenden oder nicht repräsentativen Gewebeprobe muss gegenüber der invasiven vollständigen Exzision, hier im Sinne einer lateralen Parotidektomie, abgewogen werden.
Insbesondere die Gefahr der Parese von Ästen des Nervus facialis veranlasste den Patienten im vorliegenden Fall zur Wahl der Stanzbiopsie – auch unter dem Risiko eines Progresses durch Verzögerung der vollständigen Exzision des potenziell malignen Befunds. Die Entnahme der Stanzbiopsie wurde in Vollnarkose durchgeführt. Hierbei entleerte sich bei Punktion reichlich klare Flüssigkeit. Die anschließende histopathologische Aufarbeitung ergab jedoch keinen wegweisenden Befund, so dass schließlich die Indikation zur lateralen Parotidektomie gestellt wurde.
Der Zugang erfolgte über eine präaurikuläre Schnittführung mit Extension nach zervikal (Abbildung 3). Unter Monitoring des Nervus facialis wurde der laterale Anteil der Drüse sorgfältig von den Nervästen präpariert. Hierbei zeigte sich eine zystische, teils knorpelig umbaut wirkende Struktur, aus der sich nach Eröffnung klare Flüssigkeit entleerte. Die Entnahme gestaltete sich aufgrund der Verwachsung mit dem umgebenden Drüsengewebe schwierig. Um auch die radiologisch kaudaler – einmal lateral und einmal medial des Musculus sternocleidomastoideus – gelegenen Raumforderungen entfernen zu können, wurde die Präparation nach zervikal ausgeweitet. Auch hier zeigten sich flüssigkeitsgefüllte, zystische Strukturen.
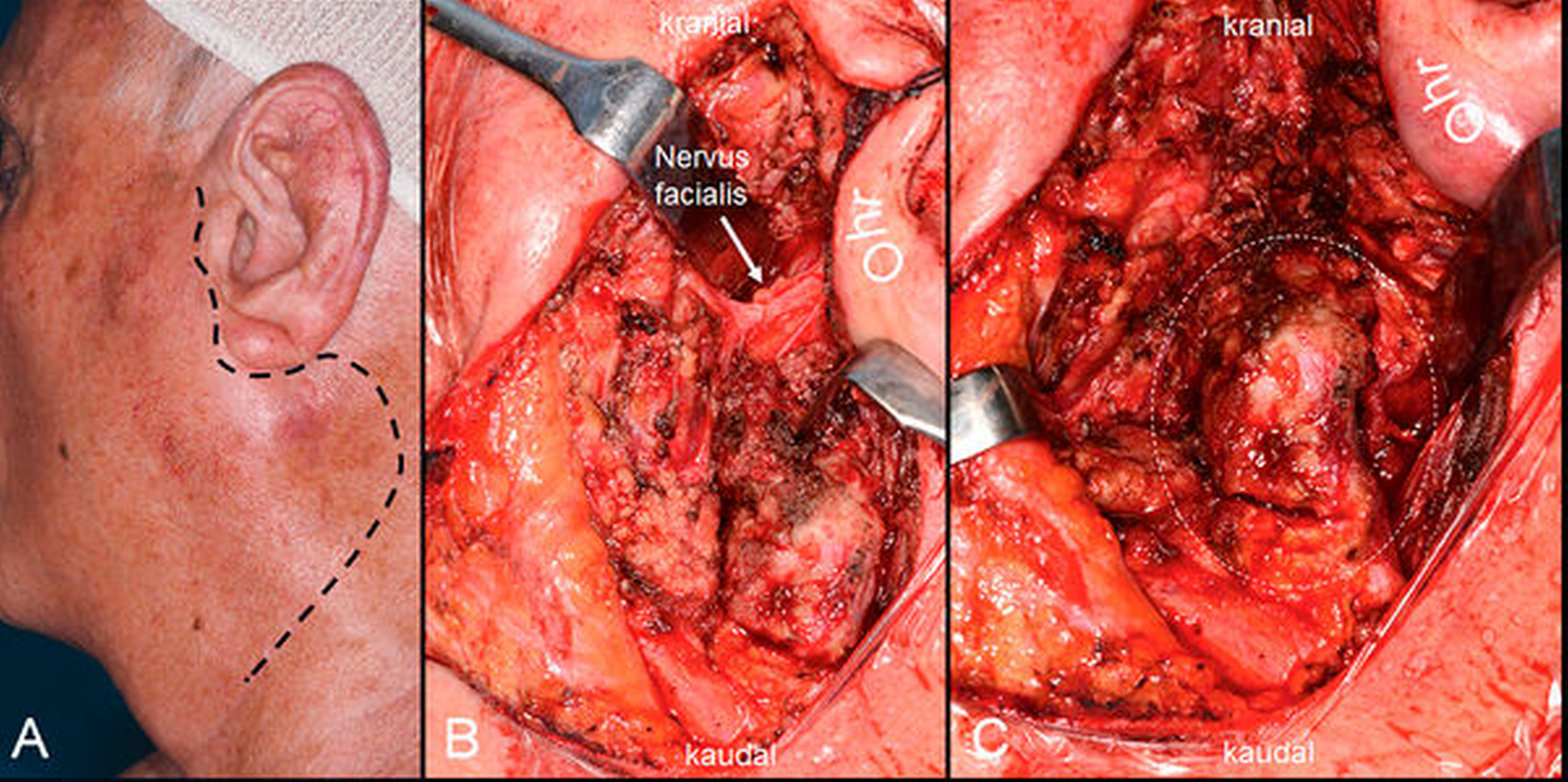
Aufgrund der anatomischen Nähe zur Arteria carotis und zum Nervus accessorius ebenso wie der bisher nicht gesicherten Differenzierung zwischen einem benignen und einem malignen Geschehen wurde die Entscheidung zur Enukleation gegenüber einer radikalen Resektion gestellt. Der Verschluss der Wunde erfolgte unter Anlage einer Rauch-Plastik – einer Mobilisation von Teilen des Musculus sternocleidomastoideus und Rotation in den Defekt zur Deckung des freiliegenden Speicheldrüsengewebes und Prävention des Frey-Syndroms.
Histologie zeigt Proliferation
In der anschließenden histopathologischen Aufarbeitung zeigte sich ein in Speicheldrüsengewebe liegendes fibrosiertes Areal mit perifokaler entzündlicher Infiltration und zentraler zystischer Erweiterung, ausgeschlagen mit einem solide wachsenden Proliferat mit zum Teil spindelzelliger Morphologie, pleomorphen Kernen und prominenten Nukleolen. In der immunhistochemischen Untersuchung wiesen die Zellen eine kräftige Anfärbung mit Antikörpern gegen Panzytokeratin, Zytokeratin 5/6, Zytokeratin 7, p40 sowie p53 auf, während der Nachweis von SM, Aktin, CD68, CD117 und S100 bei positiver interner Kontrolle negativ blieb. Anhand des Ki67-Index konnte eine stark gesteigerte Proliferation nachgewiesen werden. Diese Manifestationen eines solide, teils spindelzelligen Proliferats passte entsprechend immunhistochemischer Kontrastierung zu einem teilweise zystisch transformierten SCC der Parotis.
Der Patient entschied sich nach Aufklärung gegen eine Nachresektion oder Bestrahlung.
Innerhalb des postoperativen Verlaufs zeigte sich eine persistierende Speichelsekretion durch Eröffnung der Kapsel der Glandula parotidea, die jedoch unter Therapie mit Scopolamin-Pflastern innerhalb von vier Wochen komplett regredient war. Der weitere Verlauf der Wundheilung gestaltete sich unauffällig mit einem guten ästhetischen und funktionellen Ergebnis ohne bleibende Schädigung des Nervus facialis.
Ein primäres Leberkarzinom
Aufgrund des nun histologisch gesicherten malignen Befunds wurde ein Staging eingeleitet. Die dermatologische Untersuchung auf maligne Befunde der Haut erbrachte kein Ergebnis. Die durchgeführte Computertomografie (CT) des Abdomens zeigte eine 6,5 cm große Raumforderung des linken Leberlappens.
In der anschließenden Vorstellung innerhalb des interdisziplinären Kopf-Hals-Tumorboards wurde die Durchführung einer radiologisch gesteuerten Leberpunktion zur Klärung der Genese der hepatischen Raumforderung getroffen. Die hierbei entnommenen Proben zeigten abweichend von der primären Annahme einer Metastase des zystisch transformierten SCC der Parotis das Vorliegen eines primären hepatozellulären Karzinoms. In Zusammenschau der Befunde und unter Entscheidungsfindung mit dem Patienten wurde die Indikation zur Leberteilresektion mit kurativer Therapieintention gestellt. Zur Komplettierung des Stagings und mit der Frage nach einem Primarius der zystisch transformierten Raumforderungen der Parotis wurden eine Panendoskopie ebenso wie eine Positronen-Emissions-Tomografie (PET) durchgeführt, die jedoch keinen Anhalt auf das Vorhandensein eines Primärtumors gaben.
Neue Raumforderungen an der Glandula parotis
In der radiologischen Verlaufskontrolle zeigte sich ein rascher Progress des lokalen Geschehens mit zahlreichen neuen, weiteren Raumforderungen. Darstellbar war eine deutlich größenprogrediente, zystoide, randständig kontrastmittelaufnehmende Raumforderung im tieferen Lappen der Glandula parotis mit einem Durchmesser von 15 mm x 13 mm, die Kontakt zu Arteria carotis interna links zeigte. Des Weiteren konnten größenprogrediente Raumforderungen dorsal der Arteria carotis interna und Lymphknoten im Level III und IV bis zu einem Durchmesser von 10 mm dargestellt werden (Abbildung 4).
Parotidektomie
Entsprechend des rasch progredienten Befunds wurde seitens des interdisziplinären Tumorboards die Empfehlung zur radikalen Parotidektomie links und Neck Dissection ausgesprochen. Die Operation erfolgte unter Allgemeinanästhesie über den erweiterten Zugang des ersten Eingriffs. Nach Darstellung der Parotiskapsel entleerte sich milchige Flüssigkeit aus dem Weichgewebe. Von caudal erfolgte eine subplatysmale Aufwärtspräparation auf den Unterkiefer mit Mobilisation des Blocks und anschließender Präparation entlang des Musculus digastricus bis hin zum Musculus sternocleidomastoideus. Nach Darstellung der Vena jugularis interna zeigte diese sich adhärent an das in den Musculus sternocleidomastoideus eingewachsene metastatische Gewebe, so dass beide Strukturen abgesetzt werden mussten. Unter Schonung der Ansa cervicalis, der Nervi hypoglossus et accessorius wurde weiter nach cranial präpariert und die dort lokalisierten Tumorformationen von der Arteria carotis interna abgelöst. Schließlich erfolgte die Absetzung des caudalen Pols der Parotis unter Schonung des Stirn- und Augenastes des Nervus facialis. Im Sinne einer modifizierten Rauch-Plastik wurden Teile des Musculus trapezius abgesetzt und über dem residualen Parotispol befestigt.
Der weitere postoperative Verlauf gestaltete sich unter antibiotischer und analgetischer Therapie unauffällig, so dass der Patient nach einer viertägigen stationären Überwachung in die ambulante Weiterbetreuung entlassen werden konnte. In Anbetracht des Tumorstadiums erfolgte die Anbindung zur adjuvanten Bestrahlung des betroffenen Bereichs. Der Patient wird entsprechend des Tumorboardbeschlusses und leitliniengerecht regelmäßig klinisch und radiologisch nachkontrolliert.
Diskussion
Die Erstvorstellung von Patienten mit einem SCC der Parotis findet typischerweise erst in späten Krankheitsstadien und bei Vorliegen klinischer Symptome statt [Alvi et al., 2020]. Zeichen für die Malignität des Tumors sind ein schnelles Wachstum, ein dolenter Befund, die Unverschieblichkeit der Raumforderung gegenüber dem Umgebungsgewebe, Ulzerationen der darüber liegenden Haut, eine cervikale Lymphadenopathie oder die pathognomonische Paralyse des Nervus facialis. Allerdings kann der Befund auch, wie im vorliegenden Fall, als indolente Raumforderung ohne klinische Symptomatik auffällig werden [Alvi et al., 2020]. Insbesondere in solchen Fällen ist eine differenzialdiagnostische Unterscheidung zu benignen und anderen malignen Befunden schwierig. Mögliche Differenzialdiagnosen reichen von infektiösen Erkrankungen wie Tuberkulose, EBV, CMV und Borreliose, über chronisch-entzündliche Krankheiten (Sarkoidose) bis hin zu unterschiedlichsten Raumforderungen benigner und maligner Genese innerhalb der Speicheldrüse [siehe hierzu auch Heimes und Lippe, 2018].
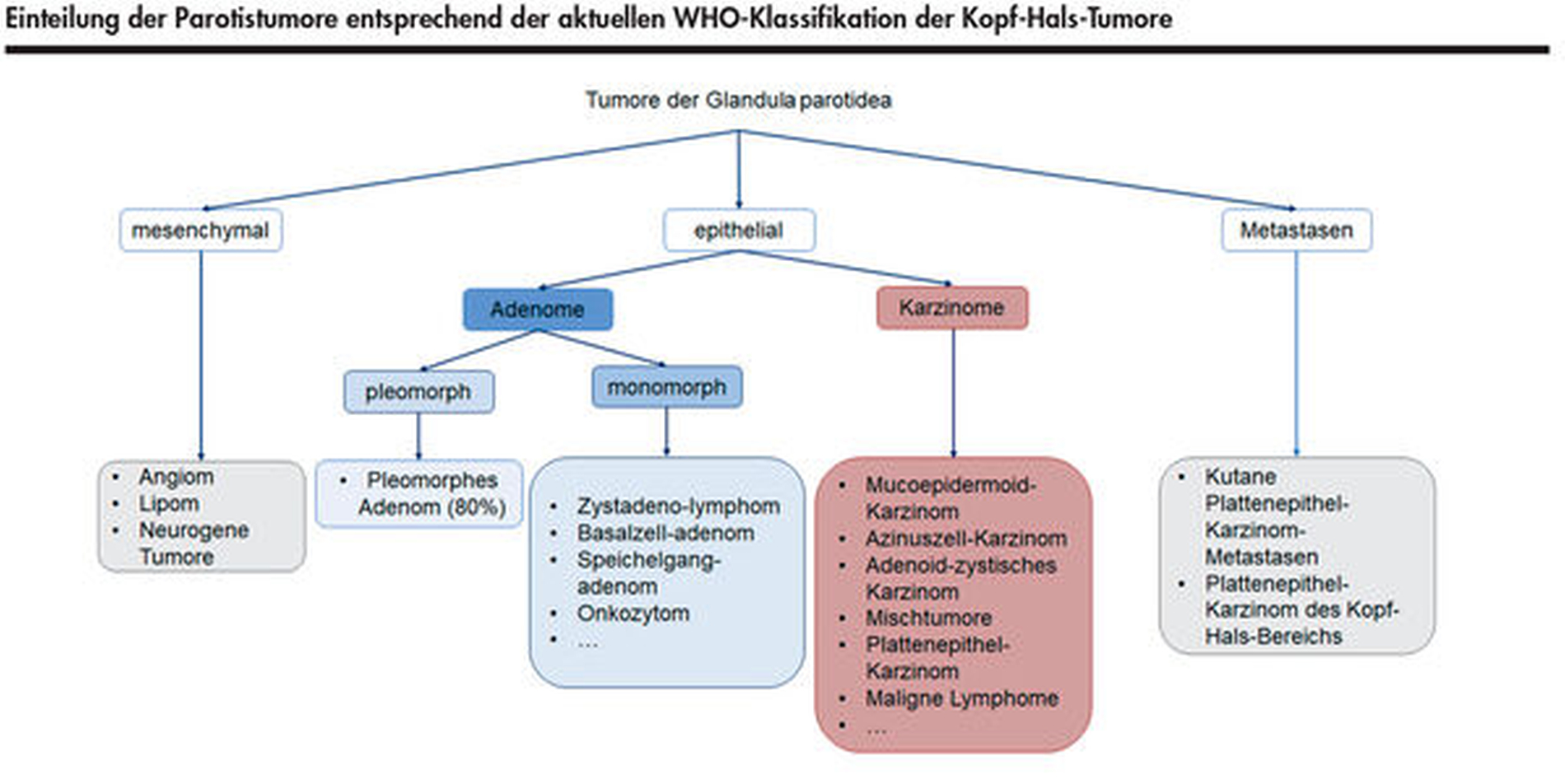
Raumforderungen der Parotis werden primär in benigne und maligne Entitäten unterteilt (Abbildung 5). Bei 80 Prozent der Neoplasien handelt es sich um benigne Formen wie das pleomorphe Adenom oder das Zystadenolymphom. Maligne Tumore hingegen werden entsprechend ihres Ursprungs in eine primäre und eine sekundäre (Metastasen)Form unterteilt [Heimes und Lippe, 2018; Alvi et al., 2020] und entstehen typischerweise nach dem 60. Lebensjahr, während die Prävalenz benigner Entitäten zwischen der vierten und der fünften Lebensdekade am höchsten liegt. Die Inzidenz maligner Speicheldrüsentumore liegt weltweit bei 0,5–3,0/ 100.000 Einwohner pro Jahr [Alvi et al., 2020].
Primäre SCC der Speicheldrüse sind mit einer Häufigkeit von 1,6 Prozent aller Speicheldrüsentumore äußerst selten [Jo et al., 2020; International Agency for Research on Cancer, 2017]. Die Diagnose eines primären Speicheldrüsen-SCC sollte erst nach Ausschluss anderer Speicheldrüsentumore oder Metastasen kutaner und oropharyngealer SCC erfolgen. Primäre Formen eines SCC treten meist innerhalb der Glandula parotidea und nur sehr selten in anderen Speicheldrüsen auf [International Agency for Research on Cancer, 2017; Jo et al., 2020].
Die Ursache eines SCC der Parotis ist meist die Differenzierung aus anderen Tumorentitäten [International Agency for Research on Cancer, 2017], wobei auch die Entstehung aus einer längerfristigen duktalen Obstruktion beispielsweise durch Speichelsteine mit einer anschließenden Meta- und Dysplasie beschrieben wird. Auch eine postradiogene Genese ist möglich [Jo et al., 2020].
Eine – wie im vorliegenden Fall dokumentierte – zystische Transformation eines SCC der Parotis wurde nach Wissen der Autoren bisher in der Literatur nicht beschrieben. Zystische Transformationen von Lymphknotenmetastasen hingegen sind zwar selten und treten vermutlich regionenspezifisch auf, entstammen laut vorliegender Literatur jedoch meist einem Primarius der Kopf-Hals-Region. Hierbei handelt es sich häufig um ein SCC – in 72 bis 90 Prozent der Fälle aus dem Bereich des Waldeyer Rachenrings –, selten auch um papilläre Schilddrüsenkarzinome.
Zum aktuellen Zeitpunkt werden zwei Hypothesen zur Entstehung einer zystischen Transformation einer Lymphknotenmetastase diskutiert. Eine Hypothese geht davon aus, dass es zu einer malignen Transformation von Speicheldrüsenzellen aus dem Waldeyer‘schen Rachenring kommt, die schließlich metastasieren und zystisch transformieren. Die zweite Hypothese beschäftigt sich mit der Idee, dass transformierte Keratinozyten, die eine intrinsische Fähigkeit zur Zystenbildung besitzen, maligne transformieren und in ein Transitions-SCC münden, das schließlich zystische Metastasen bildet [Mokhtari, 2012].
Entsprechend der vermuteten Ätiopathogenese eines SCC der Parotis ist eine plattenepitheliale Metaplasie eines pleomorphen Adenoms oder eines Zystadenolymphoms gegenüber einem primären SCC histologisch schwierig abzugrenzen [Jayaram et al., 1998]. Histologisch ist auch eine Unterscheidung zwischen einem primären SCC der Parotis und einer plattenepithelialen Metastase schwierig. Es wird lediglich vermutet, dass Metastasen gegenüber einem primären SCC eher zu einer zentralen Nekrosebildung neigen. Beide Formen erscheinen makroskopisch als eine zentral im Drüsengewebe liegende Raumforderung mit Extension nach extraparenchymal [Jo et al., 2020].
Da die Speicheldrüse aus sekretorischen, duktalen und myoepithelialen Bestandteilen aufgebaut ist, weisen die meisten Tumoren eine solche Differenzierung auf [Jo et al., 2020]. SCC der Parotis entstammen meist der Haut, entweder als direkte Invasion der Speicheldrüse per continuitatem oder als Metastase, können aber auch aus dem Gehörgang einwachsen. Sie müssen differenzialdiagnostisch von einem Mucoepidermoid-Karzinom und dem Speichelgangskarzinom abgegrenzt werden [Jo et al., 2020].
Das primäre SCC neigt zu einer desmoplastischen Reaktion und umgebender Inflammation ohne Mucinproduktion. Letzteres Charakteristikum unterscheidet das SCC von einem Mucoepidermoid-Karzinom [Jo et al., 2020].
Fazit für die Praxis
Plattenepithelkarzinome der Parotis sind mit einer Häufigkeit von 1,6 Prozent aller Speicheldrüsentumore eine Seltenheit.
Zystisch transformierte Lymphknotenmetastasen entstammen häufig dem Waldeyer Rachenring oder den Tonsillen, weshalb eine Primärtumorsuche mittels Panendoskopie und radiologischer Bildgebung empfohlen wird.
In der klinischen Untersuchung von Patienten mit einer Raumforderung in einer Speicheldrüse ist auf typische Malignitätskriterien zu achten und bei Verdacht auf ein Malignom umgehend an einen Facharzt zu überweisen.
Entscheidend ist eine repräsentative Histologie; sollte diese nicht durch eine Feinnadel-/Stanzbiopsie erreicht werden können, ist eine vollständige Exstirpation des Befunds notwendig.
Goldenberg et al. empfahlen eine radiologische Diagnostik mittels CT oder MRT, gefolgt von einer primären histologischen Sicherung des Befunds mittels Feinnadelbiopsie. Im Fall inkonklusiver oder negativer Ergebnisse wäre eine Exzisionsbiopsie durchzuführen. Bei Vorliegen eines SCC sollen eine Panendoskopie ebenso wie eine Biopsie des Waldeyer Rachenrings, eine beidseitige Tonsillektomie und eine Neck Dissection erwogen werden [Goldenberg et al., 2006].
Die grundsätzliche Klassifikation maligner Tumore der Parotis unterscheidet zwischen Befunden unter 2 cm ohne makroskopische extraparenchymale Ausbreitung oder Nervinvasion als T1-Befund, Befunden zwischen 2 cm und 4 cm Größe ohne extraparenchymale Ausbreitung (T2), T3-Tumoren von einer Ausdehnung über 4 cm mit und ohne extraparenchymale Ausbreitung und T4-Befunden mit Vorliegen einer höhergradigen Invasion von Nachbarstrukturen wie der Haut, der Mandibula, dem Gehörgang und des Nervus facialis (T4a) ebenso wie der Schädelgrube und einem Umwachsen der Arteria carotis (T4b) [Alvi et al.,2020].
Die Standardtherapie maligner Parotistumore besteht in der vollständigen Parotidektomie unter Belassen des N. facialis (solange dieser nicht befallen ist). Eine Neck Dissection ist bei klinisch/radiologisch auffälligem Lymphknotenstau oder großen Befunden (T3, T4) ebenso wie High-grade-Tumoren, wie dem Mucoepidermoid-Karzinom, dem Carcinoma ex Pleomorphes Adenom [Kämmerer et al., 2009] und dem SCC der Parotis durchzuführen.
Grundsätzlich ist bei Malignomen der Parotis mit einer schlechten Ansprechrate auf alleinige Chemotherapie zu rechnen, so dass der Bestrahlung als Adjuvanz eine besondere Bedeutung zukommt. Indikationen für eine Bestrahlung sind Tumore über 4 cm Größe, inkomplette oder knappe Resektionsgrenzen, Rezidive, ebenso wie eine perineurale, venöse oder lymphatische Invasion oder eine Fernmetastasierung des Tumors. Große Relevanz besitzt die Bestrahlung auch in der Therapie des Adenoidzystischen Karzinoms und bei High-grade-Tumoren [Alvi et al., 2020].
Aufgrund der Seltenheit primärer SCC der Parotis ist die Prognose der Erkrankung weitestgehend unbekannt [International Agency for Research on Cancer, 2017], jedoch ist davon auszugehen, dass ein frühes extrakapsuläres Wachstum und ein rascher Progress prognostisch ungünstige Zeichen darstellen [Alvi et al., 2020].
Als negative Prognosefaktoren gelten außerdem ein hohes Patientenalter (> 85 Jahre), eine Tumorgröße über 4 cm, eine extraparenchymale Ausbreitung, lymphatische oder Fernmetastasen. Nach operativer Entfernung der Befunde ist die Fünf-Jahres-Überlebensrate jedoch günstiger als gegenüber einer alleinigen Radiatio anzusehen [Jo et al., 2020], liegt jedoch trotzdem bei nur etwa 30 Prozent [Takahashi et al., 2014].
Zusammenfassung
Anhand des vorliegenden Falls zeigt sich die schwierige Differenzialdiagnostik der Speicheldrüsenraumforderung. Nach den Recherchen der Autoren handelt es sich bei der gestellten Diagnose um die erstmalige Beschreibung eines multilokulären, zystisch transformierten SCC der Parotis. Mit einer Häufigkeit von 1,6 Prozent aller Speicheldrüsentumore ist das SCC der Parotis eine Seltenheit und muss klinisch durch typische Malignitätskriterien gegenüber benignen Befunden abgegrenzt werden. Eine adäquate Bildgebung ist insbesondere bei fraglicher Dignität des Befunds durchzuführen, wobei schlussendlich nur anhand einer repräsentativen Probenentnahme die histologische Sicherung des Befunds erfolgen und die richtige Therapie eingeleitet werden kann. Insofern kommt dem Erstbehandler eine zentrale Rolle als diagnostischer Weichensteller für den Patienten zu.
Dr. Med. Diana Heimes
Klinik und Poliklinik für Mund-, Kiefer und Gesichtschirurgie – plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
Prof. Dr. Dr. Peer W. Kämmerer, Ma, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
Literaturliste
Alvi S, C. D., Limaiem F. (2020, 2020 Aug 11). „Parotid Cancer.“ from www.ncbi.nlm.nih.gov/books/NBK538340/.
Goldenberg, D., J. Sciubba and W. M. Koch (2006). „Cystic metastasis from head and neck squamous cell cancer: a distinct disease variant?“ Head Neck 28(7): 633-638.
Heimes D, K. P., Lippe E (2018). „Der besondere Fall mit CME: Lymphknotenmetastase bei einem benignen Tumor?“ Zahnmedizinische Mitteilungen 20/2018.
International Agency for Research on Cancer (2017). WHO Classification of Head and Neck Tumours.
Jayaram, G., R. Pathmanathan and V. Khanijow (1998). „Cystic lesion of the parotid gland with squamous metaplasia mistaken for squamous cell carcinoma. A case report.“ Acta Cytol 42(6): 1468-1472.
Jo, U., J. S. Song, S. H. Choi, S. Y. Nam, S. Y. Kim and K. J. Cho (2020). „Primary squamous cell carcinoma of the salivary gland: immunohistochemical analysis and comparison with metastatic squamous cell carcinoma.“ J Pathol Transl Med.
Kämmerer, P. W., A. Kreft, T. Toyoshima, B. Al-Nawas and M. O. Klein (2009). „Misleading initial histological diagnosis of a polymorphous low-grade adenocarcinoma in situ ex pleomorphic adenoma-a case report.“ Oral Maxillofac Surg 13(2): 99-103.
Mokhtari, S. (2012). „Mechanisms of cyst formation in metastatic lymph nodes of head and neck squamous cell carcinoma.“ Diagn Pathol 7: 6.
Takahashi, H., N. Kashiwagi, T. Chikugo, K. Nakanishi, Y. Tomita and T. Murakami (2014). „Squamous cell carcinoma originating in the parotid gland: MRI features with histopathological correlation.“ Clin Radiol 69(1): 41-44.