Der osteolytische Prozess im Unterkiefer – Differenzialdiagnose Plasmozytom
Eine 57-jährige Patientin stellte sich mit einer seit dem Vortag zunehmenden Schwellung des rechten Unterkiefers in der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz vor. Vier Monate zuvor habe sich der Zahn 47 gelockert, woraufhin sich die Frau bei ihrem Hauszahnarzt zur Abklärung vorgestellt hatte. In der durchgeführten Panoramaschichtaufnahme zeigte sich ein multizystisch anmutender Befund von regio 45 bis in den aufsteigenden Unterkieferast reichend (Abbildung 1). Die Patientin entschied sich jedoch im Nachgang aufgrund der subjektiv fehlenden klinischen Symptomatik – entgegen der Empfehlung des Hauszahnarztes – gegen eine zeitnahe Vorstellung in der Mund-, Kiefer- und Gesichtschirurgie.
Nach einem Intervall von vier Monaten jedoch zeigte sich neben der neu aufgetretenen Schwellung auch Zahn 46 gelockert, so dass sich die Patientin selbstständig zur weiteren Abklärung in der Universitätsmedizin Mainz vorstellte. Klinisch war zum Vorstellungszeitpunkt keine Beeinträchtigung der Durchblutung, der Motorik oder der Sensibilität zu beobachten; jedoch berichtete die Patientin über rezidivierende und in letzter Zeit zunehmende, nach präaurikulär ziehende Schmerzen. In der körperlichen Untersuchung zeigte sich eine druckdolente paramandibuläre Schwellung des rechten Unterkiefers mit enoral tastbarem, aufgetriebenem knöchernem Saum. Zu keiner Zeit bestanden Schluck- oder Atembeschwerden oder weitere klinische Zeichen für ein Abszessgeschehen.
Aufgrund des klinisch unklaren Lokalbefunds in Zusammenschau mit dem radiologischen Befund wurde die Indikation zur Durchführung einer Digitalen Volumentomografie gestellt. Diese bestätigte eine von regio 45 bis in den aufsteigenden Unterkieferast reichende, etwa 6,5 cm lange zystische Läsion mit partieller Auflösung der Kortikalis. Die Wurzeln der sich in der Läsion befindlichen Zähne 47 und 46 wiesen keine Anzeichen einer Resorption auf. Innerhalb der Läsion waren knöcherne Septen zu erkennen, die auf einen multizystischen Prozess hinwiesen (Abbildung 2).
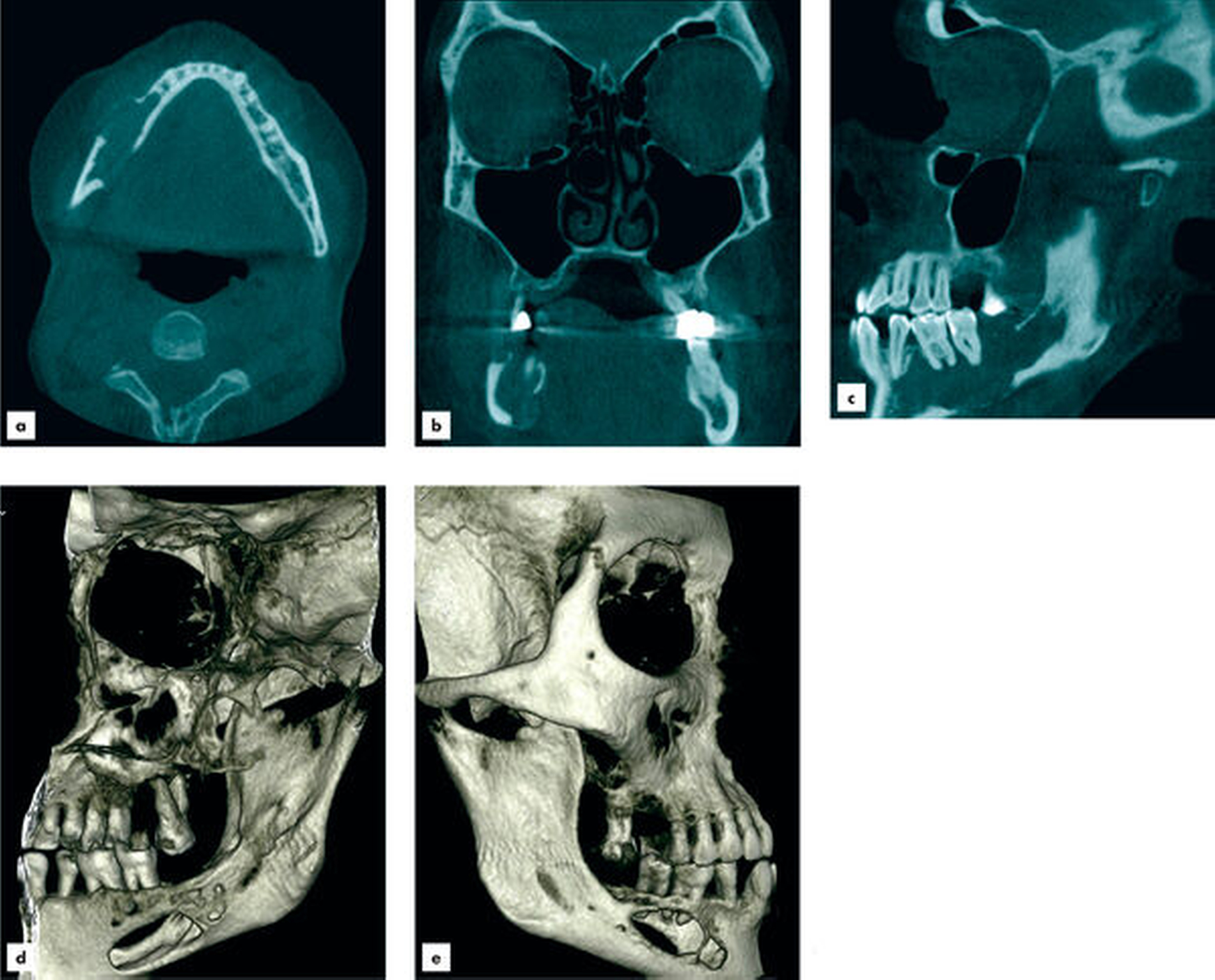
In Anbetracht des klinisch und radiologisch auffälligen, aber weiterhin unklaren Befunds wurde die Indikation zur Durchführung einer Probenentnahme in Lokalanästhesie gestellt. Nach Leitungsanästhesie des Nervus alveolaris inferior und des Nervus buccalis erfolgte eine marginale Schnittführung von 47 bis 45 mit Entlastung anterior. Nach subperiostaler Präparation konnte ein etwa 2 cm2 großer Defekt des vestibulären Knochens direkt kaudal der Zähne 46 und 47 dargestellt werden. Durch Sondierung über die Kortikalisarrosion ließ sich der lytische Prozess im Unterkiefer austasten; der Innenraum der Läsion war teilweise leer, teils gefüllt mit einem rötlichen, weichen Gewebe. Hier erfolgte die Entnahme von Weichgewebe aus der Läsion und von Knochenproben aus dem Randbereich der Kortikalisarrosion.
Die histopathologische Aufarbeitung der Präparate ergab das Bild eines entzündlich infiltrierten, fibrosierten Weichgewebes sowie von Knochenfragmenten mit großflächig erfasstem, monomorphem Infiltrat, das immunhistochemisch weiter untersucht werden musste. Die „BIOMED-2“ Multiplex-PCR-Untersuchungen zur B-Zell-Klonalitätsanalyse zeigten nach kapillarelektrophoretischer Auftrennung für die IgH-CDR1- und -CDR2-Bereiche jeweils klonale Amplifikate. Immunhistochemisch war das Präparat stark CD138-positiv. Es stellten sich wenig eingestreute CD45-positive Zellen und wenige CD68-positive Makrophagen dar. Die Antikörperfärbung gegen Ki67 wies auf eine gering gesteigerte Proliferation hin, während die Untersuchung auf Kappa-Leichtketten eine kräftige Anfärbung bei nur schwacher Anfärbung mit Antikörpern gegen Lambda-Leichtketten zeigte.
Histopathologisch und immunhistochemisch passten die Befunde zu einem plasmazellulären Infiltrat mit immunhistochemischer Kappa-Leichtketten-Klonalität mit dem molekularpathologischen Nachweis von B-Zell-Klonalität, was mit dem Krankheitsbild eines Multiplen Myeloms oder eines Plasmozytoms vereinbar gewesen wäre. In Anbetracht dieses Befunds erfolgte die Vorstellung in der hämato-onkologischen Abteilung der Universitätsmedizin Mainz. Entsprechend erfolgte leitliniengerecht eine Ausbreitungsdiagnostik mittels Low-dose-Ganzkörpercomputertomografie und einer Knochenmarkspunktion. Diese ergaben keinen Anhalt auf einen weiteren Fokus des Erkrankungsbildes oder auf eine Infiltration des Knochenmarks, so dass von einem singulären Geschehen ausgegangen werden musste und somit die Diagnose eines Plasmozytoms gestellt wurde.
Nach der Besprechung des Falls im hämato-onkologischen Tumorboard wurde die Empfehlung für eine lokale Radiotherapie mit insgesamt 40 Gy in kurativer Intention ausgesprochen. Aufgrund des hohen Lockerungsgrades der Zähne 47 und 46 und der Lage im Zentrum des malignen Befunds wurde die Extraktion dieser Zähne in Lokalanästhesie zur Prophylaxe einer Infektion unter Radiotherapie durchgeführt. Der weitere postoperative Verlauf gestaltete sich regelrecht, so dass die Strahlentherapie wie geplant durchgeführt werden konnte.
Diskussion
Das Multiple Myelom, in älteren Arbeiten auch Morbus Kahler genannt, ist ein B-Zell-Non-Hodgkin-Lymphom. Der Begriff „Multiples Myelom“ muss als multilokuläres Krankheitsbild von einem solitären Prozess, dem Plasmozytom, unterschieden werden – auch wenn die Begriffe häufig synonym verwendet werden. Das Krankheitsbild ist geprägt von einer monoklonalen Vermehrung einer Plasmazellpopulation, die abnorme monoklonale Antikörper beziehungsweise deren Leichtketten produziert [Schulz, 2017; Wörmann et al., 2018]. Die Ursache des Multiplen Myeloms ist bis heute unklar. Zytogenetisch findet man bei etwa 40 Prozent der Patienten Trisomien [Wörmann et al., 2018].
Die Erkrankung betrifft bevorzugt Männer und tritt gehäuft zwischen dem 50. und dem 70. Lebensjahr auf. In Deutschland werden jährlich 3.600 Neuerkrankungsfälle bei Männern und 2.900 Neuerkrankungsfälle bei Frauen erstdiagnostiziert [Wörmann et al., 2018]. Je nach Befallsmuster unterscheidet man zwischen dem Multiplen Myelom mit einer diffusen Infiltration des Knochenmarks, dem Plasmozytom mit einem singulären Auftreten einer Plasmazellvermehrung und dem leukämischen Verlauf, der Plasmazell-Leukämie. Klassifiziert wird das Krankheitsbild entsprechend der produzierten monoklonalen Antikörper. In der Hälfte der Fälle wird monoklonales Immunglobulin G – ein monomeres, reifes Immunglobulin – von den entarteten Plasmazellen gebildet. In einem Viertel der Verläufe kommt es zur übermäßigen Produktion von mono- oder dimerem Immunglobulin A und in 20 Prozent der Fälle zur Bildung monoklonaler Leichtketten, die auch als Bence-Jones-Protein bekannt sind [Schulz, 2017; Wörmann et al., 2018].
Das vermehrte Vorkommen monoklonaler Antikörper beim Multiplen Myelom oder beim Plasmozytom muss abgegrenzt werden von der abnormen Produktion der Immunglobulin-M-Antikörper, die im Rahmen eines anderen B-Zell-Non-Hodgkin-Lymphoms, des Morbus Waldenström, gebildet werden. Dieses Krankheitsbild ist sowohl klinisch als auch laborchemisch eine der relevanten Differenzialdiagnosen des Multiplen Myeloms [Schulz, 2017]. Wie im vorliegenden Fall müssen bei solitär zystischen Befunden im Unterkiefer auch differenzialdiagnostisch verschiedene andere Knochenerkrankungen abgegrenzt werden. Hierunter fallen in Anbetracht des radiologischen Bildes insbesondere uni- und multilokuläre Aufhellungen wie epitheliale und nicht-epitheliale Kieferzysten, benigne und maligne Tumore ossären oder anderen Ursprungs und tumorähnliche Veränderungen des Knochens. Zu nennen wären hier beispielsweise das Ameloblastom und die Keratozyste als benigne odontogene Tumore, das Osteosarkom, das Ewing-Sarkom, andere Lymphome oder ossäre Metastasen als maligne Tumore oder auch das Zentrale Riesenzellgranulom, das den tumorähnlichen Knochenveränderungen zugeordnet wird [Anderson et al., 2013; Howaldt, 2016].
Klinisch können sich das Multiple Myelom und das Plasmozytom recht heterogen präsentieren. Von einem asymptomatischen Verlauf über eine B-Symptomatik (unspezifische Begleitsymptomatik bestehend aus den drei Symptomen Fieber, Nachtschweiß und Gewichtsverlust) bis hin zu fulminanten Blutbildungsstörungen ist der Verlauf variabel und abhängig von der Ausprägung der Erkrankung. Durch die Verdrängung der Blutbildung kann eine Anämie mit den entsprechenden Symptomen Müdigkeit und Abgeschlagenheit entstehen. Eine Leukopenie kann, ebenso wie ein Antikörpermangelsyndrom aufgrund der massiven Produktion funktionsuntüchtiger Antikörper, eine erhöhte Infektneigung bedingen. Die reduzierte Bildung von Thrombozyten kann außerdem mit einer verstärkten Blutungsneigung im Sinne petechialer Blutungen einhergehen. Als klinisches Korrelat der Leichtketten-Proteinurie können Patienten über schäumenden Urin berichten. Wichtig ist, dass bei Vorliegen eines Multiplen Myeloms / Plasmozytoms trotz der Zuordnung zu den B-Zell-Non-Hodgkin-Lymphomen eine Vergrößerung der Lymphknoten eher untypisch ist [Schulz, 2017].
Fazit für die Praxis
Das Plasmozytom als häufigster maligner Knochentumor ist eine seltene Differenzialdiagnose der Osteolyse im Unterkiefer und muss von anderen zystischen Läsionen unterschieden werden.
Das Plasmozytom gehört zu den B-Zell-Non-Hodgkin-Lymphomen und ist vom Multiplen Myelom abzugrenzen.
Die erweiterte Diagnostik ist komplex und sollte durch einen Spezialisten durchgeführt werden; zur definitiven Sicherung des Befunds ist eine Probenentnahme aus der auffälligen Region notwendig, um die Verdachtsdiagnose von anderen benignen und malignen Raumforderungen abgrenzen zu können.
Das Multiple Myelom kann mit schwerwiegenden Komplikationen und Folgeerkrankungen – insbesondere mit einer progredienten Nierenschädigung – einhergehen.
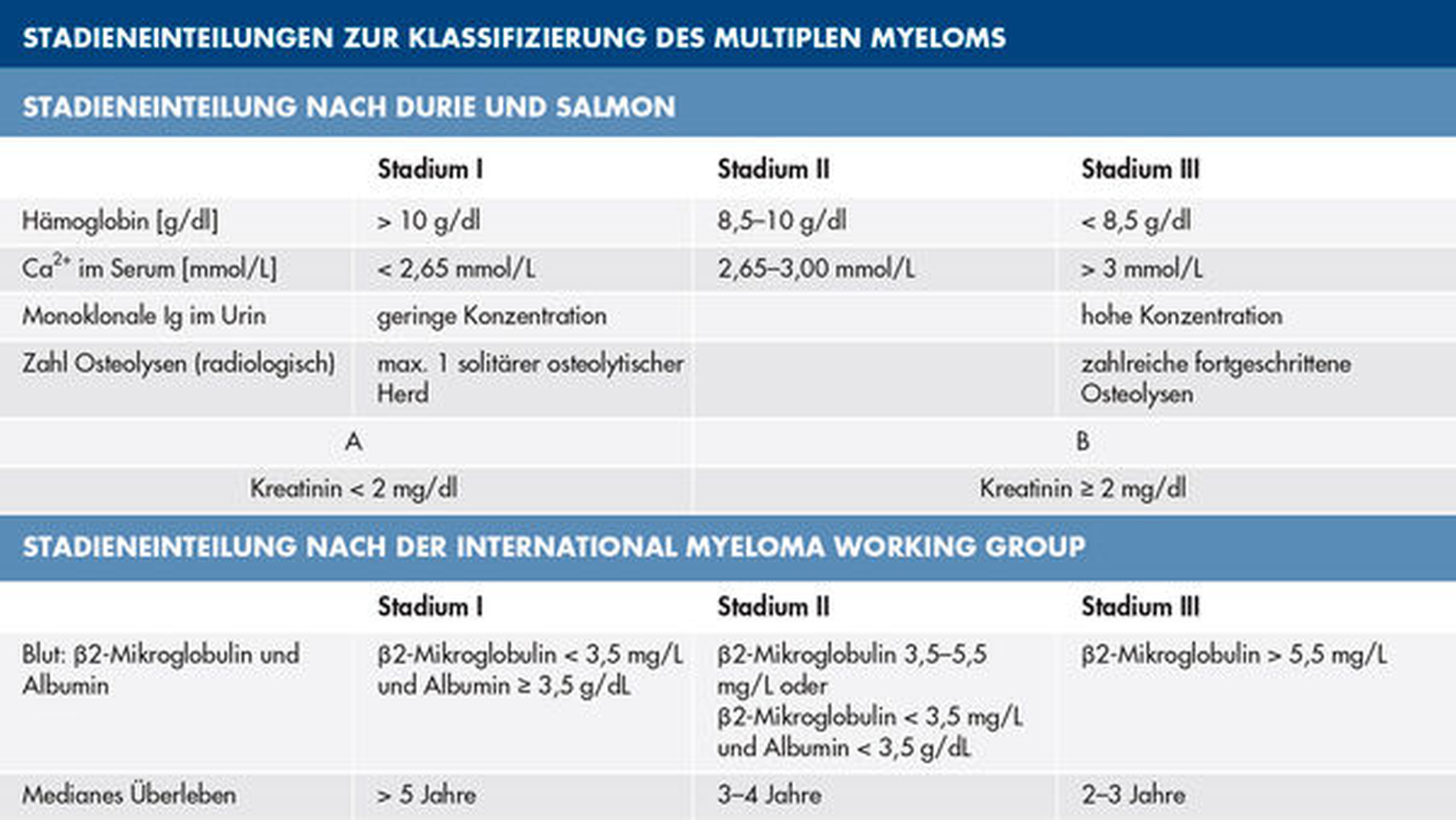
Die Stadieneinteilung erfolgt entsprechend der klinischen und laborchemischen Parameter nach Durie und Salmon oder der International Myeloma Working Group (Tabelle 1) [Schulz, 2017]. Die Untersuchung laborchemischer Parameter wie des Blutbilds (Anämie, Thrombozytopenie, Leukopenie), aber auch von Entzündungswerten wie der Blutsenkungsgeschwindigkeit (diese ist häufig ein erster Hinweis auf das Vorliegen der Erkrankung), des Blut-Kalzium-Wertes und des Anteils an Beta-2-Mikroglobulin (Anteil des Major-Histocompatibility-Complex-Systems, der durch Immunzellen synthetisiert wird) spielt bei der Diagnose eine wichtige Rolle. Aufgrund der Nierengängigkeit der vergleichbar kleinen Antikörperbestandteile kommt es zur Proteinurie und hiermit zu einer quantifizierbaren Ausscheidung von Bence-Jones-Protein, aber auch monoklonaler Antikörper. In der Immunfixationselektrophorese ist schließlich der sehr charakteristische M-Gradient bei monoklonaler Gammopathie (Peak der gamma-Globulinfraktion typisch für das Multiple Myelom) zu beobachten [Wörmann et al., 2018]. Bei Verdacht auf das Vorliegen eines Multiplen Myeloms muss, wie auch im vorliegenden Fall, schließlich eine Knochenmarkszytologie mittels Knochenmarkspunktion erstellt werden. Wenn sich die Erkrankung bereits im blutbildenden System ausgebreitet hat, sind sogenannte Plasmazellnester, also ein lockerer Verbund der monoklonalen Plasmazellen, zu beobachten. Da neben laborchemischen und zytologischen Parametern auch die Ausbreitung der Erkrankung im Körper des Patienten eine Rolle für die Prognose spielt und um das Risiko für tumorassoziierte Komplikationen abschätzen und gegebenenfalls therapieren zu können, wird standardmäßig eine Low-dose-Ganzkörpercomputertomografie zum Nachweis von Osteolysen oder einer Osteopenie durchgeführt.
Die Diagnose eines Multiplen Myeloms erfolgt entsprechend der Kriterien der International Myeloma Working Group: Dieses gilt als gesichert, wenn ein Endorganschaden vorliegt, über zehn Prozent Plasmazellen im Knochenmarkausstrich identifiziert werden können und monoklonale Antikörper oder Leichtketten im Serum oder Urin des Patienten vorhanden sind. Das Kriterium des Endorganschadens beruht auf den sogenannten CRAB-Kriterien. Dieses Akronym setzt sich aus den Punkten Hyperkalziämie [C], Niereninsuffizienz (renal insufficiency) [R], Anämie [A] und Knochenbeteiligung (bone lesions) [B] zusammen. Das Plasmozytom lässt sich hiervon, wie auch im vorliegenden Fall, durch den fehlenden Nachweis eines Endorganschadens, dem geringen Anteil an Plasmazellen im Knochenmark (< 10 Prozent) und der Begrenzung auf eine singuläre Osteolyse abgrenzen. Grundvoraussetzung ist jedoch die bioptische Sicherung der klonalen Plasmazellen im Befund [Schulz, 2017; Wörmann et al., 2018].
Die Wahl der Therapie erfolgt entsprechend der klinischen Symptomatik und des Allgemeinzustands. Erfüllt der Patient die CRAB-Kriterien, ist grundsätzlich die Gabe von hochdosierten Glukokortikoiden in Kombination mit einer Chemotherapie möglich. Bei Osteolysen wird die Gabe von Antiresorptiva wie Denosumab oder Zolendronat empfohlen [Anderson et al., 2018; Wörmann et al., 2018]. Mögliche Komplikationen der Erkrankung sind die Entwicklung einer hyperkalziämischen Krise aufgrund der Mobilisation des Kalziums aus dem lytischen Knochen mit Symptomen wie schwerer Exsikkose, Psychose und schließlich Koma. Die Letalität dieses Krankheitsbildes liegt bei 50 Prozent. Eine weitere mögliche Komplikation ist die AL-Amyloidose, bei der es durch die Ablagerung von Leichtketten in verschiedenen Geweben des Körpers zu Folgeerscheinungen wie Kardiomyopathie, Herz- oder Niereninsuffizienz und einem Malabsorptionssyndrom kommen kann. Insbesondere die Niere ist aufgrund des massiven Anfalls an Proteinen und Kalzium besonders stark betroffen. Der Verlauf der Erkrankung ist je nach Stadium und Allgemeinzustand sehr variabel. Trotz der heute deutlich besseren therapeutischen Methoden ist die Heilung nur in sehr seltenen Fällen möglich. Die absolute Fünfjahresüberlebensrate liegt bei 40 Prozent [Schulz, 2017; Wörmann et al., 2018].
Literaturliste
(2013). Facharztwissen Mund-, Kiefer- und Gesichtschirurgie. Berlin, Springer Medizin.
Anderson, K., N. Ismaila, P. J. Flynn, S. Halabi, S. Jagannath, M. S. Ogaily, J. Omel, N. Raje, G. D. Roodman, G. C. Yee and R. A. Kyle (2018). „Role of Bone-Modifying Agents in Multiple Myeloma: American Society of Clinical Oncology Clinical Practice Guideline Update.“ J Clin Oncol 36(8): 812-818.
Schulz (2017). Plasmazellneoplasien. Facharztwissen Hämatologie, Onkologie K. Possinger, A. Regierer and J. Eucker. München, Elsevier. 4. Auflage.
Herold, G. (2016). Innere Medizin. Köln.
Howaldt, H.-P. S., Rainer (2016). Einführung in die Mund-, Kiefer-, Gesichtschirurgie. Köln, Deutscher Ärzte-Verlag GmbH.
Wörmann, B., C. Driessen, H. Einsele, H. Goldschmidt, E. Gunsilius, M. Kortüm, N. Kröger, H. Ludwig, L.-O. Mügge, R. Naumann, R. Pritzkuleit, C. Röllig, C. Scheid, C. Taverna, K. Weisel and F. Weißinger (2018) „Multiples Myelom.“