In-situ-Melanom der Mundschleimhaut
aEin 46-jähriger Patient in gutem Allgemeinzustand stellte sich nach Überweisung durch seinen Hauszahnarzt aufgrund einer neu aufgetretenen, rasch progredienten, dunklen Mundschleimhautveränderung in der Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz vor. Anamnestisch war ein vor acht Jahren alio loco exzidiertes, superfiziell spreitendes malignes Melanom des linken Oberschenkels bekannt. Weitere relevante Nebendiagnosen bestanden nicht, der Patient war Nichtraucher, trank selten Alkohol und nahm keine Dauermedikation ein.
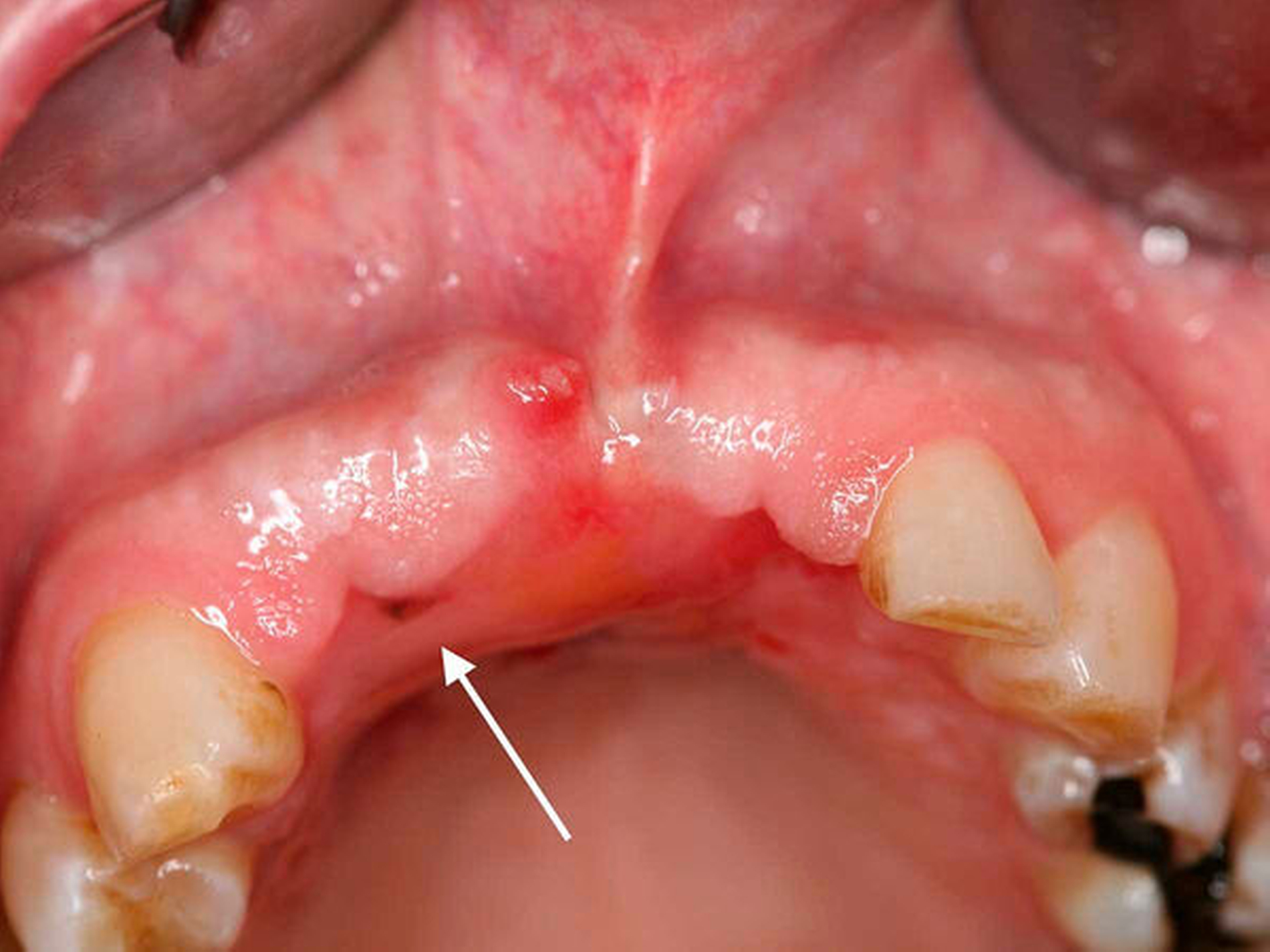
Bei der Aufnahmeuntersuchung zeigte sich eine schwärzliche, circa 2 cm x 1,5 cm messende, unregelmäßige Makula der Mundschleimhaut mit unscharfer Begrenzung, die sich von der marginalen Gingiva in regio 11 in Richtung des harten Gaumens erstreckte (Abbildung 1). Die sonografische Untersuchung der Halsweichteile war unauffällig, die Panoramaschichtaufnahme zeigte einen konservierend und prothetisch suffizient versorgten, altersentsprechenden Normalbefund. Die Schleimhautveränderung war bereits klinisch hochgradig verdächtig auf ein Mundschleimhautmelanom.
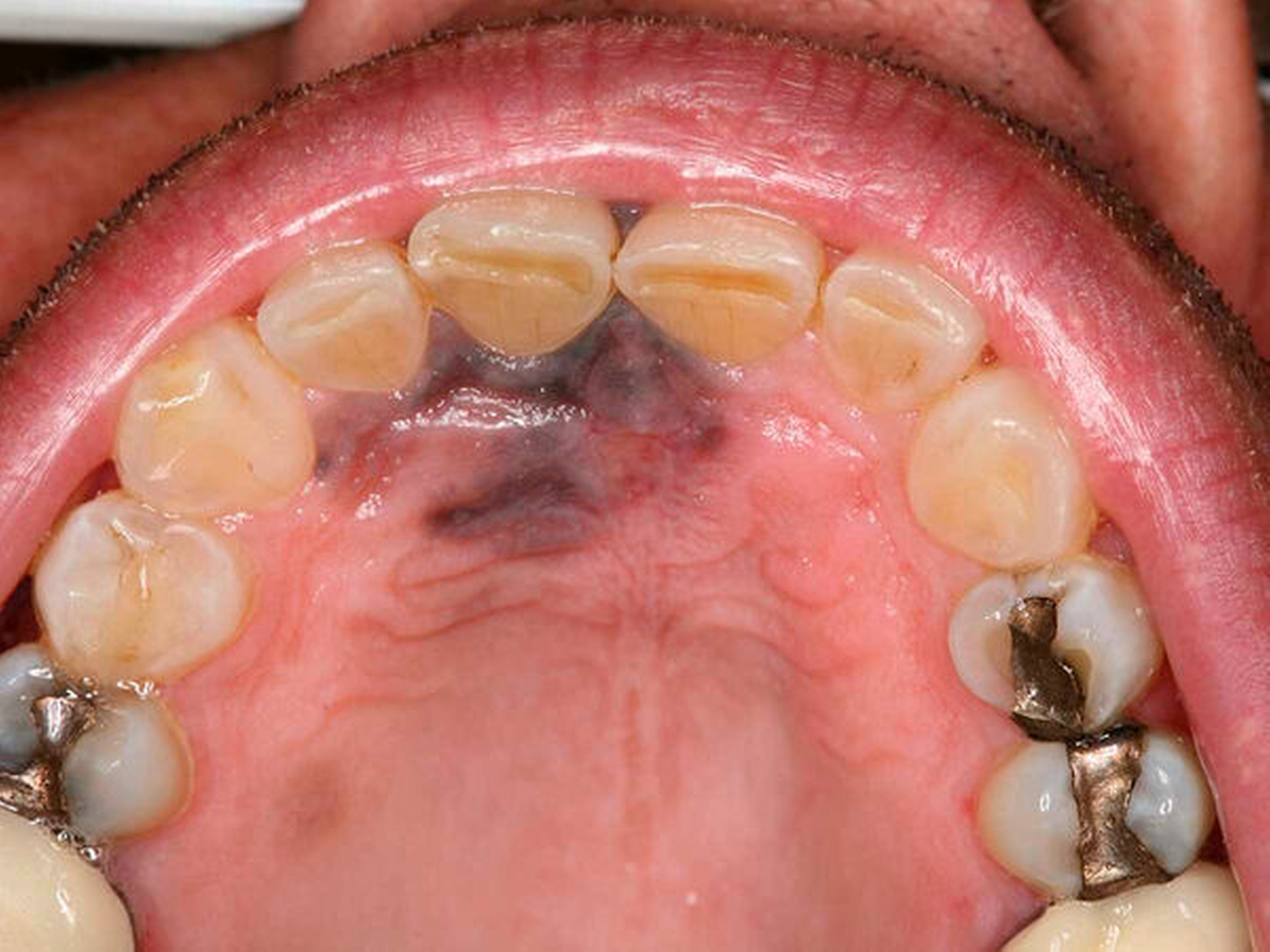
Zeitnah wurden mehrere Gewebeproben entnommen. Zu diesem Zeitpunkt erschien eine komplette Exzisionsbiopsie aufgrund der Tumorgröße, der unklaren Invasivität und der zu erwartenden Ausdehnung der Resektion nicht sinnvoll. In der histopathologischen Untersuchung stellten sich subepidermal Nester von Zellen mit rundovalen Zellkernen, Pigmentierung, Hyperchromasie, geringen Kerngrößenschwankungen und prominenten Nukleolen dar. Die beschriebenen Nester waren HMB45 und Melan-A positiv mit einem Proliferationsindex von 25 Prozent (Ki-67). Es war kein Melan-A/ HMB45-Gradient nachweisbar. Insgesamt war der Befund mit einem Melanoma in situ vereinbar.
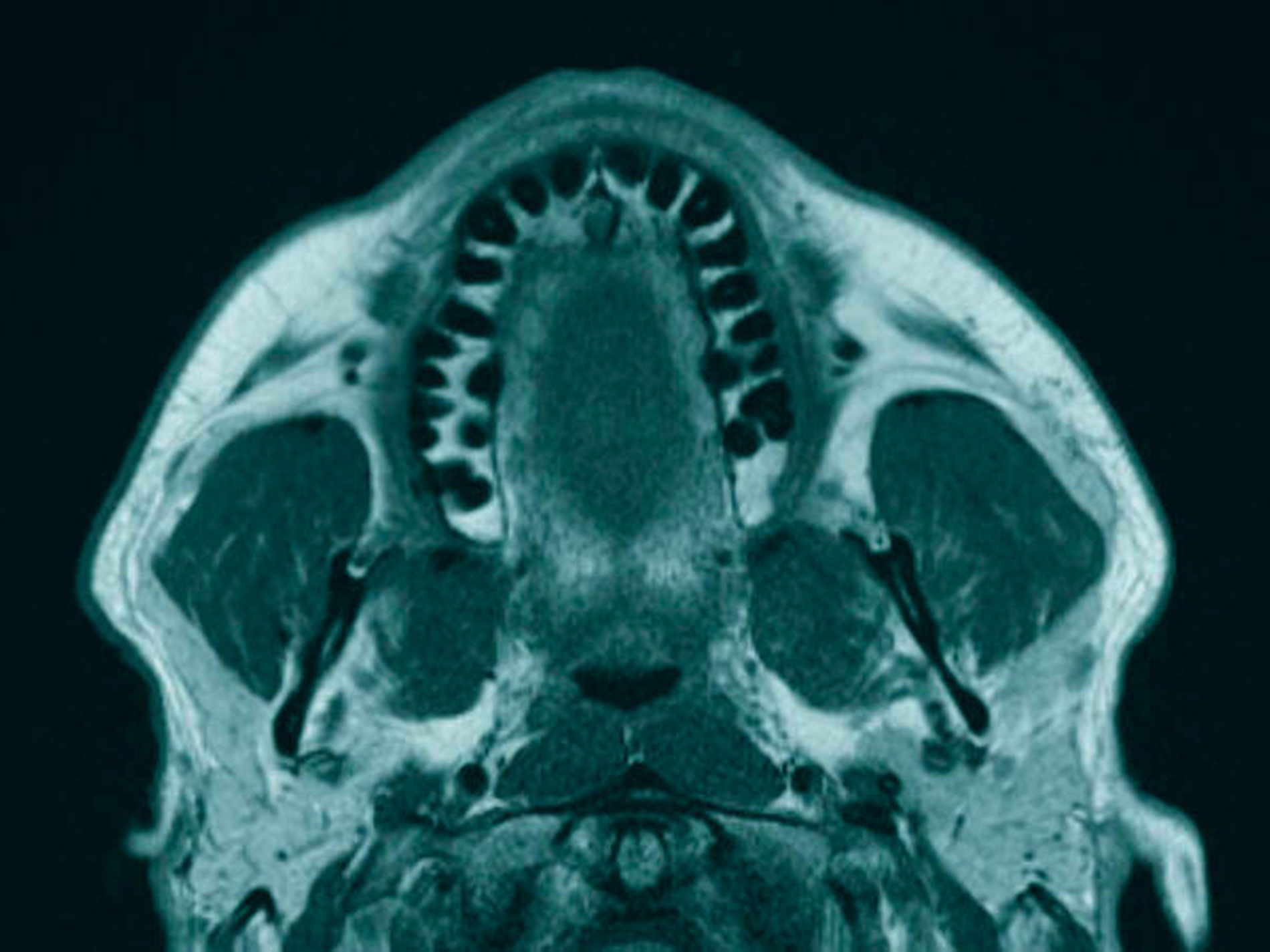
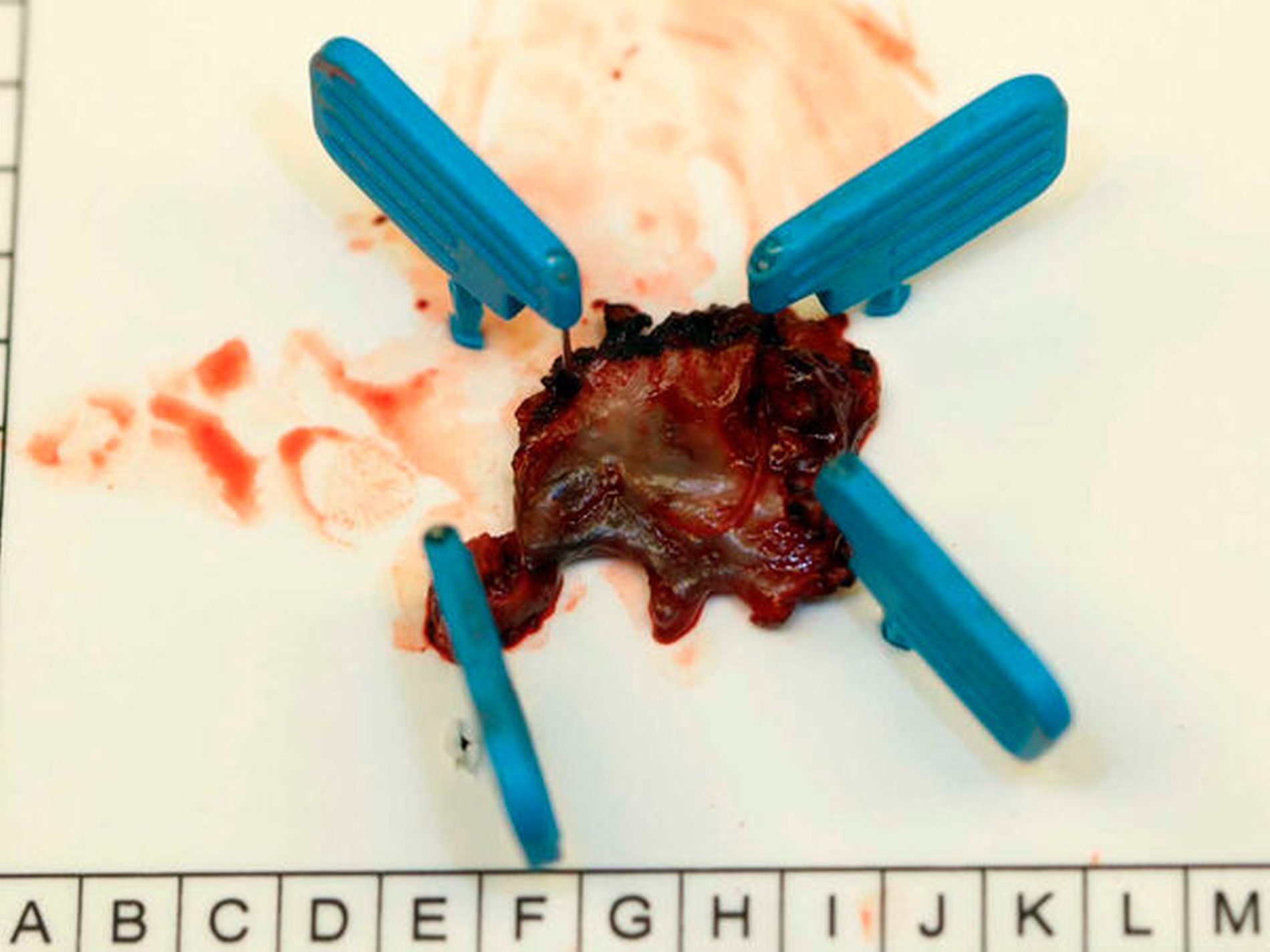
Anschließend wurde zur Ausbreitungsdiagnostik eine Magnetresonanztomografie (MRT) der Kopf-Hals-Weichteile mit Kontrastmittel durchgeführt (Abbildung 2). Hierbei kam eine malignomsuspekte Raumforderung im Oberkiefer im Bereich der regiones 11 bis 21 zur Darstellung, metastasensuspekte Auffälligkeiten der Halslymphknoten konnten nicht ausgemacht werden. Nach Besprechung des Falles in der interdisziplinären Tumorkonferenz wurde der Befund lokal mit Sicherheitsabstand in toto exzidiert und die mit der Raumforderung kommunizierenden Zähne 12, 11 und 21 extrahiert (Abbildung 3).
In der definitiven histopathologischen Untersuchung zeigte sich der Befund eines malignen Melanoma in situ der Mundschleimhaut, das lokal im Gesunden exzidiert worden war. Der postoperative Verlauf gestaltete sich regelrecht, der Patient wurde in vierwöchigen Abständen zur Nachsorge MKG-chirurgisch und dermatologisch einbestellt und prothetisch mit einer Interimsprothese versorgt.
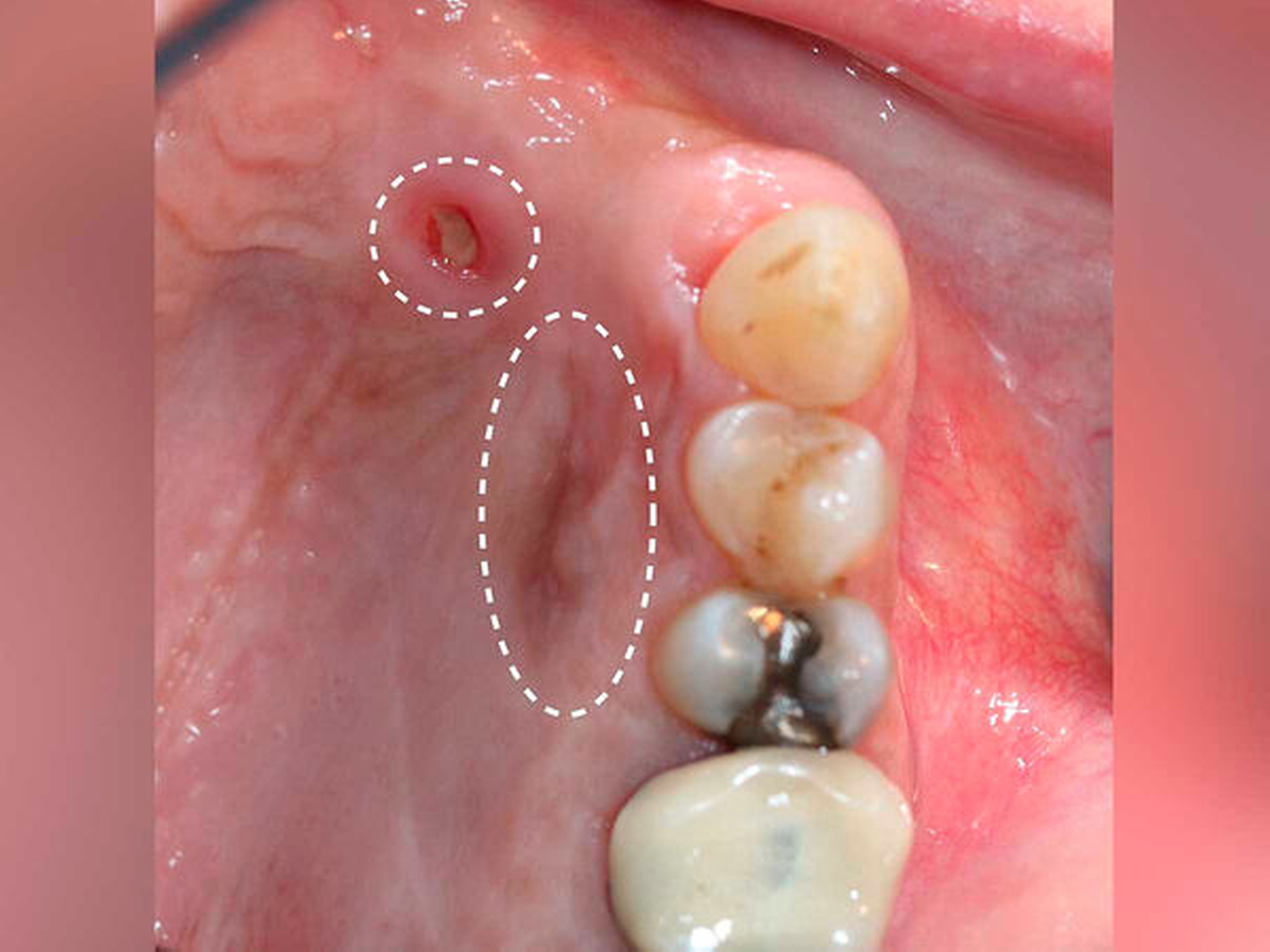
Nach drei Monaten war erneut eine circa 2 mm x 2 mm große schwärzliche Mundschleimhautveränderung in regio 012 auffällig (Abbildung 4). Die Raumforderung inklusive einer kortikalen Knochenspange des Alveolarkamms und des Os palatinum von regio 13 bis regio 23 wurde großflächig reseziert. Histopathologisch wurde ein R0-reseziertes Rezidiv des vorbekannten Melanoma in situ bestätigt, eine tiefere Tumorinfiltration über die Basalmembran hinweg oder sogar bis in den ortsständigen Knochen konnte ausgeschlossen werden.
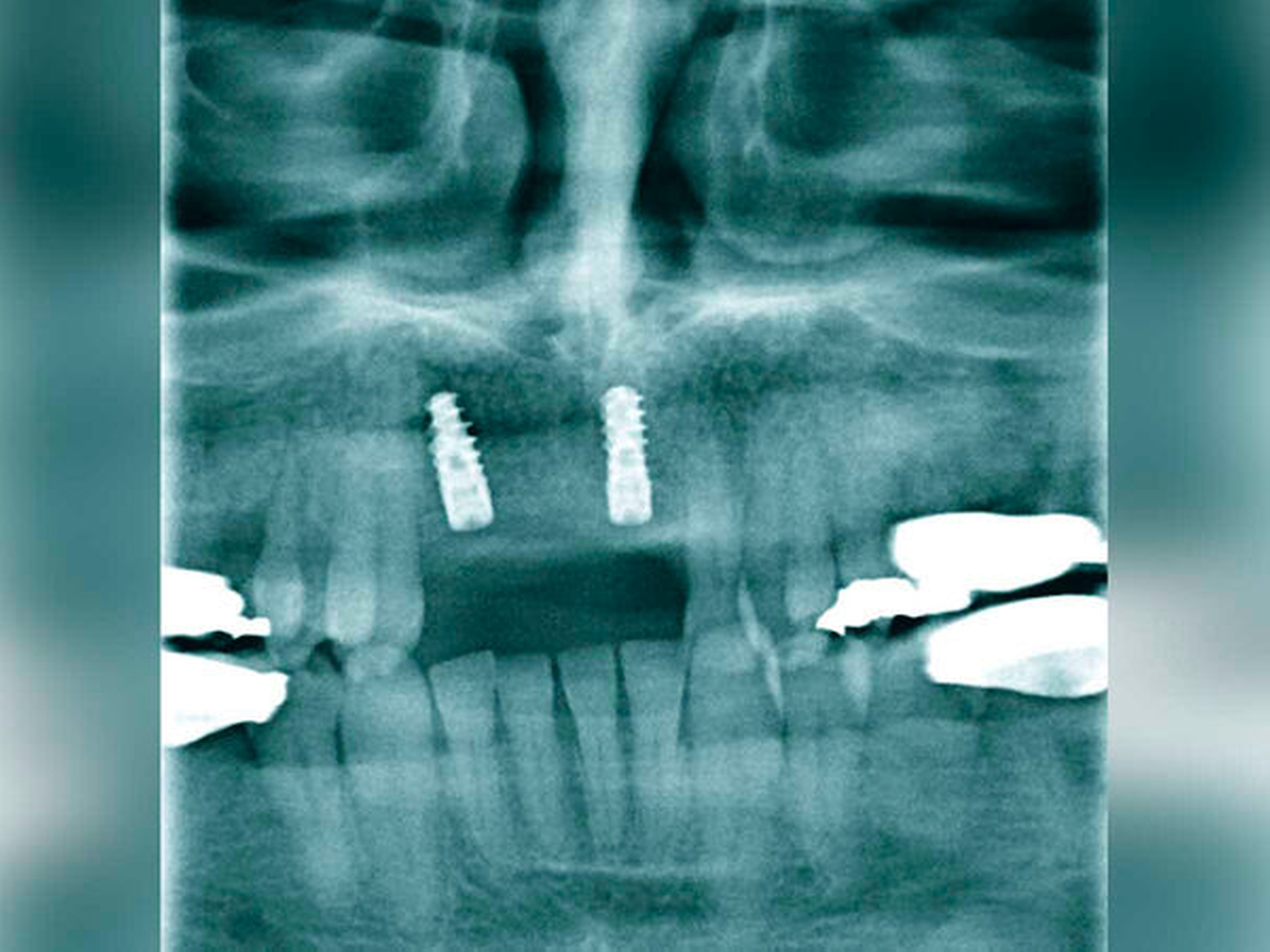
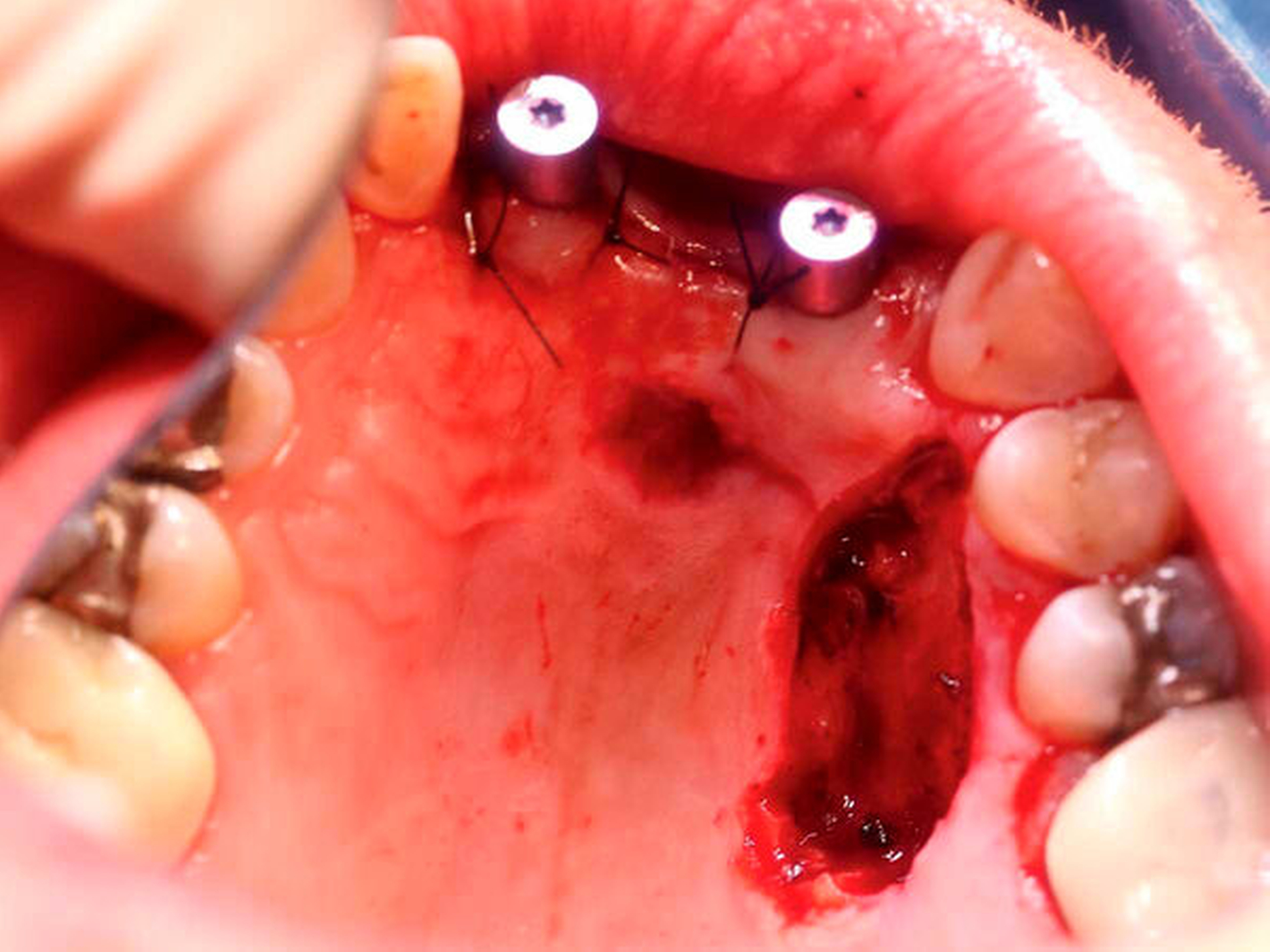
Nach sekundärer Granulation der Exzisionswunde erfolgte die Insertion von zwei Implantaten in den regiones 12 und 21 (Abbildung 5). Da eine zeitnahe Radiatio im weiteren Verlauf nicht ausgeschlossen werden konnte, wurde auf eine Augmentation des zuvor teilresezierten Alveolarkamms verzichtet, um eine festsitzende Implantatversorgung nicht zu gefährden. Weitere sechs Monate später trat erneut ein Rezidiv im Bereich des harten Gaumens auf (Abbildung 6), das wiederum ausgedehnt im Sinne einer R0-Situation exzidiert wurde. Zusätzlich wurden die zuvor inserierten Implantate im gleichen Eingriff freigelegt (Abbildung 7).
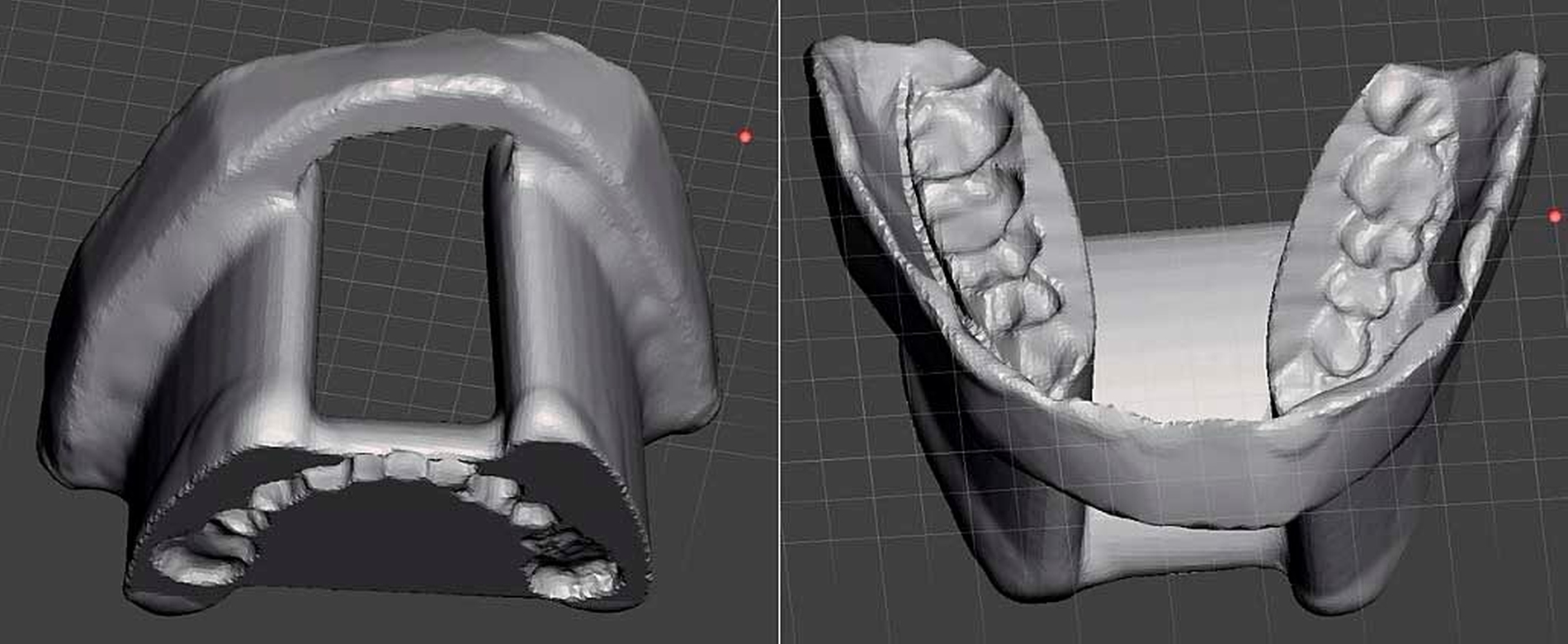
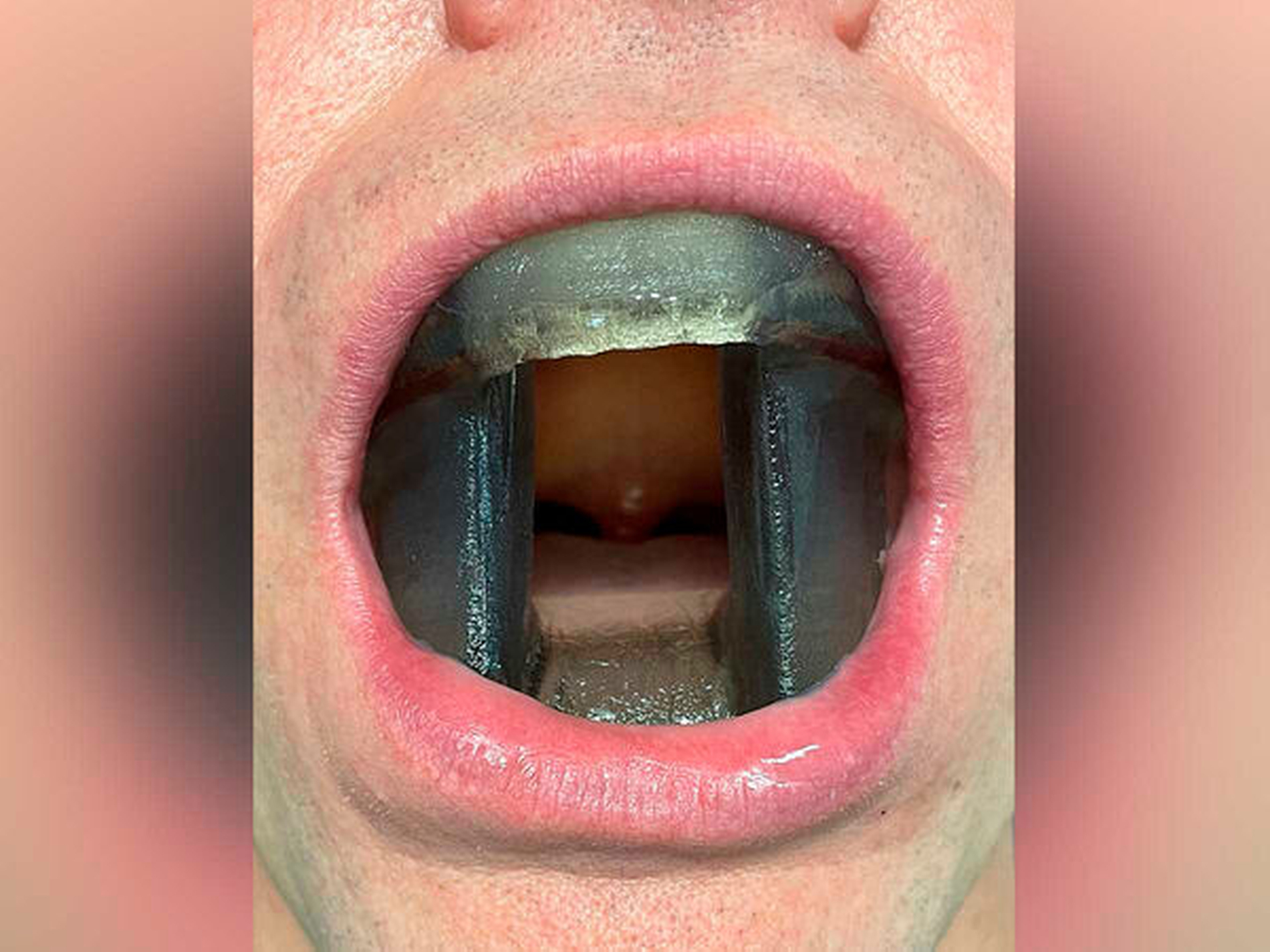
Nach erneuter Besprechung des Falles im interdisziplinären Tumorboard wurde eine Radiatio empfohlen. Um unerwünschte Folgen der Bestrahlung im Bereich der Zungen- und Wangenschleimhaut zu vermeiden, wurde nach Scannen von Ober- und Unterkieferabdrücken des Patienten eine patientenspezifische Vorrichtung, die einen zungenretrahierenden Strahlenstent und einen Wangenschleimhautretraktor kombiniert, digital designt und 3-D-gedruckt (Abbildung 8). Im Anschluss folgte eine fraktionierte Bestrahlung im Bereich des Oberkiefers und des Gaumens mit einem zirkulären Sicherheitsabstand von 2 cm und einer Gesamtdosis von 57,5 Gray. Nach einer anfänglich ausgeprägten perioralen Mukositis gestaltete sich der weitere Verlauf komplikationslos.
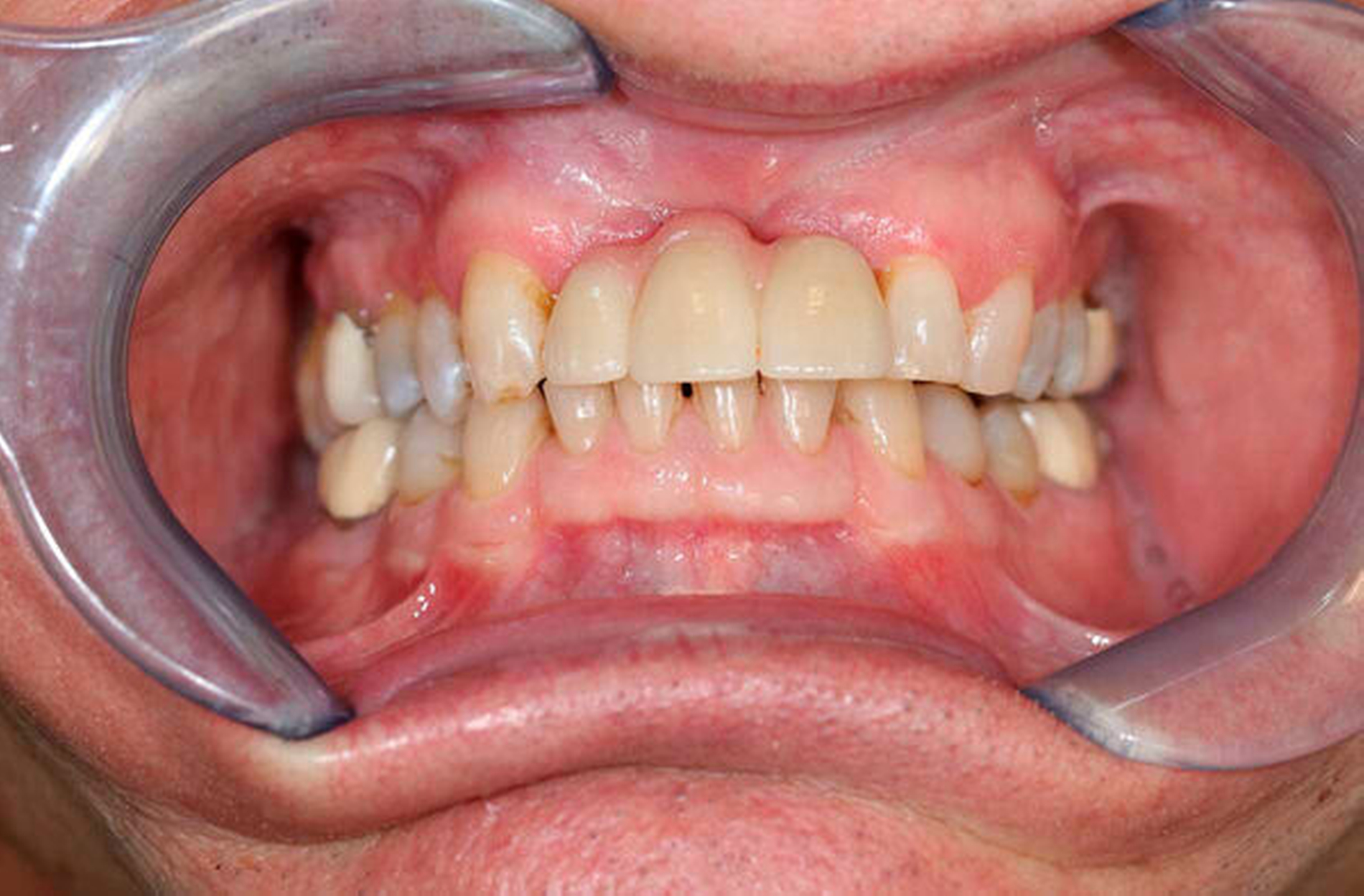
Die prothetische Versorgung erfolgte mit einer keramisch vollverblendeten, implantatgetragenen Brücke von 12 auf 21 (Abbildung 9), aufgrund der vorausgegangenen Resektion eines Teils des anterioren Alveolarkamms durchaus kompromissbehaftet, jedoch funktionell und aus Sicht des Patienten höchst zufriedenstellend. Der Patient stellt sich seit zwei Jahren in regelmäßigen Intervallen zu klinischen und sonografischen, bisher unauffälligen Verlaufskontrollen vor.
Diskussion
Das maligne Melanom der Haut rangiert bei Männern auf Platz 5 und bei Frauen auf Platz 4 der häufigsten Krebserkrankungen in Deutschland. Die Inzidenz des malignen Melanoms der Haut ist in den vergangenen Jahrzehnten sprunghaft auf aktuell circa 20 Neuerkrankungen pro 100.000 Einwohner pro Jahr angestiegen. Dies liegt zum einen am Wandel der Gesellschaft hin zu mehr Freizeitaktivitäten, die im Zusammenhang mit einer vermehrten UV-Exposition stehen, was den Hauptrisikofaktor für die Entstehung eines kutanen malignen Melanoms darstellt. Zum anderen steht der Anstieg der Inzidenz aber auch mit einer häufigeren Diagnosestellung aufgrund der Einführung des Hautkrebsscreenings ab dem 35. Lebensjahr in Verbindung [Robert Koch-Institut, 2017, aktueller Stand 2021].
Rund 25 Prozent der malignen Melanome entstehen im Kopf-Hals-Bereich, primäre Schleimhautmelanome der Mundhöhle machen aber insgesamt nur weniger als ein Prozent aller malignen Melanome und weit unter ein Prozent der malignen Mundhöhlentumoren aus. Sie stellen damit eine sehr seltene Entität dar. Hauptlokalisation sind der harte Gaumen und die Gingiva des Oberkiefers [Ashok et al., 2020].
Der Tumor geht histologisch von Melanozyten aus, die im Bereich der Haut der Pigmentierung dienen und vor schädlicher UV-Strahlung schützen. In der Mundhöhle scheinen sie antimikrobielle Aufgaben zu erfüllen und sind somit der Immunabwehr zuzuordnen [Mackintosh, 2001; Plonka et al., 2009]. Als Risikofaktoren für die Entstehung eines Mundschleimhautmelanoms (orales mukosales Melanom; OMM) werden karzinogene Noxen wie Rauchen oder übermäßiger Alkoholkonsum, aber auch verschiedene genetische Mutationen vermutet. Sonneneinstrahlung spielt beim OMM keine Rolle, eine Vorläuferläsion wurde bisher nicht identifiziert [Tchernev et al., 2018; Ashok et al., 2020].
Nach der Anamnese steht die klinische Untersuchung im Vordergrund, wobei der Früherkennung eine entscheidende prognostische Bedeutung zugeschrieben wird. Generell ist jede Mundschleimhautveränderung, die länger als zwei Wochen vorbesteht, abklärungsbedürftig. Liegt jedoch nur der geringste klinische Verdacht auf ein Mundschleimhautmelanom vor, sollte diese Frist nicht abgewartet werden und eine sofortige Abklärung erfolgen. Eine bläuliche, bräunliche oder schwarze makulöse oder noduläre Mundschleimhautveränderung im Sinne eines melanotischen OMM ist meist eindrücklich und auch durch den weniger erfahrenen Untersucher leicht zu erkennen. Im Gegensatz dazu sind bis zu 40 Prozent der OMM amelanotisch und weisen damit keine typische Pigmentierung auf, was eine klinische Diagnose deutlich erschwert [Patrick et al., 2007; Carvajal et al., 2012; Chandan et al., 2020]. Aber auch die pigmentierten Varianten werden zumeist erst spät diagnostiziert, da den Patienten belastende Symptome wie Schmerzen, Blutungen, Ulzerationen oder Foetor ex ore erst in fortgeschrittenen Stadien auftreten [Singh et al., 2019].
Im Juli 2020 ist die aktualisierte Version der „S3-Leitlinie zur Diagnostik, Therapie und Nachsorge des Melanoms“ erschienen, die den mukosalen Melanomen ein eigenes Kapitel widmet, in dem vor allem Empfehlungen zur histologischen Diagnose, zur Klassifikation und zur Therapie gegeben werden [Eigentler et al., 2020]. Zur Sicherung der klinischen Verdachtsdiagnose muss die Entnahme einer repräsentativen Gewebeprobe zur histopathologischen Untersuchung erfolgen. Kleinere Läsionen sollten bereits initial in toto exzidiert werden. Mikroskopisch können melanotische OMM oft bereits in der Hämatoxylin-Eosin-(HE-)Färbung erfolgreich diagnostiziert werden. Zusätzlich stehen zur Diagnosebestätigung oder bei unklaren Befunden und bei amelanotischen OMM immunhistochemische Marker wie HMB45 und Melan-A zur Verfügung, die gerade das amelanotische OMM histologisch gegenüber Lymphomen, undifferenzierten Karzinomen oder Sarkomen abgrenzen [Casiraghi und Lefèvre, 2009].
Die Ausbreitungsdiagnostik des OMM ist abhängig vom jeweiligen Stadium und analog zum kutanen malignen Melanom, dabei nimmt das Melanoma in situ wiederum eine gesonderte Rolle ein. Neben einer sonografischen Untersuchung der Halsweichteile kann eine Magnetresonanztomografie (MRT) der Kopf-Hals-Region zur Beurteilung der lokoregionären Ausdehnung und der Halslymphknoten, wo in der Regel zuerst Metastasen auftreten, durchgeführt werden [Medina et al., 2003]. Generell wird jedoch in frühen Stadien keine direkte Empfehlung für eine Schnittbildgebung ausgesprochen. Zur Ausbreitungsdiagnostik beim Melanoma in situ reicht laut Leitlinie die klinische Untersuchung aus. Wohingegen im fortgeschrittenen Stadium eine MRT Kopf, eine Ganzkörperschnittbildgebung mittels PET-CT, CT oder MRT, eine Skelettszintigrafie und die Bestimmung der Tumormarker S100B und LDH dazukommen [Eigentler et al., 2020]. Zu beachten ist dabei, dass aufgrund der Seltenheit des OMM nur geringe Evidenzlevel der Empfehlungen vorliegen, die auf einem Expertenkonsens und nicht auf randomisiert kontrollierten Studien beruhen.
Die Therapie der Wahl und die einzig potenziell kurative Behandlung eines OMM ist die radikale chirurgische Resektion mit ausreichend Sicherheitsabstand im Gesunden von in der Regel 1 cm [Penel et al., 2006]. Die Radikalität richtet sich nach der Ausdehnung des Tumors. Hierbei ist zu beachten, dass dieser häufig eher flächig und weniger in die Tiefe zu wachsen scheint [Chandan et al., 2020]. Trotzdem muss bei Verdacht auf Infiltration in Umgebungsstrukturen auch hier ein adäquater Sicherheitsabstand eingehalten werden, weshalb auch beim OMM beispielsweise eine Unterkieferkontinuitätsresektion mit anschließender Rekonstruktion infrage kommen kann [Penel et al., 2006; López et al., 2016; Eigentler et al., 2020].
Die Ausdehnung der chirurgischen Therapie wird bei In-situ-Melanomen kontrovers diskutiert, da diese auch bei minimalen Sicherheitsabständen zum Tumorrand in nur circa zwei Prozent der Fälle rezidivieren [Joyce et al., 2015]. Das zeigt, wie ungewöhnlich ein mehrfach R0-reseziertes, rezidivierendes Melanoma in situ – wie im hier beschriebenen Fall – zu sein scheint. Erstaunlicherweise gibt es aber gerade für die Lokalisation eines Melanoma in situ des harten Gaumens mehrere Fallberichte, in denen trotz adäquater Therapie teilweise auch noch nach Jahren eine Rezidivneigung festgestellt wurde [Shastri et al., 2020; Becker et al., 2021]. Hier wird deutlich, dass dieser Fall eine besondere chirurgische Herausforderung darstellt. Da in Bezug auf den chirurgischen Sicherheitsabstand beim OMM in situ weder Leitlinien noch einheitliche Empfehlungen existieren, orientiert sich die chirurgische Ausdehnung an den lokalen anatomischen Gegebenheiten, der Einschätzung und Erfahrung des Operateurs und dem Wunsch des Patienten.
Demgegenüber wird beim invasiven OMM eine elektive Neck Dissection empfohlen, da hier in bis zu 75 Prozent der Fälle Lymphknotenmetastasen detektiert werden können [Medina et al., 2003; Krengli et al., 2006]. Zusätzlich kann dem Patienten bei invasiven Tumoren oder bei R1-Situationen eine adjuvante Radiatio angeboten werden. Beim metastasierten OMM oder bei Inoperabilität kann nach Erhebung des individuellen Mutationsstatus eine zielgerichtete systemische Therapie unter dem Einsatz von BRAF-, MEK-, KIT- oder Checkpoint-Inhibitoren erfolgen, um so möglicherweise das Gesamtüberleben bei vertretbarer Nebenwirkungsrate zu verlängern [Eigentler et al., 2020].
Insgesamt hat das OMM eine schlechte Prognose [Sun et al., 2012]. Daher sind eine frühestmögliche Diagnosestellung und eine zeitnahe Therapieeinleitung wichtige Kriterien für das Outcome des Patienten. Ebenso wichtig ist die Nachsorge nach abgeschlossener Therapie, um Rezidive, loko-regionäre oder Fernmetastasen frühzeitig zu erkennen und zu behandeln. Darüber hinaus sind die kau-funktionelle und auch die ästhetische Rehabilitation sowie eine adäquate Supportivtherapie entscheidend für die postchirurgische Lebensqualität des Patienten.
Literaturliste
Ashok, S., S. Damera, S. Ganesh and R. Karri (2020). „Oral malignant melanoma.“ J Oral Maxillofac Pathol 24(Suppl 1): S82-s85.
Becker, P., A. Pabst, M. Bjelopavlovic, D. Müller and P. W. Kämmerer (2021). „Treatment Modalities of Recurrent Oral Mucosal Melanoma In Situ.“ Medicina (Kaunas) 57(9).
Carvajal, R. D., S. A. Spencer and W. Lydiatt (2012). „Mucosal melanoma: a clinically and biologically unique disease entity.“ J Natl Compr Canc Netw 10(3): 345-356.
Casiraghi, O. and M. Lefèvre (2009). „[Undifferentiated malignant round cell tumors of the sinonasal tract and nasopharynx].“ Ann Pathol 29(4): 296-312.
Chandan, S. N., S. K. Shetty and B. V. Deepa (2020). „Primary Malignant Melanoma of Oral Mucosa - Report of Two Cases.“ Contemp Clin Dent 11(2): 195-198.
Eigentler, T., J. Hoge, C. Garbe and D. Schadendorf (2020). „S3-Leitlinie zur Diagnostik, Therapie und Nachsorge des Melanoms.“ AWMF Leitlinie Registernummer 032/024OL.
Joyce, K. M., C. W. Joyce, D. M. Jones, P. Donnellan, A. J. Hussey, P. J. Regan and J. L. Kelly (2015). „An assessment of histological margins and recurrence of melanoma in situ.“ Plast Reconstr Surg Glob Open 3(2): e301.
Krengli, M., L. Masini, J. H. Kaanders, P. Maingon, S. B. Oei, A. Zouhair, E. Ozyar, M. Roelandts, M. Amichetti, M. Bosset and R. O. Mirimanoff (2006). „Radiotherapy in the treatment of mucosal melanoma of the upper aerodigestive tract: analysis of 74 cases. A Rare Cancer Network study.“ Int J Radiat Oncol Biol Phys 65(3): 751-759.
López, F., J. P. Rodrigo, A. Cardesa, A. Triantafyllou, K. O. Devaney, W. M. Mendenhall, M. Haigentz, Jr., P. Strojan, P. K. Pellitteri, C. R. Bradford, A. R. Shaha, J. L. Hunt, R. de Bree, R. P. Takes, A. Rinaldo and A. Ferlito (2016). „Update on primary head and neck mucosal melanoma.“ Head Neck 38(1): 147-155.
Mackintosh, J. A. (2001). „The antimicrobial properties of melanocytes, melanosomes and melanin and the evolution of black skin.“ J Theor Biol 211(2): 101-113.
Medina, J. E., A. Ferlito, P. K. Pellitteri, A. R. Shaha, A. Khafif, K. O. Devaney, S. R. Fisher, C. J. O'Brien, R. M. Byers, K. T. Robbins, K. T. Pitman and A. Rinaldo (2003). „Current management of mucosal melanoma of the head and neck.“ J Surg Oncol 83(2): 116-122.
Patrick, R. J., N. A. Fenske and J. L. Messina (2007). „Primary mucosal melanoma.“ J Am Acad Dermatol 56(5): 828-834.
Penel, N., Y. Mallet, X. Mirabel, J. T. Van and J. L. Lefebvre (2006). „Primary mucosal melanoma of head and neck: prognostic value of clear margins.“ Laryngoscope 116(6): 993-995.
Plonka, P. M., T. Passeron, M. Brenner, D. J. Tobin, S. Shibahara, A. Thomas, A. Slominski, A. L. Kadekaro, D.
Hershkovitz, E. Peters, J. J. Nordlund, Z. Abdel-Malek, K. Takeda, R. Paus, J. P. Ortonne, V. J. Hearing and K. U.
Schallreuter (2009). „What are melanocytes really doing all day long...?“ Exp Dermatol 18(9): 799-819.
Robert-Koch-Institut (2017 (aktueller Stand 2021)). „Malignes Melanom der Haut – ICD-10 C43.“ Zentrum für Krebsregisterdaten.
Shastri, M., T. Paterson, B. S. Bisase and A. W. Barrett (2020). „Malignant melanoma in situ of the palate: Radical treatment or “watch and wait„?“ Oral Oncol 110: 104805.
Singh, D., P. Pandey, M. K. Singh and S. Kudva (2019). „Prevalence of malignant melanoma in anatomical sites of the oral cavity: A meta-analysis.“ J Oral Maxillofac Pathol 23(1): 129-135.
Sun, C. Z., Y. F. Chen, Y. E. Jiang, Z. D. Hu, A. K. Yang and M. Song (2012). „Treatment and prognosis of oral mucosal melanoma.“ Oral Oncol 48(7): 647-652.
Tchernev, G., T. Lotti and U. Wollina (2018). „Palatal Melanoma: “The Silent Killer„.“ Open Access Maced J Med Sci 6(2): 364-366.