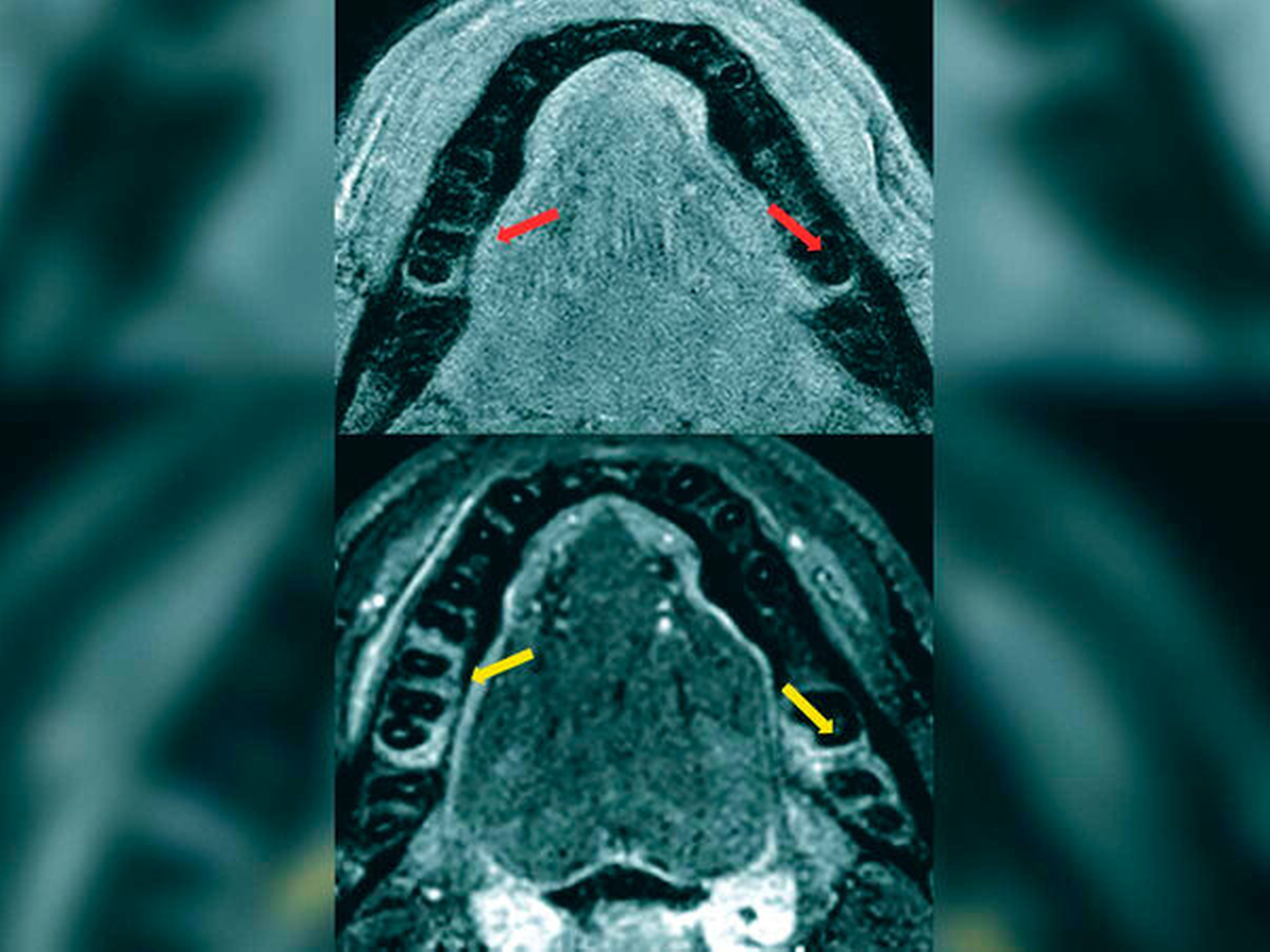
MRT zeigt mit Gingivitis assoziierte Knochenveränderungen
Einer parodontalen Erkrankung geht meist eine reversible Entzündung voraus, die – nach aktuellem Kenntnisstand – in diesem Stadium auf die Gingiva beschränkt zu sein scheint. Bei einem Fortschreiten dieser Entzündung kann sich daraus eine Parodontitis entwickeln, die durch einen graduellen Abbau von Strukturen des Parodontiums gekennzeichnet ist. Klinisch führt dies zu einer pathologischen Vertiefung des gingivalen Sulkus, was letztendlich zu Zahnlockerungen und schließlich zum Zahnverlust führen kann [Petersen und Ogawa, 2012]. Die derzeitigen Diagnostikmethoden einer Parodontitis beruhen auf der Beurteilung des bereits stattgefundenen Gewebeabbaus. Hierfür werden neben klinischen Parametern wie zum Beispiel Blutung bei Sondierung ergänzend Röntgenaufnahmen zur Beurteilung des Knochenverlusts herangezogen.
Bekannt ist, dass der röntgenologisch sichtbare Knochenverlust das tatsächliche Ausmaß des Abbaus oft nicht vollständig widerspiegelt. Ortman et al. beschreiben, dass die konventionelle Bissflügelaufnahme beispielsweise intraossäre radioluzente Läsionen erst ab einer 50-prozentigen Knochendemineralisation erfasst. Was geschieht vorher im Knochen – bevor es zu einer Entkalkung gekommen ist? Wird bei einer Gingivitis möglicherweise bereits auch der Knochen verändert? Die Tatsache, dass frühe Veränderungen im Röntgen keine Spuren hinterlassen, schließt nicht aus, dass der Knochen bereits am entzündlichen Geschehen beteiligt ist. Diese Fragen haben die Autoren in einer an der TU München durchgeführten Studie untersucht, deren Ergebnisse kürzlich im Journal of Clinical Periodontology publiziert worden sind.
Methodik
Ein Studienkollektiv aus 42 Patienten (28–79 Jahre, Durchschnittsalter 56 ± 14,6; 25 m, 17 w) mit generalisierter Parodontitis erhielt eine MRT-Untersuchung, bevor diese der Parodontalbehandlung zugeführt wurde. Die generierten MR-Bilder wurden mit MR-Bildern einer klinisch parodontal gesunden Kontrollgruppe (n = 34) verglichen. Zahnärztliche Eingriffe innerhalb der vergangenen sechs Monate galten als Ausschlusskriterium. Alle Studienteilnehmer erhielten ein im Rahmen des Parodontitisscreenings standardisiertes Untersuchungsprotokoll – bestehend aus der Erhebung der Taschensondierungstiefe an sechs Zahnstellen und dem Zeichen der Blutung bei Sondierung.
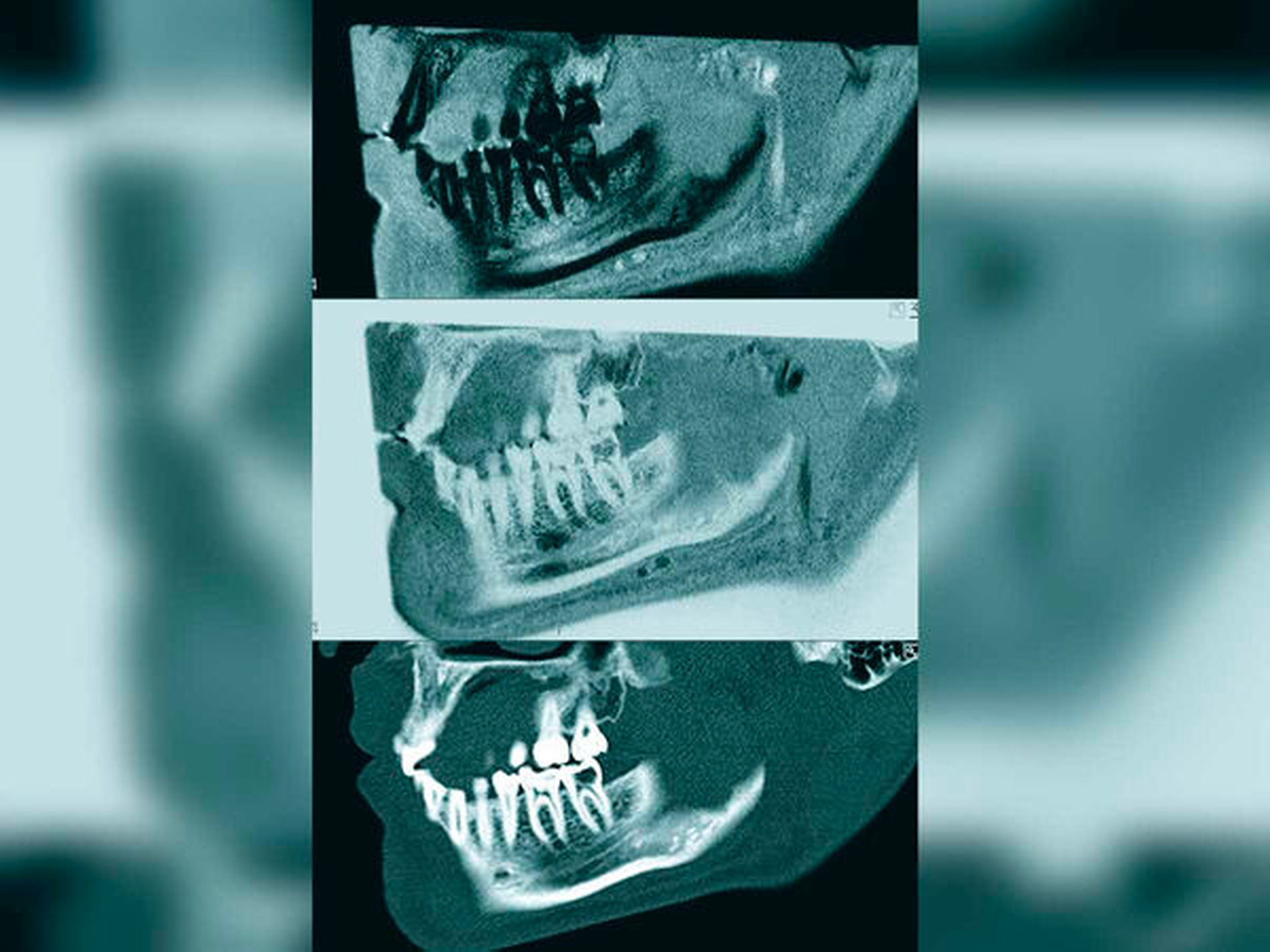
Definiert wurde eine generalisierte Parodontitis, wenn ein Attachmentverlust an zwei oder mehr als zwei interdentalen Stellen nicht benachbarter Zähne festzustellen war und/oder eine Taschensondierungstiefe (TST) von > 3 mm an der oralen oder an der lingualen Position auftrat. Aktuelle OPT-Aufnahmen wurden in die Auswertungen einbezogen (sofern verfügbar) und durch die Patienten zur weiteren Evaluation zur Verfügung gestellt. Die MRT-Untersuchungen wurden am Klinikum rechts der Isar in der Abteilung für Diagnostische und Interventionelle Neuroradiologie an einem 3T-MRT-Scanner (Elition, Philips Healthcare, Best, Niederlande) durchgeführt, wobei eine 16-Kanal-Kopf-Hals-Spule verwendet wurde. Es wurden je zwei Sequenzen aufgenommen, wobei die eine der Darstellung von Knochen dediziert ist (T1 FFE Black bone, 3D isotrope Sequenz mit 0,43 x 0,43 x 0,43 mm Voxelgröße) und die andere sehr sensitiv intraossäre Ödeme detektieren kann (T2 STIR, 3D isotrope Sequenz mit 0,65 x 0,65 x 0,65 mm Voxelgröße). Die Aufnahmezeit betrug circa fünf bis sechs Minuten pro Sequenz, so dass der Patient insgesamt circa zwölf Minuten im Scanner verbrachte. Die Applikation von Kontrastmittel war nicht notwendig.
Die Auswertung der Bildgebungsparameter erfolgte verblindet. Die MRT-Bildbetrachtung wurde durch erfahrene Radiologen durchgeführt, die keinerlei Informationen bezüglich des klinischen Parodontitisbefunds hatten. Der klinische Parodontitisstatus wurde durch Zahnärzte erhoben – zwei bis 14 Tage, bevor die MRT-Aufnahmen durchgeführt wurden, so dass auch hier der Bildstatus den Untersuchern unbekannt war. Die MRT-Aufnahmen wurden bezüglich ihrer Bildqualität kategorisiert, wobei die Kriterien die Abgrenzbarkeit anatomischer Strukturen und Pathologien sowie Bewegungs- und Metallartefakte beinhalteten und sich nach der klinischen Verwertbarkeit richteten. Primär wurden im gesunden Kontrollkollektiv Normwerte für die Signalintensität des trabekulären Knochens an definierten Arealen zwischen den Inzisoren und im Bereich der Prämolaren erhoben. Diese dienten als Standardvergleichswerte am Gesunden.
Statistische Auswertung
Die von Parodontitis betroffenen Zahnstellen wurden entsprechend ihrer Sondierungstiefe in Gruppen eingeteilt (< 3 mm, 4 mm, 5 mm, 6 mm, ... 9 mm). Das knöcherne Ödem wurde analog der Positionen der Taschensondierung linear senkrecht in die Tiefe vermessen. Der Knochen, der noch nicht abgebaut, aber ödematös verändert war, wurde als präklinischer Knochenverlust definiert. Um die Varianz des Ödemvolumens zwischen den unterschiedlichen Gruppen zu vergleichen, wurden der Mann-Whitney- und der Kruskal-Wallis-Test angewandt. Zum Vergleich zweier Gruppen diente die Berechnung des Spearman-Rho-Koeffizienten, um den Zusammenhang zwischen dem Parameter Blutung bei Sondierung (ja/nein) zu beurteilen. Es wurde eine binäre logistische Regressionsanalyse durchgeführt, um zum einen die Auswirkung der Taschensondierungstiefe auf die ossäre Ödemausdehnung zu untersuchen sowie zum anderen umgekehrt den Einfluss der Ödemgröße auf eine pathologische (> 3 mm) Taschensondierungstiefe. Die Gruppen wurden ferner eingeteilt in positives Blutungszeichen bei Sondierung (ja/nein) und pathologische versus nicht pathologische Taschensondierungstiefen (> 3 mm / ≤ 3 mm). Es wurde eine weitere binäre logistische Regressionsanalyse durchgeführt an Stellen mit einer nicht als pathologisch definierten Taschensondierungstiefe (≤ 3 mm), wobei der Faktor des Vorhandenseins eines ossären Ödems (ja/nein) als abhängige Variable gewählt wurde. Ein p-Wert von < 0,05 wurde als signifikant angesehen. Der bereits stattgefundene Knochenabbau wurde anhand der OPT- und der MRT-Aufnahmen vermessen, und die Werte wurden miteinander verglichen.
Ergebnisse
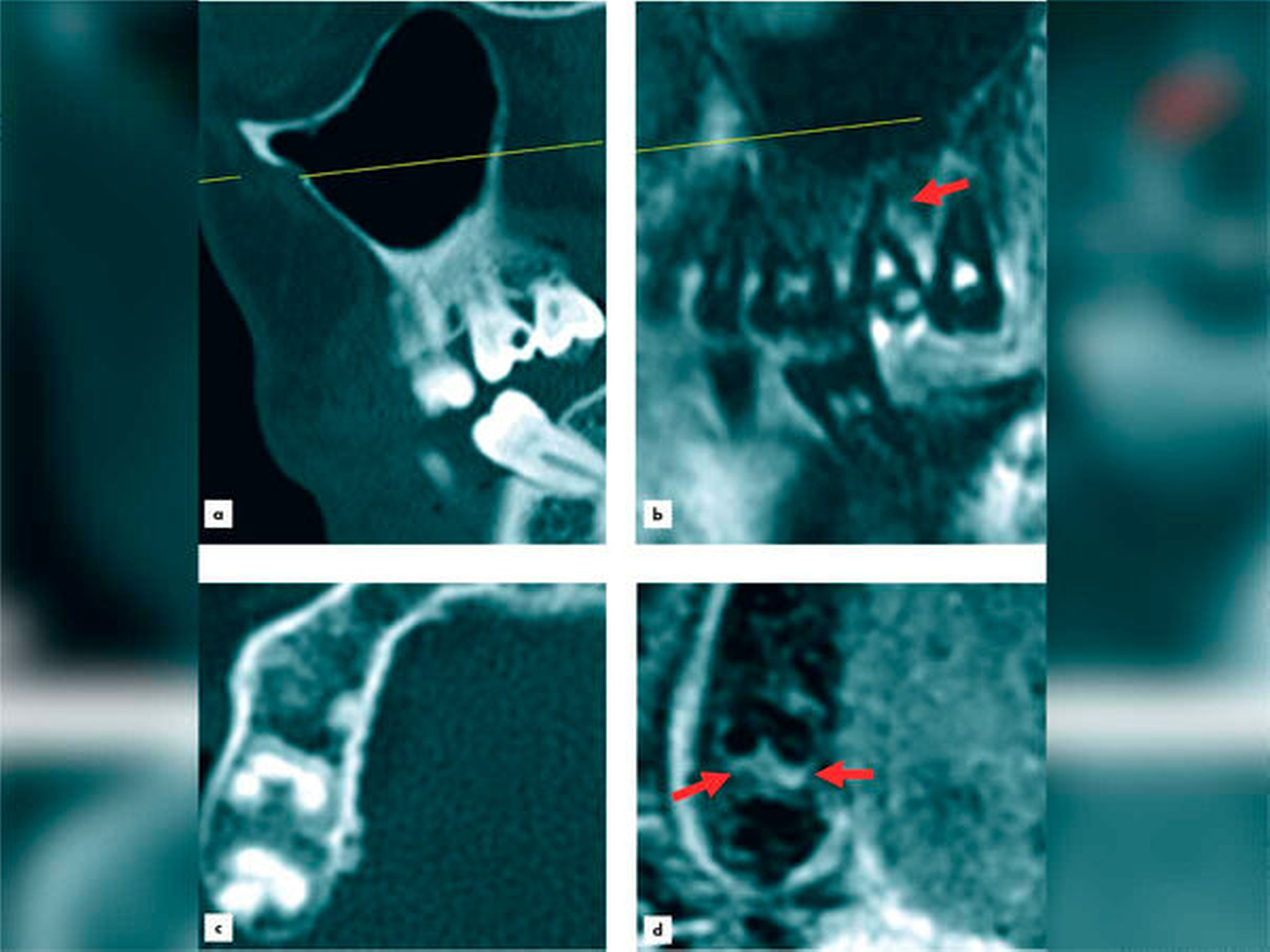
Die Auswertung des Knochenverlusts ergab einen Unterschied zwischen den Werten, die in der OPT gemessen wurden, und denen aus den MRT-Aufnahmen von circa vier Prozent. Es besteht jedoch nur eine begrenzte Vergleichbarkeit der beiden Bildgebungsmodalitäten, da es sich beim Verfahren der OPT-Bildgebung um ein zweidimensionales Verfahren mit zusätzlichem Verzerrungsfaktor und bei der MRT um ein dreidimensionales Schnittbildverfahren handelt. Besser wäre der Vergleich MRT zu DVT gewesen, der uns leider nur sehr vereinzelt vorlag (Abbildungen 2 und 3).
Monika Probst
Die MRT-Signalwerte in den Ödemsequenzen (3D STIR) bei den Kontrollpersonen und den Parodontitispatienten wurden verglichen, wobei sich ein hochsignifikanter Unterschied zwischen beiden Gruppen fand. Bei den Parodontitispatienten waren die Werte mehr als doppelt so hoch wie in der Kontrollgruppe, was den visuellen Bildeindruck messtechnisch bestätigte. In der Gruppe der Parodontitispatienten wurde das visuell detektierte Ödem durch zwei Radiologen (einen Neuroradiologen mit mehr als zehn Jahren Berufserfahrung und einen Radiologen, gleichzeitig Zahnarzt, mit fünf Jahren Berufserfahrung) vermessen. Es zeigte sich eine sehr gute Übereinstimmung zwischen den beiden Befundenden (ICC = 0,994, p < 0,0001), so dass hier valide, reproduzierbare Werte vorliegen.
Die Patientenkohorte wurde entsprechend der gemessenen Taschensondierungstiefe eingeteilt in ≤ 3 mm und > 3 mm. Die Größe des knöchernen Ödems an Stellen mit Taschensondierungstiefen, die einen gesunden (≤ 3 mm) und einen pathologischen Zustand (> 3 mm) repräsentieren, war hoch signifikant unterschiedlich (p < 0,0001). Die lineare Ausdehnung des Knochenödems wurde mit zunehmender Taschentiefe intensiver. Die Größenausdehnung des Knochenödems korrelierte signifikant mit der Taschensondierungstiefe (rho = 0,556; p < 0,0001) sowie mit einer Blutung bei Sondierung (rho = 0,264; p < 0,0001). Wenn man das ossäre Ödem als von Knochenabbau gefährdetes Areal betrachtet, ergab sich zu dem bereits stattgefundenen Knochenverlust ein zusätzlicher präklinischer Knochenverlust von 38 bis 89 Prozent. Eine Untergruppenanalyse, wobei nur die Zahnstellen mit einer Sondierungstaschentiefe ≤ 3 mm ausgewertet wurden, ergab ein signifikant stärkeres Knochenödem an Stellen mit (0,37 ± 1,01 mm) als ohne (0,22 ± 0,91 mm; p < 0,0001) Blutung bei der Sondierung. Das Zeichen der Blutung bei Sondierung korrelierte signifikant mit präklinischen Veränderungen im Alveolarknochen, nämlich einem 2,51-fach höheren Risiko für ein Knochenödem an Stellen, die positiv auf Blutung bei Sondierung waren (OR 2,51; 95 Prozent CI: 1,54–4,11; p < 0,0001).
Diskussion
Die Diagnose der Parodontitis basiert bisher auf klinischen und röntgenologischen Befunden, das heißt Taschentiefe, klinischer Knochenverlust oder röntgenologischer Knochenverlust [Elashiry et al., 2019]. Die Strategie und der Erfolg der Parodontalbehandlung sind unweigerlich an den individuellen Schweregrad der Erkrankung, also den Verlust des parodontalen Attachments, gebunden [Pretzl et al., 2019; Sanz-Sanchez et al., 2020]. Dementsprechend zielen die klinischen und röntgenologischen Parameter darauf ab, das aktuelle Ausmaß der parodontalen Zerstörung zu erkennen und zu charakterisieren sowie das individuelle Stadium der Erkrankung zu klassifizieren [Assessment, 2004]. Neben dem klinisch quantifizierbaren, bereits eingetretenen Gewebeverlust scheint es wahrscheinlich, dass die anhaltende Entzündungsreaktion in der parodontalen Tasche zu vorläufigen Veränderungen im betroffenen Gewebe führt, die später in klinisch nachweisbaren Gewebedefekten münden.
Anders als die konventionelle Röntgenaufnahme basiert die Magnetresonanztomografie (MRT) auf nicht-ionisierender Strahlung und nutzt die unterschiedlichen magnetischen Eigenschaften der in Wasser und Fett enthaltenen Wasserstoffkerne zur Bildgebung. Aufgrund der Anreicherung von freiem Wasser im Extrazellulärraum entzündeter Knochenbereiche kann die MRT das daraus resultierende Knochenödem darstellen [McGonagle et al., 1998]. Die Kombination von 3-D-T1-Knochensequenzen und 3-D-T2-STIR-Sequenzen zeigt zuverlässig Knochenabbau und von Abbau gefährdeten Knochen an. Es finden sich diverse Studien in der Literatur, die alle zu dem Ergebnis kommen, dass die T1-Knochensequenzen vergleichbare Ergebnisse liefern wie CT-Scans [Breighner et al., 2018; Cho et al., 2019; Gersing et al., 2019; Ruetters et al., 2019; Juerchott et al., 2020]. Die T2-STIR-Sequenz grenzt aktive entzündliche knöcherne Läsionen zuverlässig ab [Baraliakos et al., 2005]. Stellen mit einer klinischen Sondierungstiefe von ≤ 3 mm werden im Allgemeinen mit einem gesunden Zahnhalteapparat assoziiert [Chapple et al., 2018]. Interessanterweise fanden sich jedoch in der MRT auch knöcherne Ödeme an Stellen mit Sondierungstiefen von 2 oder 3 mm. Insbesondere zeigte eine spezifische Analyse der Daten mit einer Sondierungstiefe ≤ 3 mm einen klaren Zusammenhang zwischen dem Vorhandensein eines Knochenödems und der Manifestation von Blutungen bei der Sondierung. Diesen Daten zufolge ist das Risiko für das Auftreten eines Knochenödems innerhalb des zahntragenden Knochens an Stellen mit Sondierungsblutungen 2,5-mal höher als bei negativem Blutungszeichen.
Aus klinischer Sicht wird an Stellen mit Taschensondierungstiefe ≤ 3 mm und positivem Blutungszeichen die Diagnose einer Gingivitis gestellt [Chapple et al., 2018]. Eine Gingivitis wird als häufige Vorstufe der Parodontitis angesehen, die klinische Entzündungszeichen aufweist, aber keine Knochendefekte. Da beide Entitäten in erster Linie durch eine pathogene Verschiebung des subgingivalen Mikrobioms verursacht werden, schlagen neuere ätiologische Modelle vor, dass eine beginnende Dysbiose zunächst eine Gingivitis verursacht, die sich in Abhängigkeit von individuellen Faktoren zu einer offenen Dysbiose entwickelt, die schließlich verstärkte Entzündungsreaktionen zusammen mit einer klinischen Zerstörung des parodontalen Befestigungsapparats auslöst [Meyle und Chapple, 2015]. In Übereinstimmung mit diesem Modell könnte das knöcherne Ödem auf Teile des zahntragenden Knochens hinweisen, die bereits angegriffen, aber noch nicht knöchern zerstört wurden. Im Fall einer anhaltenden subgingivalen Dysbiose und einer dadurch exazerbierten Entzündung könnten diese Teile des krestalen Knochens einem erheblichen Resorptionsrisiko ausgesetzt sein, das zu klinisch und/oder röntgenologisch erkennbaren parodontalen Defekten führt.
Bei Patienten mit rheumatoider Arthritis, bei denen aufgrund einer Gelenkersatztherapie histologische Gewebeproben gewonnen werden konnten, korrelierten die auf STIR-MRT-Bildern erkennbaren Knochenödeme und Erosionen tatsächlich histologisch mit entzündlichen Infiltraten und dem Ersatz von Knochenmarkfett durch Entzündungszellen in unmittelbarer Nähe von Defekten des kortikalen Knochens [Jimenez-Boj et al., 2007]. Ob diese Erkenntnisse aus der Rheumatologie auf die Parodontologie übertragbar sind, ist noch nicht histologisch gesichert, aber die Hinweise verdichten sich.
Das Ausmaß des Knochenödems korreliert nicht zwangsläufig mit dem des Knochenverlusts. So können beispielsweise alte Substanzdefekte bei einer arretierten Parodontitis bestehen bleiben. Das Knochenödem scheint vielmehr mit der Krankheitsaktivität als mit dem Ausmaß einer bereits vorbestehenden Knochendestruktion zusammenzuhängen.
Wenn man postuliert, dass die lineare Ausdehnung des Knochenödems als ein frühes Vorläuferstadium einer entzündlich bedingten Geweberesorption zu werten wäre, dann könnte der Gesamtknochenverlust, das heißt der tatsächliche und der präklinische Knochenverlust, den durch klinische Tests – wie Taschensondierungstiefen – vermuteten Knochenverlust um bis zu 89 Prozent übersteigen. Sowohl der Erfolg der Parodontalbehandlung als auch die Prognose für den Erhalt parodontal geschädigter Zähne werden stark vom verbleibenden Attachment und einer erhöhten Zahnmobilität beeinflusst [Faggion et al., 2007]. Obwohl die Entscheidung über den Erhalt oder die Entfernung von Zähnen mit progredienter Parodontalerkrankung in erster Linie auf dem Fortschreiten des Knochenverlusts beruht, haben mehrere Studien gezeigt, dass die Prognose für eine erfolgreiche Behandlung und/oder das Überleben der Zähne nur unzureichend vorhersagbar ist [McGuire, 1991; Checchi et al., 2002]. Da die mittels MRT festgestellten knöchernen Veränderungen mit einer signifikanten Entzündung zusätzlicher Teile des zahntragenden Knochens korrelieren, die über den klinischen Gewebedefekt hinausgehen, könnte man annehmen, dass die schlechte Vorhersagbarkeit zumindest teilweise durch den Mangel an Informationen über den tatsächlichen Umfang des bereits erkrankten Gewebes bedingt ist. Auch wenn die intraossären Veränderungen nicht zwangsläufig zu einem parodontalen Knochenverlust in der Zukunft führen müssen, könnte eine ergänzende MRT-Untersuchung der von Parodontitis betroffenen Zähne vor der Entscheidung über die Zahnerhaltung die Chance für eine belastbarere Therapieoption bieten.
Nachteile der MRT-Diagnostik sind deren hohe Kosten und die bislang noch begrenzte Verfügbarkeit. Suszeptibilitätsartefakte durch restauratives Material stellen nur bei stark magnetischen Komponenten ein Hindernis dar. Es hat sich gezeigt, dass – selbst wenn einzelne Zähne aufgrund von Metallartefakten nicht auswertbar sein sollten – sich nur sehr selten der ganze Patient als ungeeignet für die MRT-Diagnostik erweist. Nicht die Menge des Fremdmaterials, sondern die Tatsache, ob das verwendete Material ferro- oder diamagnetisch ist, führt zu metallinduzierten Artefakten. Gold und Amalgam zum Beispiel erzeugen fast keine Artefakte, Titan nur wenige, während Edelstahl hohe Artefakte verursacht [Chockattu et al., 2018].
Kürzlich durchgeführte oralchirurgische Eingriffe müssen anamnestisch erfragt werden, da auch diese zu einem knöchernen Ödem durch die mechanische Manipulation führen könnten. Das gilt auch für Tumorerkrankungen und Osteomyelitis.
Zusammenfassung
Die MRT ist in der Lage, parodontal erkrankte Zähne und die damit verbundenen intraossären Veränderungen darzustellen. Die Studienergebnisse deuten darauf hin, dass das Knochenödem als Surrogatmarker für frühe Stadien der Parodontalerkrankung dienen kann. Damit kann die MRT einen Mehrwert für die Parodontitisdiagnostik generieren. Herauszustellen ist, dass selbst an formal „parodontal gesunden“ Stellen mit einer Taschentiefe < 3 mm bei Vorliegen eines positiven Blutungszeichens bei der Sondierung überhäufig bereits ein knöchernes Ödem gefunden werden kann. Diese Erkenntnisse bieten neue Möglichkeiten für die Früherkennung, Entscheidungsfindung und das Therapiemonitoring von Parodontalerkrankungen.
Literaturliste
Armitage, G. C. (1999). Development of a classification system for periodontal diseases and conditions. Annals of periodontology, 4(1), 1-6.
Assessment, S. C. o. H. T. (2004). Chronic Periodontitis - Prevention, Diagnosis and Treatment: A Systematic Review. (9187890968). Accessed 16 Jan 2020, from Swedish Council on Health Technology Assessment.
Baraliakos, X., Hermann, K. G., Landewe, R., Listing, J., Golder, W., Brandt, J., & Braun, J. (2005). Assessment of acute spinal inflammation in patients with ankylosing spondylitis by magnetic resonance imaging: a comparison between contrast enhanced T1 and short tau inversion recovery (STIR) sequences. Annals of the Rheumatic Diseases, 64(8), 1141– 1144.
Breighner, R. E., Endo, Y., Konin, G. P., Gulotta, L. V., Koff, M. F., & Potter, H. G. (2018). Technical developments: zero echo time imaging of the shoulder: enhanced osseous detail by using MR imaging. Radiology, 286(3), 960– 966.
Chapple, I. L. C., Mealey, B. L., Van Dyke, T. E., Bartold, P. M., Dommisch, H., Eickholz, P., Geisinger, M. L., Genco, R. J., Glogauer, M., Goldstein, M., Griffin, T. J., Holmstrup, P., Johnson, G. K., Kapila, Y., Lang, N. P., Meyle, J., Murakami, S., Plemons, J., Romito, G. A., … Yoshie, H. (2018). Periodontal health and gingival diseases and conditions on an intact and a reduced periodontium: Consensus report of workgroup 1 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of Clinical Periodontology, 45(Suppl 20), S68– S77.
Checchi, L., Montevecchi, M., Gatto, M. R., & Trombelli, L. (2002). Retrospective study of tooth loss in 92 treated periodontal patients. Journal of Clinical Periodontology, 29(7), 651– 656.
Cho, S. B., Baek, H. J., Ryu, K. H., Choi, B. H., Moon, J. I., Kim, T. B., Kim, S. K., Park, H., & Hwang, M. J. (2019). Clinical feasibility of zero TE skull MRI in patients with head trauma in comparison with CT: a single-center study. AJNR American Journal of Neuroradiology, 40(1), 109– 115.
Chockattu, S. J., Suryakant, D. B., & Thakur, S. (2018). Unwanted effects due to interactions between dental materials and magnetic resonance imaging: a review of the literature. Restor Dent Endod, 43(4), e39.
Dai, R., Lam, O.L., Lo, E.C., Li, L.S., Wen, Y., McGrath, C. A systematic review and meta-analysis of clinical, microbiological, and behavioural aspects of oral health among patients with stroke. J Dent. 2015, 43(2), 171-80.
Elashiry, M., Meghil, M. M., Arce, R. M., & Cutler, C. W. (2019). From manual periodontal probing to digital 3-D imaging to endoscopic capillaroscopy: Recent advances in periodontal disease diagnosis. Journal of Periodontal Research, 54(1), 1– 9.
Faggion, C. M. Jr, Petersilka, G., Lange, D. E., Gerss, J., & Flemmig, T. F. (2007). Prognostic model for tooth survival in patients treated for periodontitis. Journal of Clinical Periodontology, 34(3), 226– 231.
Fagundes, N.C.F., Almeida, A.P.C.P.S.C., Vilhena, K.F.B., Magno, M.B., Maia, L.C., Lima, R.R. Periodontitis As A Risk Factor For Stroke: A Systematic Review And Meta-Analysis. Vasc Health Risk Manag. 2019, 15, 519-532.
Frencken, J. E., Sharma, P., Stenhouse, L., Green, D., Laverty, D., & Dietrich, T. (2017). Global epidemiology of dental caries and severe periodontitis–a comprehensive review. Journal of clinical periodontology, 44, S94-S105.
Gersing, A. S., Pfeiffer, D., Kopp, F. K., Schwaiger, B. J., Knebel, C., Haller, B., Noël, P. B., Settles, M., Rummeny, E. J., & Woertler, K. (2019). Evaluation of MR-derived CT-like images and simulated radiographs compared to conventional radiography in patients with benign and malignant bone tumors. European Radiology, 29(1), 13– 21.
Jimenez-Boj, E., Nöbauer-Huhmann, I., Hanslik-Schnabel, B., Dorotka, R., Wanivenhaus, A.-H., Kainberger, F., Trattnig, S., Axmann, R., Tsuji, W., Hermann, S., Smolen, J., & Schett, G. (2007). Bone erosions and bone marrow edema as defined by magnetic resonance imaging reflect true bone marrow inflammation in rheumatoid arthritis. Arthritis and Rheumatism, 56(4), 1118– 1124.
Juerchott, A., Sohani, M., Schwindling, F. S., Jende, J. M. E., Kurz, F. T., Rammelsberg, P., Heiland, S., Bendszus, M., & Hilgenfeld, T. (2020). In vivo accuracy of dental magnetic resonance imaging in assessing maxillary molar furcation involvement: A feasibility study in humans. Journal of Clinical Periodontology, 47(7), 809– 815.
Kassebaum, N. J., Bernabé, E., Dahiya, M., Bhandari, B., Murray, C. J. L., & Marcenes, W. (2014). Global Burden of Severe Periodontitis in 1990-2010: A Systematic Review and Meta-regression. Journal of dental research, 93(11), 1045-1053.
McGonagle, D., Gibbon, W., O'Connor, P., Green, M., Pease, C., & Emery, P. (1998). Characteristic magnetic resonance imaging entheseal changes of knee synovitis in spondyloarthropathy. Arthritis and Rheumatism, 41(4), 694– 700.10.1002/1529-0131(199804)41:4<694:AID-ART17>3.0.CO;2-#.
McGuire, M. K. (1991). Prognosis versus actual outcome: a long-term survey of 100 treated periodontal patients under maintenance care. Journal of Periodontology, 62(1), 51– 58.
Meyle, J., & Chapple, I. (2015). Molecular aspects of the pathogenesis of periodontitis. Periodontology 2000, 69(1), 7– 17.
Mundgesundheitsstudie, F. D. (2016). Kurzfassung. Institut der Deutschen Zahnärzte im Auftrag von Bundeszahnärztekammer und Kassenzahnärztlicher Bundesvereinigung, 1, 6-8.
Ortman LF, Dunford R, McHenry K, Hausmann I. Subtraction radiography and computer-assisted densitometric analyses of standardized radiographs. A comparison study with 125I absorptiometry. J Periodontal Res 1985: 20: 644– 651
Petersen, P. E., & Ogawa, H. (2012). The global burden of periodontal disease: towards integration with chronic disease prevention and control. Periodontology 2000, 60(1), 15-39.
Pretzl, B., Sälzer, S., Ehmke, B., Schlagenhauf, U., Dannewitz, B., Dommisch, H., Eickholz, P., & Jockel-Schneider, Y. (2019). Administration of systemic antibiotics during non-surgical periodontal therapy-a consensus report. Clinical Oral Investigations, 23(7), 3073– 3085.
Ruetters, M., Juerchott, A., El Sayed, N., Heiland, S., Bendszus, M., & Kim, T. S. (2019). Dental magnetic resonance imaging for periodontal indication - a new approach of imaging residual periodontal bone support. Acta Odontologica Scandinavica, 77(1), 49– 54.
Sanz-Sanchez, I., Montero, E., Citterio, F., Romano, F., Molina, A., & Aimetti, M. (2020). Efficacy of access flap procedures compared to subgingival debridement in the treatment of periodontitis. A systematic review and meta-analysis. Journal of Clinical Periodontology, 47(S22), 282– 302.