Tooth-shell-technique: Kieferkammaugmentation mit autologem Dentin
Ein 50-jähriger Patient wurde von seinem Hauszahnarzt in die chirurgische Abteilung der Akademie für Zahnärztliche Fortbildung Karlsruhe überwiesen, mit der Bitte um Implantation regio 22. Der Zahn 22 wies klinisch eine Fistel und eine pathologische Lockerung sowie radiologisch eine ausgedehnte periapikale Transluzenz im Sinne einer chronischen apikalen Parodontitis auf. Es handelte sich um einen wurzelgefüllten Zahn. Der Hauszahnarzt hatte ihn als nicht erhaltungsfähig eingestuft und ihn deshalb schon vor der Überweisung extrahiert. Deswegen stand Zahn 22 nicht als Augmentationsmaterial zur Verfügung.
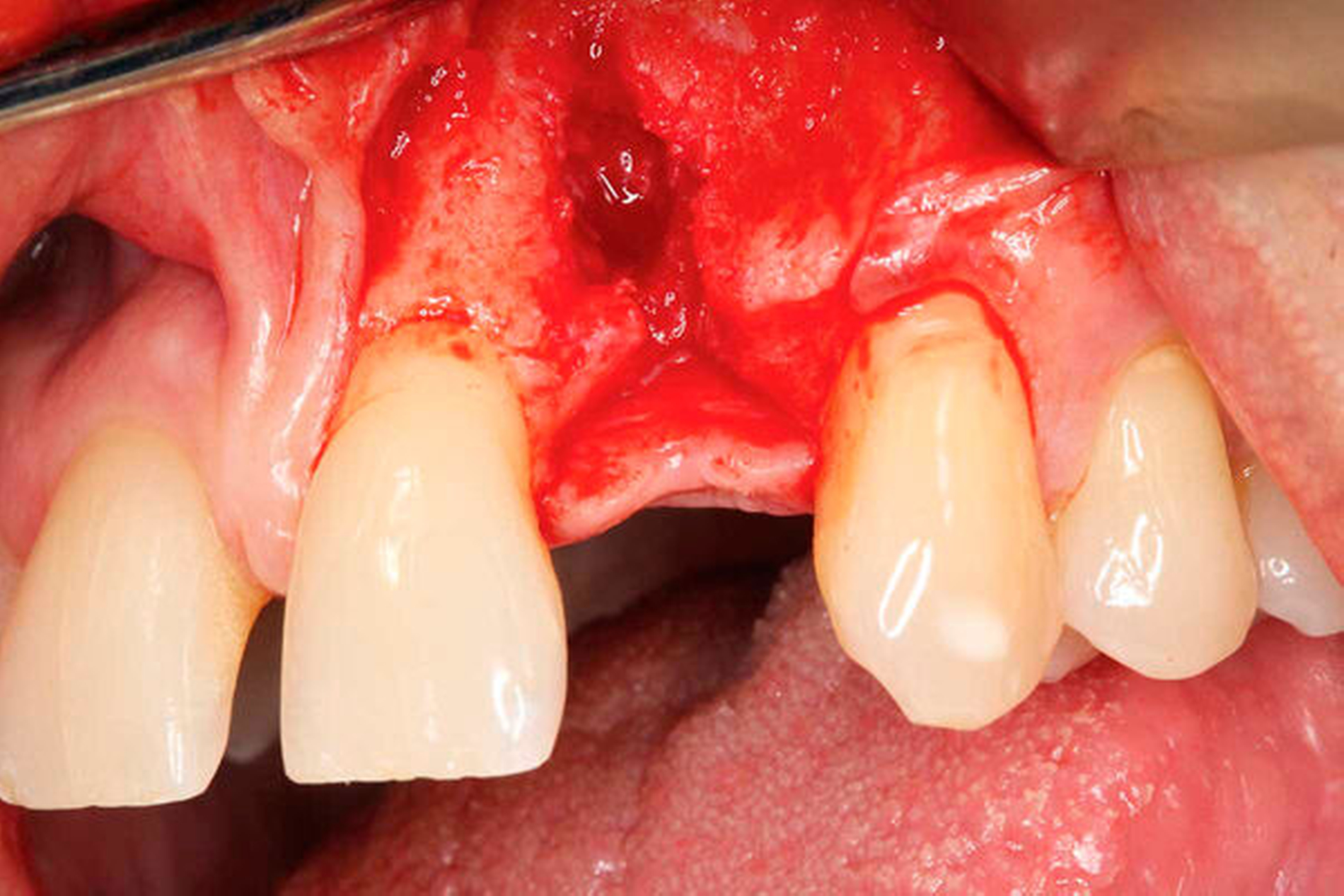
Die Allgemeinanamnese des Patienten war unauffällig. Eine Medikamenteneinnahme oder das Vorliegen von Allergien wurden verneint. Der Wunsch des Patienten war eine implantologische Lösung für den fehlenden Zahn 22 (Abbildung 1). Eine Brückenversorgung sollte, wenn möglich, vermieden werden.
Die klinische Befunderhebung ergab eine Schaltlücke regio 22. Die restlichen Zähne in Ober- und Unterkiefer zeigten keine Auffälligkeiten. Der CO2-Sensibilitätstest der Zähne 21 und 23 war positiv. Ein Diastema lag zwischen den Zähnen 11 und 21 vor (Abbildung 1). Auch Zahn 22 stand zuvor auf Lücke zu Zahn 21.
Zur besseren Beurteilbarkeit der vorliegenden Knochensituation wurde eine digitale Volumentomografie angefertigt. Darin wurde eine deutliche Resorption der bukkalen Knochenlamelle ersichtlich. Die Nachbarzähne waren unauffällig (Abbildung 1). Aus den vorliegenden Befunden ergaben sich folgende Diagnosen:
Insuffizientes Knochenlager regio 22
Nicht erhaltungswürdiger Zahn 18
Therapie
Da regio 11/21 ein Diastema vorlag sowie zuvor Zahn 22 lückig zu Zahn 21 war, kam eine Brückenkonstruktion aufgrund ästhetischer Nachteile für den Patienten nicht infrage. Außerdem sollten ein Beschleifen und der damit einhergehende Hartsubstanzverlust an den Nachbarzähnen vermieden werden. Die bukkale Knochenlamelle war infektionsbedingt weitestgehend resorbiert, wodurch sich die Notwendigkeit einer Augmentation ergab. Da der Patient eine Knochenentnahme nach Möglichkeit vermeiden wollte, sollte ein nicht erhaltungswürdiger und durch die Schleimhaut ragender oberer Weisheitszahn für die Augmentation mit autologem Dentin genutzt werden.
Aufgrund der dreiwandigen Defektform regio 22 war eine Augmentation mit simultaner Implantation vorgesehen. Der Patient würde über die Neuartigkeit der geplanten Tooth-shell-technique, fehlende Langzeituntersuchungen und mögliche Komplikationen aufgeklärt.
Zahnaufbereitung: Nach der Extraktion des Zahnes 18 folgte die Entfernung von Debris sowie des Parodontalligaments von der Wurzeloberfläche mit einem grobkörnigen Diamantschleifer unter Wasserkühlung (Abbildung 2a). Mittels einer diamantierten Trennscheibe (Frios MicroSaw, Dentsply Sirona Implants, Mannheim, Deutschland) wurde unter Wasserkühlung eine circa 1–1,5 mm starke Dentinscheibe gewonnen (Abbildung 2b). Das restliche Dentin wurde mit einem sterilen Einweg-Mahlwerk (Smart Dentin Grinder, Kometa Bio, Creskill, USA) in 300–1200 μm große Dentinpartikel zerkleinert (Abbildungen 2c und 2d). Die Dentinscheibe und das Partikulat wurden anschließend chemisch mit antibakteriellen Lösungen aufbereitet. Abschließend erfolgte eine partielle Demineralisierung des Dentins zur Freilegung des Kollagennetzwerks und zur Freigabe osteoinduktiv wirksamer Wachstumsfaktoren [Y. K. Kim et al., 2014]. Die Zahnaufbereitung erfolgte simultan zum implantologischen Eingriff regio 22.
Operatives Vorgehen bei der Tooth-shell-technique (TST): Der augmentative Eingriff erfolgte unter perioperativer Antibiose mit Amoxicillin 750 mg dreimal täglich (ein Tag prä- und zwei Tage postoperativ). Bei bekannter Unverträglichkeit von Penicillin kann Clindamycin 300 mg dreimal täglich verordnet werden.
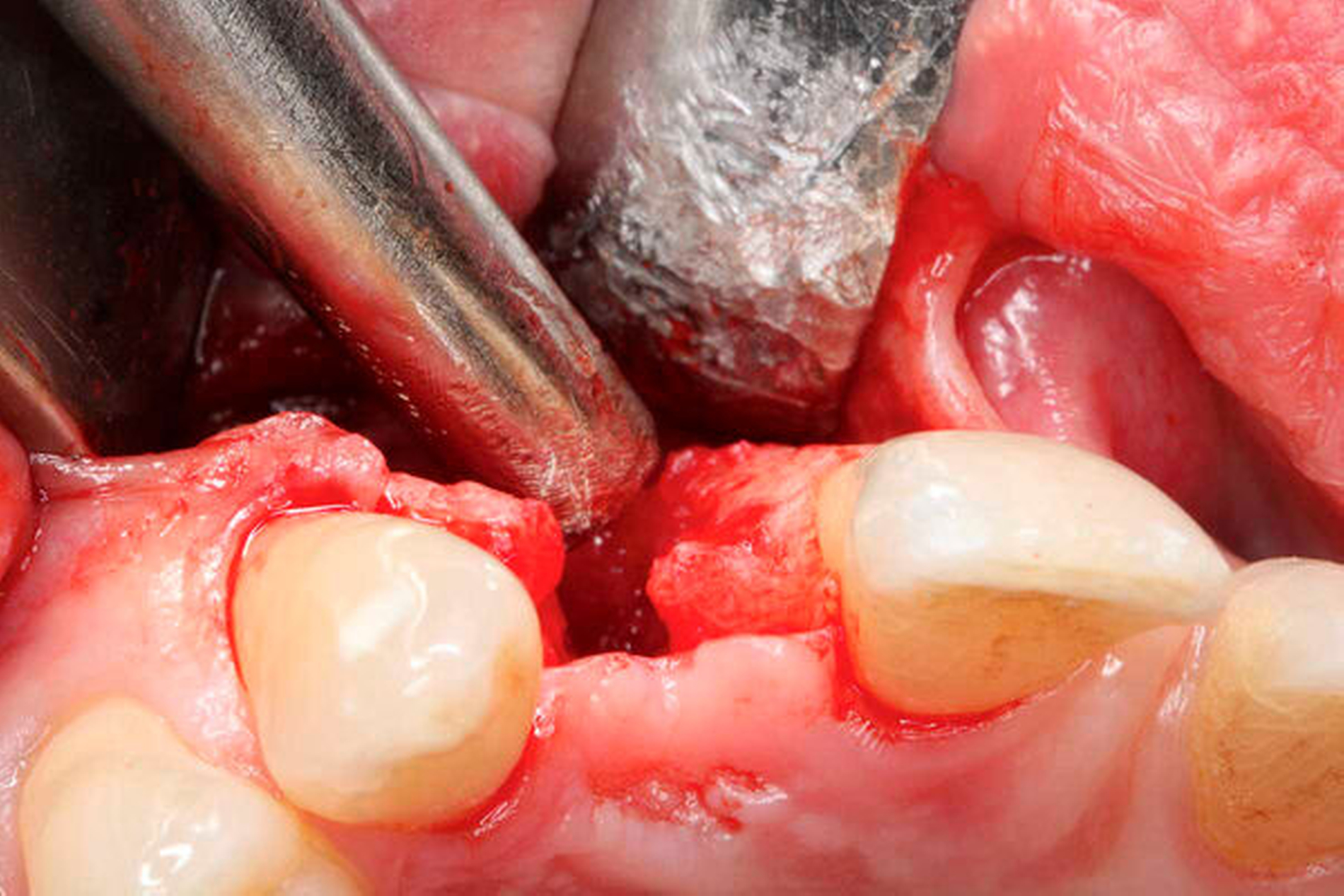
Nach Lappenbildung und Darstellung des Kieferkamms erfolgte die Aufbereitung des Implantatlagers gemäß Protokoll des Implantatherstellers. Anschließend wurde ein Implantat (ASTRA TECH Implant SystemTM EV, Dentsply Sirona, York, USA) inseriert (Abbildungen 3a bis 3c).
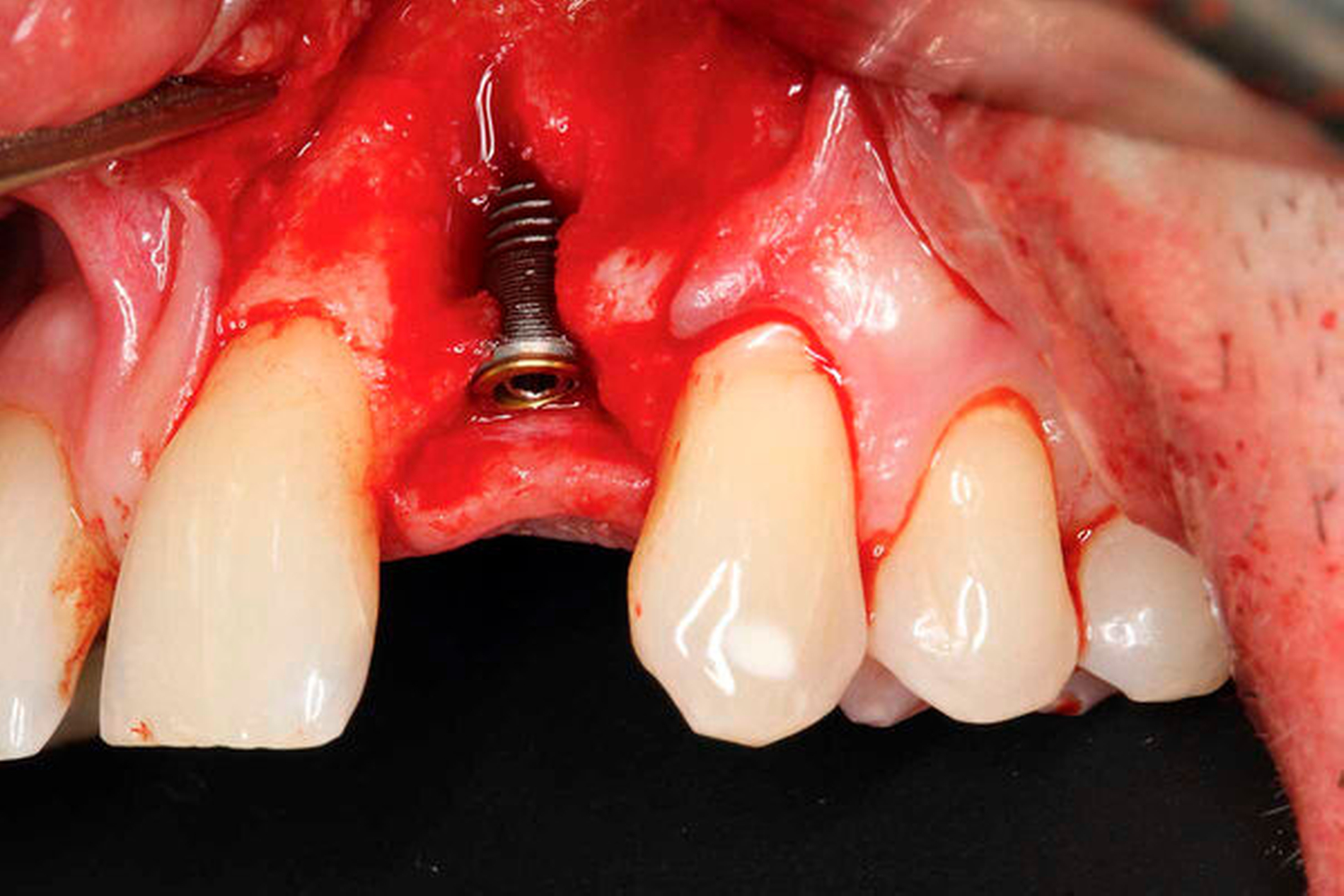
Die zuvor gewonnene und aufbereitete Dentinscheibe wurde mit Osteosyntheseschrauben (microscrews, Stoma, Emmingen-Liptingen, Deutschland) lateral des Defekts fixiert und das aufbereitete Dentinpartikulat in den Hohlraum zwischen Zahnscheibe und Implantat eingebracht (Abbildung 3d). Der Wundverschluss erfolgte spannungsfrei mit nichtresorbierbarem Nahtmaterial (Supramid 5/0, Serag-Wiessner, Naila, Deutschland). Postoperativ wurde ein DVT als Röntgenkontrolle angefertigt. Dieses zeigt das Implantat regio 22 in der Sagittalebene. Deutlich erkennbar ist die fixierte Zahnscheibe (Abbildung 4a).
Die Wundheilung in regio 22 verlief komplikationsfrei. Nach drei Monaten wurde das Implantat freigelegt. Im Rahmen dieser Behandlung erfolgte eine periimplantäre Sondierung. Diese zeigte ein stabiles Augmentat ohne erhöhte Sondierung. Die Messung des Implantatstabilitätsquotienten ISQ (Osstell Mentor, Ostell, Göteborg, Schweden) ergab einen Wert von 70. Das Implantat konnte somit für die prothetische Versorgung freigegeben werden.
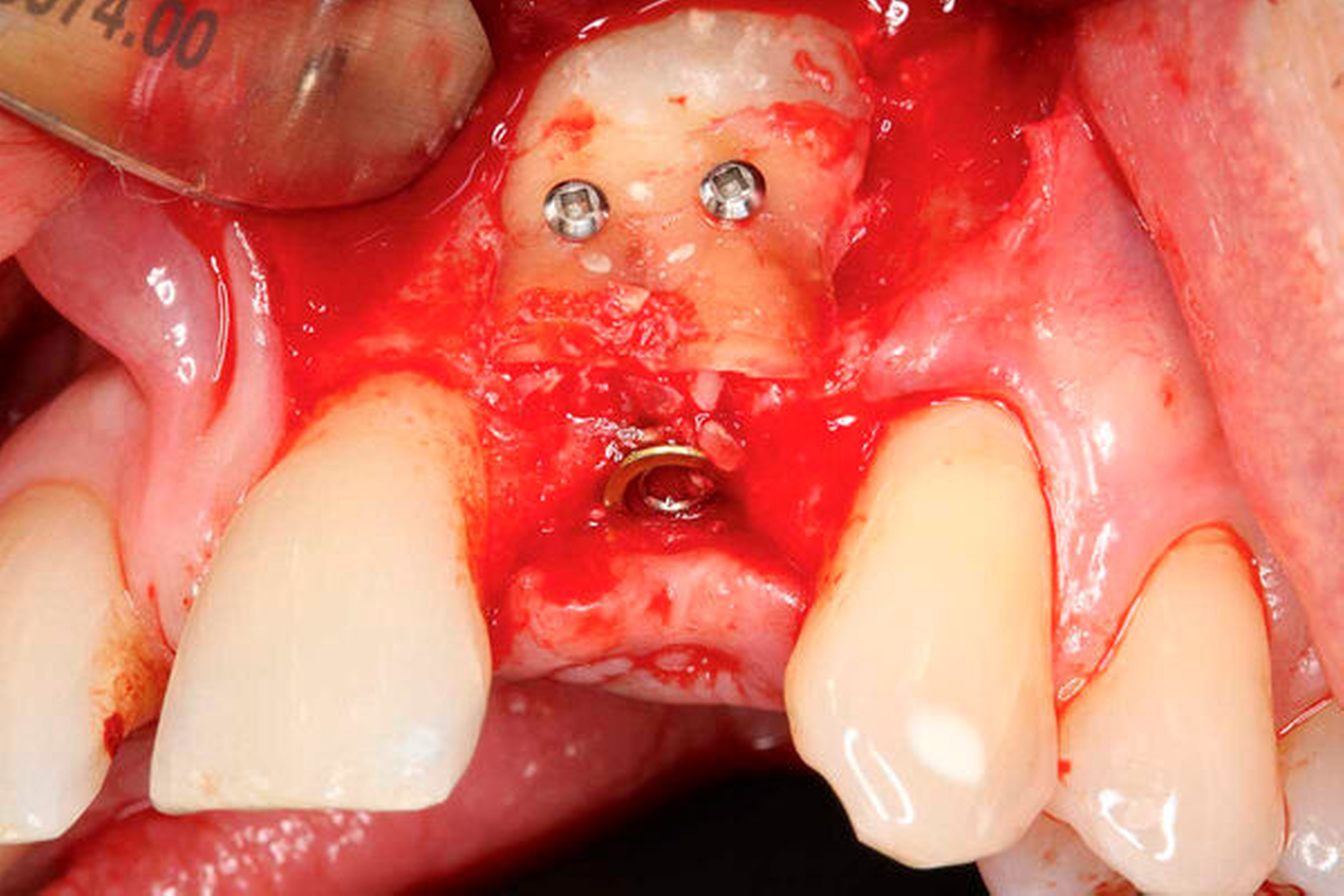
Ein Jahr nach Implantatinsertion erfolgte eine radiologische und klinische Nachkontrolle. Aufgrund der Neuartigkeit der Technik, unklarer Volumenstabilität und unbekannter Risiken wurde ein DVT angefertigt. In einem ausführlichen Gespräch wurde dies mit dem Patienten erörtert. Der Patient entschied sich deshalb für die Anfertigung eines DVTs. Das im Rahmen der Nachkontrolle angefertigte DVT zeigte eine stabile vestibuläre Lamelle ohne erkennbare Resorption (Abbildung 4b). Das augmentierte Material erscheint sehr dimensionsstabil. Das Implantat sowie das periimplantäre Gewebe waren unauffällig (Abbildung 4c).
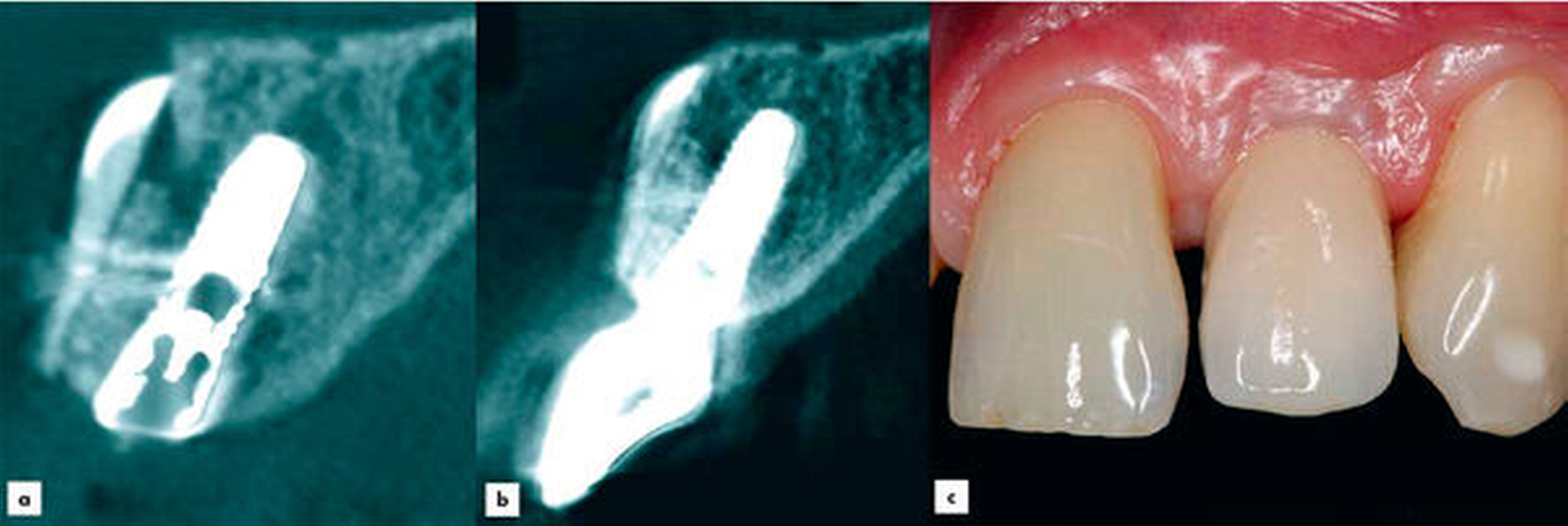
Diskussion
Für die Rekonstruktion des Kieferkamms steht eine Vielzahl an alloplastischen, allogenen oder xenogenen Knochenersatzmaterialien zur Verfügung. Dennoch gilt die Verwendung von autologem Knochen nach wie vor als Goldstandard. Autologer Knochen besitzt ausgezeichnete osteoinduktive, osteokonduktive und auch osteogenetische Eigenschaften, immunologische Reaktionen oder Krankheitsübertragungen können sicher ausgeschlossen werden und vorhersagbare Augmentationsergebnisse sind erreichbar [Sakkas et al., 2017].
Die Verwendung von Dentin wird seit einigen Jahren als alternatives autologes Material zum Kieferkammerhalt und zur Augmentation von Knochendefiziten beschrieben [Bormann et al., 2012; Minamizato et al., 2018; Schwarz et al., 2019]. Dentin eignet sich hervorragend als Knochenersatzmaterial, da es dem Knochen in seiner Zusammensetzung sehr ähnlich ist. Der Anteil anorganischer Substanz im menschlichen Dentin liegt bei circa 69 Prozent und der Anteil organischer Komponenten bei circa 17,5 Prozent. Der Alveolarknochen besteht zu circa 62 Prozent aus anorganischen und 25 Prozent organischen Bestandteilen. Sowohl beim Alveolarknochen als auch beim Dentin besteht die organische Matrix zu circa 90 Prozent aus Kollagen Typ I. Weitere neun Prozent sind nichtkollagene Proteine [Leonhardt, 1990]. Zu diesen nicht-kollagenen Proteinen zählen Osteocalcin, Osteonectin, Phosphoproteine, Proteoglykane und Sialoprotein sowie wachstumsstimulierende Faktoren wie das Bone Morphogenic Protein-2 (BMP-2), der Transforming Growth Factor-ß (TGF-ß) und der Insulin Like Growth Factor-II (IGF-II), welche die Differenzierung von mesenchymalen Stammzellen in Chondrozyten und knochenbildenden Zellen beeinflussen [S. Y. Kim et al., 2017; Y. K. Kim et al., 2014; Linde, 1989].
Die anorganischen Bestandteile des Dentins setzen sich wie beim Alveolarknochen vor allem aus verschiedenen Calciumphosphaten (Hydroxyl-apatit, ß-Tricalciumphosphat, Octacalciumphosphat und amorphes Calciumphosphat) zusammen. Diese Bestandteile finden aufgrund ihrer guten osteokonduktiven Eigenschaften unter anderem Einsatz als alloplastische Knochenersatzmaterialen [Murata et al., 2013]. Die osteokonduktiven und -induktiven Eigenschaften von Dentin konnten in mehreren Tierstudien und klinischen Studien am Menschen nachgewiesen werden [Al-Asfour et al., 2017; Andersson, 2010; Bono et al., 2017].
Durch den Einsatz von autologem Dentin kann im Gegensatz zu autologem Knochen eine Spenderregion sowie die damit verbundene Entnahmemorbidität vermieden werden. Zudem gibt es Hinweise, dass die Resorption von autologem Dentin signifikant geringer ist als bei autologen Knochenblocktransplantaten [Ramanauskaite et al., 2019].
Die in diesem Fall angewendete Methode (Tooth-shell-technique) wurde vom Autor 2017 entwickelt und erstmalig im Australian Dental Journal veröffentlicht [Korsch, 2021]. Diese Technik dient der Rekonstruktion von Kieferkammdefekten unter Einsatz von autologem Dentin und stellt eine Modifikation der von Khoury beschriebenen Split-Bone-Block-Technik dar [Khoury & Hanser, 2019]. Der auszufüllende Defekt wird bei der Split-Bone-Block-Technik durch den interponierten partikulierten Knochen deutlich schneller revaskularisiert als bei rein kortikalen oder kortikospongiösen Transplantaten. Deswegen sind mit dieser Technik bessere Regenerationsergebnisse erreichbar [Khoury F., 2009]. Der Vorteil der Tooth-shell-technique im Vergleich zur Fixierung von ganzen Zahnwurzeln ist, dass diese Technik nicht auf die Dimension der verwendeten Zahnwurzel limitiert ist und Augmentationsbreiten erlaubt, die größer sind als die Zahnwurzel breit ist. Durch das partikulierte Dentin im Spaltraum zwischen Knochen und Dentinscheibe ist eine bessere Revaskularisierung und Regeneration als bei soliden Dentinblöcken zu erwarten, wie es bei der von Khoury beschriebenen Technik nachweislich ist [Khoury & Hanser, 2019]. Vorteilhaft ist zudem, dass mit dieser Technik Augmentation und Implantatinsertion simultan erfolgen können, sofern es die Defektmorphologie und -größe zulassen [Korsch, 2021; Korsch & Peichl, 2021]. Ein Vergleich der Tooth-shell-technique mit der Technik nach Khoury konnte zeigen, dass diese zu gleichwertigen Ergebnissen nach drei Monaten führt [Korsch & Peichl, 2021]. Langzeituntersuchungen der Tooth-shell-technique stehen noch aus. Histologisch zeigte sich im Tierversuch eine knöcherne Ersatzresorption des Dentins und eine Kontaktfläche zwischen Implantat und Knochen, die mit autologen Knochenblöcken vergleichbar waren [Schwarz et al., 2016; Schwarz et al., 2016]. Im direkten Kontakt zwischen Dentin und der Titanoberfläche des Implantats konnte histologisch die Bildung von Wurzelzement und mineralisiertem Hartgewebe nachgewiesen werden [Baumer et al., 2015; Hurzeler et al., 2010; Schwarz et al., 2013].
Voraussetzung für die Tooth-shell-technique ist ein nicht erhaltungsfähiger oder nicht erhaltungswürdiger Zahn. In allen anderen Fällen muss eine Alternativtherapie angewandt werden.
Alternativ zu der in diesem Fall vorgestellten Tooth-shell-technique hätte hier auch eine klassische GBR (guided bone regeneration) Anwendung finden können. Die GBR ist eine gut dokumentierte und wissenschaftlich gut untersuchte Technik [Bassetti et al., 2016; Tolstunov et al., 2019]. Allerdings scheint die Volumenstabilität des Augmentats bei der GBR im krestralen Bereich signifikant schlechter zu sein als bei stabil fixierten Augmentaten wie Titan-Mesh oder Knochenblocktransplantaten [Mertens et al., 2019]. Beim vorliegenden Fall war bei der Jahreskontrolle eine gute Volumenstabilität im krestalen Bereich erkennbar.
Kritisch betrachtet werden muss, dass zur der hier vorgestellten Tooth-shell-technique keine Langzeitergebnisse vorliegen. Studien mit hoher Fallzahl sowie längerem Nachbeobachtungszeitraum sind deshalb erforderlich.
Literaturliste
Al-Asfour, A., Andersson, L., Kamal, M., & Joseph, B. (2013). New bone formation around xenogenic dentin grafts to rabbit tibia marrow. Dent Traumatol, 29(6), 455-460. doi:10.1111/edt.12045
Al-Asfour, A., Farzad, P., Al-Musawi, A., Dahlin, C., & Andersson, L. (2017). Demineralized Xenogenic Dentin and Autogenous Bone as Onlay Grafts to Rabbit Tibia. Implant Dent, 26(2), 232-237. doi:10.1097/ID.0000000000000518
Andersson, L. (2010). Dentin xenografts to experimental bone defects in rabbit tibia are ankylosed and undergo osseous replacement. Dent Traumatol, 26(5), 398-402. doi:10.1111/j.1600-9657.2010.00912.x
Bassetti, M. A., Bassetti, R. G., & Bosshardt, D. D. (2016). The alveolar ridge splitting/expansion technique: a systematic review. Clin Oral Implants Res, 27(3), 310-324. doi:10.1111/clr.12537
Baumer, D., Zuhr, O., Rebele, S., Schneider, D., Schupbach, P., & Hurzeler, M. (2015). The socket-shield technique: first histological, clinical, and volumetrical observations after separation of the buccal tooth segment - a pilot study. Clin Implant Dent Relat Res, 17(1), 71-82. doi:10.1111/cid.12076
Bono, N., Tarsini, P., & Candiani, G. (2017). Demineralized dentin and enamel matrices as suitable substrates for bone regeneration. J Appl Biomater Funct Mater, 15(3), e236-e243. doi:10.5301/jabfm.5000373
Bormann, K. H., Suarez-Cunqueiro, M. M., Sinikovic, B., Kampmann, A., von See, C., Tavassol, F., . . . Rucker, M. (2012). Dentin as a suitable bone substitute comparable to ss-TCP-an experimental study in mice. Microvasc Res, 84(2), 116-122. doi:10.1016/j.mvr.2012.06.004
Hurzeler, M. B., Zuhr, O., Schupbach, P., Rebele, S. F., Emmanouilidis, N., & Fickl, S. (2010). The socket-shield technique: a proof-of-principle report. J Clin Periodontol, 37(9), 855-862. doi:10.1111/j.1600-051X.2010.01595.x
Jun, S. H., Ahn, J. S., Lee, J. I., Ahn, K. J., Yun, P. Y., & Kim, Y. K. (2014). A prospective study on the effectiveness of newly developed autogenous tooth bone graft material for sinus bone graft procedure. J Adv Prosthodont, 6(6), 528-538. doi:10.4047/jap.2014.6.6.528
Khoury, F., & Hanser, T. (2019). Three-Dimensional Vertical Alveolar Ridge Augmentation in the Posterior Maxilla: A 10-year Clinical Study. Int J Oral Maxillofac Implants, 34(2), 471-480. doi:10.11607/jomi.6869
Khoury F., H. T., Khoury Ch., Neugebauer J., Trepelle T., Tunkel J., Zöller J. E. . (2009). Augmentative Verfahren in der Implantologie. Biologie und Physiologie des Implantatlagers unter Berücksichtigung von Transplantationsverfahren. Quintessenz Verlag, 2-30.
Kim, S. Y., Kim, Y. K., Park, Y. H., Park, J. C., Ku, J. K., Um, I. W., & Kim, J. Y. (2017). Evaluation of the Healing Potential of Demineralized Dentin Matrix Fixed with Recombinant Human Bone Morphogenetic Protein-2 in Bone Grafts. Materials, 10(1049), 1-13. doi:10.3390/ma10091049
Kim, Y. K., Yun, P. Y., In-Woong Um, I. W., Lee, H. J., Yi, Y. J., Bae, J. H., & Lee, J. (2014). Alveolar ridge preservation of an extraction socket using autogenous tooth bone graft material for implant site development: prospective case series. . The Journal of Advanced Prosthodontics, 6, 521-527.
Korsch, M. (2021). Tooth shell technique: A proof of concept with the use of autogenous dentin block grafts. Aust Dent J, 66(2), 159-168. doi:10.1111/adj.12814
Korsch, M., & Peichl, M. (2021). Retrospective Study: Lateral Ridge Augmentation Using Autogenous Dentin: Tooth-Shell Technique vs. Bone-Shell Technique. . Int J Environ Res Public Health, 18(6). doi:10.3390/ijerph18063174
Leonhardt, H. (1990). Histologie, Zytologie und Mikroanatomie des Menschen. Flexibles Taschenbuch Med, mit Schlüssel zum Gegenstandskatalog. Thieme, 3.
Linde, A. (1989). Dentin matrix proteins: composition and possible functions in calcification. Anat Rec, 224(2), 154-166. doi:10.1002/ar.1092240206
Mertens, C., Braun, S., Krisam, J., & Hoffmann, J. (2019). The influence of wound closure on graft stability: An in vitro comparison of different bone grafting techniques for the treatment of one-wall horizontal bone defects. Clin Implant Dent Relat Res, 21(2), 284-291. doi:10.1111/cid.12728
Minamizato, T., Koga, T., I, T., Nakatani, Y., Umebayashi, M., Sumita, Y., . . . Asahina, I. (2018). Clinical application of autogenous partially demineralized dentin matrix prepared immediately after extraction for alveolar bone regeneration in implant dentistry: a pilot study. Int J Oral Maxillofac Surg, 47(1), 125-132.
doi:10.1016/j.ijom.2017.02.1279
Murata, M., Akazawa, T., Mitsugi, M., Kabir, M. A., Um, I. W., Minamida, Y., . . . Qin, C. (2013). Autograft of Dentin Materials for Bone Regeneration. IntechOpen, 391-402. doi:10.5772/53665
Ramanauskaite, A., Sahin, D., Sader, R., Becker, J., & Schwarz, F. (2019). Efficacy of autogenous teeth for the reconstruction of alveolar ridge deficiencies: a systematic review. Clin Oral Investig, 23(12), 4263-4287. doi:10.1007/s00784-019-02869-1
Sakkas, A., Wilde, F., Heufelder, M., Winter, K., & Schramm, A. (2017). Autogenous bone grafts in oral implantology-is it still a „gold standard“? A consecutive review of 279 patients with 456 clinical procedures. Int J Implant Dent, 3(1), 23. doi:10.1186/s40729-017-0084-4
Schwarz, F., Golubovic, V., Becker, K., & Mihatovic, I. (2016). Extracted tooth roots used for lateral alveolar ridge augmentation: a proof-of-concept study. J Clin Periodontol, 43(4), 345-353. doi:10.1111/jcpe.12481
Schwarz, F., Golubovic, V., Mihatovic, I., & Becker, J. (2016). Periodontally diseased tooth roots used for lateral alveolar ridge augmentation. A proof-of-concept study. J Clin Periodontol, 43(9), 797-803.
doi:10.1111/jcpe.12579
Schwarz, F., Hazar, D., Becker, K., Sader, R., & Becker, J. (2018). Efficacy of autogenous tooth roots for lateral alveolar ridge augmentation and staged implant placement. A prospective controlled clinical study. J Clin Periodontol, 45(8), 996-1004. doi:10.1111/jcpe.12977
Schwarz, F., Mihatovic, I., Golubovic, V., & Becker, J. (2013). Dentointegration of a titanium implant: a case report. Oral Maxillofac Surg, 17(3), 235-241. doi:10.1007/s10006-012-0378-x
Schwarz, F., Sahin, D., Becker, K., Sader, R., & Becker, J. (2019). Autogenous tooth roots for lateral extraction socket augmentation and staged implant placement. A prospective observational study. Clin Oral Implants Res, 30(5), 439-446. doi:10.1111/clr.13429
Tolstunov, L., Hamrick, J. F. E., Broumand, V., Shilo, D., & Rachmiel, A. (2019). Bone Augmentation Techniques for Horizontal and Vertical Alveolar Ridge Deficiency in Oral Implantology. Oral Maxillofac Surg Clin North Am, 31(2), 163-191. doi:10.1016/j.coms.2019.01.005