Das Nierenzellkarzinom beim Hauszahnarzt
Eine 65-jährige Patientin stellte sich erstmalig mit einer seit circa zwei Monaten bestehenden Raumforderung der Unterlippe linksseitig in unserer Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Göttingen vor. Nach eigenen Angaben war sie vor einiger Zeit gestürzt, wobei es zu einer Verletzung der Unterlippe gekommen sei. Die Wunde habe sie einige Zeit mit Salben behandelt, worunter sie eine Größenprogredienz beobachtet habe. Neben einer chronisch obstruktiven Lungenerkrankung, einer Hypothyreose und einer Kontrastmittelallergie wurden in der Anamnese keine weiteren Vorerkrankungen angegeben.
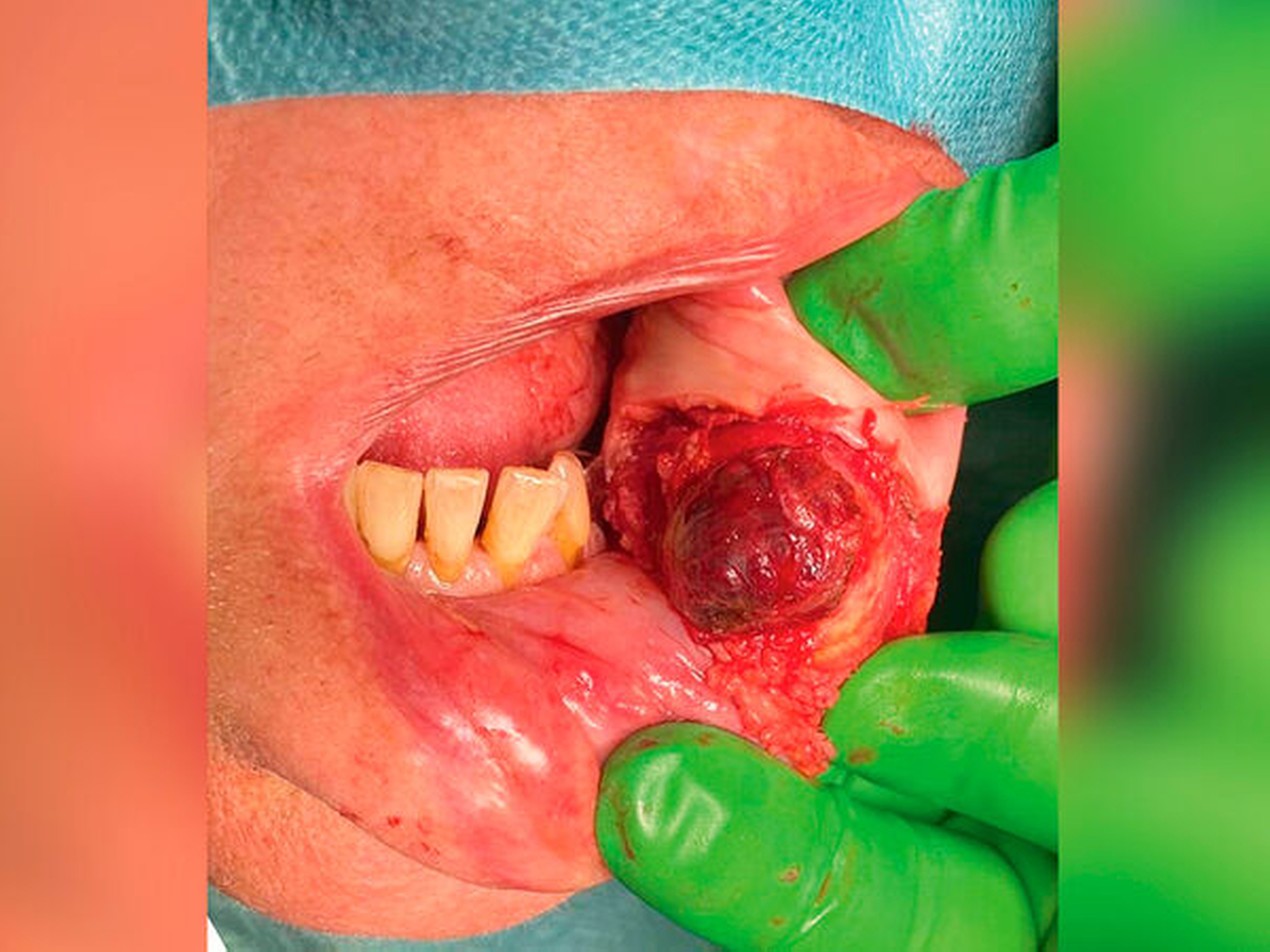
Klinisch tastete sich der Befund in der Unterlippe von intra- und extraoral bei einer Größe von circa 10 mm x 20 mm derb, wenig verschieblich gegen das umgebende Weichgewebe, indolent, nicht komprimierbar sowie ohne Anzeichen von Fluktuation oder Überwärmung. Extraoral imponierte die Raumforderung mit bläulich-lividem Hautkolorit (Abbildung 1). Die Sensomotorik war seitengleich intakt.
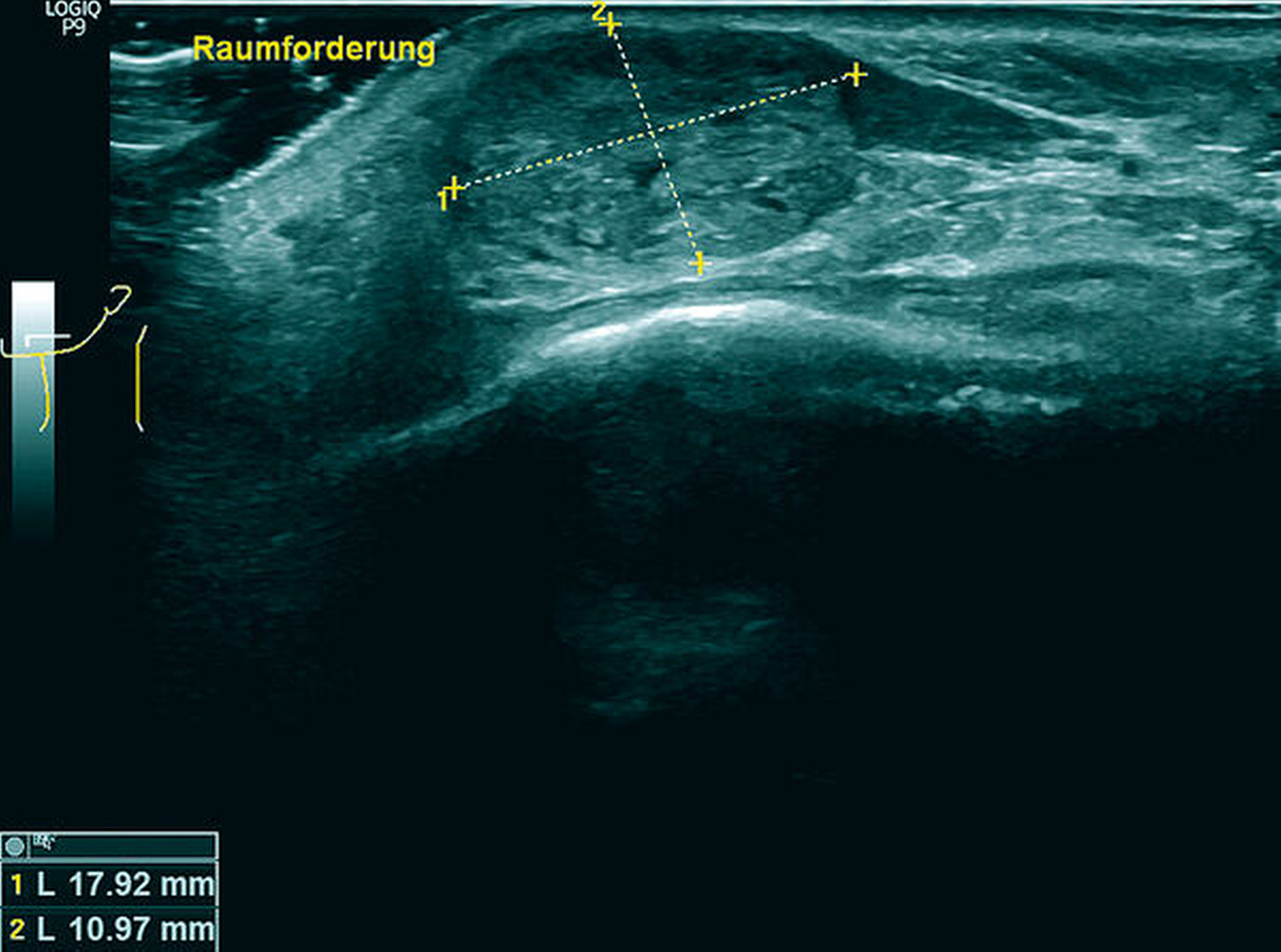
Eine am selben Tag durchgeführte sonografische Untersuchung des klinischen Befunds ergab eine ovaläre, homogen-echoreiche Schallantwort mit scharfer Begrenzung (Abbildung 2). Im zusätzlich durchgeführten Orthopantomogramm bildete sich die Raumforderung nicht ab.
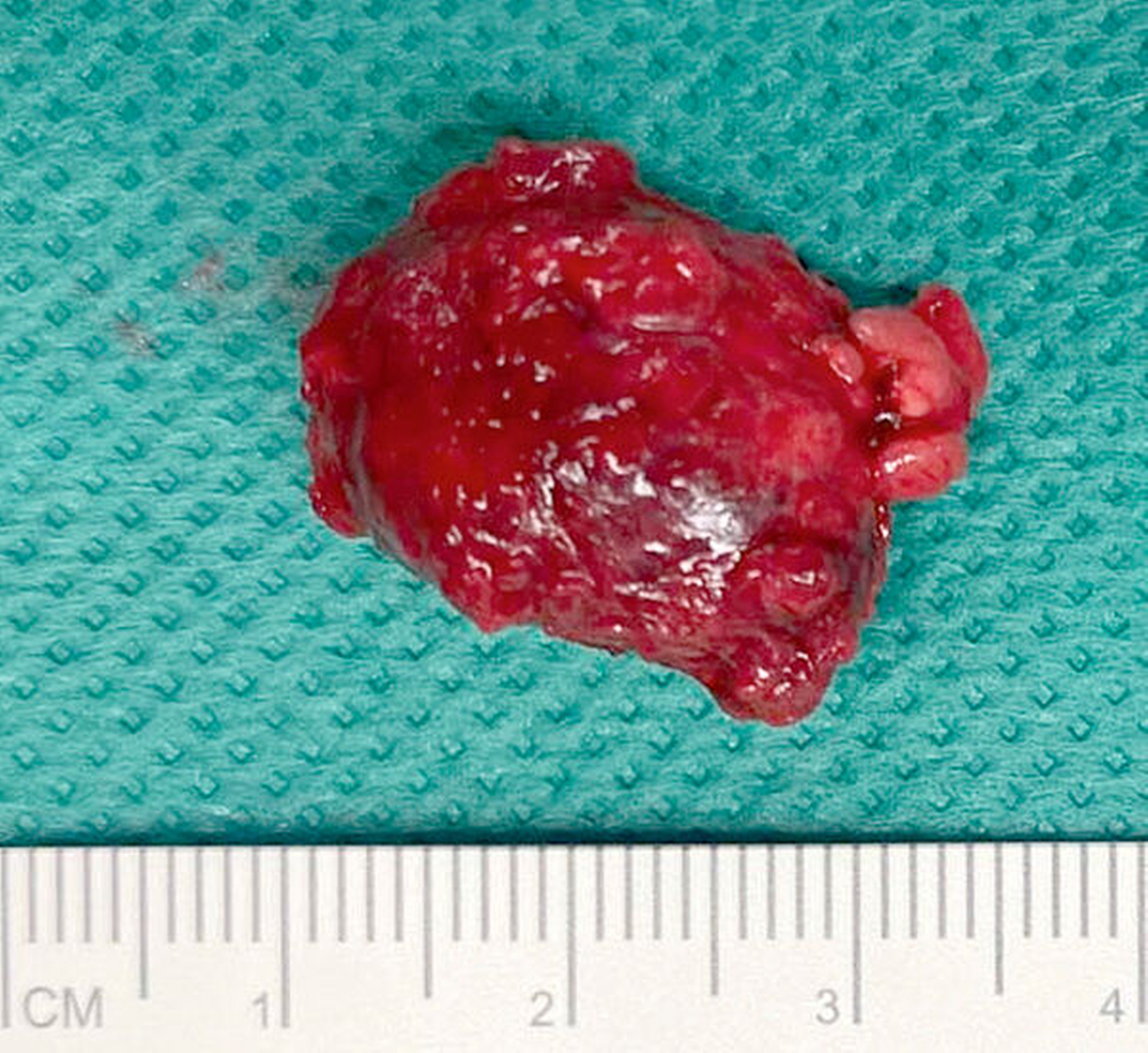
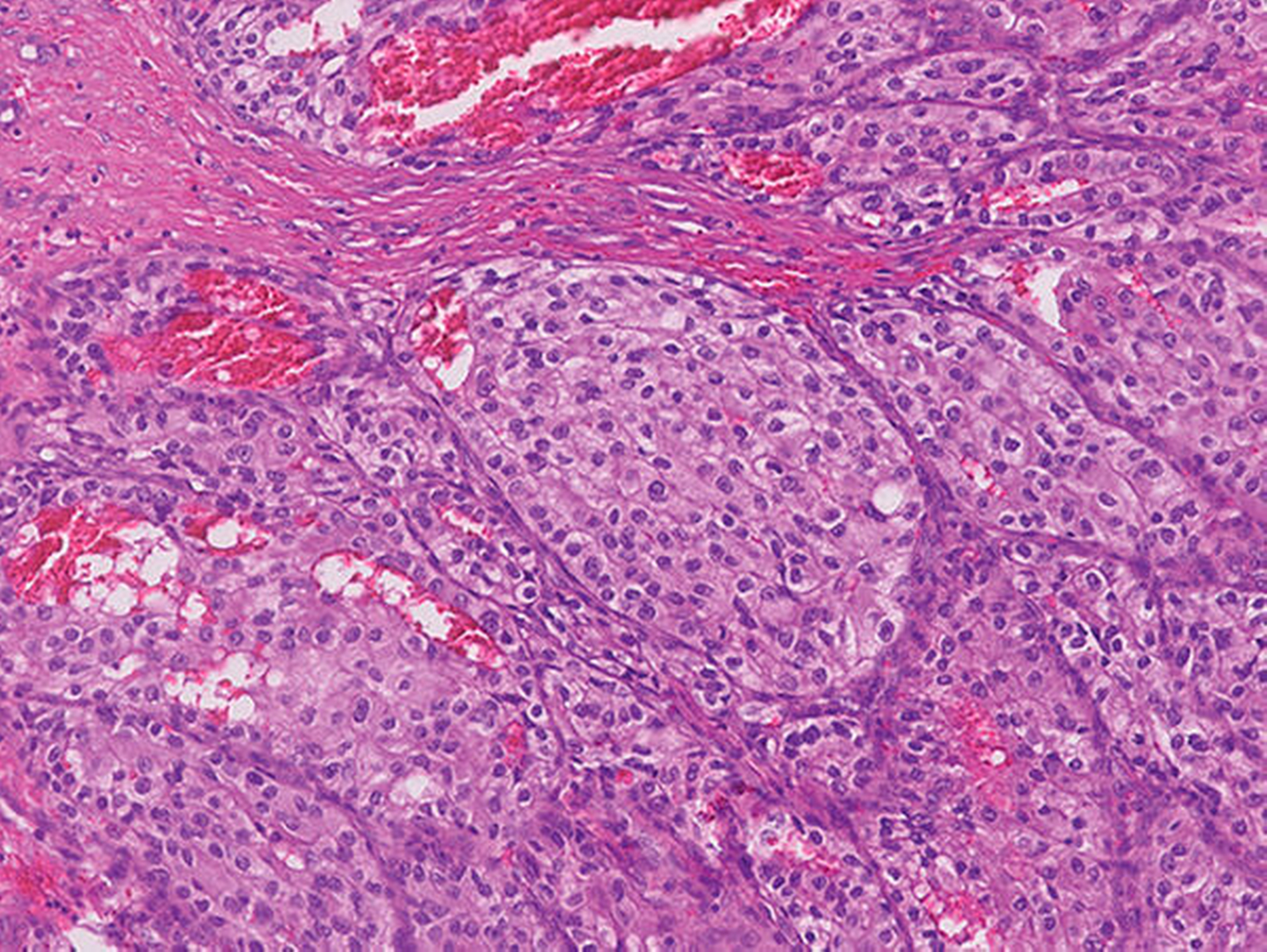
Die histopathologische Aufarbeitung nach Exzisionsbiopsie ergab den zunächst überraschenden Befund einer Spätmetastase eines klarzelligen Nierenzellkarzinoms (NKZ).
Bei der Besprechung des histopathologischen Befunds erinnerte sich die Patientin dann an eine Operation an der linken Niere im Jahr 2003, bei der ein Tumor entfernt worden sei. Bei der sich anschließenden Staging-Untersuchung mittels nativer Computertomografie des Thorax kamen multiple pulmonale Rundherde mit hilären Lymphknoten beidseits, eine vergrößerte weiter abklärungsbedürftige Glandula thyroidea und ein konfluierendes Lungenemphysem zur Darstellung. Die Untersuchung musste bei in der Vorgeschichte stattgehabtem anaphylaktischem Schock nach der Gabe von jodhaltigem Kontrastmittel nativ durchgeführt werden.
Die weitere Magnetresonanztomografie des Abdomens mit Kontrastmittel zeigte keinen Anhalt für ein Lokalrezidiv bei Zustand nach Nephrektomie linksseitig und eine rechte Niere ohne Malignomanhalt. Auch abdominopelvin gab es keinen Hinweis metastasensuspekter Läsionen. Zur Festlegung des weiteren Therapieprozederes wurde der Fall im urologischen Tumorboard – in Anwesenheit aller das jeweilige Organsystem betreffenden Fachdisziplinen – vorgestellt, wo nach Abklärung der Raumforderung in der Glandula thyroidea die klare Empfehlung zur Einleitung einer Systemtherapie nach einer Risikoklassifizierung nach Heng ausgesprochen wurde.
Die histopathologische Untersuchung der Schilddrüse nach erfolgter Thyreoidektomie ergab ebenfalls eine Metastase des klarzelligen NZK. Aktuell befindet sich die Patientin in ambulanter Systemtherapie und erhält eine Therapie mittels Pembrolizumab und Lenvatinib.
Diskussion
Das Nierenzellkarzinom (NZK) macht mit einer Prävalenz von 99.600 Erkrankten über die vergangenen zehn Jahre insgesamt drei Prozent aller Tumorerkrankungen aus [RKI, 2021]. Bei einem Häufigkeitsgipfel zwischen dem 60. und dem 70. Lebensjahr sind Männer im Verhältnis 2:1 häufiger betroffen als Frauen. Aufgrund eines lange symptomlosen Verlaufs werden Patienten erst spät beim behandelnden Urologen vorstellig. Hierbei sind atypische metachrone Metastasen, insbesondere im Mund- Kiefer- und Gesichtsbereich, eine wirkliche Seltenheit und bedürfen zur Diagnosesicherung und weiteren Behandlung zeitnah einer Überweisung an einen Facharzt.
Schwellung am Unterkiefer oder an der Unterlippe – Differenzialdiagnosen
Die für die weitere Diagnostik und Therapie entscheidende Differenzialdiagnosen einer Schwellung am Unterkiefer oder der Unterlippe können Zysten, Abszesse, Fremdkörpergranulome, spezifische Infektionen (zum Beispiel Aktinomykose, Tuberkulose, Sarkoidose, Melkersson-Rosenthal-Syndrom), eine autoimmune Entzündungsreaktion, eine Gefäßmalformation, Erkrankungen einer kleinen/großen Speicheldrüse (Lithiasis, Infektion, maligne Neoplasie), benigne/maligne Neoplasien oder die Metastase einer malignen Grunderkrankung sein.
Zunächst lag im oben beschriebenen Patientenfall mit einer Raumforderung an der Unterlippe linksseitig und dem aufgebotenen klinischen Bild sowie dem anamnestisch angegebenen Trauma (Abbildung 1) die Verdachtsdiagnose eines infizierten Hämatoms mit Abszessbildung nahe. Bei der Anamneseerhebung mit dem langwierigen Verlauf und dem angegebenen Trauma in der Vorgeschichte sollte differenzialdiagnostisch auch ein Fremdkörpergranulom oder eine spezifische Infektion in Betracht gezogen werden. Nach der weiteren sonografischen Diagnostik konnten diese in unserem Fall weder ausgeschlossen noch bewiesen werden. Der Vorteil der Sonografie lag hier in der schnellen Ausschlussmöglichkeit einer vaskularisierten Gefäßneubildung, einer Zyste oder eines Abszesses. Da sich bei fehlender dorsaler Schallverstärkung und nicht nachweisbarem Dopplerecho kein Hinweis auf einen flüssigkeitsgefüllten, epithelial ausgekleideten oder perfundierten Hohlraum zeigte (Abbildung 2), konnten diese Differenzialdiagnosen somit schnell ausgeschlossen werden. Weiter ist die Lokalisation der Unterlippe und der Wange für eine Pathologie der kleinen oder der großen Speicheldrüsen untypisch und macht auch hier die Diagnose unwahrscheinlich. Letztendlich war zur Diagnosesicherung die histografisch kontrollierte Exzisionsbiopsie indiziert, die im beschriebenen Fall eine metachrone Absiedlung eines klarzelligen NZK nachweisen konnte.
Das Nierenzellkarzinom
Epidemiologie und Ätiologie
Das klarzellige NZK ist ausgehend von den Tubulusepithelzellen der Niere mit einem Anteil von drei Prozent aller Tumore ein seltenes Adenokarzinom [RKI, 2021]. Aufgrund der langen Symptomlosigkeit sind ein Großteil sono- oder computertomografische Zufallsbefunde. Ein frühes invasives Wachstum mit Einbruch ins Nierenbecken erklärt das Leitsymptom: schmerzlose Hämaturie. Dieses gilt sehr unspezifisch für alle Neoplasien der Niere und der oberen Harnwege und kann genauso durch viele andere Pathologien wie zum Beispiel einen klassischen Harnwegsinfekt, ein Trauma, eine Antikoagulantieneinnahme, eine Nephro- oder Urolithiasis sowie Nephritiden verursacht werden. Die Metastasierung maligner Zellen erfolgt typischerweise hämatogen über Invasivität in die Vena renalis und Streuung über die Vena cava inferior mit Fernmetastasen in Lunge, Knochen, Leber und Gehirn [McKay et al., 2014]. 25 Prozent der Frauen mit einem NZK haben hämatogene Fernmetastasen zum Zeitpunkt der Diagnose [Herold, 2017].
Das NZK kann erworbener oder hereditärer Genese sein. Als Risikofaktoren für ein erworbenes NZK gelten: Adipositas, chronische Niereninsuffizienz, Rauchen, arterielle Hypertonie, berufliche Exposition: halogenierte Kohlenwasserstoffe und Röntgenstrahlung [Capitanio et al., 2019]. Die hereditäre Variante zeigt ätiologisch heterogene Mutationen im von-Hippel-Lindau-Gen [Creighton et al., 2013].
Die häufigste Lokalisation des NZK ist der obere Nierenpol, wodurch sich der alte Name „Hypernephrom“ erklären lässt.
Klinik
Allgemein sind Patienten mit NZK lange symptomarm. Auffällig wird das NZK erst spät durch eine schmerzlose Makrohämaturie, einen Flankenschmerz, einen tastbaren Oberbauchtumor oder eine neu aufgetretene Varikozele als Zeichen einer unteren Einflussstauung infolge der Komprimierung der Venae testiculares [Bergmann et al., 2022].
Eine B-Symptomatik mit Gewichtsabnahme, Nachtschweiß und Fieber unklarer Genese ist genauso unspezifisch möglich wie eine vielfältige Anzahl paraneoplastischer Syndrome. Diese treten als Polyzythämie, Neuropathie, Hyperkalzämie, unklare Leberwerterhöhungen mit Gerinnungsstörungen (Stauffer-Syndrom), Gynäkomastie, Cushing-Syndrom, Hirsutismus oder Thrombozytose in Erscheinung [Bedke et al., 2007].
Bei klinisch asymptomatischen, inzidentellen Befunden handelt es sich meist um ein frühes Tumorstadium mit vergleichsweise besserer Prognose [Carlo et al., 2019]. Ist die Symptomatik durch Metastasen verursacht, entspricht sie einer Pathie im betroffenen Organ oder Gewebe. Beispielsweise leidet der Patient an Knochenschmerzen oder pathologischen Frakturen bei Skelettbefall, Husten und Dyspnoe bei pulmonalen oder an neurologischen Ausfällen bei zerebralen oder spinalen Metastasen [Bergmann et al., 2022].
Diagnostik
NZK werden in etwa 50 Prozent der Fälle zufällig im Rahmen von sonografischen oder computertomografischen Untersuchungen [Bergmann et al., 2022] diagnostiziert. Die klinische Diagnostik beinhaltet neben der körperlichen Untersuchung mit besonderer Achtsamkeit auf eine abdominelle Raumforderung oder Varikozele die Nutzung von Urin-Stix zum Nachweis einer Hämaturie. Eine laborchemische Blutanalyse mit einer Bestimmung des Blutbilds, Nierenretentionsparametern, Leberwerten (AST, ALT) sowie der Laktatdehydrogenase (LDH) ist zum Ausschluss paraneoplastischer Syndrome und zur Prognosebestimmung angezeigt.
Als erste weiterführende Diagnostik bei neu aufgetretenen Symptomen ist die abdominelle Sonografie die Methode der ersten Wahl. Zeigen sich hier Auffälligkeiten und lässt die Nierenfunktion eine Kontrastmittelgabe zu, ist zur weiteren Diagnostik eine Computertomografie indiziert. Bei Niereninsuffizienz oder Infiltration der Vena cava inferior sollte eine Magnetresonanztomografie mit Kontrastmittel des Abdomens ergänzend durchgeführt werden [Bergmann et al., 2022].
Grundsätzlich wird nach der aktuellen Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) zur Resektionsplanung und für das präoperative Staging eine native Computertomografie von Leberkuppe bis Symphyse sowie mit früharterieller (Nieren bis Beckeneingang) und venöser Phase von Leberkuppe bis Symphyse nach einheitlichen Standards empfohlen [AWMF, 2021].
Therapie
Die kurative Therapie des NZK besteht in der Regel – wenn möglich – in der chirurgischen Entfernung des Tumors. Diese umfasst je nach Tumorstadium und Ausdehnung eine partielle oder radikale Nephrektomie mit Metastasen- und gegebenenfalls Tumorzapfenresektion in der Vena cava inferior. Die Lymphknotenresektion hat keinen prognoseverbessernden Wert [Blom et al., 2009] und wird nur bei Verdacht auf Lymphknoteninfiltration zur Sicherung des TNM-Stadiums oder bei lokaler Symptomatik empfohlen. Ist eine operative Therapie unmöglich, wird eine neoadjuvante Systemtherapie mit nachfolgender Nephrektomie und Metastasenchirurgie empfohlen [Bergmann et al., 2022].
Aufgrund der hohen Resistenz des NZK gegenüber Chemotherapeutika werden diese in der Systemtherapie nicht angewendet. Stattdessen kommen hier Biologicals wie Nivolumab, Pembrolizumab (PD-1-Rezeptor-Blocker) oder/und Lenvatinib, Sunitinib und Cabozantinib (Tyrosinkinase-Inhibitoren) zum Einsatz [AWMF, 2021].
Metastasierung
Die Filialisierung des NZK findet primär durch hämatogene Streuung über die Vena cava inferior mit typischen Manifestationen in der Lunge, in der Leber, in den Knochen und im Gehirn statt [McKay et al., 2014]. Lokoregionale Lymphknotenstationen werden über lymphogene Streuung erreicht. Grundsätzlich wird beim Auftreten von Metastasen die interdisziplinäre Vorstellung aller das Organsystem betreffenden Fachdisziplinen empfohlen [Bergmann et al., 2022].
Fazit für die Praxis
Die Differenzialdiagnosen einer Schwellung im Bereich des Unterkiefers sollten dem Behandler während der klinischen Untersuchung präsent sein.
Bis zum Beweis des Gegenteils kann jede Raumforderung als maligne Neoplasie betrachtet werden.
Das Vorliegen einer malignen Erkrankung ist auch bei völlig asymptomatischen Patienten möglich.
Manifestationen von für das zahn- und kieferchirurgische Fachgebiet untypischen Tumorerkrankungen sind selten, aber möglich.
Bei der Erkennung suspekter Raumforderungen in der zahnärztlichen Behandlung und Kontrolle empfiehlt sich eine frühzeitige fachärztliche Anbindung.
Die operative Entfernung von Metastasen wird empfohlen, insofern eine R0-Resektion möglich ist [AWMF, 2021], da hier nach der Resektion von Absiedlungen vor allem in der Lunge, in der Leber und im Gehirn lang anhaltende Remissionen beobachtet werden konnten [Blanco-Fernández et al., 2022; Internò et al., 2021; Meacci et al., 2021]. Eine Verlaufskontrolle zur Detektion von etwaigen neuen Metastasen sollte vor einer Metastasenchirurgie durchgeführt werden, um die Dynamik der Erkrankung und die Sinnhaftigkeit einer Metastasenresektion abschätzen zu können. Letztendlich ist die Entscheidung zur chirurgischen Therapie individuell zu treffen und muss Faktoren wie Komorbiditäten, Prognose und Patientenwunsch berücksichtigen. Gibt es nach initialer vollständiger Resektion des Primarius samt Metastasen keinen klinischen Tumornachweis mehr („no evidence of disease“, NED) ist eine adjuvante Therapie mit einem PD1-Rezeptorblocker, je nach Risikoklassifikation nach Heng [Heng et al., 2013], gegebenenfalls in Kombination mit einem Tyrosinkinaseinhibitor, indiziert [Bergmann et al., 2022].
Prognose
Grundsätzlich sind wie bei den meisten Tumoren die Tumorformel nach TNM-Klassifikation und das davon ausgehende UICC-Tumorstadium prognosebestimmend für das NZK. Die Fünfjahresüberlebensrate wird in den Stadien I und II mit bis zu 90 Prozent, im Stadium III ohne Befall von Lymphknoten bis 60 Prozent, mit Befall von Lymphknoten bis 30 Prozent und im Stadium IV mit Entfernung von Fernmetastasen bei circa 30 Prozent und ohne weitere Behandlung mit weniger als fünf Prozent angegeben [Herold, 2017].
Literaturliste
Amin, M. B., Greene, F. L., Edge, S. B., Compton, C. C., Gershenwald, J. E., Brookland, R. K., Meyer, L., Gress, D. M., Byrd, D. R., & Winchester, D. P. (2017). The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more „personalized“ approach to cancer staging. CA: A Cancer Journal for Clinicians, 67(2), 93–99. doi.org/10.3322/caac.21388
AWMF Leitlinie: Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Kurzversion 3.0. (2021). 74.
Bedke, J., Buse, S., Kurosch, M., Haferkamp, A., Jäger, D., & Hohenfellner, M. (2007). Paraneoplastische Syndrome des Nierenzellkarzinoms. Der Urologe, 46(1), 45–48. doi.org/10.1007/s00120-006-1269-2
Bergmann, L., Bauernhofer, T., Bokemeyer, C., Casper, J., Flörcken, A., Gauler, T., Grünwald, V., Kuczyk, M. A., Peters, I., Pritzkuleit, R., Raida, M., Schmidinger, M., Stenner-Liewen, F., & von Amsberg, G. (2022, Mai). Nierenzellkarzinom (Hypernephrom) [Connector]. Onkopedia. www.onkopedia.com/de/onkopedia/guidelines/nierenzellkarzinom-hypernephrom
Blanco-Fernández, G., Fondevila-Campo, C., Sanjuanbenito, A., Fabregat-Prous, J., Secanella-Medayo, L., Rotellar-Sastre, F., Pardo-Sánchez, F., Prieto-Calvo, M., Marín-Ortega, H., Sánchez-Cabús, S., Diez-Valladares, L., Alonso-Casado, Ó., González-Serrano, C., Rodríguez-Sanjuan, J. C., García-Plaza, G., Jaén-Torrejimeno, I., Suárez-Muñoz, M. Á., Becerra-Massare, A., Rio, P. S., … Rojas-Holguín, A. (2022). Pancreatic metastases from renal cell carcinoma. Postoperative outcome after surgical treatment in a Spanish multicenter study (PANMEKID). European Journal of Surgical Oncology, 48(1), 133–141. doi.org/10.1016/j.ejso.2021.08.011
Blom, J. H. M., van Poppel, H., Maréchal, J. M., Jacqmin, D., Schröder, F. H., de Prijck, L., & Sylvester, R. (2009). Radical Nephrectomy with and without Lymph-Node Dissection: Final Results of European Organization for Research and Treatment of Cancer (EORTC) Randomized Phase 3 Trial 30881. European Urology, 55(1), 28–34. doi.org/10.1016/j.eururo.2008.09.052
Capitanio, U., Bensalah, K., Bex, A., Boorjian, S. A., Bray, F., Coleman, J., Gore, J. L., Sun, M., Wood, C., & Russo, P. (2019). Epidemiology of Renal Cell Carcinoma. European Urology, 75(1), 74–84. doi.org/10.1016/j.eururo.2018.08.036
Carlo, M. I., Hakimi, A. A., Stewart, G. D., Bratslavsky, G., Brugarolas, J., Chen, Y.-B., Linehan, W. M., Maher, E., Merino, M. J., Offit, K., Reuter, V., Shuch, B., & Coleman, J. A. (2019). Familial Kidney Cancer: Implications of New Syndromes and Molecular Insights. European urology, 76(6), 754–764. doi.org/10.1016/j.eururo.2019.06.015
Creighton, C. J., Morgan, M., Gunaratne, P. H., Wheeler, D. A., Gibbs, R. A., Gordon Robertson, A., Chu, A., Beroukhim, R., Cibulskis, K., Signoretti, S., Vandin Hsin-Ta Wu, F., Raphael, B. J., Verhaak, R. G. W., Tamboli, P., Torres-Garcia, W., Akbani, R., Weinstein, J. N., Reuter, V., Hsieh, J. J., … University of North Carolina at Chapel Hill. (2013). Comprehensive molecular characterization of clear cell renal cell carcinoma. Nature, 499(7456), 43–49. doi.org/10.1038/nature12222
Heng, D. Y., Xie, W., Regan, M. M., Harshman, L. C., Bjarnason, G. A., Vaishampayan, U. N., Mackenzie, M., Wood, L., Donskov, F., Tan, M.-H., Rha, S.-Y., Agarwal, N., Kollmannsberger, C., Rini, B. I., & Choueiri, T. K. (2013). External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: A population-based study. The Lancet Oncology, 14(2), 141–148. doi.org/10.1016/S1470-2045(12)70559-4
Herold, G. (2017). Innere Medizin. (o. J.). www.uicc.org/tnm
Internò, V., De Santis, P., Stucci, L. S., Rudà, R., Tucci, M., Soffietti, R., & Porta, C. (2021). Prognostic Factors and Current Treatment Strategies for Renal Cell Carcinoma Metastatic to the Brain: An Overview. Cancers, 13(9), 2114. doi.org/10.3390/cancers13092114
McKay, R. R., Kroeger, N., Xie, W., Lee, J.-L., Knox, J. J., Bjarnason, G. A., MacKenzie, M. J., Wood, L., Srinivas, S., Vaishampayan, U. N., Rha, S.-Y., Pal, S. K., Donskov, F., Tantravahi, S. K., Rini, B. I., Heng, D. Y. C., & Choueiri, T. K. (2014). Impact of Bone and Liver Metastases on Patients with Renal Cell Carcinoma Treated with Targeted Therapy. European Urology, 65(3), 577–584. doi.org/10.1016/j.eururo.2013.08.012
Meacci, E., Nachira, D., Zanfrini, E., Evangelista, J., Triumbari, E. K. A., Congedo, M. T., Petracca Ciavarella, L., Chiappetta, M., Vita, M. L., Schinzari, G., Rossi, E., Tortora, G., Lucchi, M., Ambrogi, M., Calabrò, F., Petrella, F., Spaggiari, L., Mammana, M., Lloret Madrid, A., … Margaritora, S. (2021). Prognostic Factors Affecting Survival after Pulmonary Resection of Metastatic Renal Cell Carcinoma: A Multicenter Experience. Cancers, 13(13), 3258. doi.org/10.3390/cancers13133258
Moch, H., Cubilla, A. L., Humphrey, P. A., Reuter, V. E., & Ulbright, T. M. (2016). The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs—Part A: Renal, Penile, and Testicular Tumours. European Urology, 70(1), 93–105. doi.org/10.1016/j.eururo.2016.02.029
RKI - Zentrum für Krebsregisterdaten. (2021, November 29). Krebs—Nierenkrebs. www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Nierenkrebs/nierenkrebs_node.html