Vaskuläre Anomalie im Kopf-Hals-Bereich
Im August 2022 stellte sich eine 34-jährige Patientin nach Überweisung durch den Hauszahnarzt aufgrund einer intraoralen Schwellung im linken Seitenzahnbereich des Unterkiefers in der Poliklinik der Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz vor. Anamnestisch bestand die Schwellung schon seit mehreren Monaten, verhielt sich aber in den vergangenen Wochen größenprogredient. Die allgemeine Anamnese war unauffällig, es bestanden weder Schmerzen noch Schluckbeschwerden oder Atemnot. Im Rahmen der klinischen Untersuchung präsentierte sich eine circa 1,5 cm große, livide-bläulich verfärbte, diskrete, prall elastische Schwellung im linken Vestibulum Regio 36 ohne palpable Pulsation (Abbildung 1).
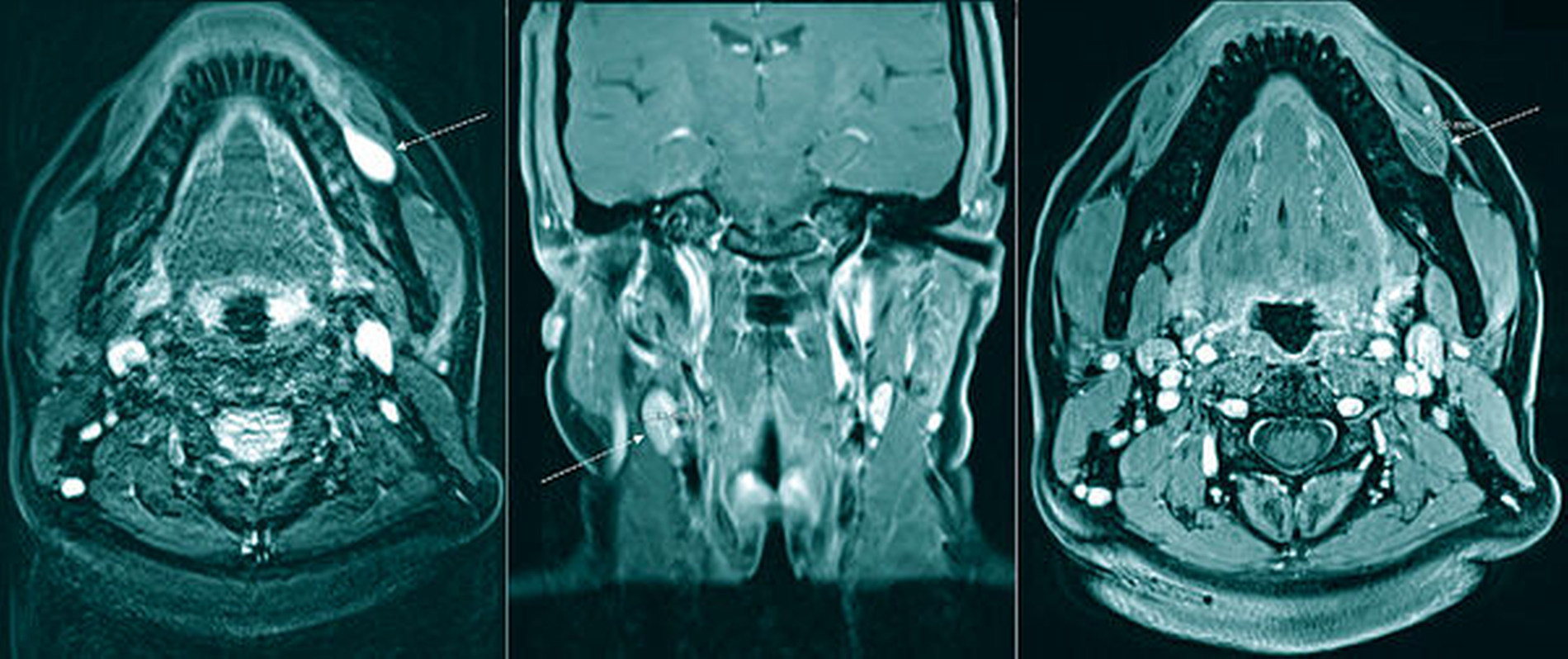
Ein mit Kontrastmittel durchgeführtes MRT ergab den bildmorphologischen Befund einer dem linken Alveolarknochen von vestibulär angelagerten, kontrastmittelanreichernden, vaskulären Anomalie (hyperintense Struktur entlang des Alveolarfortsatzes in der T1-Wichtung; Abbildung 2). Aufgrund des Patientenwunsches nach Entfernung und des zunehmenden Blutungsrisikos bei fortschreitender Größenprogredienz erfolgte die Resektion des Befunds bereits in der darauffolgenden Woche in Allgemeinanästhesie.
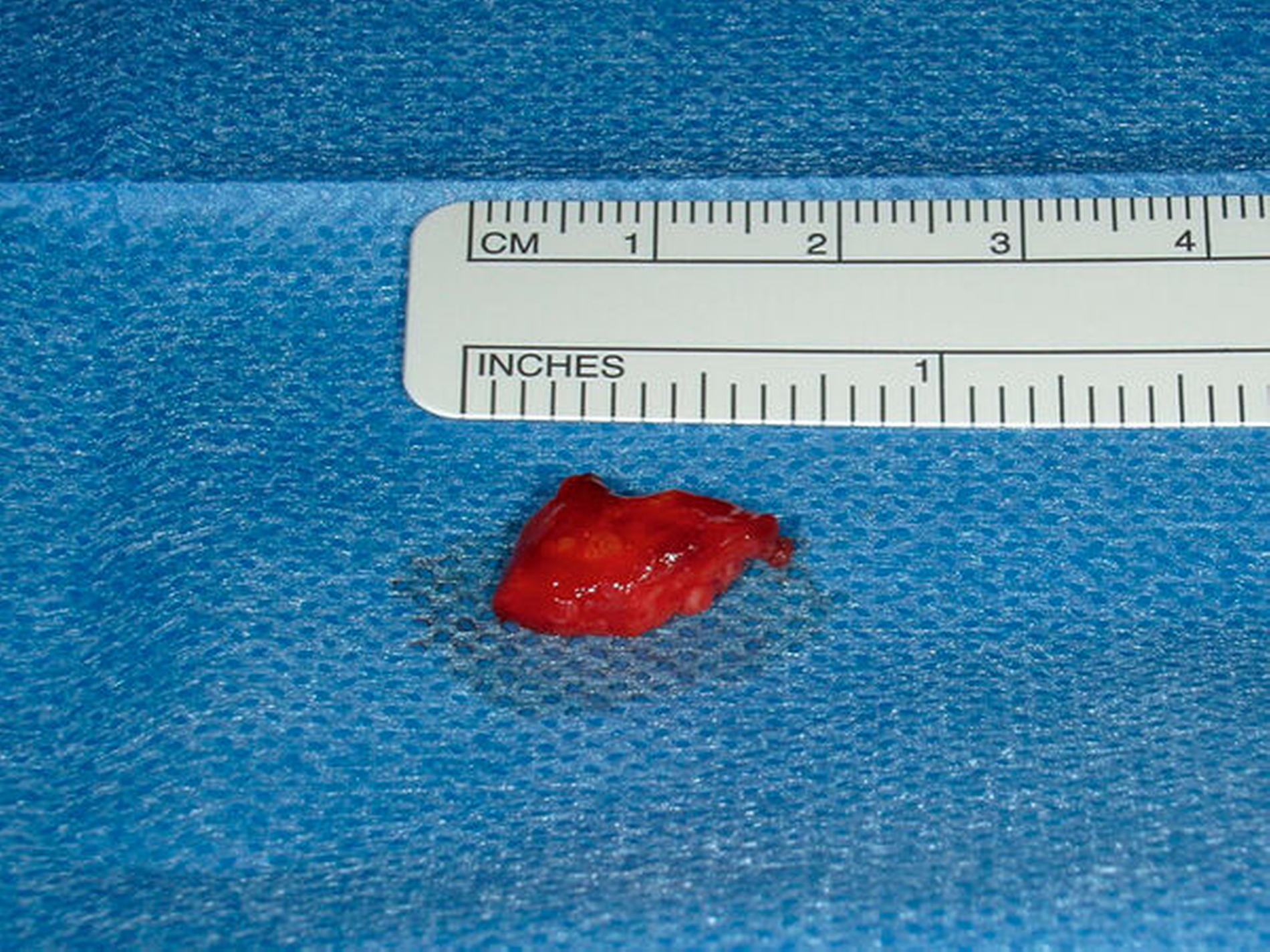
Nach marginaler Schnittführung von 34 bis 38 mit distaler Entlastung auf dem aufsteigenden Unterkieferast sowie subperiostaler Präparation (Abbildung 3a) konnte der Befund behutsam unter Schonung der Mukosa in toto ohne Sicherheitsabstand herausgelöst werden (Abbildungen 3b, 3c und 4). Ein zuführender Gefäßstiel wurde unterbunden und nach unauffälligem postoperativem Verlauf, insbesondere ohne Zeichen einer Nachblutung, konnte die Patientin noch am selben Tag in die Häuslichkeit entlassen werden. Histopathologisch zeigte sich ein weichgewebliches Exzidat mit Anteilen eines gutartigen vaskulären Tumors histologisch vereinbar mit einer fibroadipösen vaskulären Anomalie ohne Anhalt für Malignität.
Die weitere Wundheilung zeigte sich im Verlauf komplikationslos und ohne Auftreten eines Rezidivs.
Diskussion
Vaskuläre Anomalien stellen eine heterogene Gruppe von Erkrankungen dar, die zahlreiche Entitäten einschließt. Die Anzahl der zugehörigen und klassifizierten Krankheitsbilder wächst kontinuierlich, weshalb Verwechselungen und Fehldiagnosen leicht eintreten. Dennoch ist eine exakte und schnelle Diagnosestellung zum einen für die richtige Therapieauswahl ausschlaggebend, zum anderen erspart sie aber auch vermeidbare und verzögernde Arztkontakte. Seit 2018 liegt eine aktualisierte Version der 1996 vorgestellten Klassifikation der Vaskulären Anomalien der International Society for the Study of Vascular Anomalies (ISSVA) vor, die stets als Grundlage der Diagnosefindung herangezogen werden sollte [Wassef et al., 2015; Ahlawat et al., 2019].
Neue Untersuchungsmethoden, insbesondere der genetischen Grundlagen, haben sowohl das Verständnis der molekulargenetischen Pathogenese erweitert als auch zu neuen, auf den identifizierten Signalwegen basierenden, Therapieansätzen geführt [Boscolo et al., 2015; Canaud et al., 2021]. Im Allgemeinen lassen sich vaskuläre Anomalien in zwei Hauptgruppen unterteilen: die vaskulären Malformationen und die vaskulären Tumoren. Bei vaskulären Tumoren handelt es sich um echte, in der Regel benigne Neoplasien ausgehend von gesteigerter Proliferation der Endothelzellen [Dhiman et al., 2015]. Dabei zeigt sich am häufigsten eine weichgewebliche Manifestation im Kopf-Hals-Bereich (typischerweise Wange, Stirn und Augenlid), doch auch intraossäre Manifestationen wurden bereits beschrieben [Alves et al., 2006]. Den häufigsten vaskulären Tumor stellt das Hämangiom dar und obwohl dieser bereits im Säuglings- und Kleinkindalter symptomatisch wird, lässt sich ein charakteristischer Wachstumszyklus aus Proliferations-, Stagnations- und Involutionsphase abgrenzen [Ernemann et al., 2003].
Hiervon lassen sich morphologisch, molekular- und pathogenetisch die vaskulären Malformationen differenzieren, die im Gegensatz zum Hämangiom keine lokale Häufung im Kopf-Hals-Bereich aufweisen, sondern als Folge einer fehlerhaften Angiogenese während der Embryonalentwicklung bereits kongenital an unterschiedlichsten Lokalisationen im Körper auftreten können [Werner et al., 2001; Kaban und Mulliken, 1986]. Da keine neoplastische Entartung vorliegt, sind folglich der Endothelzellzyklus und die Mastzellenpopulation nicht verändert [Kaban und Mulliken, 1986]. Neuere molekulargenetische Untersuchungen konnten sporadische Mutationen im Signalweg der Rezeptor-Tyrosinkinase im Rahmen der zellulären Reaktionskaskade nach Aktivierung durch Vascular Endothelial Growth Factor (VEGF) als häufige Ursache der vaskulären Malformationen identifizieren [Kang et al., 2015; Jiang und Liu, 2009]. Die am häufigsten betroffenen Signalwege sind hierbei Ras und PIK3CA, nicht selten in Verbindung mit G-Protein-Malfunktionen [Boscolo et al., 2015; Limaye et al., 2015; Soblet et al., 2013]. Aus diesen Erkenntnissen resultieren bereits neue Therapieansätze, die sich durch Modulation des Rezeptor-Tyrosinkinase-Signalwegs, beispielsweise der mTOR-Inhibitor Sirolimus oder Anti-Angiogenese-Faktoren wie ARQ 092, als vielversprechend erwiesen haben. Insbesondere bei pädiatrischen Patienten mit syndromalen Erkrankungen finden diese Immunmodulatoren Anwendung [Canaud et al, 2021; Adams et al., 2016].
Trotz des kongenitalen Auftretens wird der größte Teil der vaskulären Malformationen erst im jungen Erwachsenenalter klinisch apparent, denn während sich Hämangiome im Rahmen der Involutionsphase zurückbilden können, weisen vaskuläre Malformationen eine Progressionstendenz proportional zum Gesamtwachstum auf [Ernemann et al., 2003]. Außerdem können Trauma, Infektionen oder endokrine Veränderungen in einer Größenprogredienz resultieren [Kaban und Mulliken, 1986].
Innerhalb der vaskulären Malformationen lassen sich nach ISSVA-Klassifikation vier Gruppen unterschieden. An erster Stelle stehen die einfachen Malformationen, zu denen kapilläre, venöse, lymphatische und arteriovenöse Malformationen sowie arteriovenöse Fisteln zählen. Im klinischen Alltag ist außerdem gerade bei den einfachen Malformationen die Einteilung hinsichtlich der sonografisch determinierten Flussstärke in High-flow- und Low-flow-Läsionen gebräuchlich. Während sich die High-flow-Läsionen klinisch häufig pulsatil und vibrierend mit fakultativen Strömungsgeräuschen präsentieren, fehlen diese Charakteristika bei Low-flow-Läsionen [Kaban und Mulliken, 1986].
Sind im Rahmen einer einzelnen Läsion mindestens zwei verschiedene Gefäßtypen beteiligt, werden diese Läsionen durch die Gruppe der kombinierten Malformationen – im Einzelnen die lymphatisch-venöse, die kapillär-venöse, die kapillär-lymphatische, die kappilär-arteriovenöse und die kapillär-lymphatisch-venöse Malformation – repräsentiert. Weiterhin ist an dritter Stelle die Gruppe der Anomalien der großen Gefäße zu nennen, innerhalb derer zwischen Art des Gefäßes, Herkunft, Anzahl, Länge und Kommunikation differenziert wird. An letzter Stelle steht die Kategorie der vaskulären Anomalien, die mit anderen Anomalien und Fehlbildungen assoziiert sind. Hierzu zählen das CLAPO-Syndrom, das CLOVES-Syndrom, das Parkes-Weber-Syndrom sowie das Megalencephaly-Polydactyly-Polymicrogyria-Hydrocephalus-Syndrom und das Macrocephaly-capillary-Malformations-Syndrom [Wassef et al., 2015].
Hinsichtlich der Diagnostik unterscheiden sich vaskuläre Tumoren nicht von vaskulären Malformationen. Nach initialer Anamnese und körperlicher Untersuchung kann bereits die (Doppler-)Sonografie ohne Strahlenbelastung Aufschlüsse über Art, Ausbreitung, Invasionstiefe und Gefäßversorgung der Läsion geben. Eine anschließende Bildgebung mittels CT oder MRT mit Kontrastmittel komplementiert die prätherapeutische Diagnostik und kann bereits zur Diagnosestellung führen [Robertson et al., 1999]. Insbesondere bei Befunden, die aufgrund ihrer Komplexität oder Lokalisation weiterer Abklärung bedürfen, kann auch eine Digitale Substraktionsangiografie durchgeführt werden.
Therapeutisch ist die Unterscheidung zwischen vaskulärem Tumor und vaskulärer Malformation als Grundlage der Therapieauswahl von großer Bedeutung. Während beispielsweise Hämangiome bei nachweisbarem Wachstum zur Begrenzung und Prävention weiterer Destruktion sofort zu therapieren sind, steht bei vaskulären Malformationen die Blutungsprophylaxe im Vordergrund, so dass auch eine konservative Therapie möglich ist. Hinsichtlich der grundsätzlichen Therapieziele bestehen jedoch keine Unterschiede zwischen den Krankheitsbildern. Neben der Blutungskontrolle, stehen die vollständige Entfernung sowie die Verhinderung von Rezidiven im Vordergrund [Dhiman et al., 2015]. Hierfür stehen unterschiedliche Methoden zur Verfügung. Neben den bereits genannten neuartigen immunmodulatorischen Wirkstoffen stehen auch die Lasertherapie oder Interventionen wie die intraläsionale Sklerosierung und Embolisation und Kürettage zur Verfügung [Behnia et al., 2014; Lemound et al., 2011]. Darüber hinaus besteht abhängig von der Lokalisation auch die Möglichkeit der chirurgischen Resektion. Letztendlich muss allerdings immer unter Berücksichtigung der Operabilität, möglicher Komorbiditäten, der Lokalisation und des Patientenwunsches eine individuelle Therapieplanung erfolgen.
Zusammenfassung
Vaskuläre Anomalien lassen sich nach der neuesten Klassifikation der International Society for the Study of Vascular Anomalies in die beiden Hauptgruppen der vaskulären Malformationen und der vaskulären Tumoren einteilen. Im Gegensatz zu vaskulären Tumoren, die echte Neoplasien darstellen (mit den Hämangiomen als häufigste Erscheinungsform), beruhen vaskuläre Malformationen auf einer fehlerhaften Angiogenese in der Embryonalentwicklung und werden trotz des kongenitalen Auftretens häufig erst durch eine Progressionstendenz in späteren Lebensphasen klinisch auffällig.
Obwohl sich die vaskulären Malformationen weiter in vier Untergruppen differenzieren lassen, besteht hinsichtlich der Diagnostik, die auf der klinischen Untersuchung, Sonografie und radiologischer Bildgebung mittels CT oder MRT beruht, kein Unterschied zwischen den vaskulären Anomalien. Die therapeutischen Grundsätze für alle vaskulären Anomalien beruhen auf Blutungskontrolle sowie der vollständigen Entfernung und Vermeidung von Rezidiven. Aufgrund der molekulargenetischen Erkenntnisse der vergangenen Jahre haben sich neue Therapieansätze wie beispielsweise die Modulation des Signalweges der Rezeptor-Tyrosinkinase etabliert und bereits vielversprechende Ergebnisse – insbesondere bei fehlender Operabilität bei pädiatrischen Patienten – geliefert. Dennoch stellt auch weiterhin die vollständige chirurgische Resektion einen entscheidenden Therapiepfeiler dar.
Fazit für die Praxis
Bei vaskulären Anomalien handelt es sich um eine heterogene Gruppe verschiedener Erkrankungen, ausgehend von den Gefäßen, wodurch insbesondere die Diagnosestellung erschwert werden kann.
Die International Society for the Study of Vascular Anomalies (ISSVA) unterscheidet vaskuläre Tumoren als echte Neoplasien – mit dem Hämangiom als häufigste Erscheinungsform – von vaskulären Malformationen, ausgehend von einer fehlerhaften Angiogenese.
Die Gruppe der vaskulären Malformationen wiederum wird in die einfachen, kombinierten Anomalien der großen Gefäße und in Malformationen in Assoziation mit weiteren Anomalien differenziert.
Diagnostisch folgen auf die Anamnese und die klinische Untersuchung immer die (Doppler-)sonografische Darstellung sowie MRT- oder CT-Untersuchungen. Dennoch lässt sich die abschließende Diagnose häufig erst durch die histopathologische Begutachtung des Befunds stellen.
Neben neuen vielversprechenden Therapieansätzen wie Sirolimus und ARQ 092, die aus den Erkenntnissen molekulargenetischer Untersuchungen hervorgegangen sind, stellt die vollständige chirurgische Exzision (bei vorhandener Operabilität) nach wie vor eine der wichtigsten Therapiemöglichkeiten dar.
Literaturliste
1. Wassef, M., et al., Vascular Anomalies Classification: Recommendations From the International Society for the Study of Vascular Anomalies. Pediatrics, 2015. 136(1): p. e203-14.
2. Ahlawat, S., et al., International Society for the Study of Vascular Anomalies Classification of Soft Tissue Vascular Anomalies: Survey-Based Assessment of Musculoskeletal Radiologists' Use in Clinical Practice. Curr Probl Diagn Radiol, 2019. 48(1): p. 10-16.
3. Boscolo, E., et al., AKT hyper-phosphorylation associated with PI3K mutations in lymphatic endothelial cells from a patient with lymphatic malformation. Angiogenesis, 2015. 18(2): p. 151-62.
4. Canaud, G., et al., A review of mechanisms of disease across PIK3CA-related disorders with vascular manifestations. Orphanet J Rare Dis, 2021. 16(1): p. 306.
5. Dhiman, N.K., et al., Central cavernous hemangioma of mandible: Case report and review of literature. Natl J Maxillofac Surg, 2015. 6(2): p. 209-13.
6. Alves, S., et al., Condylar hemangioma: report of a case and review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, 2006. 102(5): p. e23-7.
7. Ernemann, U., et al., [Hemangiomas and vascular malformations in the area of the head and neck]. Radiologe, 2003. 43(11): p. 958-66.
8. Werner, J.A., et al., Current concepts in the classification, diagnosis and treatment of hemangiomas and vascular malformations of the head and neck. Eur Arch Otorhinolaryngol, 2001. 258(3): p. 141-9.
9. Kaban, L.B. and J.B. Mulliken, Vascular anomalies of the maxillofacial region. J Oral Maxillofac Surg, 1986. 44(3): p. 203-13.
10. Kang, H.C., et al., Clinical and Genetic Aspects of the Segmental Overgrowth Spectrum Due to Somatic Mutations in PIK3CA. J Pediatr, 2015. 167(5): p. 957-62.
11. Jiang, B.H. and L.Z. Liu, PI3K/PTEN signaling in angiogenesis and tumorigenesis. Adv Cancer Res, 2009. 102: p. 19-65.
12. Limaye, N., et al., Somatic Activating PIK3CA Mutations Cause Venous Malformation. Am J Hum Genet, 2015. 97(6): p. 914-21.
13. Soblet, J., et al., Variable Somatic TIE2 Mutations in Half of Sporadic Venous Malformations. Mol Syndromol, 2013. 4(4): p. 179-83.
14. Adams, D.M., et al., Efficacy and Safety of Sirolimus in the Treatment of Complicated Vascular Anomalies. Pediatrics, 2016. 137(2): p. e20153257.
15. Robertson, R.L., et al., Head and neck vascular anomalies of childhood. Neuroimaging Clin N Am, 1999. 9(1): p. 115-32.
16. Behnia, H., et al., Comprehensive treatment and rehabilitation of a patient with maxillary arteriovenous malformation. J Craniofac Surg, 2014. 25(5): p. e463-7.
17. Lemound, J., et al., Treatment of mandibular high-flow vascular malformations: report of 2 cases. J Oral Maxillofac Surg, 2011. 69(7): p. 1956-66.