UAW-Meldungen zu Clindamycin wieder zunehmend
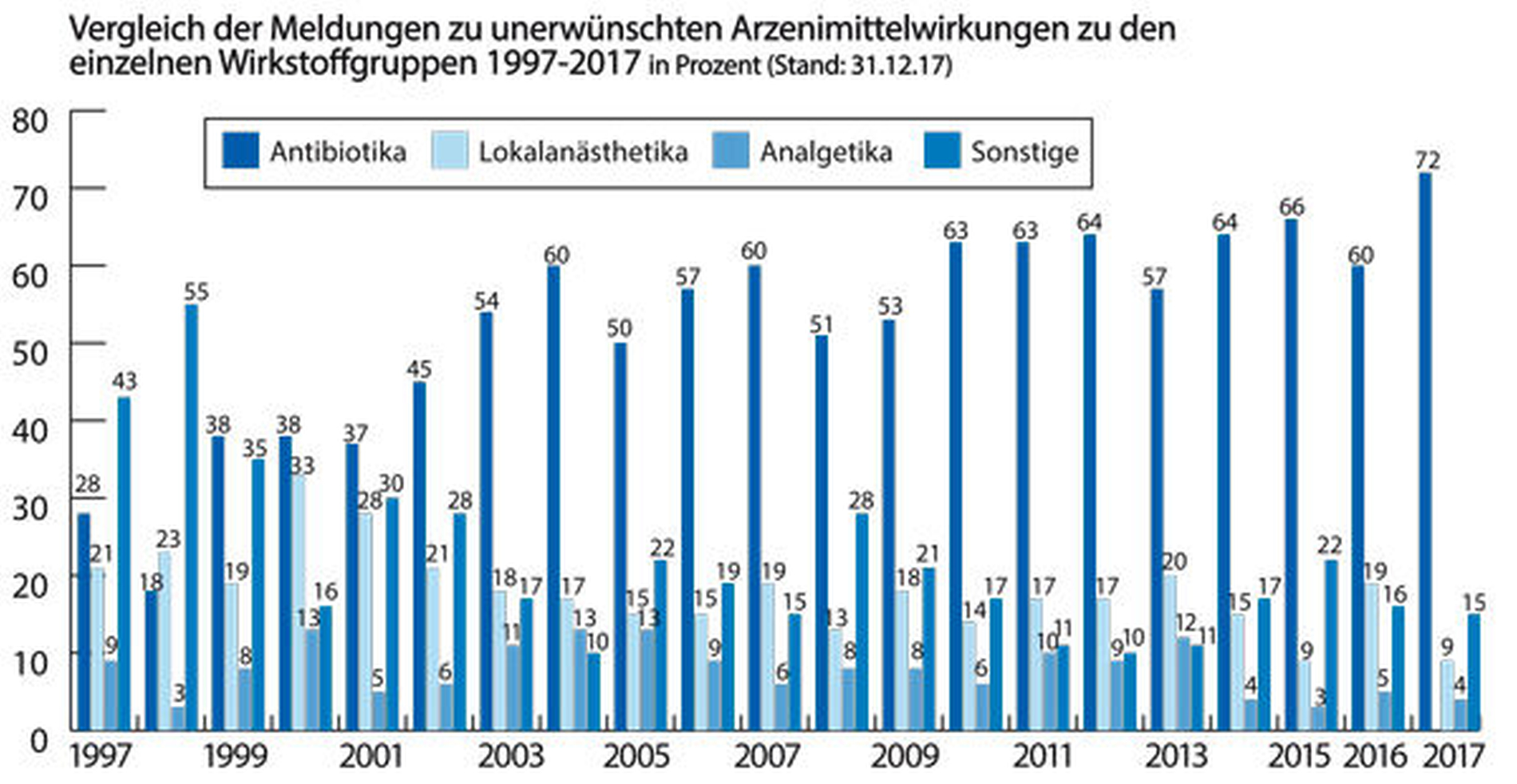
Der 2016 beobachtete rückläufige Anteil an UAW-Meldungen zu Clindamycin innerhalb der Wirkstoffgruppe der Antibiotika (2016: n = 19, das entsprach 28 Prozent der Meldungen zu Antibiotika; 2015: n = 31, 59 Prozent) setzte sich nicht fort: Im Jahr 2017 wurden wieder insgesamt 25 Meldungen (40 Prozent der UAW-Meldungen zu Antibiotika) zu Clindamycin registriert, wohingegen für das Betalactam-Antibiotikum Amoxicillin 24 Meldungen (zwei Meldungen hiervon in Kombination mit Clavulansäure, insgesamt 39 Prozent aller UAW-Meldungen zu Antibiotika) zu verzeichnen waren (2016: n = 41, 60 Prozent; 2015: n = 15, 28 Prozent). Weiterhin waren 2017 wie im Vorjahr vier UAW-Meldungen (6 Prozent) zu Metronidazol zu verzeichnen (2015: n = 3, 15 Prozent), zu weiteren Antibiotika wurden lediglich eine (Azithromycin, Ciprofloxacin, Cotrimoxazol) oder zwei Meldungen (Doxycyclin, Penicillin, Sultamicillin) registriert.
Eine detaillierte Betrachtung der UAW im Zusammenhang mit Antibiotika zeigt, vergleichbar den Vorjahren, ein Überwiegen an allergischen Hautreaktionen (Amoxicillin – teilweise in Kombination mit Clavulansäure – n = 19, Clindamycin n = 16, sonstige n = 5; typische Symptome: Juckreiz, Kribbeln, Exanthem in verschiedenen Varianten, Urtikaria, Ödem) sowie gastrointestinale Beschwerden (Amoxicillin – teilweise in Kombination mit Clavulansäure – n = 6, Clindamycin n = 10, sonstige n = 5; typische Symptome: Übelkeit, Erbrechen, Diarrhoe, Obstipation, abdominelle Schmerzen und Krämpfe, Brennen Zunge/Rachenraum). Hervorzuheben ist die Meldung einer pseudomembranösen Colitis unter Clindamycin, die dem zu erwartenden Risikoprofil des Medikaments entspricht und ein lebensbedrohliches Ausmaß annehmen kann.
Die meisten Antibiotika können zudem die Funktionalität des zentralen und des peripheren Nervensystems einschränken [Stahlmann & Schindler, 2016]. Im Jahr 2017 wurden zehn Antibiotika-assoziierte zentralnervöse Nebenwirkungen wie Kopfschmerzen, Schwindel, Schwäche oder Abgeschlagenheit, Angst und Schlafstörungen sowie in einem Fall eine nicht näher spezifizierte Parästhesie nach Gabe von Clindamycin registriert.
Hervorzuheben sind zudem die potenziell vital bedrohlichen UAW „Herzrasen“ (1x unter Azithromycin mit Schweißausbrüchen und Schmerzen im linken Arm; 1x unter Cotrimoxazol mit Anstieg des Blutdrucks und Extrasystolen), „anaphylaktischer Schock mit Atemnot“ (1x unter Clindamycin), „Aussetzen der Herzaktivität“ (1x unter Clindamycin) sowie Dyspnoe (1x unter Penicillin). Unabhängig von der Genese zeigen diese UAW, dass eine strukturierte Auseinandersetzung mit den grundlegenden Inhalten der aktuellen Reanimationsleitlinien [Deutscher Rat für Wiederbelebung – German Resuscitation Council e. V., 2015], das Vorhalten einer Basis-Notfallausrüstung sowie regelmäßige Notfall- und Reanimationstrainings innerhalb des Teams auch in der zahnärztlichen Patientenversorgung unverzichtbar sind.
Einsatz von Antibiotika in der zahnärztlichen Praxis
Im Jahr 2017 stiegen mit 25 Meldungen zu Clindamycin (40 Prozent der Antibiotikagruppe) sowohl die Gesamtzahl als auch der prozentuale Anteil im Vergleich zum Vorjahr (n = 19, 28 Prozent) wieder an. Betrachtet man die zahnärztlichen Verordnungsdaten zeigte sich 2017 mit 9,9 Millionen verordneten definierten Tagesdosen (DDD) an Clindamycin (31 Prozent aller verordneten DDD an Antibiotika und Antiinfektiva, zweithäufigstes verordnetes Antibiotikum nach Aminopenicillinen mit 13,4 Millionen DDD) zwar weiterhin eine Reduktion der Verschreibungshäufigkeit um 3 Prozent im Verhältnis zu 2016, jedoch wurden erneut fast 60 Prozent aller Clindamycin-Therapien durch Zahnärzte verordnet [Halling, 2018]. Dies steht weiterhin im Widerspruch zur objektivierbar untergeordneten therapeutischen Relevanz von Clindamycin für den zahnärztlichen Bereich [Schindler & Stahlmann, 2014].
Betalactam-Antibiotika sind Mittel der ersten Wahl
Laut den gültigen Empfehlungen sind Betalactam-Antibiotika aufgrund der guten Wirksamkeit im grampositiven Bereich, des schnellen Wirkungseintritts und der breiten Dosierungsreserve im zahnmedizinischen Bereich weiterhin als Mittel der ersten Wahl anzusehen. Im Fall einer erhöhten Resistenzlage sollte auf ein Kombinationspräparat mit einem Betalactamase-Inhibitor wie zum Beispiel Amoxicillin/Clavulansäure zurückgegriffen werden [Deutscher Arbeitskreis für Zahnheilkunde, 2018]. Die UAW-Meldungen des Jahres 2017 zeigen jedoch, dass auch im Fall der Therapie mit Amoxicillin (+ Clavulansäure) mit klinisch relevanten Nebenwirkungen gerechnet werden muss. Hier sind insbesondere allergische Unverträglichkeitsreaktionen aller Schweregrade (in den meisten Fällen Hautreaktionen) und gastrointestinale Symptome (Übelkeit, Erbrechen, Diarrhoe, Obstipation) zu erwarten. Zudem sollte bei der Gabe eines Kombinationspräparats bedacht werden, dass insbesondere Clavulansäure lebertoxisch wirken kann. Die Antibiotika Amoxicillin/Clavulansäure, Trimethoprim-Sulfamethoxazol und auch Makrolide wie zum Beispiel Azithromycin zählen zu den häufigsten Auslösern einer Arzneimittel-induzierten Leberschädigung (DILI = drug induced liver injury) [Stine, 2015], die klinisch oft zunächst völlig asymptomatisch bleibt. Später imponieren dann sublatent Übelkeit, Diarrhoen, Müdigkeit, Appetitverlust, Erbrechen, Gewichtsverlust und leichter Ikterus. Besonders gefürchtet ist die Chronifizierung einer akut Arzneimittel-induzierten Leberschädigung, die mit 18 Prozent häufiger vorkommt als bisher angenommen [Stine, 2015]. Entscheidend ist, beim Auftreten entsprechender Symptome diagnostisch an einen möglichen Kausalzusammenhang dieser Symptomatik mit Arzneimitteln und insbesondere Antibiotika oder auch Analgetika zu denken. Auch wenn eine Antibiotika-Therapie schon länger zurückliegt, sollten die Leberenzyme dann kontrolliert werden. Während leichte Erhöhungen der Aminotransferasen unbedenkliche hepatische Anpassungsreaktionen auf ein Medikament widerspiegeln können, ist folgendes Enzymmuster gemäß einer Expertenkommission alarmierend und sollte unverzüglich zu einer weiteren hepatologischen Abklärung führen: (a) ALT-Wert größer/gleich 5× des oberen Referenzbereichs, (b) ALP-Wert größer/gleich 2× oder (c) ALT-Wert größer/gleich 3× und Gesamt-Bilirubin größer/gleich 2× des oberen Referenzbereichs [Aithal, 2011].
Clindamycin ist Mittel der zweiten Wahl
Clindamycin stellt insbesondere angesichts des Risikos relevanter gastrointestinaler Nebenwirkungen hingegen nur das Mittel der zweiten Wahl dar, zum Beispiel im Fall einer Penicillin-Allergie. Eine weitere, aus pharmakologischer Perspektive günstige therapeutische Option stellt die Kombination Ampicillin/Sulbactam dar (Präparat für die orale Therapie: Sultamicillin), für die zwar eine explizite Zulassung im zahnärztlichen Bereich fehlt, die jedoch bereits bei geringen Konzentrationen anaerobe Bakterien (Bacteriodes-Arten, Clostridien, Peptokokken) hemmt und zudem eine gute Knochengängigkeit bietet [Schindler & Stahlmann, 2014].
Analgetika
Der Anteil an UAW-Meldungen zu Analgetika belief sich im Jahr 2017 auf 4 Prozent (Abbildung 2), dies entsprach in etwa dem Verhältnis der vergangenen Jahre (2016: 5 Prozent). Mit 22,2 Millionen verordneten DDD stellte Ibuprofen 2017 erneut das mit Abstand am häufigsten zahnärztlich eingesetzte Analgetikum dar; vergleichsweise wurde jedoch nur eine UAW-Meldung in Form einer Hautrötung mit Juckreiz im Bereich der Kniekehlen bis zur Leiste registriert. Zu Metamizol mit 1,0 Millionen verordneten DDD wurde ebenfalls nur einmalig ein Exanthem am ganzen Körper gemeldet. Im Kontext einer Therapie mit Tramadol wurden einmalig zwei zusammenhängende UAW aufgenommen (Übelkeit und „stundenlanges Erbrechen“, „Kreislaufkollaps“). Während die Meldungen zu Nicht-Opioid-Analgetika (Ibuprofen, Metamizol) gemäß der Einteilung nach der „Leitlinie Allergologische Diagnostik von Überempfindlichkeitsreaktionen auf Arzneimittel“ [Brockow & et al., 2015] eher als individuelle Überempfindlichkeitsreaktionen (Typ B) im Sinne einer Allergie imponieren, lassen sich Übelkeit und protrahiertes Erbrechen mit nachfolgendem Kollaps unter Tramadol mit einer pharmakologisch-toxischen Reaktion (Typ A) durch eine vermutlich individuell pharmakogenetisch bedingte zu hohe Dosierung erklären. Tramadol wird durch das Leberenzym CYP2D6 zu seinem aktiv wirksamen Metaboliten O-Desmethyltramadol metabolisiert. Nur dieser ist pharmakologisch aktiv. Wenn ein Patient einen Mangel an diesem Enzym aufweist beziehungsweise dieses Enzym beim Patienten vollständig fehlt, lässt sich unter Umständen keine ausreichende schmerzlindernde Wirkung erzielen. Laut Schätzungen weisen bis zu 7 Prozent der kaukasischen Population diesen Mangel auf. Wenn der Patient jedoch ein ultraschneller CYP2D6-Metabolisierer ist, dann besteht selbst bei üblicher Dosierung von Tramadol das Risiko für die Entwicklung von Nebenwirkungen einer Opioid-Toxizität. Im gemeldeten Fall ist davon auszugehen, dass der betroffene Patient ein ultraschneller CYP2D6-Metabolisierer ist. Somit wird aus Tramadol pro Zeiteinheit so viel O-Desmethyltramadol gebildet, dass toxische Konzentrationen erreicht werden.
Zusammengefasst ergibt sich für die systemisch-analgetische Therapie im Kontext zahnärztlicher Behandlungen ein überschaubares Risikoprofil. Dennoch sollte vor einer Therapie mit nichtsteroidalen Antirheumatika (etwa Ibuprofen, Diclofenac, Acetylsalicylsäure) auch immer eine strukturierte Medikamentenanamnese erfolgen, da beispielsweise bei gleichzeitiger Einnahme systemischer Antikoagulantien ein relevant erhöhtes gastrointestinales Blutungsrisiko resultiert, das eine zusätzliche Begleittherapie mit Protonenpumpen-Inhibitoren erforderlich macht [Schindler, 2018].
Lokalanästhetika
Während für Lokalanästhetika im Jahr 2016 ein vorübergehender Anstieg des Anteils an allen gemeldeten UAW auf 19 Prozent zu verzeichnen war (2015: 9 Prozent), zeigte sich für das Jahr 2017 wieder ein Rückgang auf 9 Prozent (Abbildung 2). Vergleichbar zu den letztjährigen Ergebnissen wurden führend Meldungen zu Articain (n = 7; in sechs der sieben Fälle in Kombination mit Epinephrin) registriert, was sich durch dessen hochfrequente Verwendung im zahnmedizinischen Bereich erklären lässt (im Jahr 2013 zum Beispiel in 97 Prozent aller zahnärztlichen Lokalanästhesien [Halling, 2018]). Das 2017 registrierte UAW-Spektrum umfasste primär Meldungen, die am ehesten auf allergische Unverträglichkeitsreaktionen hindeuten (Schwellung/Ödem, Rötung, Juckreiz; in den Bereichen Gesicht, Leiste und Hände; bis hin zu Atemnot und Kreislaufreaktionen). Weitere registrierte Symptome wie Schwindel und Übelkeit sind schwerer einzuordnen, da sie auch eine beginnende Exzitation im Sinne eines zentralnervös toxischen Effekts wiederspiegeln können. Letzterer steht häufig im Zusammenhang mit einer unbemerkten akzidentiellen intravasalen Applikation beziehungsweise mit einer unerwartet erhöhten Resorptionsgeschwindigkeit trotz korrekter Applikation und kann sich in maximaler Ausprägung in Form von Krampfanfällen oder einer Kreislaufdepression äußern [Zink & Graf, 2003]. Zudem ist die Möglichkeit einer unerwünschten systemischen Epinephrin-Wirkung im Sinne einer hypertensiven Krise aus den gleichen Gründen zu beachten, die sich beispielsweise in pectanginösen Beschwerden oder Kopfschmerzen äußern kann – auch wenn 2017 im Gegensatz zum Vorjahr keine derartigen Meldungen zu verzeichnen waren. Insbesondere unter Therapie mit nichtselektiven Betablockern, trizyklischen Antidepressiva und MAO-Hemmern ist in diesem Kontext mit überschießenden oder aberranten Effekten zu rechnen [Schindler, 2018].
Die Übersicht zeigt, dass der Einsatz lokaler Anästhetika im Wesentlichen sicher ist, jedoch wie bei den Antibiotika stets mit potenziell bedrohlichen Nebenwirkungen gerechnet werden muss. Die bestmögliche Prävention bietet weiterhin das methodisch korrekte Vorgehen bei der Applikation: initiale Aspiration in zwei Ebenen zum Ausschluss der intravasalen Lage, langsame Testinjektion von 0,1 bis 0,2 ml, nachfolgende behutsame Applikation der restlichen Lösung nach frühestens 20 bis 30 Sekunden mit adjustiertem Injektionsdruck.
Sonstige Medikamente
Der Anteil der Meldungen in der Gruppe „Sonstige Medikamente“ lag im Jahr 2017 mit 15 Prozent in vergleichbarer Größenordnung zum Vorjahr (16 Prozent, Abbildung 2). Die inhomogene Konstellation dieser Gruppe erklärt sich durch die Zusammenfassung auch solcher Präparate, die ursprünglich von einem Haus- oder Facharzt verschrieben wurden, die aber im Zusammenhang mit einer durch einen Zahnarzt gemeldeten UAW standen. Wie im Vorjahr wurden zwei Meldungen typischer Gingivahyperplasien unter Amlodipin-Therapie registriert. Auf histologischer Ebene wird eine gesteigerte Kollagensynthese auf Basis einer gingivalen Fibroblastenzunahme vermutet, die Symptomatik wird insbesondere im Kontext bakterieller Zahnfleischentzündungen beobachtet [Mishra et al., 2012]. Es wurden drei UAW allergischen Charakters im Kontext einer Chlorhexidin-Gabe gemeldet. Das anaphylaktische Potenzial des Wirkstoffs Chlorhexidingluconat ist inzwischen bereits bekannt und wurde vonseiten des BfArM bereits im September 2013 auf der Basis von 147 Berichten aus Deutschland mit einer entsprechenden Warnung bedacht [Bundesinstitut für Arzneimittel und Medizinprodukte, 2013]. Entsprechende Meldungen sind auch vonseiten der US-amerikanischen Food and Drug Administration zu verzeichnen. Grundsätzlich ist vor jeder Anwendung von Chlorhexidin eine Anamnese hinsichtlich bisheriger Verträglichkeit zu erheben, als Alternative steht zum Beispiel Octenidin als Antiseptikum zur Verfügung.
Im Jahr 2017 waren zwei Meldungen zu verstärkten behandlungsassoziierten Blutungen unter dem neuen oralen Antikoagulans (NOAK) Rivaroxaban zu verzeichnen, das gemeinsam mit Apixaban und Edoxaban zu der Gruppe der Faktor-Xa-Antagonisten gehört. Ein weiteres NOAK stellt der Thrombin-Inhibitor Dabigatran dar. Diese Substanzen bieten im Vergleich zu Vitamin-K-Agonisten zwar ein geringeres Risiko hinsichtlich schwerer Blutungsereignisse bei vergleichbarer Effektivität [Rank et al., 2017], sind in ihrer Wirksamkeit jedoch nicht sicher durch konventionelle Laborparameter zu erfassen. Daher nehmen eine strukturierte Gerinnungsanamnese sowie eine realistische Einschätzung des Eingriffsumfangs bei NOAKs einen hohen Stellenwert ein; bei Dabigatran ist zudem die verlängerte Wirkdauer im Fall einer Niereninsuffizienz zu beachten. Die unter Federführung der DGZMK sowie der DGMKG im August 2017 publizierte AWMF-S3-Leitlinie „Zahnärztliche Chirurgie unter oraler Antikoagulation/Thrombozytenaggregationshemmung“ bietet in diesem Kontext detaillierte Empfehlungen zu typischen klinischen Konstellationen. Grundsätzlich ist immer die Möglichkeit der Eingriffsdurchführung in einer Fachklinik mit Zugriff auf Gerinnungsprodukte sowie die verfügbaren Antidote in Betracht zu ziehen [Kämmerer et al., 2017].
Hinsichtlich der rekurrent in niedriger Anzahl registrierten UAW im Zusammenhang mit antiresorptiven Substanzen wurde 2017 eine Periimplantitis im Zusammenhang mit Alendronat verzeichnet. Grundsätzlich ist bei Patienten unter Tumor-assoziierter Bisphosphonatmedikation das Risiko der Nekrotisierung des Kieferknochens zu beachten. Daher sollte vor Therapiebeginn eine Sanierung des Kieferbereichs durchgeführt werden. Im Fall eines notwendigen invasiven zahnmedizinischen Eingriffs während einer laufenden Bisphosphonat-Therapie sollte die Medikation pausiert werden [Felsenberg et al., 2006].
Ebenfalls im Rahmen der Gruppe „Sonstige Medikamente“ wurden zwei Meldungen zu Fluoriden beziehungsweise Natriumfluoriden registriert, die mit den Symptomen „metallischer Geschmack“, „starker Speichelfluss“ sowie „Ausschlag“ mit „Schwellung“ dem typischen Nebenwirkungsprofil entsprachen. Insbesondere hinsichtlich der beispielsweise in elmex® gelee enthaltenen Beistoffe Pfefferminz-Aroma und Krauseminzöl muss bei entsprechender Sensibilisierung zudem mit Überempfindlichkeitsreaktionen bis hin zu Atemnot gerechnet werden.
Im Zusammenhang mit dem ACE-Hemmer Perindopril wurde ein Fall einer Gesichtsschwellung im Sinne eines Quincke-Ödems aufgenommen. Diese UAW entspricht dem bekannten Profil der Wirkstoffgruppe und kann in Verbindung mit einem Kehlkopfödem lebensbedrohlich sein. Im Fall eines Auftretens ist das Medikament unverzüglich abzusetzen, der Patient sollte zudem überwacht werden, bis die Symptome abgeklungen sind. Antihistaminika können eine Linderung verschaffen.
Organbezogenheit der Nebenwirkungen
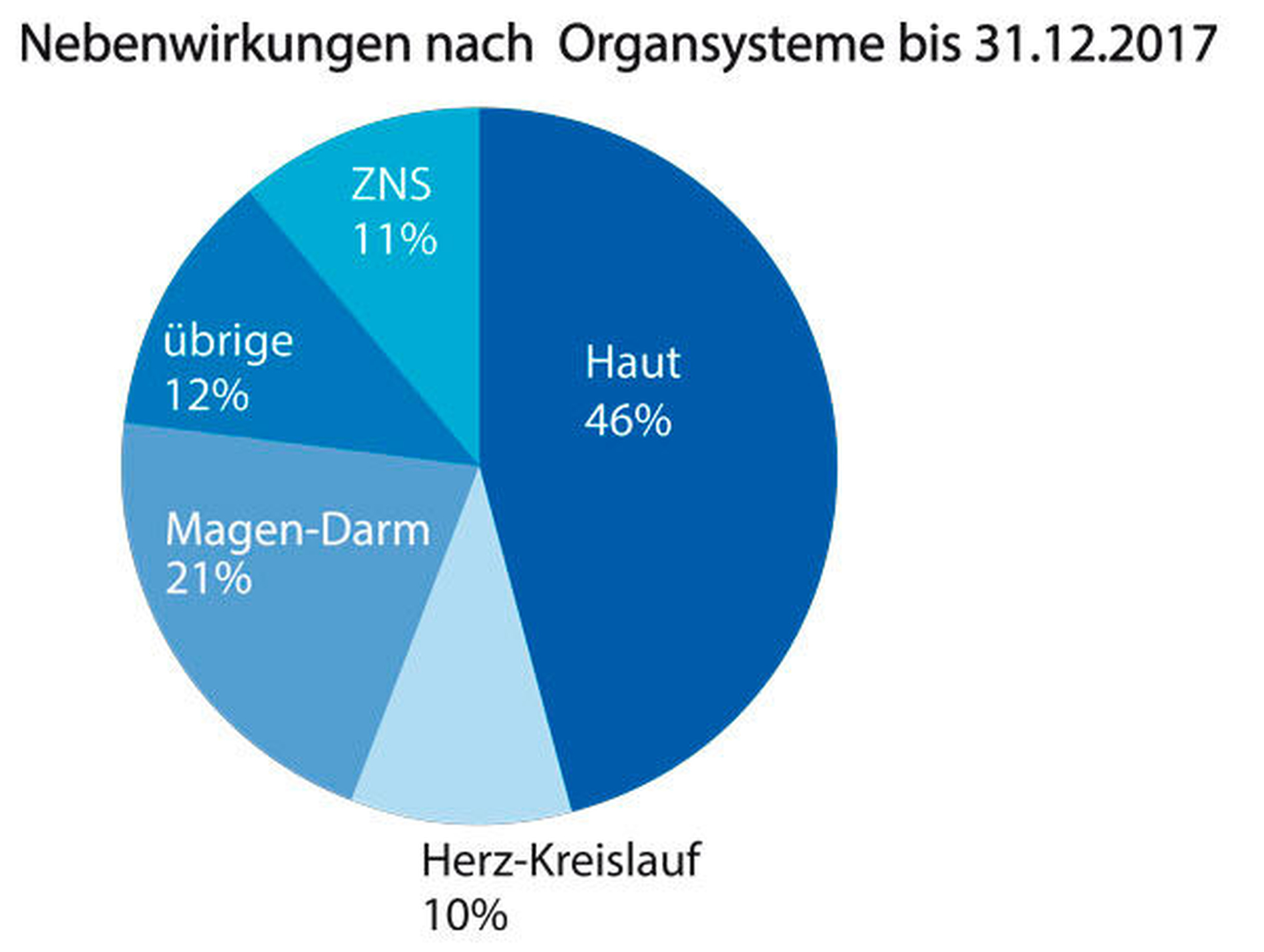
Das im Jahr 2017 am häufigsten von gemeldeten UAW betroffene Organ war mit 46 Prozent die Haut, meist in Form von allergischen Symptomen wie Exanthem, Schwellung und Juckreiz (Abbildung 3). Am zweithäufigsten war mit 21 Prozent der Magen-Darm-Trakt betroffen; führende UAW waren hier Übelkeit, Erbrechen und Durchfall, zumeist im Zusammenhang mit einer Amoxicillin- oder Clindamycin-Therapie. Hier ist zu beachten, dass die gastrointestinale Verträglichkeit beider Substanzen durch eine Einnahme mit ausreichend Flüssigkeit (mindestens 200–250 ml Wasser) verbessert werden kann. Elf Prozent aller 2017 registrierten Nebenwirkungen betrafen das zentrale Nervensystem – in den meisten Fällen waren diese mit einer antibiotischen Therapie assoziiert. Antibiotika können grundsätzlich neurotoxische Symptome verursachen, die bei Penicillinen, Cephalosporinen und Chinolonen in erster Linie über eine Inhibition der GABAA-Rezeptoren vermittelt werden, deren Ursache bei Metronidazol, Makroliden, Clindamycin und Tetrazyklinen jedoch noch weitgehend ungeklärt ist. Hier kann insbesondere die Berücksichtigung potenziell begünstigender Faktoren wie neuropsychiatrischer Begleiterkrankungen, weiterer Medikationen sowie Nierenfunktionseinschränkungen zur Therapieoptimierung beitragen [Stahlmann & Schindler, 2016]. Der Anteil unerwünschter Herz-Kreislauf-Effekte betrug 2017 zehn Prozent und verteilte sich in der Mehrzahl gleichmäßig auf Antibiotika-Therapien und die Applikationen von Lokalanästhetika mit und ohne Epinephrin-Zusatz. In der Gesamtschau der jeweiligen Symptome waren hier anaphylaktische Reaktionen, systemische Epinephrin-Effekte oder im Fall der Lokalanästhetika exzitatorische Begleiteffekte im Zuge einer zentralnervös toxischen Wirkung naheliegende Ursachen.
Resümee
Die im Jahr 2017 registrierten UAW-Meldungen an die AKZ traten – analog den vergangenen zehn Jahren – führend in Assoziation mit der Applikation von Analgetika, Lokalanästhetika und Antibiotika auf. Antibiotika waren mit einem Anteil von 72 Prozent die Wirkstoffgruppe mit den häufigsten Meldungen an die AKZ. Nach einem vorübergehenden Rückgang im Jahr 2016 wurden erneut die meisten Antibiotika-assoziierten Meldungen im Zusammenhang mit einer Clindamycin-Therapie registriert. Auch wenn es sich bei den meisten Meldungen um UAW leicht- bis mittelgradiger Ausprägung handelte, muss bei jeder der diskutierten Medikamentengruppen auch stets mit dem Auftreten schwerwiegender bis vital bedrohlicher Komplikationen im Rahmen der Anwendung gerechnet werden. Das behandelnde Praxisteam sollte in der Lage sein, diese nach dem Absetzen eines Notrufs bis zum Eintreffen des Rettungsdienstes/Notarztes leitliniengerecht zu behandeln.
Dr. med. Carsten Schumacher
Medizinische Hochschule Hannover,
Clinical Research Center (OE 8660)
Feodor-Lynen-Str. 15, 30625 Hannover
Dr. med. dent. Jens Nagaba
Bundeszahnärztekammer
Chausseestr. 13, 10115 Berlin
Prof. Dr. med. Christoph Schindler
Medizinische Hochschule Hannover,
Clinical Research Center (OE 8660)
Feodor-Lynen-Str. 15, 30625 Hannover
Melden Sie UAW!
Aufgrund des Bekanntheitsgrads sowie der Stabilität des UAW-Spektrums von im zahnärztlichen Kontext verwendeten Arzneimitteln wird leider auch im Fall schwerer Verläufe häufig von einer Meldung abgesehen, wodurch eine kontinuierliche und stabile Sicherheitsbeurteilung erschwert wird. UAW müssen jedoch – unabhängig von der Schwere – auch bei bereits beschriebenem und gut bekanntem Kausalzusammenhang immer gemeldet werden. Einzelheiten zur Meldung von UAW finden Sie im Kasten „So melden Sie Nebenwirkungen“.
Meldestatistik der AKZ
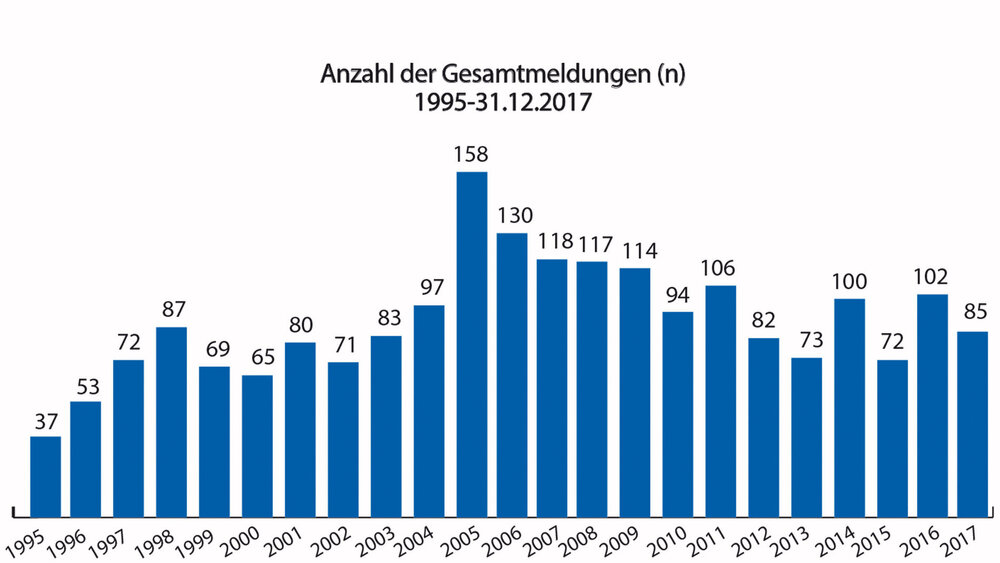
Seit dem Jahr 1995 bis zum 31.12.2017 waren insgesamt 2.085 UAW-Meldungen von Zahnärzten an die AKZ zu verzeichnen (Abbildung 1). Die niedrigste Anzahl an Meldungen wurde 1995 abgegeben (n = 37), die höchste Anzahl im Jahr 2005 (n = 158). Im Jahr 2017 gingen bei der AKZ insgesamt 85 UAW-Meldungen mehrheitlich von niedergelassenen Zahnärzten ein. Im Vergleich dazu wurden dem BfArM 2017 insgesamt 60.323 UAW-Verdachtsfälle gemeldet. 78 Prozent der Meldungen kamen von pharmazeutischen Unternehmen (n = 47.105), sieben Prozent von der Arzneimittelkommission der deutschen Ärzteschaft (n = 4.116), fünf Prozent von der Arzneimittelkommission der Deutschen Apotheker (n = 3.073), vier Prozent von anderen Heilberufen (n = 2.438) und fünf Prozent entfielen auf sonstige Quellen (n = 2.966) [Bundesinstitut für Arzneimittel und Medizinprodukte, 2018]. Die zahnärztlichen UAW-Meldungen kamen damit im Jahr 2017 lediglich auf einen Anteil von circa 0,1 Prozent.
Arzneimittelkommission Zahnärzte (AKZ)
Die systematische Erfassung und Analyse von Einzelberichten zu Verdachtsfällen unerwünschter Arzneimittelwirkungen (UAW) und Wechselwirkungen, die in Assoziation mit der Verwendung eines Arzneimittels in der praktisch-klinischen Nutzung auffallen, ist eine Grundvoraussetzung zur Aufrechterhaltung der Arzneimittelsicherheit. Im zahnärztlichen Bereich obliegt diese Aufgabe der Arzneimittelkommission Zahnärzte (AKZ), einem gemeinsamen Ausschuss der Bundeszahnärztekammer und der Kassenzahnärztlichen Bundesvereinigung. Ihr gehören acht bis zehn Experten aus unterschiedlichen Fachrichtungen an (unter anderem niedergelassene Zahnärzte, Werkstoffkundler, Pharmakologen und Toxikologen). Die Bezeichnung als „Pharmakovigilanzzentrum“ hebt ihren Beitrag zur Sicherheit und Qualität von Arzneimitteln hervor [Bundeszahnärztekammer, 2018].
Literaturliste
Aithal GP, Watkins PB, Andrade RJ, et al. Case definition and phenotype standardization in drug-induced liver injury. Clin Pharmacol Ther 2011; 89: 806–15.
Brockow K, et al. (2015). Leitlinie Allergologische Diagnostik vonÜberempfindlichkeitsreaktionen auf Arzneimittel. Allergo J Int, 24(94), 44-57.
Bundesinstitut für Arzneimittel und Medizinprodukte. (2013). Chlorhexidin: Anaphylaktische Reaktionen. Abgerufen von www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RI/2013/RI-chlorhexidin.html am 24.01.2019.
Bundesinstitut für Arzneimittel und Medizinprodukte. (2018). Eingänge zu UAW-Berichten - Sachstand BfArM (82. Routinesitzung, 19.04.2018).
Bundeszahnärztekammer. (2017). Musterberufsordnung (11.11.2017).
Bundeszahnärztekammer. (2018). Arzneimittelkommission. Abgerufen von www.bzaek.de/berufsausuebung/arzneimittel-medizinprodukte/arzneimittelkommission.html am 24.01.2019.
Deutscher Rat für Wiederbelebung - German Resuscitation Council e.V. (2015). Reanimation 2015 – Leitlinien kompakt (1. Auflage).
Deutscher Arbeitskreis für Zahnheilkunde. Online abgerufen am 02.03.2019 18.57 Uhr: daz-forum.org/problematische-antibiotikaverordnungen-in-zahnaerztlichen-praxen/
Felsenberg D, Hoffmeister B, Amling M, Mundlos, Seibel, Fratzl P. (2006). Onkologie: Kiefernekrosen nach hoch dosierter Bisphosphonattherapie. Dtsch Arztebl, 103(46).
Halling F. (2018). Zahnärztliche Arzneiverordnungen. In Arzneiverordnungs-Report 2018 (pp. 813-824): Springer-Verlag GmbH.
Kämmerer PW, Al-Nawas B, et al. (2017). S3-Leitlinie (Langversion): Zahnärztliche Chirurgie unter oraler Antikoagulation/ Thrombozytenaggregationshemmung (AWMF-Registernummer: 083-018).
Mishra MB, Khan ZY, Mishra S. (2012). Gingival overgrowth and drug association. J Acad Med Sci, 2(3), 91-96.
Rank A, Diener HC, Hiller E. (2017). NOAK - Gerinnungsmanagement bei schweren Blutungen. Arzneimitteltherapie, 35, 321-327.
Schindler C. (2018). Relevante Arzneimittelwechselwirkungen in der zahnärztlichen Praxis. Dtsch Zahnarztl Z, 73, 412-419.
Schindler C, Stahlmann R. (2014). Sultamicillin als therapeutische Alternative zu Amoxicillin und Clavulansäure. Zahnärztliche Mitteilungen, 13.
Stahlmann R, Schindler C. (2016). Antibiotika in der Zahnmedizin. Zahnärztliche Mitteilungen, 11.
Zink W, Graf BM. (2003). Toxikologie der Lokalanästhetika. Anaesthesist, 52, 1102-1123.