Was wir heute über Bruxismus wissen
Das rechtzeitige Erkennen von Bruxismus hilft, die Folgen zu reduzieren oder prophylaktisch vorzugehen. Daher sollte ein Bruxismus-Screening (Abbildung 1) in die tägliche Routine einfließen. Primärer Bruxismus ist nicht kausal therapierbar. Die Folgen können nicht kariöse Zahnhartsubstanzdefekte sein, Schäden und der Verlust von Restaurationsmaterialien, empfindliche Zähne, eine Hypertrophie der Kaumuskulatur oder gar Craniomandibuläre Dysfunktionen (CMD). Sekundärer Bruxismus kann auf eine Erkrankung hinweisen, etwa einen gastroösophagealen Reflux, schlafbezogene Atmungsstörungen, Schlafstörungen, Bewegungsstörungen (Restless-legs-Syndrom) oder Nebenwirkungen von Medikamenten, Drogen oder Genussmitteln. Diese erfordern gegebenenfalls die Überweisung zum Facharzt.
Bruxismus – Definition
Obwohl schon über 100 Jahre bekannt, wird Bruxismus als eigenständiges Phänomen wissenschaftlich erst in den vergangenen zwei Jahrzehnten untersucht. Eine renommierte internationale Arbeitsgruppe ver ö ffentlichte 2018 eine neue Definition von Bruxismus [Lobbezoo et al., 2018]. Danach werden Schlaf- und Wachbruxismus unterschieden:
Schlafbruxismus ist eine Aktivität der Kaumuskulatur während des Schlafs. Er wird charakterisiert als rhythmisch (phasisch) oder nicht-rhythmisch (tonisch) und ist keine Bewegungsstörung oder eine Schlafstörung bei ansonsten gesunden Individuen.
Wachbruxismus ist eine Aktivität der Kaumuskulatur während des Wachzustands. Wachbruxismus wird charakterisiert als wiederholter oder dauerhafter Zahnkontakt und/oder als Anspannen oder Verschieben des Unterkiefers ohne Zahnkontakt. Bei ansonsten gesunden Individuen handelt es sich dabei nicht um eine Bewegungsstörung.
Die Studien zur Prävalenz sind hinsichtlich einer Geschlechterdominanz inkonsistent. Die Prävalenz schwankt in Abhängigkeit vom diagnostischen Verfahren. Bei Kindern werden Prävalenzzahlen für Schlafbruxismus von bis zu 56 Prozent angegeben [Manfredini et al., 2013], bei Erwachsenen ist der Wachbruxismus häufiger mit bis zu 31 Prozent, der Schlafbruxismus seltener mit bis zu 16 Prozent [Manfredini et al., 2013]. Bruxismus tritt in der gesamten Lebensspanne ab dem Durchtritt der Z ä hne bis ins hohe Alter auf [Castrillon et al., 2016]. Die Pr ä valenz ist im zweiten und im dritten Lebensjahrzehnt am höchsten, um dann zum Alter hin abzunehmen [Shetty et al., 2010].
Ätiologie
Bruxismus gilt als multifaktoriell bedingt [Murali et al., 2015; Manfredini et al., 2009; Manfredini et al., 2011]. Schlafbruxismus wird eher zentralnervösen Ursachen zugeschrieben, Wachbruxismus eher emotionalem Stress [Castrillon et al., 2016; Alfano et al., 2018; Guo et al., 2018; Manfredini et al., 2016; Manfredini et al., 2016; Carlsson et al., 2003; Lobbezoo et al., 2001]. Weitere ätiologische Faktoren sind Angststörungen, Schlafstörungen (zum Beispiel Insomnie, Schlafapnoe), physiologische/biologische/genetische Faktoren, neurochemische Transmitter, Reflux oder exogene Faktoren wie Nikotin-, Alkohol- oder Drogenkonsum [Manfredini et al., 2009; Alfano et al., 2018; Manfredini et al., 2016; Manfredini et al., 2016; Manfredini et al., 2011; Lobbezoo et al., 2012; Lavigne et al., 1997; Feu et al., 2013; Bertazzo-Silveira et al., 2016; Castroflorio et al., 2015; Ella et al., 2016; Garrett et al., 2018; Melo et al., 2018; Mengatto et al., 2013; Kuhn et al., 2018; Peskersoy et al., 2016]. Auch die Einnahme bestimmter Medikamente kann Bruxismus ausl ö sen. Dazu geh ö ren dopaminhaltige Medikamente [Falisi et al., 2014], Antidepressiva in Form von trizyklischen Antidepressiva oder Serotonin-Wiederaufnahme-Hemmer (SSRI) [Garrett et al., 2018; Gerber et al., 1998; Lobbezoo et al., 2001; Uca et al., 2015], Medikamente zur Behandlung des Aufmerksamkeitsdefizit-Syndroms (ADHS) [Malki et al., 2004], Narkotika [Winocur et al., 2001] und Antihistaminika [Falisi et al., 2014].
Diagnostik
Anhand diagnostischer Grundlagen werden die in Tabelle 1 genannten Einstufungen unterschieden.
Die Anamnese allein sollte nicht zur Diagnostik von Schlaf- oder Wachbruxismus genutzt werden [Casett et al., 2017; Palinkas et al., 2015; Raphael et al., 2015]. Die Leitlinie empfiehlt, die Kriterien der American Association for Sleep Medicine (AASM) f ü r Schlafbruxismus zu nutzen [Palinkas et al., 2015; Raphael et al., 2015]. Diese Kriterien helfen, neben der Anamnese auch klinische Anzeichen zu beurteilen, wie einen abnormen, nicht kariösen Zahnhartsubstanzverlust und/oder den Verlust von Restaurationsmaterialien, Missempfindungen, M ü digkeit oder Schmerz in der Kaumuskulatur und Kiefer ö ffnungsbehinderungen beim Aufwachen sowie die Hypertrophie des M. masseter bei willk ü rlichem, kr ä ftigem Kieferpressen. Die Deutsche Gesellschaft f ü r Funktionsdiagnostik und -therapie stellt ein entsprechendes Bruxismus-Screening online zur Verf ü gung (Abbildung 1, www.dgfdt.de).
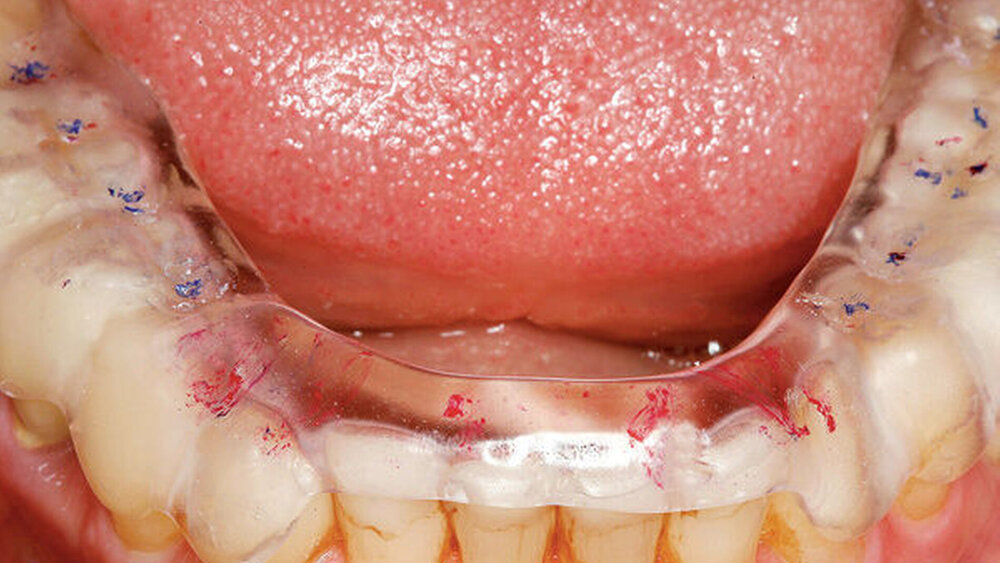
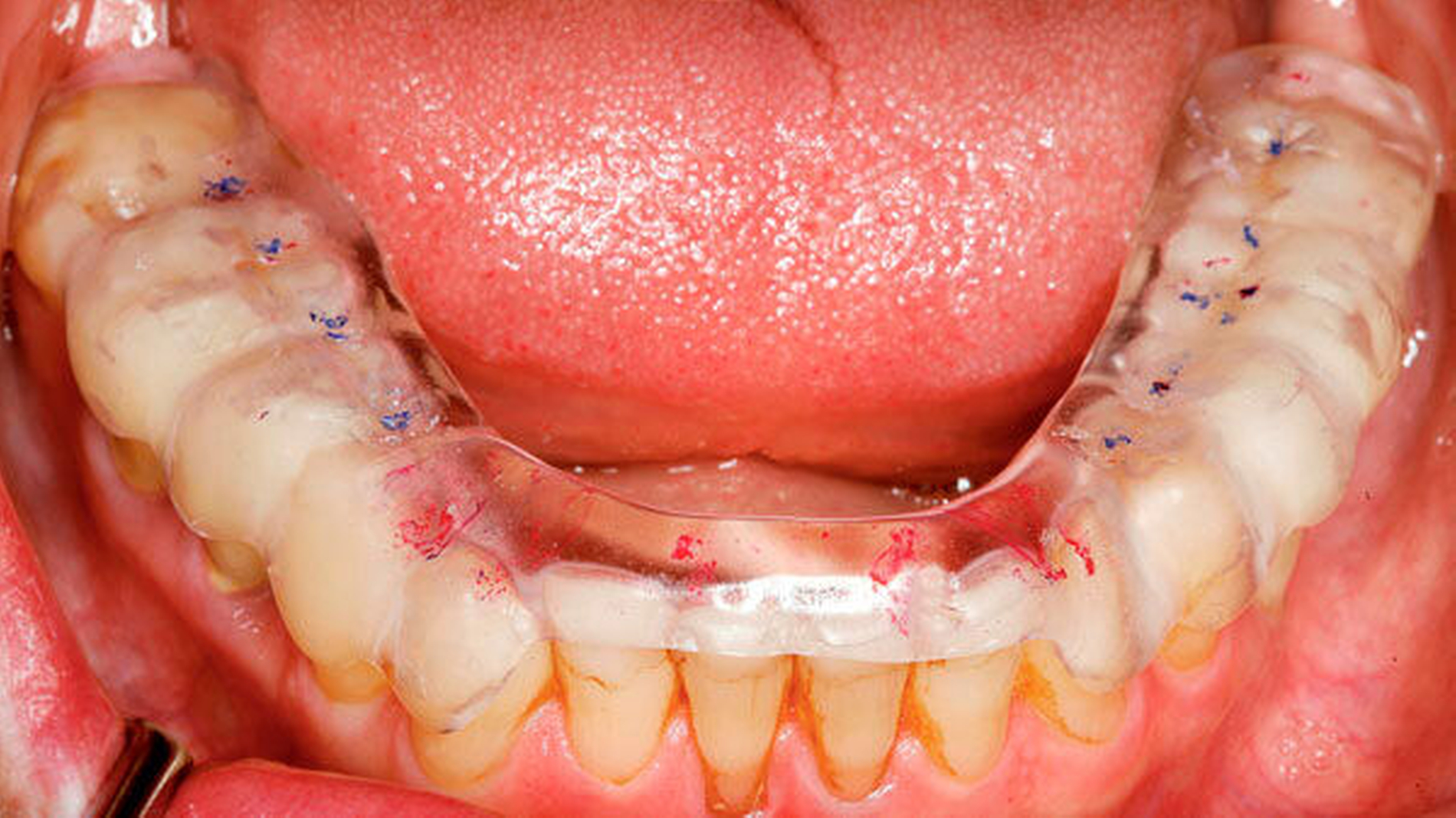
Eingefärbte Schienen können zur Darstellung nächtlicher Bruxismusaktivitäten in Form von Abriebmustern genutzt werden [Ommerborn et al., 2015]. Die Leitlinie weist aber darauf hin, dass damit Schlafbruxismus in Form von Pressen unerkannt bleibt und f ü r Mehrschichtschienen keine ausreichende Evidenz zur Diagnostik von Schlafbruxismus besteht.
Zur instrumentellen Diagnostik des definitiven Schlafbruxismus und/oder Wachbruxismus stellen aufzeichnende tragbare EMG-Ger ä te eine Alternative zur Polysomnografie dar [Casett et al., 2017; Inano et al., 2013; Manfredini et al., 2014; Miettinen et al., 2018; Stuginski-Barbosa et al., 2016] (Abbildung 2). Die Empfehlung der Leitlinie ist somit offen, da ausreichende Evidenz zur Empfehlung dieser Geräte noch fehlt. Die Polysomnografie (PSG) gilt als Referenz zur Diagnose des definitiven Schlafbruxismus. Da die PSG jedoch einen hohen technischen, finanziellen und zeitlichen Aufwand erfordert, sollte sie Studien und der Diagnostik von Schlafstörungen wie zum Beispiel schlafbezogenen Atmungsstörungen (SBAS) vorbehalten bleiben [Rompré et al., 2007; Lavigne et al., 1996]. Wachbruxismus lässt sich auch durch Selbstbeobachtung, gegebenenfalls unterstützt durch moderne, elektronische Technologien [Watanabe et al., 2011], diagnostizieren.
Einstufung | Diagnostische Verfahren |
|---|---|
Möglicher Bruxismus | Anhand anamnestischer Angaben des Patienten, Schlafpartners oder Eltern |
Wahrscheinlicher Bruxismus | Anhand klinischer Anzeichen mit oder ohne anamnestische Angaben |
Definitiver Bruxismus | Anhand instrumenteller Untersuchung mit oder ohne klinischer Anzeichen und/oder anamnestische Angaben. |
Tabelle 1: Bildquelle: Peroz und Lange nach [Lobbezoo et al., 2018]
Bruxismus und CMD
Ob Bruxismus als prädisponierender, ausl ö sender und/oder unterhaltender Faktor einer CMD gilt, wird nach wie vor kontrovers diskutiert [Jimen é z-Silva et al., 2016; Manfredini et al., 2010]. Die uneinheitliche Studienlage ist bedingt durch die uneinheitliche Diagnostik des Bruxismus (anamnestische Angaben, klinische Untersuchung, EMG, PSG), die fehlende Differenzierung zwischen Wachbruxismus und Schlafbruxismus und die unterschiedliche Differenzierung spezifischer CMD-Diagnosen. Da Bruxismus zudem zeitlich fluktuiert, sind Fall-Kontroll-Studien unzuverlässig. Noch nicht ausreichend erforscht sind Interaktionen zwischen Bruxismus und CMD-Schmerzen.
Bruxismus gilt aber als Risikofaktor für die Entstehung einer CMD. Insbesondere vorübergehende Schl ä fenkopfschmerzen, wie sie in den DC-TMD-Frageb ö gen (DC-TMD – Diagnostic Criteria for Temporomandibular Disorders) als „ auf eine CMD zur ü ckzuf ü hrende Kopfschmerzen “ differenziert werden [Schiffman et al., 2014], scheinen in einem engen Zusammenhang mit Bruxismus zu stehen [Jimenéz-Silva et al., 2016; De Luca Canto et al., 2014; Blanco Aguilera et al., 2014; Cioffi et al., 2017; Sierwald et al., 2015]. Bruxismus kann mit Schmerzen in der Kaumuskulatur sowie schmerzhaften Dysfunktionen der Kiefergelenke zusammenhängen. Daher schlussfolgert die Leitlinie, dass bei bestehender CMD mögliche Symptome und klinische Zeichen für Bruxismus identifiziert werden sollten.
Bruxismus und Okklusion
Die Auswertung der Literatur stützt die These nicht, dass bestimmte okklusale Parameter Bruxismus auslösen oder unterhalten können. Bestimmte okklusale Parameter scheinen in Kombination mit Bruxismus ein Risiko für CMD zu sein. Dazu gehören insbesondere laterotrusives Gleiten und Gleiten vom maximalen Rückschub des Unterkiefers in die maximale Interkuspidation von mehr als 2 mm. Welche Bedeutung der Bruxismus für die CMD hat, bleibt jedoch unklar [Manfredini et al., 2014].
Behandlung des Bruxismus
Beratung, Aufklärung, Selbstbeobachtung
Die Aufklärung und die Beratung der Patienten mit der Diagnose Bruxismus sind zentrale therapeutische Schritte im Sinne der Informationstherapie. Vielen Patienten ist nicht bewusst, dass sie an Bruxismus leiden [Panek et al., 2012]. Die Aufkl ä rung sollte die Darstellung der festgestellten Befunde umfassen, Diagnose, ätiologische Zusammenhänge, Risikofaktoren, Prognose, Therapiemöglichkeiten und deren Kosten sowie die Risiken der Behandlung und Nichtbehandlung nach aktuellem wissenschaftlichem Erkenntnisstand [Visscher et al., 2000; Lobbezoo et al., 2008; De la Hoz, 2013; Guaita et al., 2016; Goldstein et al., 2017].
Neben der Aufklärung und Beratung im Sinne einer Informationstherapie wird das Bewusstwerden der Kaumuskelaktivitäten als ein wichtiger initialer Behandlungsschritt angesehen. Dies geschieht in Form von Selbstbeobachtung im Alltag [Treacy, 1999]. Dadurch werden die Patienten befähigt, sich bewusst zu machen, wie häufig und unter welchen Bedingungen sie im Wachzustand die Kiefer anspannen und/oder verschieben – mit und ohne Zahnkontakt –, um dieser Muskelaktivität entgegenwirken zu können (Abbildung 3). Es eignen sich dazu einfache Hilfsmittel wie optische Signale in Form roter Punkte, die im Arbeitsumfeld oder im häuslichen Bereich den Patienten immer wieder daran erinnern sollen, zu reflektieren, ob die Kaumuskulatur angespannt oder entspannt ist, ob die Z ä hne in oder ohne Kontakt sind, ob die Zunge gegen die Z ä hne gedr ü ckt oder die Wange eingesaugt wird.
Okklusionsschienen
Okklusionsschienen gelten als reversible okklusale Ma ß nahmen, die eher symptomatisch eingesetzt den Abrieb der Z ä hne bei Schlafbruxismus verhindern helfen (Abbildung 4). Nachgewiesen werden konnte auch eine Reduktion der Kaumuskelaktivit ä t durch Schienen, dies jedoch nicht regel- und dauerhaft [Guaita et al., 2016; Manfredini et al., 2015]. Vielmehr wird eine intermittierende Trageweise empfohlen, um diesen Effekt auf die Muskulatur zu erzielen [Jokubauskas et al., 2018]. Die Wirkung der Schiene beruht auf einer Veränderung neuromuskulärer Reflexe und einer veränderten Rekrutierung von Muskelfasern durch die veränderte Okklusion [Ispirgil et al., 2018]. Treten jedoch Gewöhnungseffekte auf, verliert sich dieser Effekt.
Es werden eher harte als weiche Schienen empfohlen, da sie ein geringeres Risiko für Zahnfehlstellungen aufweisen. Zudem ließ sich bei weichen Schienen ein aktivitätssteigender Effekt auf die Muskulatur nachweisen [Lobbezoo et al., 2008; Macedo et al., 2007]. Am h ä ufigsten wurden Oberkieferschienen untersucht. Ein klares Konzept für die okklusale Gestaltung in Statik und Dynamik konnte aus den Studien nicht abgeleitet werden. Dickere Schienen (6 mm) zeigten einen geringeren Effekt auf Bruxismus als weniger dicke (3 mm) [Manfredini et al., 2015]. Ein horizontaler Frontzahn-Jig erwies sich als effektiv zur Minderung der Muskelaktivität. Eine längerfristige Tragedauer kann jedoch nicht empfohlen werden, da ungewollte Zahnstellungsveränderungen auftreten können [Stapelmann et al., 2008].
Bimaxilläre Schienen, die den Unterkiefer protrusiv stellen (UPS) reduzierten die Kaumuskelaktivität besser als Zentrikschienen. Mit dem Einsatz dieser Schienen bei Patienten mit Bruxismus und obstruktiver Schlafapnoe lässt sich zeitgleich die SBAS als relevanter Kofaktor behandeln [Lobbezoo et al., 2008; Singh et al., 2015; Jokubauskas et al., 2018].
- Im Rahmen der zahnärztlichen Behandlung von Schlafbruxismus können Schienen zum Schutz der Zähne im Schlaf eingegliedert werden, um durch die Unterbrechung der Zahn-zu-Zahn-Kontakte zuverlässig vor übermäßiger Attrition zu schützen [Lobbezoo et al., 2008; Macedo et al., 2007; Carra et al., 2012].
- Schienen können zur vorübergehenden Reduktion der Aktivität von Schlafbruxismus eingesetzt werden [Guaita et al., 2016; Ispirgil et al., 2018; Stapelmann et al., 2008; Singh et al., 2015].
- Aufgrund der geringsten Nebeneffekte sollten über einen längeren Zeitraum harte Schienen verwendet werden, die alle Zähne bedecken [Lobbezoo et al., 2008; Macedo et al., 2007].
- Wenn Bruxismus bei Patienten mit einer SBAS auftritt, können bimaxilläre Unterkiefer-Protrusionsschienen (UPS) erwogen werden (siehe S3-Leitlinie „Nicht erholsamer Schlaf“ aus 2017, AWMF-Register Nr. 063/001) [Manfredini et al., 2015; Singh et al., 2015; Huynh et al., 2006].
- Schienen können bei Kindern kurzfristig erwogen werden. Nach Abschluss der Gebissentwicklung k ö nnen Schienen wie bei Erwachsenen eingesetzt werden [Giannasi et al., 2013; Hachmann et al., 1999].
Definitive okklusale Maßnahmen
Zu den definitiven okklusalen Interventionen gehören Einschleifmaßnahmen, okklusale Rehabilitationen im direkten Verfahren mittels plastischer Materialien oder indirekter Verfahren aus diversen Materialien wie Komposit, Keramik, Metallkeramik oder Metallen. Die Materialfrage wird in der Leitlinie nicht behandelt, da es bislang laut S3-Leitlinie „Vollkeramische Kronen und Brücken“ (AWMF-Registernummer 083–012) keine ausreichende externe Evidenz dazu gibt.
Aus den wenigen Literaturquellen mit niedriger Qualität lässt sich keine positive Evidenz ableiten, dass okklusale Maßnahmen eine sinnvolle Bruxismusbehandlung darstellen [Tsukiyama et al., 2001]. Der durch Bruxismus bedingte zunehmende Zahnhartsubstanzverlust erfordert aus funktionell- ä sthetischen und prothetischen Gr ü nden h ä ufig eine Erhöhung der vertikalen Dimension. Es muss jedoch den Behandlern und auch den Patienten bewusst sein, dass diese Maßnahmen einen höheren Substanzverlust nach sich ziehen als der Bruxismus selbst. Mit erhöhten Misserfolgsraten technischer wie biologischer Art ist zu rechnen.
Zur kausalen Behandlung von Bruxismus sollen definitive okklusale Maßnahmen nicht eingesetzt werden [Lobbezoo et al., 2008; Tsukiyama et al., 2001; Manfredini et al., 2017].
Wichtig ist der Hinweis, dass vor Ver ä nderung der Kieferrelation bei Bruxismuspatienten mit definitiven prothetischen Therapiema ß nahmen eine Vorbehandlung basierend auf funktionsanalytischen Ma ß nahmen mit Okklusionsschienen und/oder Langzeitprovisorien zur Simulation durchgef ü hrt werden sollte. Bei kieferorthopädischen und/oder kieferchirurgischen Ver ä nderungen der Kieferrelation sollten funktionsanalytische Ma ß nahmen erwogen werden [Bernhardt et al., 2014].
Nach der prothetischen Rehabilitation sollte bei Schlafbruxismus eine Schutzschiene eingesetzt werden.
Pharmakologie
Da Schlafbruxismus sehr wahrscheinlich eher zentralnervös verursacht wird und auch als Reaktion auf psychoaktive Substanzen auftritt, wurden verschiedene Medikamente wie dopaminerge Substanzen, Antihistaminika, serotonerge Antidepressiva und Trizyklika, Clonidin als Alpha-1-Antagonist oder Antikonvulsiva (Gabapentin) hinsichtlich der Wirkung auf Bruxismus untersucht [Winocur et al., 2003]. Am häufigsten angewendet wurde jedoch Botulinumtoxin, das die Freisetzung des Neurotransmitters Acetylcholin verhindert und damit eine reversible schlaffe L ä hmung der Skelettmuskulatur bewirkt [Tan et al., 2000; Lee et al., 2010].
Bedingt durch die Nebenwirkungen, die häufig recht individuelle Wirkung der Medikamente und die schlechte Datenlage aufgrund geringer Patientenzahlen, kurzer Anwendungsdauer oder ausbleibender Wirkung auf die Bruxismusaktivität sollten bei Erwachsenen und Kindern systemisch wirksame Medikamente zur Bruxismusbehandlung nicht gegeben werden [Winocur et al., 2001; Lobbezoo et al., 2008; Macedo et al., 2014; Al-Wayli, 2017; Ghanizadeh et al., 2013; Ohmure et al., 2016].
Die Injektion von Botulinumtoxin bei Erwachsenen in die Kaumuskulatur kann als Behandlungsmaßnahme erwogen werden. Hierbei sind der „Off-Label-Use“ und berufsrechtliche Vorgaben zu beachten [Manfredini et al., 2015; Al-Wayli, 2017; De la Torre Canales et al., 2017; Long et al., 2012; Persaud et al., 2013; De Mello Sposito et al., 2014; Cahlin et al., 2017].
Psychotherapie
Psychotherapeutische Therapieansätze werden in Literaturübersichten von diverser Qualität dargelegt [Shetty et al., 2010; Lobbezoo et al., 2008; Manfredini et al., 2015; Bader et al., 2000; De la Hoz-Aizpurua et al., 2011]. Sie umfassen kognitive Verhaltenstherapien wie das Erlernen ad ä quater Selbstwahrnehmung und Unterbrechung von Verhaltensketten durch konkurrierende Verhaltensweisen oder Selbstmanagement-Techniken und das Training sozialer Kompetenzen und Konfrontationsverfahren. Häufig wird die Progressive Muskelrelaxation nach Jacobson (PMR) unterstützend eingesetzt, die auch als Entspannungsmaßnahme im Rahmen der Aufklärung Erwähnung findet oder in der Physiotherapie angewendet wird.
Die Leitlinie spricht sich daher in einer offenen Empfehlung dafür aus, dass die PMR zur Behandlung des Bruxismus eingesetzt werden kann. Die kognitive Verhaltenstherapie kann zur Schmerzreduktion eingesetzt werden [Manfredini et al., 2015; De la Hoz-Aizpurua et al., 2011; Makino et al., 2014; Restrepo et al., 2001; Valiente Lopez et al., 2015; Trindade et al., 2015].
Physiotherapie
Die Physiotherapie umfasst manualtherapeutische Techniken an der Muskel- und Gelenkstruktur und Anwendungen von physikalischen Maßnahmen wie heiße Rolle, Fangopackungen, Eis oder Ultraschall. Diese Maßnahmen sind nicht geeignet, die Bruxismusaktivität zu beeinflussen [Lobbezoo et al., 2008]. Sie tragen jedoch dazu bei, die Beschwerden im Sinne einer CMD zu behandeln, die durch Bruxismus initiiert sein können. Daher empfiehlt die Leitlinie in einer offenen Empfehlung, dass für die Behandlung von CMD-Symptomen, die m ö glicherweise durch Bruxismus getriggert werden, eine Verordnungskombination aus manueller Therapie und erg ä nzendem Heilmittel, beispielsweise einer Kälte- oder Wärmeanwendung, erwogen werden kann [Treacy, 1999; Amorim et al., 2018; Frucht et al., 1995; Gomes et al., 2014; Gomes et al., 2015].
Ziel der Physiotherapie ist es zudem, Patienten auf beitragende oder unterhaltende Faktoren hinzuweisen. Patienten mit Wachbruxismus sollten daher zu Wahrnehmungs- und/oder Achtsamkeits- und/oder Entspannungstechniken zum Selbstmanagement angeleitet werden [Treacy, 1999; Amorim et al., 2018].
Biofeedback
Durch Biofeedback werden in der Regel aktivitätsabh ä ngig k ö rperliche Funktionen der Patienten beispielsweise akustisch, per Vibration, elektrische Reizung oder optisch zur ü ckgemeldet, damit dadurch diese K ö rperfunktionen wahrgenommen und beeinflusst werden k ö nnen. Die Studienergebnisse aus zum Teil randomisierten kontrollierten Studien konnten zeigen, dass sich durch Biofeedback die Bruxismusaktivität reduzieren lässt. Diese Wirkung ist allerdings nur vorübergehend, w ä hrend der aktiven Phase der Biofeedback-Anwendung [Manfredini et al., 2015; Jokubauskas et al., 2018].
Fallberichte zeigen, dass durch Biofeedback-Therapie auch eine positive Wirkung auf die nächtliche Bruxismusaktivität erfolgen kann. Aufgrund der unzureichenden Datenlage schlussfolgert die Leitlinie, dass Biofeedback zur Reduktion des Wach- und des Schlafbruxismus eingesetzt werden kann [Manfredini et al., 2015; Jokubauskas et al., 2018; Gu et al., 2015; Watanabe et al., 2011].
Zusammenfassung
In der Praxis eignet sich zur Diagnostik eines wahrscheinlichen Bruxismus das Bruxismus-Screening, das sowohl die Anamnese als auch die Untersuchung des Patienten einbezieht (Abbildung 1).
Die Aufklärung und die Anleitung zur Selbstbeobachtung, zur Änderung von Lebensgewohnheiten und zur Minderung der Kaumuskelaktivit ä t stehen im Vordergrund des Managements von Bruxismus. Schienen dienen zum Schutz der Zähne und können zur Minderung der Bruxismusaktivität beitragen. Biofeedback kann zur Unterstützung der Verhaltenstherapie eingesetzt werden, hat jedoch keine Langzeitwirkung. Definitive okklusale Maßnahmen sind aus prothetischen Gründen und bei ästhetisch-funktionellen Defiziten sinnvoll, setzen aber eine funktionelle Untersuchung und Vorbehandlung voraus. Dennoch unterliegen sie einem h ö heren technischen und biologischen Risiko. Zum Schutz der Rekonstruktion sollte eine Schiene eingesetzt werden.
Prof. Dr. Ingrid Peroz
Charité – Universitätsmedizin Berlin
Abteilung für Zahnärztliche Prothetik, Alterszahnmedizin und Funktionslehre
Aßmannshauser Str. 4–6, 14197 Berlin
und
Präsidentin der Deutschen Gesellschaft für Funktionsdiagnostik und -therapie
Liesegangstr. 17 a, 40211 Düsseldorf
Dr. Matthias Lange
Praxis für Zahnheilkunde
Lietzenburger Str. 51, 10789 Berlin
und
Vorstand der Deutschen Gesellschaft für Funktionsdiagnostik und -therapie
Liesegangstr. 17 a, 40211 Düsseldorf
Literaturübersicht
1. Lobbezoo F, Ahlberg J, Raphael KG et al. International consensus on the assessment of bruxism: Report of a work in progress. J Oral Rehabil 2018; 45: 1-8.
2. Manfredini D, Restrepo C, Diaz-Serrano K et al. Prevalence of sleep bruxism in children: a systematic review of the literature. J Oral Rehabil 2013; 40: 631-642.
3. Manfredini D, Winocur E, Guarda-Nardini L et al. Epidemiology of bruxism in adults: a systematic review of the literature. J Orofac Pain 2013; 27: 99-110.
4. Castrillon EE, Ou KL, Wang K et al. Sleep bruxism: an updated review of an old problem. Acta Odontol Scand 2016; 74: 328-334.
5. Shetty S, Pitti V, Satish Babu CL et al. Bruxism: a literature review. J Indian Prosthodont Soc 2010; 10: 141-148.
6. Murali RV, Rangarajan P, Mounissamy A. Bruxism: Conceptual discussion and review. J Pharm Bioallied Sci 2015; 7: S265-270.
7. Manfredini D, Lobbezoo F. Role of psychosocial factors in the etiology of bruxism. J Orofac Pain 2009; 23: 153-166.
8. Manfredini D, Bucci MB, Sabattini VB et al. Bruxism: overview of current knowledge and suggestions for dental implants planning. Cranio 2011; 29: 304-312.
9. Alfano CA, Bower JL, Meers JM. Polysomnography-detected bruxism in children is associated with somatic complaints but not anxiety. J Clin Sleep Med 2018; 14: 23-29.
10. Guo H, Wang T, Niu X et al. The risk factors related to bruxism in children: A systematic review and meta-analysis. Arch Oral Biol 2018; 86: 18-34.
11. Manfredini D, Bracci A, Djukic G. BruxApp: the ecological momentary assessment of awake bruxism. Minerva Stomatol 2016; 65: 252-255.
12. Manfredini D, Arreghini A, Lombardo L et al. Assessment of anxiety and coping features in bruxers: A portable electromyographic and electrocardiographic Study. J Oral Facial Pain Headache 2016; 30: 249-254.
13. Carlsson GE, Egermark I, Magnusson T. Predictors of bruxism, other oral parafunctions, and tooth wear over a 20-year follow-up period. J Orofac Pain 2003; 17: 50-57.
14. Lobbezoo F, Naeije M. Bruxism is mainly regulated centrally, not peripherally. J Oral Rehabil 2001; 28: 1085-1091.
15. Manfredini D, Fabbri A, Peretta R et al. Influence of psychological symptoms on home-recorded sleep-time masticatory muscle activity in healthy subjects. J Oral Rehabil 2011; 38: 902-911.
16. Lobbezoo F, Ahlberg J, Manfredini D et al. Are bruxism and the bite causally related? J Oral Rehabil 2012; 39: 489-501.
17. Lavigne GL, Lobbezoo F, Rompré PH et al. Cigarette smoking as a risk factor or an exacerbating factor for restless legs syndrome and sleep bruxism. Sleep 1997; 20: 290-293.
18. Feu D, Catharino F, Quintão CCA et al. A systematic review of etiological and risk factors associated with bruxism. JO 2013; 40: 163-171.
19. Bertazzo-Silveira E, Kruger CM, Porto De Toledo I et al. Association between sleep bruxism and alcohol, caffeine, tobacco, and drug abuse: A systematic review. J Am Dent Assoc 2016; 147: 859-866 e854.
20. Castroflorio T, Bargellini A, Rossini G et al. Risk factors related to sleep bruxism in children: A systematic literature review. Arch Oral Biol 2015; 60: 1618-1624.
21. Ella B, Ghorayeb I, Burbaud P et al. Bruxism in Movement Disorders: A Comprehensive Review. J Prosthodont 2016; 26: 599-605.
22. Garrett AR, Hawley JS. SSRI-associated bruxism: A systematic review of published case reports. Neurol Clin Pract 2018; 8: 135-141.
23. Melo G, Dutra KL, Rodrigues Filho R et al. Association between psychotropic medications and presence of sleep bruxism: A systematic review. J Oral Rehabil 2018; 45: 545-554.
24. Mengatto CM, Dalberto Cda S, Scheeren B et al. Association between sleep bruxism and gastroesophageal reflux disease. J Prosthet Dent 2013; 110: 349-355.
25. Kuhn M, Türp JC. Risikofaktoren für Bruxismus - Eine Literaturübersicht von 2007 bis 2016. Swiss Dent J 2018; 128: 125-129.
26. Peskersoy C, Peker S, Kaya A et al. Evaluation of the relationship between migraine disorder andoral comorbidities: multicenter randomized clinical trial. Turk J Med Sci 2016; 46: 712-718.
27. Falisi G, Rastelli C, Panti F et al. Psychotropic drugs and bruxism. Expert Opin Drug Saf 2014; 13: 1319-1326.
28. Gerber PE, Lynd LD. Selective serotonin-reuptake inhibitor-induced movement disorders. Ann Pharmacother 1998; 32: 692-698.
29. Lobbezoo F, van Denderen RJ, Verheij JG et al. Reports of SSRI-associated bruxism in the family physician's office. J Orofac Pain 2001; 15: 340-346.
30. Uca AU, Uguz F, Kozak HH et al. Antidepressant-Induced Sleep Bruxism: Prevalence, Incidence, and Related Factors. Clin Neuropharmacol 2015; 38: 227-230.
31. Malki GA, Zawawi KH, Melis M et al. Prevalence of bruxism in children receiving treatment for attention deficit hyperactivity disorder: a pilot study. J Clin Pediatr Dent 2004; 29: 63-67.
32. Winocur E, Gavish A, Volfin G et al. Oral motor parafunctions among heavy drug addicts and their effects on signs and symptoms of temporomandibular disorders. J Orofac Pain 2001; 15: 56-63.
33. Casett E, Reus JC, Stuginski-Barbosa J et al. Validity of different tools to assess sleep bruxism: a meta-analysis. J Oral Rehabil 2017; 44: 722-734.
34. Palinkas M, De Luca Canto G, Rodrigues LAM et al. Comparative capabilities of clinical assessment, diagnostic criteria, and polysomnography in detecting sleep bruxism. J Clin Sleep Med 2015; 11: 1319-1325.
35. Raphael KG, Janal MN, Sirois DA et al. Validity of self-reported sleep bruxism among myofascial temporomandibular disorder patients and controls. J Oral Rehabil 2015; 42: 751-758.
36. Ommerborn MA, Girak M, Schneider C et al. Diagnosis and quantification of sleep bruxism: New analysis method for the Bruxcore Bruxism. Cranio Mandib Func 2015; 7.
37. Inano S, Mizumori T, Kobayashi Y et al. Identification of sleep bruxism with an ambulatory wireless recording system. Int J Prosthodont 2013; 26: 527-535.
38. Manfredini D, Ahlberg J, Castroflorio T et al. Diagnostic accuracy of portable instrumental devices to measure sleep bruxism: a systematic literature review of polysomnographic studies. J Oral Rehabil 2014; 41: 836-842.
39. Miettinen T, Myllymaa K, Muraja-Murro A et al. Screen-printed ambulatory electrode set enables accurate diagnostics of sleep bruxism. J Sleep Res 2018; 27: 103-112.
40. Stuginski-Barbosa J, Porporatti AL, Costa YM et al. Diagnostic validity of the use of a portable single-channel electromyography device for sleep bruxism. Sleep Breath 2016; 20: 695-702.
41. Rompré PH, Daigle-Landry D, Guitard F et al. Identification of a sleep bruxism subgroup with a higher risk of pain. J Dent Res 2007; 86: 837-842.
42. Lavigne GJ, Rompré PH, Montplaisir JY. Sleep bruxism: validity of clinical research diagnostic criteria in a controlled polysomnographic study. J Dent Res 1996; 75: 546-552.
43. Jimenéz-Silva A, Peña-Durán C, Tobar-Reyes J et al. Sleep and awake bruxism in adults and its relationship with temporomandibular disorders: A systematic review from 2003 to 2014. Acta Odontol Scand 2016; 875: 36-58.
44. Manfredini D, Lobbezoo F. Relationship between bruxism and temporomandibular disorders: a systematic review of literature from 1998 to 2008. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2010; 109: e26-50.
45. Schiffman E, Ohrbach R, Truelove E et al. Diagnostic Criteria for Temporomandibular Disorders (DC/TMD) for Clinical and Research Applications: recommendations of the International RDC/TMD Consortium Network* and Orofacial Pain Special Interest Groupdagger. J Oral Facial Pain Headache 2014; 28: 6-27.
46. De Luca Canto G, Singh V, Bigal ME et al. Association between tension-type headache and migraine with sleep bruxism: a systematic review. Headache 2014; 54: 1460-1469.
47. Blanco Aguilera A, Gonzalez Lopez L, Blanco Aguilera E et al. Relationship between self-reported sleep bruxism and pain in patients with temporomandibular disorders. J Oral Rehabil 2014; 41: 564-572.
48. Cioffi I, Landino D, Donnarumma V et al. Frequency of daytime tooth clenching episodes in individuals affected by masticatory muscle pain and pain-free controls during standardized ability tasks. Clin Oral Investig 2017; 21: 1139-1148.
49. Sierwald I, John MT, Schierz O et al. Association of temporomandibular disorder pain with awake and sleep bruxism in adults. J Orofac Orthop 2015; 76: 305-317.
50. Manfredini D, Stellini E, Marchese-Ragona R et al. Are occlusal features associated with different temporomandibular disorder diagnoses in bruxers? Cranio 2014; 32: 283-288.
51. Panek H, Nawrot P, Mazan M et al. Coincidence and awareness of oral parafunctions in college students. Community dental health 2012; 29: 74-77.
52. Visscher CM, Lobbezoo F, Naeije M. Treatment of bruxism: physiotherapeutic approach. Ned Tijdschr Tandheelkd 2000; 107: 293-296.
53. Lobbezoo F, van der Zaag J, van Selms MK et al. Principles for the management of bruxism. J Oral Rehabil 2008; 35: 509-523.
54. De la Hoz JL. Sleep bruxism: review and update for the restorative dentist. Alpha Omegan 2013; 106: 23-28.
55. Guaita M, Hogl B. Current treatments of bruxism. Curr Treat Options Neurol 2016; 18.
56. Goldstein RE, Auclair Clark W. The clinical management of awake bruxism. J Am Dent Assoc 2017; 148: 387-391.
57. Treacy K. Awareness/relaxation training and transcutaneous electrical neural stimulation in the treatment of bruxism. J Oral Rehabil 1999; 26: 280-287.
58. Manfredini D, Ahlberg J, Winocur E et al. Management of sleep bruxism in adults: a qualitative systematic literature review. J Oral Rehabil 2015; 42: 862-874.
59. Jokubauskas L, Baltrusaityte A. Efficacy of biofeedback therapy on sleep bruxism: A systematic review and meta-analysis. J Oral Rehabil 2018; 45: 485-495.
60. Ispirgil EP, Erdogan SB, Akin A et al. The hemodynamic effects of occlusal splint therapy on the masseter muscle of patients with myofascial pain accompanied by bruxism. Cranio 2018; DOI: 10.1080/08869634.2018.1491929: 1-10.
61. Macedo CR, Silva AB, Machado MA et al. Occlusal splints for treating sleep bruxism (tooth grinding). Cochrane Database Syst Rev 2007; DOI: 10.1002/14651858.CD005514.pub2: 1-29.
62. Stapelmann H, Türp JC. The NTI-tss device for the therapy of bruxism, temporomandibular disorders, and headache - where do we stand? A qualitative systematic review of the literature. BMC Oral Health 2008; 8: 1-23.
63. Singh PK, Alvi HA, Singh BP et al. Evaluation of various treatment modalities in sleep bruxism. J Prosthet Dent 2015; 114: 426-431.
64. Jokubauskas L, Baltrusaityte A, Pileicikiene G. Oral appliances for managing sleep bruxism in adults: a systematic review from 2007 to 2017. J Oral Rehabil 2018; 45: 81-95.
65. Carra MC, Bruni O, Huynh N. Topical review: sleep bruxism, headaches, and sleep-disordered breathing in children and adolescents. J Orofac Pain 2012; 26: 267-276.
66. Huynh NT, Rompré PH, Montplaisir JY et al. Comparison of various treatments for sleep bruxism using determinants of number needed to treat and effect size. Int J Prosthodont 2006; 19: 435-441.
67. Giannasi LC, Santos IR, Alfaya TA et al. Effect of an occlusal splint on sleep bruxism in children in a pilot study with a short-term follow up. J Body Mov Ther 2013; 17: 418-422.
68. Hachmann A, Martins EA, Araujo FB et al. Efficacy of the nocturnal bite plate in the control of bruxism for 3 to 5 year old children. J Clin Pediatr Dent 1999; 24: 9-15.
69. Tsukiyama Y, Baba K, Clark GT. An evidence-based assessment of occlusal adjustment as a treatment for temporomandibular disorders. J Prosthet Dent 2001; 86: 57-66.
70. Manfredini D, Poggio CE. Prosthodontic planning in patients with temporomandibular disorders and/or bruxism: A systematic review. J Prosthet Dent 2017; 117: 606-613.
71. Bernhardt O, Imhoff B, Lange M et al. Bruxismus: Ätiologie, Diagnostik, Therapie. Dtsch Zahnärztl Z 2014; 69: 46-48.
72. Winocur E, Gavish A, Voikovitch M et al. Drugs and bruxism: a critical review. J Orofac Pain 2003; 17: 99-111.
73. Tan EK, Jankovic J. Treating severe bruxism with botulinum toxin. J Am Dent Assoc 2000; 131: 211-216.
74. Lee SJ, McCall WD, Kim YK et al. Effect of botulinum toxin injection on nocturnal bruxism: a randomized controlled trial. Am J Phys Med Rehabil 2010; 89: 16-23.
75. Macedo CR, Macedo EC, Torloni MR et al. Pharmacotherapy for sleep bruxism. Cochrane Database Syst Rev 2014; DOI: 10.1002/14651858.CD005578.pub2: 1-51.
76. Al-Wayli H. Treatment of chronic pain associated with nocturnal bruxism with botulinum toxin. A prospective and randomized clinical study. J Clin Exp Dent 2017; 9: e112-e117.
77. Ghanizadeh A, Zare S. A preliminary randomised double-blind placebo-controlled clinical trial of hydroxyzine for treating sleep bruxism in children. J Oral Rehabil 2013; 40: 413-417.
78. Ohmure H, Kanematsu-Hashimoto K, Nagayama K et al. Evaluation of a proton pump inhibitor for sleep bruxism: A randomized clinical trial. J Dent Res 2016; 95: 1479-1486.
79. De la Torre Canales G, Câmara-Souza MB, do Amaral CF et al. Is there enough evidence to use botulinum toxin injections for bruxism management? A systematic literature review. Clin Oral Investig 2017; 21: 727-734.
80. Long H, Liao Z, Wang Y et al. Efficacy of botulinum toxins on bruxism: an evidence-based review. Int Dent J 2012; 62: 1-5.
81. Persaud R, Garas G, Silva S et al. An evidence-based review of botulinum toxin (Botox) applications in non-cosmetic head and neck conditions. J R Soc Med Sh Rep 2013; 4: 1-9.
82. De Mello Sposito MM, Feres Teixeira SA. Botulinum Toxin A for bruxism; a systematic review. Acta Fisiatr 2014; 21: 201-204.
83. Cahlin BJ, Hedner J, Dahlstrom L. A randomised, open-label, crossover study of the dopamine agonist, pramipexole, in patients with sleep bruxism. J Sleep Res 2017; 26: 64-72.
84. Bader G, Lavigne G. Sleep bruxism; an overview of an oromandibular sleep movement disorder. Sleep Med Rev 2000; 4: 27-43.
85. De la Hoz-Aizpurua J-L, Díaz-Alonso E, LaTouche-Arbizu R et al. Sleep bruxism. Conceptual review and update. Med Oral Patol Oral Cir Bucal 2011; 16: e231-238.
86. Makino I, Arai YC, Aono S et al. The effects of exercise therapy for the improvement of jaw movement and psychological intervention to reduce parafunctional activities on chronic pain in the craniocervical region. Pain Pract 2014; 14: 413-418.
87. Restrepo CC, Alvarez E, Jaramillo C et al. Effects of psychological techniques on bruxism in children with primary teeth. J Oral Rehabil 2001; 28: 354-360.
88. Valiente Lopez M, van Selms MK, van der Zaag J et al. Do sleep hygiene measures and progressive muscle relaxation influence sleep bruxism? Report of a randomised controlled trial. J Oral Rehabil 2015; 42: 259-265.
89. Trindade M, Orestes-Cardoso S, de Siqueira TC. Interdisciplinary treatment of bruxism with an occlusal splint and cognitive behavioral therapy. Gen Dent 2015; 63: e1-4.
90. Amorim CSM, Espirito Santo AS, Sommer M et al. Effect of physical therapy in bruxism treatment: A systematic review. J Manipulative Physiol Ther 2018; 41: 389-404.
91. Frucht S, Jonas I, Kappert HF. Muscle relaxation by transcutaneous electric nerve stimulation (TENS) in bruxism. An electromyographic study. Fortschr Kieferorthop 1995; 56: 245-253.
92. Gomes CA, El Hage Y, Amaral AP et al. Effects of massage therapy and occlusal splint therapy on electromyographic activity and the intensity of signs and symptoms in individuals with temporomandibular disorder and sleep bruxism: a randomized clinical trial. Chiropr Man Therap 2014; 22.
93. Gomes CA, El-Hage Y, Amaral AP et al. Effects of massage therapy and occlusal splint usage on quality of life and pain in individuals with sleep bruxism: A randomized controlled trial. J Jpn Phys Ther Assoc 2015; 18: 1-6.
94. Gu W, Yang J, Zhang F et al. Efficacy of biofeedback therapy via a mini wireless device on sleep bruxism contrasted with occlusal splint: a pilot study. J Biomed Res 2015; 29: 160-168.
95. Watanabe A, Kanemura K, Tanabe N et al. Effect of electromyogram biofeedback on daytime clenching behavior in subjects with masticatory muscle pain. J Prosthodont Res 2011; 55: 75-81.