„Die Krankheit der Könige“ – interdisziplinäre Extraktionstherapie unter schwerer Hämophilie
Anamnestisch gab der Patient an, neben Hämophilie B an Hepatitis (A, B und C), arterieller Hypertonie und an Altersschwerhörigkeit zu leiden. Im Jahr 1994 war ein Prostatakarzinom behandelt worden.
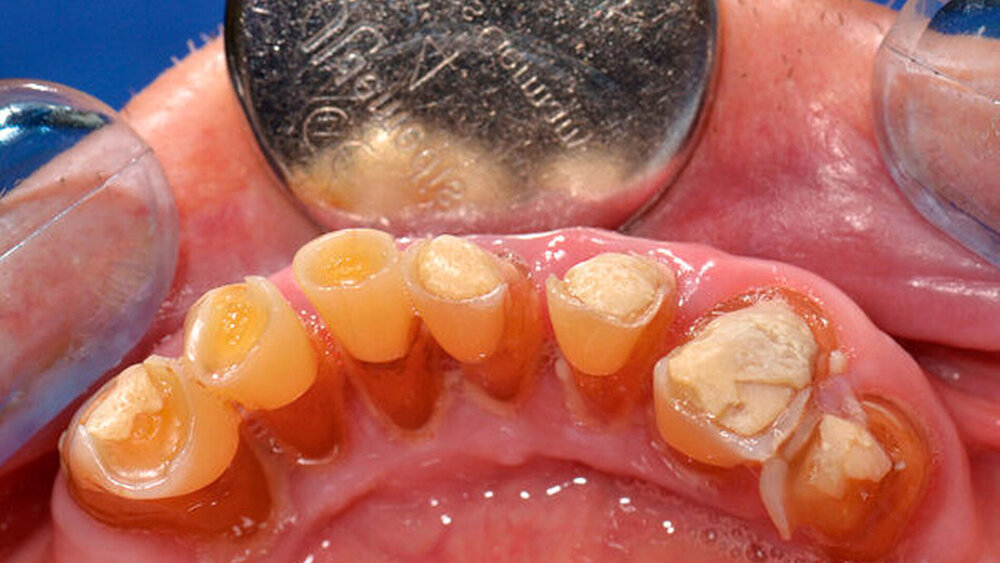
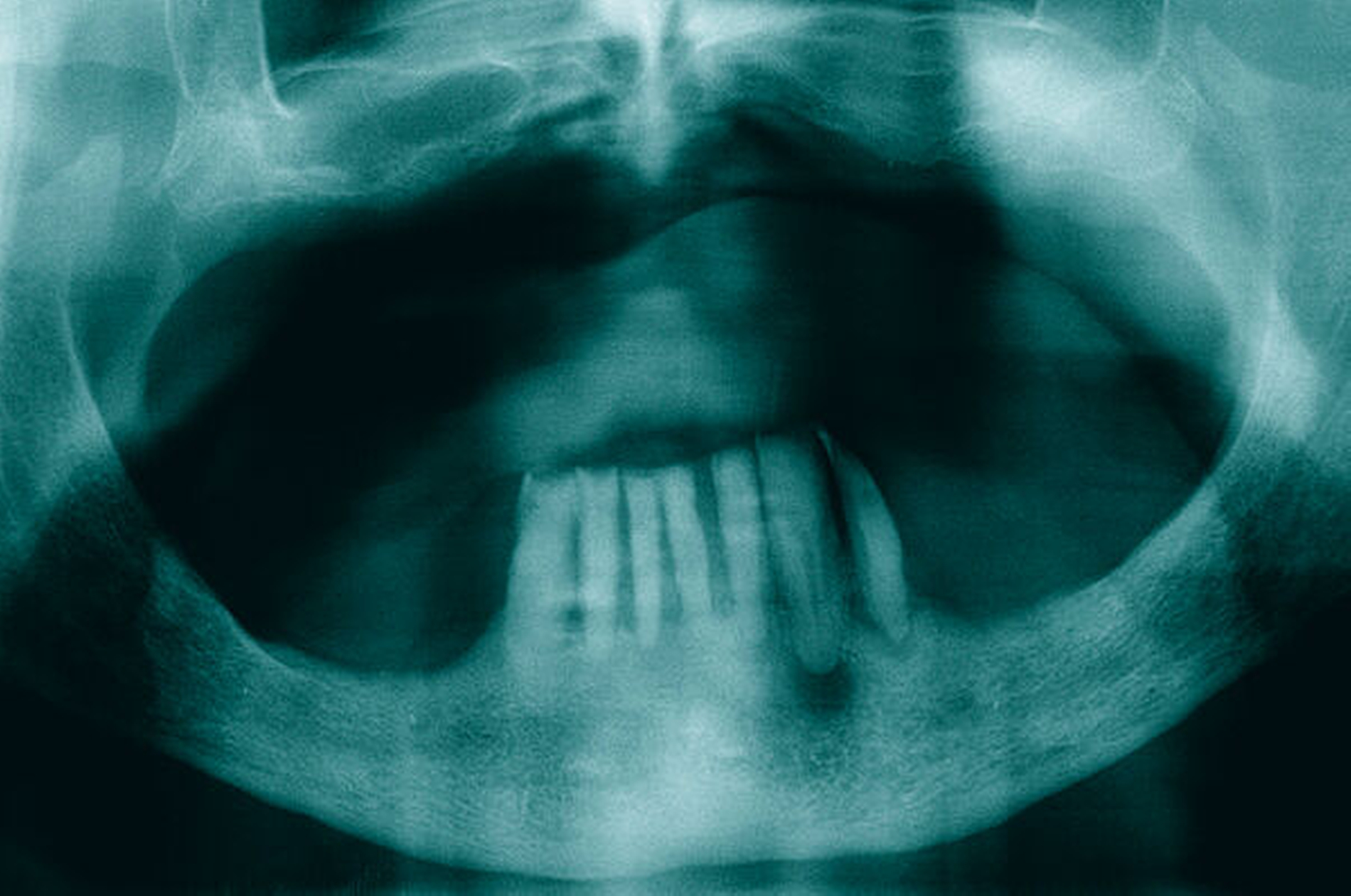
Die klinische und radiologische Untersuchung (Abbildungen 1 und 2) zeigte einen zahnlosen Oberkiefer sowie eine nicht erhaltungswürdige, stark parodontal geschädigte anteriore Restbezahnung im Unterkiefer. Aufgrund der bekannten schweren Hämophilie B (Faktor-IX-Aktivität < 1 Prozent) erfolgte die Vorstellung des Patienten in der betreuenden Gerinnungsambulanz in der Abteilung für Hämatologie, Onkologie und Palliativmedizin der Universität Rostock. In interdisziplinärer Absprache wurde unter Berücksichtigung des operativen Behandlungsbedarfs ein Faktorsubstitutionsplan für den Patienten erstellt (Tabelle). Aufgrund der Komplexität des Behandlungsprotokolls fand die weitere Therapie unter stationären Bedingungen statt.
Am Aufnahmetag wurde die erste Substitution mit 1800 I.E. humanem Blutgerinnungsfaktor IX (Berinin®, CSL Behring, Marburg) mit anschließender Faktor-IX-Aktivitätskontrolle (angestrebte Aktivität: 20 Prozent) zur Kontrolle des Therapieansprechens durchgeführt. Nach Rücksprache mit den Kollegen der Gerinnungsambulanz konnte die geplante Extraktion der Zähne 43, 42, 41, 31, 32, 33 und 34 am Folgetag unter erneuter vorheriger Substitution und Faktor-IX-Aktivitätskontrolle (Zielwert > 60 Prozent) sowie antibiotischer Abschirmung (i. v. 3 x 3 g Ampicillin/Sulbactam) durchgeführt werden.
Im ersten Schritt erfolgte die intraligamentäre Anästhesie der zu entfernenden Zähne mit 4-prozentigem Articain mit einem Adrenalinzusatz von 1:400.000 (Ubistesin®, 3M Espe, Seefeld). Anschließend fand die gewebeschonende Extraktion der Restbezahnung und die vollständige Entfernung des Granulationsgewebes statt. Die marginale Gingiva wurde zur besseren Adaptation der Schleimhaut dezent mobilisiert und nach Einlage von Tranexamsäure-getränkten Kollagenschwämmen (Hemocollagene®, Septodont, Niederkassel) erfolgte der Wundverschluss mittels resorbierbarem Nahtmaterial (Vicryl® 3.0, Ethicon, Hallbergmoos). Zur Kompression wurden zwei Aufbisstupfer für 30 Minuten eingelegt. Aufgrund der Zahnlosigkeit und der damit verbundenen erschwerten suffizienten Fixierung einer Verbandsplatte wurde auf diese verzichtet.
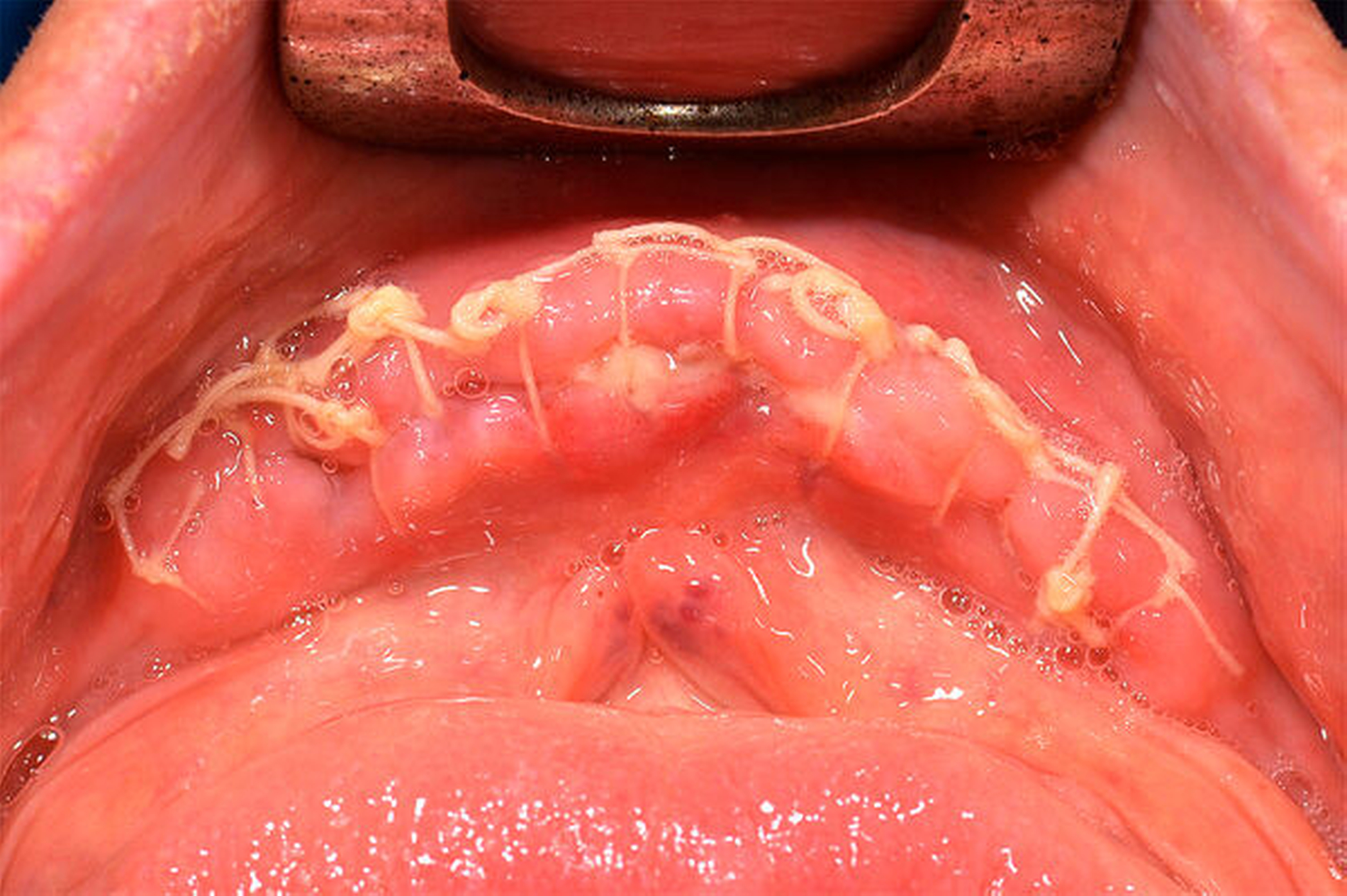
Postoperativ wurde das Substitutionsschema für acht Tage laut Plan fortgeführt. Neben der bedarfsgerechten Analgesie mit Paracetamol 3 x 3 g i. v./d (Perfalgan®, BMS, München) wurde die Antibiose prolongiert fortgesetzt. Hierunter zeigte sich der weitere stationäre Aufenthalt unauffällig, so dass der Patient bei zeitgerechtem Lokalbefund nach Beendigung der Substitution in die Häuslichkeit entlassen werden konnte (Abbildung 3). Über das postoperative Verhalten und die weitere ambulante Nachsorge wurde der Patient vor der Entlassung ausführlich unterrichtet.
Diskussion
Die wahrscheinlich früheste Erwähnung der Hämophilie findet sich im fünften Jahrhundert im Talmud, der von der rituellen Beschneidung eines Knaben erzählt, dessen zwei Brüder bei der Beschneidung gestorben seien. In der früheren Vergangenheit litten überdurchschnittlich viele Mitglieder des europäischen Hochadels und der Herrscherfamilien an Hämophilie, weshalb sie auch den Namen „Krankheit der Könige“ erhielt. Bekannte Beispiele sind die britische Königs- und die russische Zarenfamilie. Ausgangspunkt als Trägerin der Krankheit war hier vermutlich Queen Victoria von Großbritannien, deren Enkelin Alix von Hessen-Darmstadt den Zaren Nikolaus II. heiratete und die Krankheit auf ihren gemeinsamen Sohn Alexei, den letzten Zarewitsch, übertrug.
Hämophilie ist heutzutage die zweithäufigste vererbbare Blutgerinnungsstörung, von der weltweit mehr als 400.000 Menschen betroffen sind [Skinner, 2006]. Im Jahr 2017 waren laut jüngsten Berichten der World Federation of Hämophilia (WFH) in Deutschland circa 4.550 Patienten mit Hämophilie in Behandlung [WFH Report, 2018]. Dabei leiden 80 Prozent der Patienten an einem hereditären Faktor-VIII-Mangel (Hämophilie A) und 20 Prozent an einem Faktor-IX-Mangel [Franchon, 2005]. Da es sich um eine X-chromosomal-rezessiv vererbbare Erkrankung handelt, sind in der Regel Männer betroffen, während Frauen asymptomatische Träger sind.
Zwei Drittel aller betroffenen Patienten haben eine bekannte familiäre Vorgeschichte, bei allen anderen handelt es sich um spontane Neumutationen [Bolton-Maggs, 2003]. Durch diese Genmutationen kommt es zu einer geringeren Faktorsynthese in der Leber, in der Niere und im Endothelium. Als Plasmanormwert für den Faktor VIII gelten 200 ng/ml und 5.000 ng/ml für den Faktor IX [Liras, 2019]. Da der Faktor VIII sich aus zwei funktionellen Einheiten zusammensetzt, dem X-chromosomal kodierten antihämophilen Globin und dem auf Chromosom 12 kodierten von-Willebrand-Faktor, bestimmt letztendlich die Restfaktorenaktivität den Schweregrad der Hämophilie A [Depprich, 2011].
Abhängig vom laborchemisch nachweisbaren Defizit zum Referenzwert können drei Schweregrade unterschieden werden:
die milde Hämophilie bei einer Faktoraktivität zwischen 6 bis 40 Prozent,
die mittelschwere Hämophilie bei einer Faktoraktivität zwischen 1 bis 5 Prozent und
die schwere Hämophilie bei einer Faktoraktivität unter 1 Prozent [White, 2001].
Infolge der gestörten plasmatischen Homöostase besteht für dentoalveoläre chirurgische Eingriffe ein erhöhtes intra- und postoperatives Blutungsrisiko [Harrington, 2000]. Deshalb ist eine enge interdisziplinäre Zusammenarbeit zwischen behandelndem Zahnarzt und betreuendem Hämatologen zwingend erforderlich. Eine perioperative Faktorsubstitution wird in der Literatur vielfach empfohlen [Hermans, 2009; Stubbs, 2001]. Als bewährter Goldstandard hierfür gilt die Infusion von plasmatisch oder rekombinant hergestellten Faktorpräparaten. Aufgrund der kurzen Halbwertszeit von Faktor VIII (8–12 Stunden) und Faktor XI (18–24 Stunden) sind häufige, gewichtsabhängige Dosierungen erforderlich. Diese sind individuell nach Blutungsrisiko, Blutungstyp und pharmakokinetischem Profil des Patienten anzupassen und bedürfen daher engmaschiger Kontrollen.
Während die Verwendung von rekombinant hergestellten Faktorpräparaten das Risiko einer Virusübertragung im Wesentlichen reduziert, entwickeln weiterhin 8 bis 20 Prozent aller Hämophilie-A- und 2,5 bis 20 Prozent aller Hämophilie-B-Patienten als Antwort auf vorausgegangene Faktorgaben Antikörper [Sultan, 1992]. Dies erschwert die Therapie ungemein, da dann im Vorfeld beispielsweise eine Immunmodulation mittels Immunsuppressiva durchgeführt werden muss [Bolton-Maggs, 2003]. Alternativ kann bei milden bis mittelschweren Fällen der Hämophilie A Desmopressin als synthetisches Vasopressinderivat eingesetzt werden. [Mannucci, 1997; Franchini, 2010] Bei gutem Ansprechen kann dieses die Plasmalevel des von-Willebrand-Faktors und des Faktors VIII präoperativ auf das Drei- bis Sechsfache erhöhen [Castaman, 2008]. Da die Wirkung von Patient zu Patient stark variiert, sollte vor einer chirurgischen Intervention ein entsprechender Test erfolgen.
In Hinblick auf die Auswahl des Anästhesieverfahrens sollte eine Intubationsnarkose – soweit möglich – vermieden werden, da durch die Intubation ein Kehlkopfhämatom entstehen kann [Frachon, 2005]. Theoretisch besteht auch bei Techniken wie der Leitungsanästhesie des Nervus alveolaris inferior / Nervus lingualis die Gefahr der Entstehung eines parapharyngealen Hämatoms durch die Verletzung größerer Gefäße. Alternativ besteht je nach operativem Behandlungsumfang die Möglichkeit der intraligamentären Anästhesie, wobei bei sachgemäßer Durchführung keine solche Blutung auftreten kann [Shabazfar, 2014; Kämmerer, 2015]. Im Rahmen der zahnärztlich-chirurgischen Intervention ist ein möglichst atraumatisches Vorgehen zur Verringerung des Gewebetraumas sowie eine vollständige Kürettage des Granulationsgewebes notwendig.
Fazit für die Praxis
Die oralchirurgische Behandlung von Patienten mit bekannter Hämophilie bedarf einer gezielten interdisziplinären Absprache zwischen Zahnarzt und dem behandelnden Hämatologen.
Nur so ist die Voraussetzung für eine effiziente Behandlungsstrategie und eine offene Kommunikation gegenüber den Patienten gegeben.
Eine Kombination aus Faktorsubstitution oder gegebenenfalls Desmopressingabe und suffizienten lokalen hämostyptischen Maßnahmen kann schwere Nachblutungen verhindern.
Je nach Behandlungsumfang und Blutungsrisiko ist eine Behandlung unter stationären Bedingungen notwendig.
Zur weiteren Wundversorgung werden in der Literatur unterschiedlichste hämostyptische Maßnahmen wie Oxycellulose [Rayen, 2011], Kollageneinlagen [Bajkin, 2009], Gelantineschwämme [Kim, 2006] und Cyanoacrylate [Al-Belasy, 2003] beschrieben. Ein Vor- oder Nachteil einzelner Maßnahmen konnte in Studien nicht gezeigt werden [Peisker, 2014]. Die darauffolgende Naht dient zur Fixierung des eingelegten Materials, dabei sollte auf eine umfangreiche Lappenoperation verzichtet werden, um das Blutungsrisiko zu minimieren [Frachon, 2005]. Um eine späte Nachblutung zu vermeiden, wird in vielen Studien resorbierbares Nahtmaterial verwendet [Peisker, 2014; Frachon, 2005]. Die nachgehende einfache physikalische Kompression durch Aufbisstupfer oder gegebenenfalls durch präoperativ angefertigte Verbandsplatten erweist sich zudem als hoch effizient. Dabei empfiehlt es sich, zusätzlich antifibrinolytische Lösungen wie Tranexamsäure aufzubringen, um eine Auflösung des Blutkoagulums in der Alveole zu verhindern. Tranexamsäure hemmt dabei die Bindung von Plasminogen an Fibrin und verhindert so die Aktivierung von Plasmin. Zudem wird eine alleinige beziehungsweise ergänzende systemische Anwendung von Tranexamsäure in der aktuellen Literatur diskutiert [Lewandowski, 2018; Peisker, 2014] und einige Studien belegen ein geringeres Nachblutungsrisiko sowie einen geringeren Bedarf an Faktorkonzentraten [Manucci, 1998; Sindet-Pedersen, 1986].
Bei angefertigten Verbandsplatten empfiehlt es sich, diese leicht hohl zu legen, um eine Unterfütterung mit elastischen Materialien zur besseren Anpassung zu ermöglichen. Postoperativ wird eine Tragedauer von vier bis sieben Tagen angeraten [Lockhart und Gibson, 2003]. Kritisch zu betrachten sind bei der Eingliederung einer Verbandsplatte das eingeschränkte subjektive Wohlbefinden des Patienten, mögliche Schmerzen durch Schleimhautirritationen, der durch eine geringe Schienenmobilität entstehende Pumpeffekt, die vermehrte Speichelanregung und bakterielle Besiedlung und die damit erhöhte fibrinolytische Aktivität des Speichels beziehungsweise durch Sprektokinasen [Franchon, 2005].
Die Fortführung der Faktorsubstitution erfolgt in Absprache mit den behandelnden Hämatologen in der Regel bis zur vollständigen Epithelisierung der Wundalveole; während dieses Zeitraums sollten engmaschige Nachkontrollen erfolgen, da die Praxis eine eingeschränkte Wundheilung und ein höheres Infektionsrisiko zeigt.
Julia Weller
Weiterbildungsassistentin Oralchirurgie
Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtischirurgie, Universitätsmedizin Rostock
Schillingallee 35, 18057 Rostock
Dr. Ingo Buttchereit
Fachzahnarzt Oralchirurgie
Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtischirurgie, Universitätsmedizin Rostock
Schillingallee 35
18057 Rostock
ingo.buttchereit@med.uni-rostock.de
PD Dr. Dr. Peer W.Kämmerer, MA, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Literaturliste
Skinner MW. Treatment for all: a vision for the future. Haemophilia. 2006; 12: 169-173
World Federation of Hämophilia 2018: Report on the Annual Global Survey 2017. Montreal, Kanada
Franchon X. Management options for dental extraction in hemophiliacs: A study of 55 extractions (2000-2002), 2005 Rennes, Frankreich
Bolton-Maggs PH. Pasi KJ. Haemophilias A and B. Laancet. 2003; 361: 1801-1809
Liras A. Dental management of patients with haemophilia in the era of recombinant treatments: increased efficacy and decreased clinical risk; 2019, Madrid, Spanien
Depprich R. Nachblutungen - Chirurgische Problemfälle vermeiden, 2011, ZPW online
White et al. Factor VII and Factor IX Subcommittee. Definitions in hemophilia. Recommendation oft he scientific subcommittee on factor VIII ab factor IX oft he scientific and standardization committee oft he International Society of Thrombosis and Haemostasis. Thromb Haemost. 2001;85:560
Harrington B. Primary dental care of patients with haemophilia. Haemophilia 2000
Hermans et al. European Haemophilia Therapy Standardisation Board. Replacement therapy for invasive procedures in patients with haemophilia: literatur review, European survey and recommentaions. Haemophilia. 2009;15:639-58
Stubbs M, Lloyd J. A protocol fort he dental management of von Willebrand’s disease, Haemophilia A and Haemophilia B. Aust Dent j. 2001;46:37-40
Sultan Y. Prevalence of inhibitors in a population of 3435 hemophilia patients in Frnace, Thromb Haemost. 1998;79;762-6
Mannucci PM. Desmopressin (DDAVP) in the treatment of bleeding disorders: the first 20 years. Blood 1997;90:2515-21
Franchini M. et al. The use of desmopressin in mild hemophilia A. Blood Coagul Fibrinolysis. 2010;21:615-9
Castaman G. Desmopressin fort he treatmenr of haemophilia. Haemophilia. 2008; 14 Suppl 1:15-20
Shabazfar N. et al. Periodontal intraligament injection aas alternative to inferior alveolar nerve block-meta analysis oft he literature from 1979 to 2012. Clin Oral Investig, 2014. 18(2): p.351-358
Kämmerer P.W. wt al., Clinical effucacy of a computerised device (STA) and a pressure syringe (VarioJect INTRA) for intraligamentary anaesthesia. Eur J Dent Educ, 2015, 19(1):p. 16-22
Rayen et al. Dental management of hemophiliac child under general anesthesia. J Indian Soc Pedod Prev Dent. 2011; 29:74-9
Bajkin et al. Randomized, prospective trial comparing bridging therapy using low-molecular-weight heparin with maintenancce of oral anticoagulation during extraction of teeth. J Oral Maxillofac Surg, 2009
Kim JC Minor complications after mandibular third molar surgery: type, incidence, and possible prevention. Oral Surg 2006,102:4-11
AL-Belasy FA, Hemostatic effect of n-butyl-2-cyanoacrylate (histoacryl) glue in wardfarin-treatec patients undergoing oral surgery. J Oral Maxillofac Surg. 2003;61:1405-9
Peisker et al. Management of dental extraction in patients with Haemophilia A and B: A report of 58 extractions, Med Oral Pato Oral Cir Bucal. 2014
Lewandowski et al., Dental extractions in patients with mild hemophilia A and hemophilia B and von Willebrand disease without clotting factor supllementation, Polish Archives of Internal Medicine, 2018; 128 (7-8)
Mannucci et al., Treatment of von Willebrand's disease, J Intern Med Suppl. 1997;740:129-32
Sindet-Pedersen S., Prevention and treatment of oral bleedings Haemophilia 1998;4:302
Lockhart, Gibson, Dental management considerations for the patient with an acquired coagulopathy. Part 1: Coagulopathies from systemic disease. Br Dent J. 2003 Oct 25;195(8)