Pharmakologische Interaktionen von Nahrungsmitteln und Phytotherapeutika
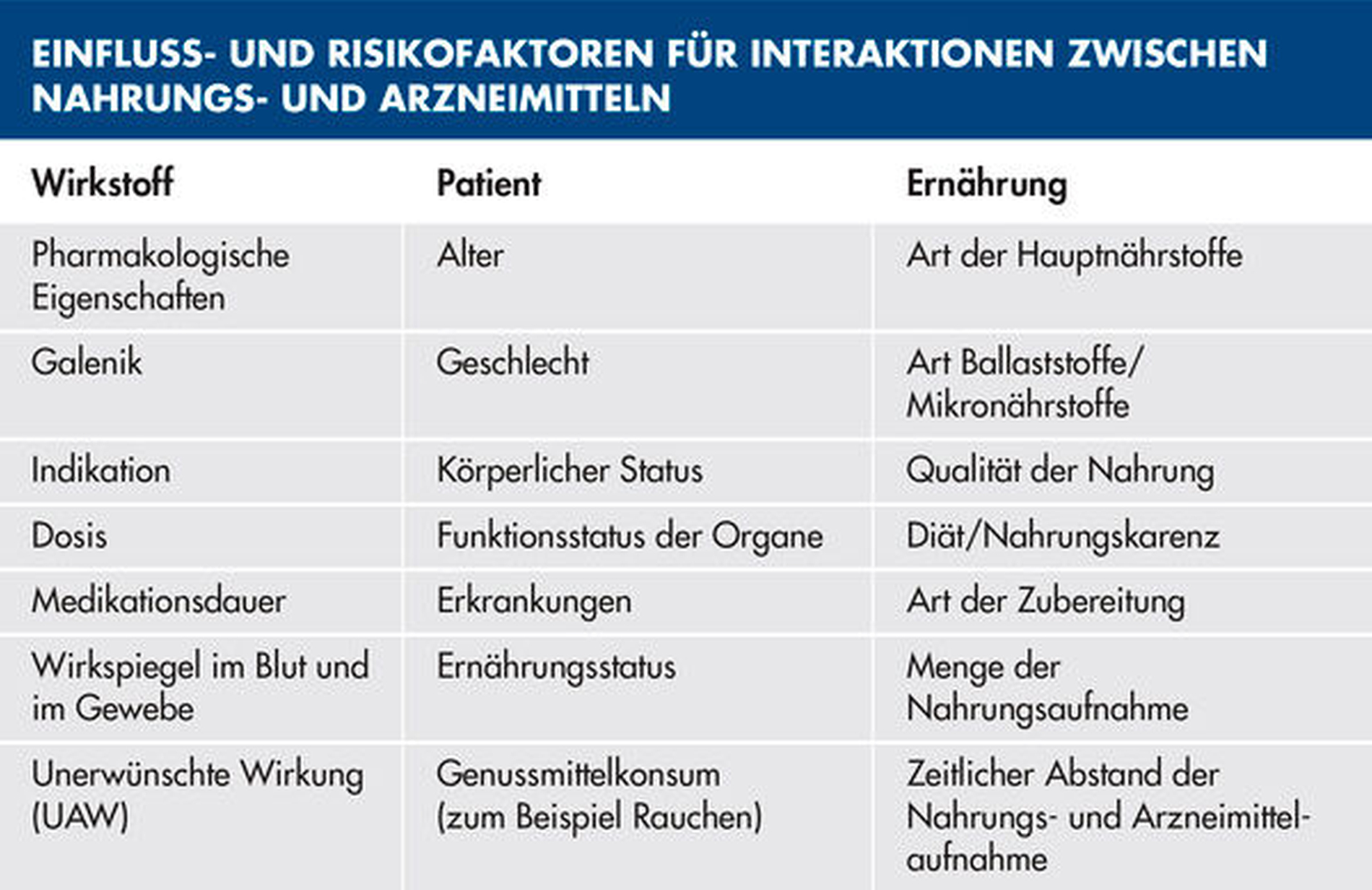
Wechselwirkungen zwischen Arzneimitteln und der Nahrung sind erheblich komplexer als die bekannten Interaktionen zwischen verschiedenen Medikamenten [Smollich und Podlogar, 2016]. Damit ist es sehr schwierig, klinisch relevante Einflüsse vorauszusagen [Gaschott und Stein, 2003]. Die Einflussfaktoren beziehen sich bei den Wechselwirkungen zwischen Nahrungs- und Arzneimitteln sowohl auf den Wirkstoff als auch auf den Patienten und die Ernährung (Tabelle 1). Die Bandbreite der möglichen Interaktionen mit Nahrungsmitteln reicht von leichten Resorptionsverzögerungen über Wirkungsverlust bis zum Auftreten von schweren Nebenwirkungen.
Während Wechselwirkungen zwischen Arzneimitteln relativ gut dokumentiert sind, gilt dies für Interaktionen zwischen Medikamenten und Nahrungsmitteln nur sehr eingeschränkt [Wisker, 2010]. Zudem werden potenzielle Wechselwirkungen zumeist nur bei gesunden jungen Patienten untersucht, obwohl aufgrund einer steigenden Polypharmazie gerade ältere Patienten einem deutlich erhöhten Risiko ausgesetzt sind. Immerhin leiden in Deutschland fast zwei Drittel der Menschen über 60 Jahren an mindestens einer chronischen Vorerkrankung [Schröder, 2020], 45 Prozent der Männer und 56 Prozent der Frauen über 65 Jahren haben Gesundheitsprobleme in drei und mehr Krankheitsbereichen [Moßhammer, 2016].
Pharmakokinetische Interaktionen
Diese Wechselwirkungen betreffen die Freisetzung, Resorption, Verteilung, Metabolisierung (Biotransformation) und die Elimination von Wirkstoffen. Die Zusammensetzung der Nahrung und auch der Zeitpunkt der Nahrungsaufnahme beeinflussen vor allem die Freisetzung und Resorption, zum Teil auch die Metabolisierung von Arzneistoffen. Das geschieht insbesondere durch folgende Effekte:
Verzögerung der Magenentleerung
Erhöhung des pH-Wertes des Magensafts
Komplexbildung und Adsorptionseffekte
Beeinflussung von Transportproteinen
vermehrte Gallesekretion
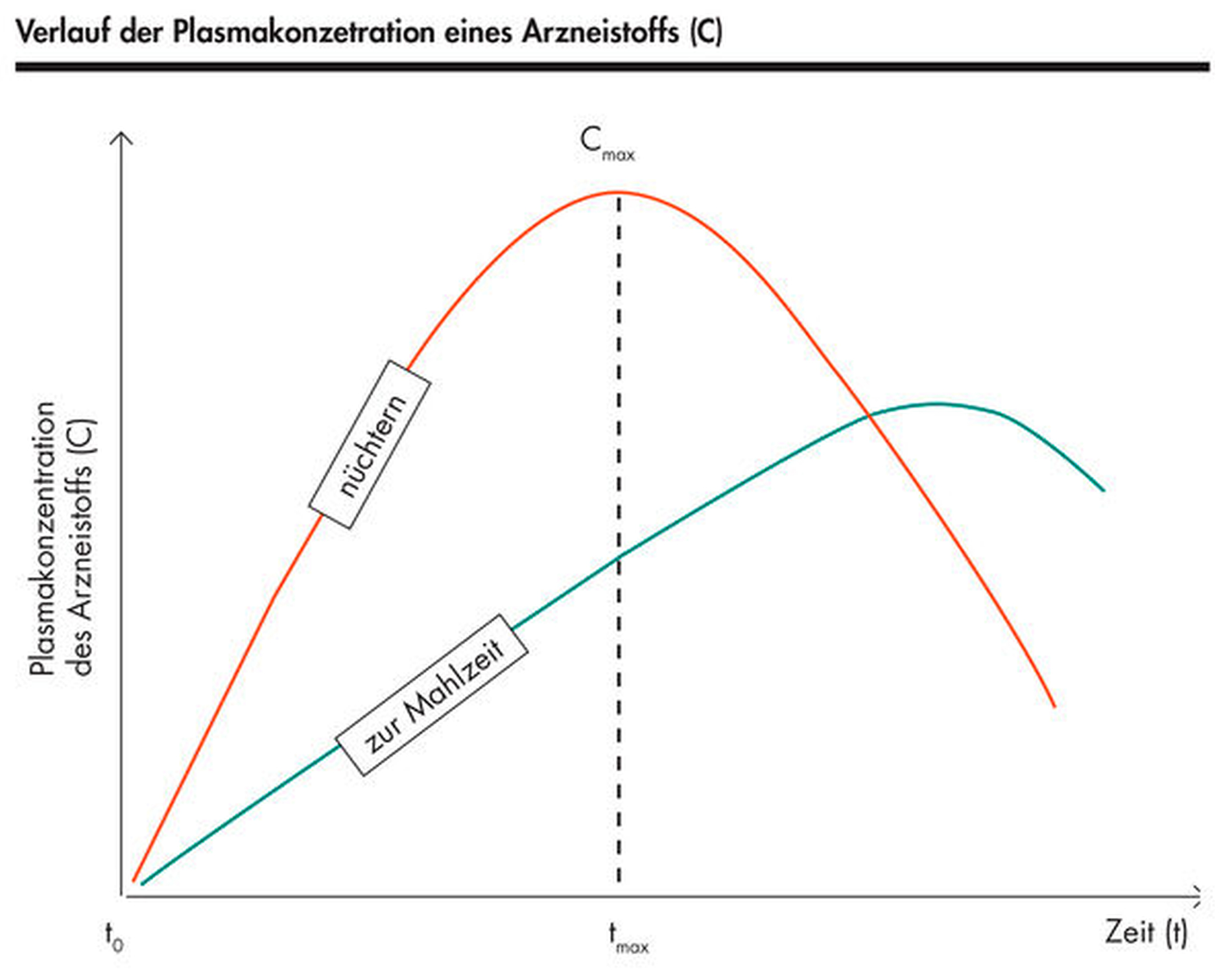
Den größten Einfluss auf die Resorption hat die verzögerte Magenentleerung aufgrund der verringerten Magenmotilität bei Nahrungsaufnahme [Frömming, 1981]. Im Vergleich zur Nüchterneinnahme kann es durch den „negativen Food-Effekt“ bei der Einnahme eines Arzneimittels zu einer Mahlzeit aufgrund der dann verlangsamten Magenentleerung auch zu einer Verlangsamung der Wirkstoffanflutung und zu einer Abflachung der Plasmaspiegelkurve kommen [Smollich und Podlogar, 2016] (Abbildung 1). Diese Effekte treten bei fettreicher, heißer sowie grober Nahrung besonders stark auf [Frömming, 1981; Gaschott und Stein, 2003].
In einer Studie von Divoll et al. wurde für das Schmerzmittel Paracetamol (Acetaminophen) belegt, dass die maximale Plasmakonzentration bei Nüchterneinnahme signifikant höher ausfiel und schneller erreicht wurde als nach dem Frühstück [Divoll et al., 1982]. Dieser Effekt trat altersunabhängig auf.
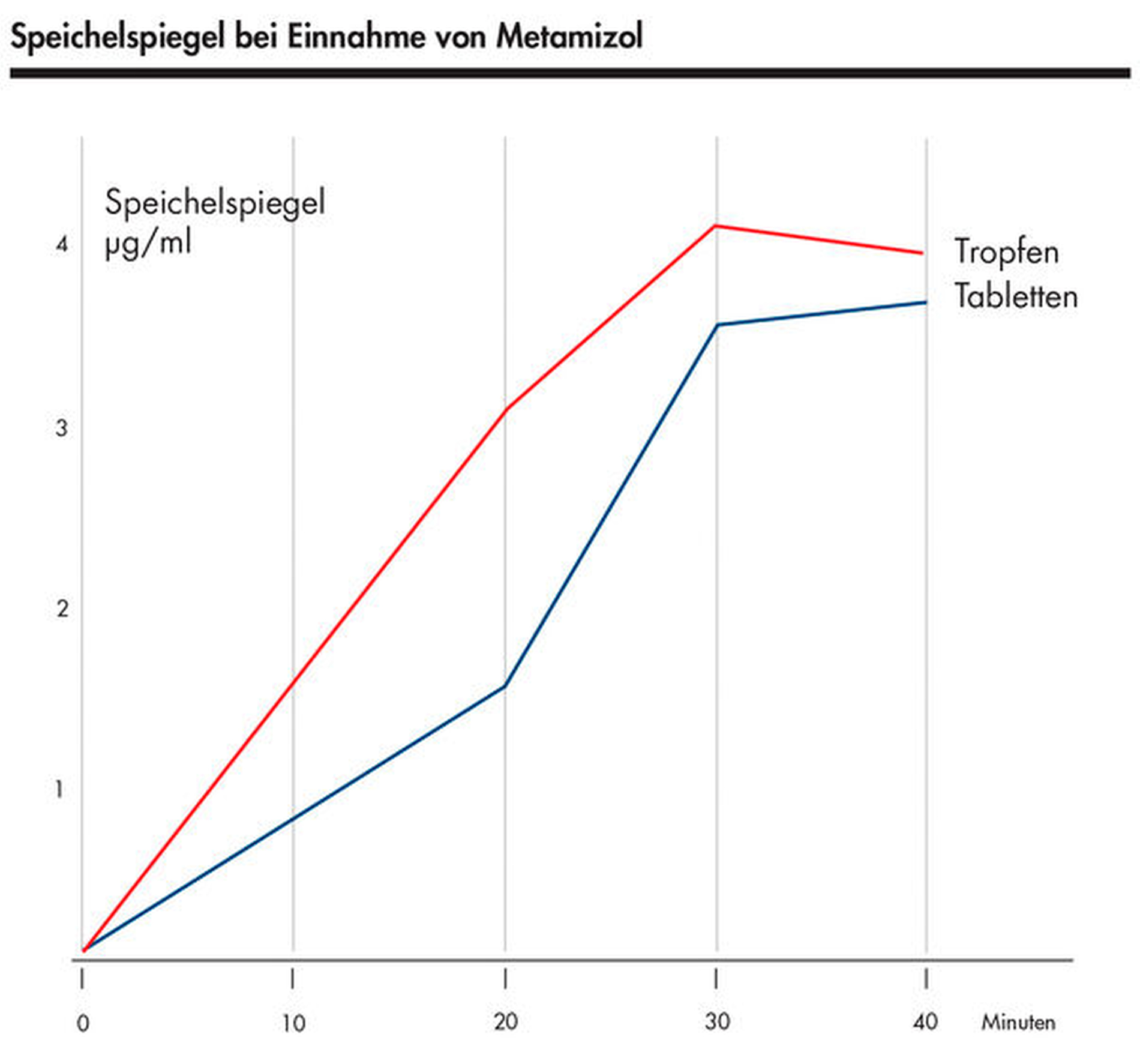
Zwar führt die Einnahme von sauren Analgetika (zum Beispiel Ibuprofen, Acetylsalicylsäure) auf nüchternen Magen ebenfalls zu einer schnelleren Absorption und einem beschleunigten Wirkungseintritt, allerdings besteht bei diesen Wirkstoffen dann ein erhöhtes Risiko für gastrointestinale Schleimhautreizungen und sogar Blutungen [Verspohl, 2002; Wisker, 2010]. Bei vollem Magen empfehlen sich Tropfen, Säfte oder Brausetabletten, denn sie gelangen am Mageninhalt vorbei zum Pylorus und in den resorptionsaktiven Dünndarm [Verspohl, 2002; Freitag-Ziegler, 2015]. Die zumeist bessere Resorption von Tropfen gegenüber Tabletten zeigt sich deutlich bei Metamizol. In einer klinischen Studie war der Speichelspiegel nach oraler Gabe von 1 g Metamizol (als Tropfen beziehungsweise Tabletten) 20 Minuten nach der Einnahme bei den Tropfen doppelt so hoch wie bei den Tabletten [Rohdewald, 1983] (Abbildung 2).
Für die meisten Antibiotika kann die Einnahme etwa eine Stunde vor dem Essen mit ausreichend Flüssigkeit empfohlen werden. So ergeben sich für die säurelabilen Arzneistoffe kürzere Kontaktzeiten mit dem Magensaft sowie geringere Verweilzeiten im Darm, so dass Durchfälle als Zeichen einer Beeinträchtigung der Darmflora seltener auftreten. Außerdem entstehen hohe Blutspiegelspitzen, bei denen auch weniger sensible Erreger geschädigt werden, die eine höhere minimale Hemmkonzentration aufweisen [Verspohl, 2002]. Die Hersteller empfehlen trotzdem bei Amoxicillin die Einnahme zur Mahlzeit. Bei dieser Überlegung hat die Vermeidung von Nebenwirkungen (Übelkeit, Erbrechen) Vorrang vor der möglichen Verringerung der Bioverfügbarkeit [Verspohl, 2002]. Eine Übersicht der Einnahmehinweise der für die Zahnmedizin relevanten Pharmaka ist in Tabelle 2 dargestellt.
Feste orale Darreichungsformen (zum Beispiel Tabletten, Kapseln) sollen laut Gebrauchsinformation fast immer mit circa 150 bis 200 ml Flüssigkeit, am besten Leistungswasser, mit möglichst aufrechtem Oberkörper eingenommen werden [N. N., 1997]. Allerdings kommt es nicht selten vor, dass Patienten aus Bequemlichkeit oder Unwissenheit diese Arzneiformen nicht mit einer ausreichenden Flüssigkeitsmenge einnehmen. Nach Schätzungen soll dieses Problem bei etwa 20 Prozent der oralen Medikamenteneinnahmen auftreten [Washington, 2001]. Eine zu geringe Flüssigkeitszufuhr bei der Einnahme kann gerade bei nichtsteroidalen Antirheumatika wie Ibuprofen, aber auch bei Tetracyclinen, Penicillinen und Bisphosphonaten zu ernsthaften Ulzerationen der Ösophagusschleimhaut führen und den Wirkungseintritt verzögern [Jaspersen, 2000; Smollich und Podlogar, 2016].
Größere Flüssigkeitsmengen stimulieren nicht nur die Magenentleerung, sie führen zu einer besseren Löslichkeit vieler Pharmaka und beschleunigen die Arzneistoffresorption bei der Einnahme auf nüchternen Magen [Verspohl, 2002]. In einer klinischen Studie wurde die mittlere Serumkonzentration von Amoxicillin bei nüchternen Probanden nach Einnahme von Amoxicillin-Kapseln mit 25 ml und mit 250 ml Wasser im Zeitverlauf gemessen [Welling, 1977]. Es konnte gezeigt werden, dass die Serumkonzentrationen von Amoxicillin mit der höheren Wassermenge zu jedem Messzeitpunkt signifikant über denjenigen mit geringerer Wassermenge lagen. Dies führt letztlich zu einem schnelleren Wirkungseintritt und zu einer höheren antibakteriellen Wirksamkeit.
Generell ist Wasser als indifferente Einnahmeflüssigkeit unproblematisch. Keinesfalls sollten säureinstabile Antibiotika wie Ampicillin oder Erythromycin mit Fruchtsäften eingenommen werden [N. N., 1997].
Eine weitere Ursache für eine verminderte Resorption ist die Bildung schwer resorbierbarer Komplexe aus Kalziumionen (zum Beispiel in Milch und Milchprodukten, in mit Kalzium angereicherten Fruchtsäften und einigen Kalzium-reichen Mineralwässern) mit Gyrasehemmern (zum Beispiel Ciprofloxacin) oder Tetracyclinen (Doxycyclin, Minocyclin) [Verspohl, 2002]. In der Folge verschlechtert sich die Bioverfügbarkeit und damit die antimikrobielle Wirksamkeit, bei Ciprofloxacin um circa 30 Prozent [Neuvonen, 1991]. Deshalb sollten diese Antibiotika nicht mit Mineral-, sondern stets mit Leitungswasser eingenommen werden und der zeitliche Abstand zu Kalzium-reichen Nahrungsmitteln sollte mindestens zwei Stunden betragen [Harder, 1997].
Pharmakodynamische Interaktionen
Pharmakodynamische Wechselwirkungen sind durch eine Änderung von Wirkung oder Nebenwirkung gekennzeichnet, ohne jedoch zu einer wesentlichen Änderung der Plasmaspiegel zu führen. Sie können auftreten, wenn sich Arzneistoffe und Nahrungsbestandteile durch Wechselwirkungen an einem Rezeptor, an einem Erfolgsorgan oder in physiologischen Regelkreisen in ihrer Wirkung verstärken oder abschwächen. Sie treten bei Nahrungsmitteln eher selten auf, sind aber für die Zahnmedizin teilweise äußerst relevant (zum Beispiel im Hinblick auf pflanzliche Arzneimittel und Antikoagulantien).
In diesem Zusammenhang sind besonders Vitamin-K-haltige Nahrungsmittel wie Blattsalat, Spinat, Brokkoli und verschiedene Kohlsorten zu nennen. Sie können die Wirkung der sogenannten Vitamin-K-Antagonisten (Phenprocoumon – Marcumar®, Warfarin – Coumadin®) massiv beeinflussen. Vitamin K ist daran beteiligt, die Gerinnungsfaktoren II, VII, IX, X in ihre gerinnungswirksamen Formen zu überführen. Vitamin-K-Antagonisten hemmen die Vitamin-K-abhängige Carboxylierung von Vorstufen der Gerinnungsfaktoren. Somit kann bei einem reduzierten Verzehr von Vitamin-K-haltigen Nahrungsmitteln (zum Beispiel durch Änderung der Ernährungsgewohnheiten) die blutgerinnungshemmende Wirkung der Vitamin-K-Antagonisten erhöht werden. Eine verstärkte Antikoagulation mit erhöhtem Blutungsrisiko ist möglich.
Alkohol (Ethanol) kann die Pharmakokinetik und -dynamik verschiedenster Arzneistoffe nachhaltig beeinflussen. Da von den betroffenen Patienten in der Anamnese häufig Art und Umfang des regelmäßigen Alkoholkonsums nicht korrekt angegeben werden, können entsprechende Interaktionen zu Therapiebeginn nicht antizipiert werden [Smollich und Podlogar, 2016]. Eine patientenorientierte Kommunikation ist hier für den Zahnarzt von entscheidender Bedeutung.
Auf pharmakokinetischer Ebene ist besonders die verstärkte Hepatotoxizität von Paracetamol zu nennen, da bei Leberfunktionsstörungen durch chronischen Alkoholkonsum ein hepatotoxischer Metabolit des Paracetamols verstärkt gebildet und verlangsamt abgebaut wird [Smollich und Podlogar, 2016]. Pharmakodynamisch ist die klinisch relevante Interaktion des Alkohols mit sedierenden Wirkstoffen zu nennen. In der Zahnmedizin bezieht sich die additive Verstärkung der Sedierung überwiegend auf das Codein, das in einigen beliebten Analgetikakombinationen (zum Beispiel Dolomo®, Paracetamol comp.®) enthalten ist. Bei der Kombination von Alkohol mit nichtsteroidalen Antirheumatika (NSAR, zum Beispiel Ibuprofen) ist besondere Vorsicht geboten, da sich das Risiko gastrointestinaler Blutungen drastisch erhöhen kann [Kaufman, 1999]. Bei einer gleichzeitigen Antikoagulantientherapie ist mit schwer vorhersehbaren Wechselwirkungen zu rechnen [Smollich und Podlogar, 2016].
Phythotherapeutika und Nahrungsergänzungsmittel
Nahrungsergänzungsmittel gehören zu den Lebensmitteln. Sie sind dazu bestimmt, die normale Ernährung zu ergänzen, um beispielsweise eine optimale Versorgung sicherzustellen und einen Mangelzustand zu vermeiden. Typische Bestandteile der Produkte sind Vitamine, Mineralstoffe, Aminosäuren, Fettsäuren, pflanzliche Extrakte und Probiotika. Nahrungsergänzungsmittel sind keine Arzneimittel, in der Praxis existieren aber verschiedene Berührungspunkte. Lebensmittelproduzenten sind jedoch nicht verpflichtet, über Gegenanzeigen, Neben- und Wechselwirkungen mit Arzneimitteln zu informieren. Freiwillige Hinweise sind allerdings möglich und sollten von den Herstellern nach Möglichkeit auch genutzt werden.
Aus zahnärztlicher Sicht sind besonders diejenigen Nahrungsergänzungsmittel und Phythotherapeutika interessant, die unmittelbaren Einfluss auf unsere Behandlungsplanung nehmen. An erster Stelle sind hier die auf die Blutgerinnung wirkenden pflanzlichen Arzneimittel zu nennen. In einer 2015 publizierten Umfrage berichteten fast 35 Prozent der erwachsenen Amerikaner, dass sie regelmäßig pflanzliche Nahrungsergänzungsmittel nehmen [Rashrash, 2017]. Allerdings blieben diese Mittel in mehr als 70 Prozent der Fälle bei der Erhebung der Anamnese zunächst unentdeckt [Kaye, 2000]. So wissen mehr als 70 Prozent der Patienten, die pflanzliche Nahrungsergänzungsmittel einnehmen, nichts über mögliche Nebenwirkungen und informieren die Behandler nicht über die Einnahme [Kaye, 2000].
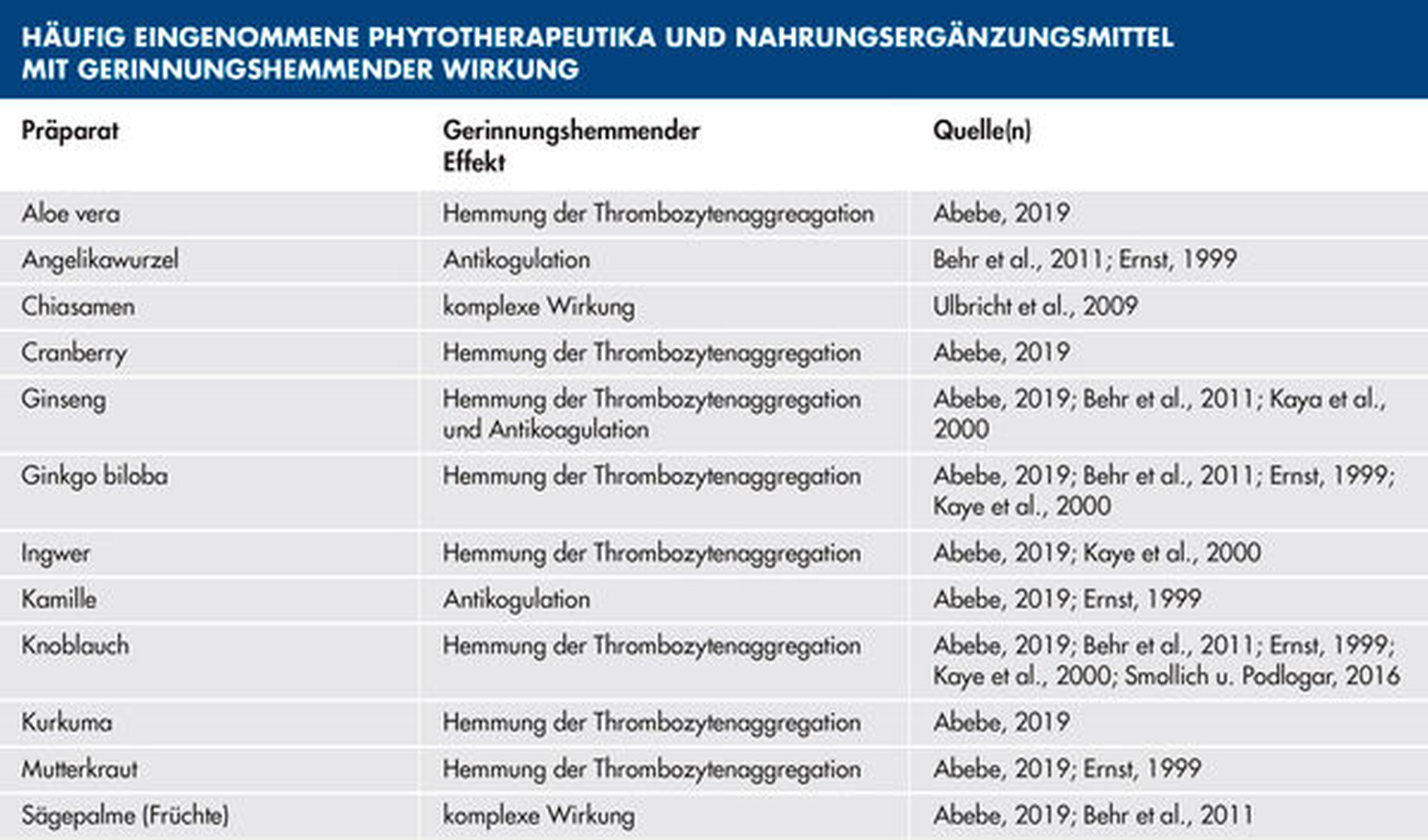
In einem aktuellen Review zur Bedeutung der pflanzlichen Arzneien für die Zahnmedizin wurden die Phytotherapeutika entsprechend ihrer Hauptwirkung auf die Blutgerinnung in vier Gruppen eingeteilt [Abebe, 2019] (Tabelle 3):
1. Hemmung der Thrombozytenaggregation
2. Antikoagulation
3. Hemmung der Thrombozytenaggregation und Antikoagulation
4. komplexe Wirkung
Generell ist die Datenlage wissenschaftlicher Untersuchungen bei pflanzlichen Arzneien (Phytotherapeutika) im Vergleich zu chemischen rezeptpflichtigen Präparaten unzureichend [Behr, 2011]. Die Literatur zeigt, dass die meisten Daten zu blutverdünnenden Phytotherapeutika auf In-vitro-Experimenten, Tierstudien und individuellen Fallberichten basieren [Abebe, 2019]. Jedoch können viele dieser Präparate in Kombination mit „schulmedizinischen“ Medikamenten zu gravierenden Nebenwirkungen führen [Abebe, 2019; Behr 2011; Ernst, 1999; Kaye, 2000]. So verstärken beispielsweise Goji-Beeren vermutlich die gerinnungshemmende Wirkung von Vitamin-K-Antagonisten. In verschiedenen Fallberichten wird in diesem Zusammenhang von gefährlichen Blutungskomplikationen berichtet [Smollich und Podlogar, 2016]. Ärzte und Zahnärzte sind in der Pflicht, gerade vor chirurgischen Eingriffen nach diesen Präparaten zu fragen. Wird ein Präparat aus Tabelle 3 eingenommen, sollte es präoperativ abgesetzt werden.
Das potenzielle Risiko von Phytotherapeutika in der Zahnmedizin darf aufgrund der zunehmenden Beliebtheit dieser Mittel nicht unterschätzt werden. Dies muss mit dem Patienten in sachlicher Form besprochen werden. Letztlich geht es in diesem Zusammenhang nicht um emotionale Befürwortung oder Gegnerschaft, sondern um das Wohl unserer Patienten [Ernst, 1999].
PD Dr. med. Dr. med. dent. Frank Halling
Gesundheitszentrum FuldaPraxis für MKG-Chirurgie/Plastische Operationen
Gerloser Weg 23a, 36039 Fulda
und Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie am Universitätsklinikum Marburg
Baldingerstr., 35043 Marburg
Dr.Halling@t-online.de
Literaturliste
1. Abebe, W. (2019). Review of herbal medications with the potential to cause bleeding: dental implications, and risk prediction and prevention avenues. EPMA J 10(1): 51-64.
2. Behr, M., J. Fanghänel, et al. (2011). Pflanzliche Arzneien und Nahrungsmittelergänzungen-Auswirkungen auf die zahnmedizinische Therapie. Dtsch Zahnärztl Z 66(5): 332-336.
3. Divoll, M., D. J. Greenblatt, et al. (1982). Effect of food on acetaminophen absorption in young and elderly subjects. J Clin Pharmacol 22(11-12): 571-576.
4. Ernst, E. (1999). Phythotherapeutika: Wie harmlos sind sie wirklich? Dtsch Ärztebl 96(48): A-3107-3109.
5. Freitag-Ziegler, G. (2015). Wechselwirkungen zwischen Nahrungs- und Arzneimitteln. Ernährung im Fokus 15(9-10): 286-291.
6. Frömming, K. H. und W. Mehnert (1981). Arzneimittelwirkung und Nahrungsaufnahme. Inf Arzt 9(I): 4-16.
7. Gaschott, T. und J. Stein (2003). Interaktionen zwischen Nahrungsinhaltsstoffen und Medikamenten. In: Praxishandbuch klinische Ernährung und Infusionstherapie. Stein, J. und K. W. Jauch (Hrsg.). Berlin, Springer, 251.
8. Harder, S. (1997). Dreimal täglich nach dem Essen? Arzneimittel und Nahrungsaufnahme. Hess Ärzteblatt 58 (2): 47-48.
9. Jaspersen, D. (2000). Drug-induced oesophageal disorders: pathogenesis, incidence, prevention and management. Drug Saf 22(3): 237-249.
10. Kaye, A. D., R. C. Clarke, et al. (2000). Herbal medicines: current trends in anesthesiology practice - a hospital survey. J Clin Anesth 12(6): 468-471.
11. Kaufman, D. W., J. P. Kelly, et al. (1999). The risk of acute major upper gastrointestinal bleeding among users of aspirin and ibuprofen at various levels of alcohol consumption. Am J Gastroenterol 94(11): 3189-3196.
12. Moßhammer, D., H. Haumann, et al. (2016). Polypharmacy-an upward trend with unpredictable effects. Dtsch Arztebl Int 113(38): 627-633.
13. Neuvonen P. J., K. P. Kivistö, et al. (1991). Interference of dairy products with the absorption of ciprofloxacin. Clin Pharmacol Ther 50 (5): 498-502.
14. N. N. (1997). Wechselwirkungen zwischen Arzneimitteln und Nahrungsmitteln Arzneimittelbrief 31(12): 89.
15. Rashrash, M., J. C. Schommer, et al. (2017). Prevalence and predictors of herbal medicine use among adults in the United States. J Patient Exp 4(3): 108-113.
16. Rohdewald, P., G. Drehsen, et al. (1983). Relationship between saliva levels of metamizol metabolites, bioavailability and analgesic efficacy. Arzneimittelforschung 33(7): 985-988.
17. Schröder, H., G. Brückner, et al. (2020). Gesundheitliche Beeinträchtigungen - Vorerkrankungen mit erhöhtem Risiko für schwere COVID-19-Verläufe. Verbreitung in der Bevölkerung Deutschlands mit seinen Regionen. Berlin, Wissenschaftliches Institut der AOK (WIdO)
18. Smollich, M. und J. Podlogar (2016). Wechselwirkungen zwischen Arzneimitteln und Lebensmitteln. Stuttgart, Wissenschaftliche Verlagsgesellschaft
19. Ulbricht, C., W. Chao, et al. (2009). Chia (Salvia hispanica): a systematic review by the natural standard research collaboration. Rev Recent Clin Trials 4(3): 168-174.
20. Verspohl, E. J. (2002). Wechselwirkungen von Arzneimitteln mit Nahrungsmitteln. Z Allg Med 78: 275-283.
21. Washington, N., C. Washington, et al. (2001). Physiological pharmaceutics: Barriers to drug absorption. 2. Aufl. Albingdon, Taylor and Francis Inc.
22. Welling, P. G., H. Huang, et al. (1977). Bioavailability of ampicillin and amoxicillin in fasted and nonfasted subjects. J Pharm Sci 66(4): 549-552.
23. Wisker, E. (2010). Interaktionen zwischen Nahrung und Arzneimitteln. Ernährungs