Botulinum Toxin zur Behandlung des gustatorischen Schwitzens
Das Frey-Syndrom gilt als Sonderform der gustatorischen Hyperhidrose im Wangenbereich (Synonyme: aurikulotemporales Syndrom, gustatorisches Schwitzen, gustatorische Hyperhidose). Das Syndrom erhielt seinen Namen durch die Neurologin Lucie Frey, die einen jungen Mann untersuchte, der aufgrund einer Schnittverletzung im Bereich der Ohrspeicheldrüse ein Schwitzen während des Verzehrs von jeglichen Speisen entwickelte [Frey 1923]. Patienten mit Frey-Syndrom zeigen abnorme Schweißabsonderungen in bestimmten Hautarealen des Kopf-Hals-Bereiches, die besonders durch gustatorische Reize, wie Kauen, Abbeißen, Schmecken und mehr ausgelöst werden können. Nach operativen Eingriffen an der Glandula parotis (laterale, konservative oder radikale Parotidektomie, Tabelle 1) finden sich die schwitzenden Areale am häufigsten in den Versorgungsbereichen des N. auriculotemporalis (aurikulotemporales Syndrom) oder N. auricularis magnus [Laskawi et al. 1998]. In nahezu 100 Prozent der Fälle lässt sich nach Entfernung der Ohrspeicheldrüse ein Frey-Syndrom nachweisen. Das Syndrom ist neben dem bekannten Schwitzen (gustatory sweating) auch gekennzeichnet durch weitere Symptome (Tabelle 2) wie Hautrötung (gustatory flushing), Kribbeln, Schwellungsgefühl bis hin zum Hautbrennen [Küttner et al. 2001].
Die Pathogenese des Frey-Syndroms ist bis heute nicht vollständig geklärt. Am ehesten anerkannt ist die Hypothese, dass regenerierende parasympathische (sekretorische) Fasern, die während des operativen Eingriffs oder einem anderweitigen Trauma geschädigt worden sind, in Kontakt mit den normalerweise sympathisch innervierten Hautschweißdrüsen tre ten. Der beiden Nervenfasertypen gemeinsame Transmitter Acetylcholin kann an seinem Zielorgan, den Hautschweißdrüsen, über die pathologisch gesteuerte Innervation die Schweißsekretion auslösen. Mögliche chirurgische Interventionen, die zu einer Verletzung von parasympathischen (sekretorischen) Fasern führen und damit ein Frey-Syndrom verursachen können, sind zum Beispiel die Entfernung der Glandula submandibularis und/ oder Glandula parotis (komplett oder partiell), die Präparation entlang des Gesichtsnerven (N. facialis) im Rahmen einer lateralen, konservativen oder radikalen Parotidektomie (Tabelle 1), ein lokales Trauma der entsprechenden Gewebe, etwa im Rahmen einer Kiefergelenksfortsatzfraktur oder eine Infektion der genannten Speicheldrüsen mit der Notwendigkeit einer chirurgischen Revision. Frenkel erklärte seine Beobachtung eines Frey-Syndroms nach Leitungsanästhesie des Nervus alveolaris inferior durch eine Nervus lingualis – Chorda tympani Schädigung mit Verminderung des Trigeminustonus und Überwiegen des parasympathischen Tonus des Nervus glossopharyngeus [1992].
Aufgrund der hohen Inzidenz des Frey-Syndroms nach chirurgischen Eingriffen an der Ohrspeicheldrüse sind verschiedene therapeutische Ansätze angewandt worden, die jedoch allesamt keinen wirklichen Nutzen für den Patienten erbrachten (Tabelle 3): Eine der ersten Methoden zur Prävention des Frey-Syndroms war es, den Nervus auriculotemporalis, den intrakraniellen Teil des N. glossopharyngeus oder den Plexus tympanicus während einer Parotidektomie zu durchtrennen [Gardner und McCubbin 1956, Golding-Wood 1962, Kidd 1955].
Andere Autoren verwendeten Muskellappen aus dem M. sternocleidomastoideus (so genannte Rauchplastik), um einerseits einer konkaven Deformität im Bereich der Parotisregion vorzubeugen, andererseits eine direkte Anastomosierung der durchtrennten sekretorischen Fasern mit den Hautschweißdrüsen zu verhindern [Kornblut et al. 1974]. Des Weiteren war das Auftreten eines gustatorischen Schwitzens geringer, wenn ein Faszientransplantat vom Oberschenkel (Fascia lata) zwischen entfernter Drüse und Haut eingelagert wurde [Singleton und Cassisi 1980]. Einige Chirurgen verwendeten das so genannte SMAS (Superficial Musculo Aponeurotic System), eine Faszienschicht zwischen Haut und oberflächlichem Drüsenanteil, zur Interposition zwischen durchtrenntem Nervengewebe und Haut [Bonnano und Casson 1992]. Auch alloplastische Materialien sind verwendet worden, für die recht zufrieden stellende Ergebnisse mit einer mittleren Inzidenz des Frey-Syndroms von zirka 30 Prozent beschrieben worden sind. Jedoch muss erwähnt werden, dass dies gehäuft mit zum Teil erheblichen Komplikationen, wie fistelnden Entzündungen, verbunden war [Dulguerov et al. 1999].
Physikalische Maßnahmen, wie eine lokale Strahlentherapie mit weicher Röntgenstrahlung (heute obsolet!, [Needles 1932]) oder pharmakologische Ansätze (systemische und/oder topische Anwendung von Anticholinergica, wie Scopolamin, Glycopyrroniumbromid oder topischen Antihyperhidrotica (Dialuminiumchlorid), [Erickson 1985, Hays et al. 1982, Laage-Hellmann 1957]), sind als therapeutische Optionen angewandt worden. Allerdings haben sich all diese Behandlungsversuche bis heute als entweder uneffektiv oder derart nebenwirkungsreich erwiesen, dass ihre Anwendung im Vergleich zu den störenden Symptomen des Frey-Syndroms einer strengen Indikationsstellung bedarf.
Botulinum Toxin stellt eine neuartige Therapieoption zur Behandlung des Frey-Syndroms dar [Drobik et al. 1995]. Botulinum Toxin ist das Exotoxin des anaeroben Bakteriums Clostridium botulinum und als das „giftigste aller Gifte“ bekannt. Bereits ein Gramm des Toxins würde ausreichen, um 1 x 106 Menschen zu töten. Der Wirkmechanismus von Botulinum Toxin besteht darin, die Freisetzung von Acethylcholin aus den präsynaptischen Vesikeln cholinerger Nerven langfristig zu blockieren (Abbildung 1), und kann daher als eine effiziente anticholinerge Therapie verstanden werden [Dulguerov et al. 2000]. Da die Sekretion der Hautschweißdrüsen – wie bereits oben erwähnt – über eine sympathisch cholinerge, das heißt Acethycholin vermittelte, Innervation getriggert wird, stellt die therapeutische Anwendung von Botulinum Toxin aufgrund seines pharmakodynamischen Ansatzpunktes eine höchst effektive Strategie dar, um das gustatorische Schwitzen zu blockieren.
Fragestellung
Ziel der vorliegenden prospektiven Untersuchung war es, am eigenen Patientengut (n=10) die Effektivität einer alleinigen Behandlung des Frey-Syndroms durch eine intrakutane Injektion von Botulinum Toxin A (Botox®) im Hinblick auf die Zufriedenheit der betroffenen Patienten einerseits, und die Langzeitwirkung der Therapie auf das gustatorische Schwitzen andererseits zu untersuchen.
Material und Methode
Patientengut
Grundlage für die Untersuchungen bildeten Patienten der Universitätsklinik für Mund-, Kiefer- und Plastische Gesichtschirurgie am Knappschaftskrankenhaus Bochum-Langendreer, die im Zeitraum von 1988 bis 1998 an verschiedenartigen Erkrankungen der Ohrspeicheldrüse operiert worden sind (Abbildung 2).
Die Operationsverfahren zur Behandlung der Patienten sind in Abbildung 3 dargestellt: Zehn Patienten (zwei Frauen und acht Männer, Durchschnittsalter: 50 Jahre, Range 20 bis 74 J.) mit insgesamt zwölf Gesichtshälften wurden in die Studie aufgenommen. Sieben der Patienten unterzogen sich einer konservativen Parotidektomie, drei einer totalen Parotidektomie. Bei zwei Patienten bestand ein beidseitiges Schwitzen, nachdem eine bilaterale Parotidektomie durchgeführt worden ist. Bei unserem Patientengut sind zum Teil die in Abbildung 3 rechts dargestellten chirurgischen Modifikationen zusätzlich angewandt worden. Entscheidendes Kriterium zur Teilnahme an der Studie war ein ausgeprägtes gustatorisches Schwitzen sowie der ausdrückliche Wunsch der Patienten, sich einer Behandlung mit Botulinum Toxin zu unterziehen. Die Patienten wurden vor der Therapie über den genauen Ablauf der Botulinum Toxin Behandlung und die möglichen Nebenwirkungen (Tabelle 4) aufgeklärt.
Ein subjektiver Fragebogen hinsichtlich Schweregrad des eigenen Leidensdruckes, Zeitpunkt des Auftretens der Symptomatik post operationem sowie Angaben über die Erfolgsrate vorausgegangener Therapiemaßnahmen wurde den Patienten ausgehändigt. Sämtliche Befunde wurden in einem eigens für jeden Patienten angelegten Untersuchungsbogen zusammengefasst. Der Erfolg der Therapie wurde zur späteren quantitativen Auswertung photodokumentiert.
Quantitative Erfassung der gustatorischen Hautareale.
Um das Ausmaß des pathologischen Schwitzens der Haut in der Region der operierten Ohrspeicheldrüse zu erfassen, wurde der Test nach Minor angewandt [Minor 1927]. Der Test beruht auf einer einfachen Jod-Stärke-Reaktion, über welche schwitzende Bereiche auch in der behaarten Kopfhaut gut dargestellt werden können. Der detaillierte Ablauf des Vorgehens ist in Abbildung 4 schrittweise dargestellt: Zunächst wird das betroffene Hautareal über der Parotisregion gründlich gereinigt und anschließend mit einem großen Watteträger Lugolscher Lösung (Jod zwei Gramm, Kaliumjodid vier Gramm auf 100 Gramm destilliertes Wasser) bestrichen (Abb. 4 a). Nach Trocknen der Lösung an der Luft wird das gleiche Hautareal mit Stärkepulver bepudert (Abb. 4 b). Daraufhin erhalten die Patienten eine Reizmahlzeit (Abb. 4 c). In unserem Falle wurde das Essen eines Apfels verordnet, da sowohl der chemische (Apfelsäure) als auch mechanische Reiz (Kauen) die Sekretion zuverlässig stimulieren. Bereits nach zwei Minuten stellt sich das schwitzende Hautareal durch Blaufärbung dar (Abb. 4 d). Der Test kann nach fünf Minuten abgebrochen werden. Anschließend erfolgt die Ausmessung des gustatorischen Areals mit einem hautfreundlichen wasserfesten Stift (Abb. 4 e).
Injektion von Botulinum Toxin A.
Nach Anzeichnung der Injektionspunkte in einem Abstand von einem Zentimeter wurden jeweils drei MU (Mouse Units ) Botulinum Toxin A (Botox®, Merz & Co. GmbH und Co., Frankfurt) intrakutan injiziert (Abb. 4 f). Die Patienten wurden nach zwei Wochen, sechs Monaten und zwölf Monaten im Hinblick auf das gustatorische Areal mit dem Test nach Minor nachuntersucht.
Ergebnisse
Subjektive Angaben der Patienten.
• Sekretagoger Stimulus
Alle Patienten gaben mehrere Möglichkeiten als Ursache für das gustatorische Schwitzen an: Bei 95 Prozent der Patienten wurde das gustatorische Schwitzen durch Zitrusfrüchte angeregt. Bei 85 Prozent der Patienten dominierten harte Speisen als Stimulus, das heißt Nahrungsmittel, bei denen die Kaumuskulatur erheblich gefordert wird. Des Weiteren stellten 85 Prozent der Patienten bei stark sauren und heißen Speisen, 95 Prozent bei stark gewürzten Speisen, 80 Prozent bei Süßigkeiten und fünf Prozent beim Trinken ein Schwitzen fest. Aufgrund dessen hielten wir einen Apfel (hart, Zitrusfrucht) als sekretagogen Stimulus für besonders geeignet, da zum einen die mastikatorische und zum anderen die „saure“ Komponente einen effektiven Reiz für die Schweißsekretion darstellt.
• Subjektive Einschätzung der Beeinträchtigung
Bei 80 Prozent aller Patienten rann der Schweiß die betroffene Gesichtshälfte herab. 45 Prozent der Patienten bemerkten zusätzlich eine Hautrötung. Die Frage nach der persönlichen Beeinträchtigung des Patienten im öffentlichen Leben ergab eine klare Aussage: Alle Patienten berichteten, sich im sozialen und gesellschaftlichen Leben beeinträchtigt zu fühlen. Daher würden sie öffentliche Auftritte, soweit möglich, weitestgehend vermeiden. 55 Prozent der Patienten empfanden das gustatorische Schwitzen als sehr störend, 25 Prozent als mäßig störend und 20 Prozent als leicht störend. Eine Beeinträchtigung wurde von jedem der Patienten angegeben (Abbildung 5).
Botulinum Toxin A und das gustatorische Schwitzen
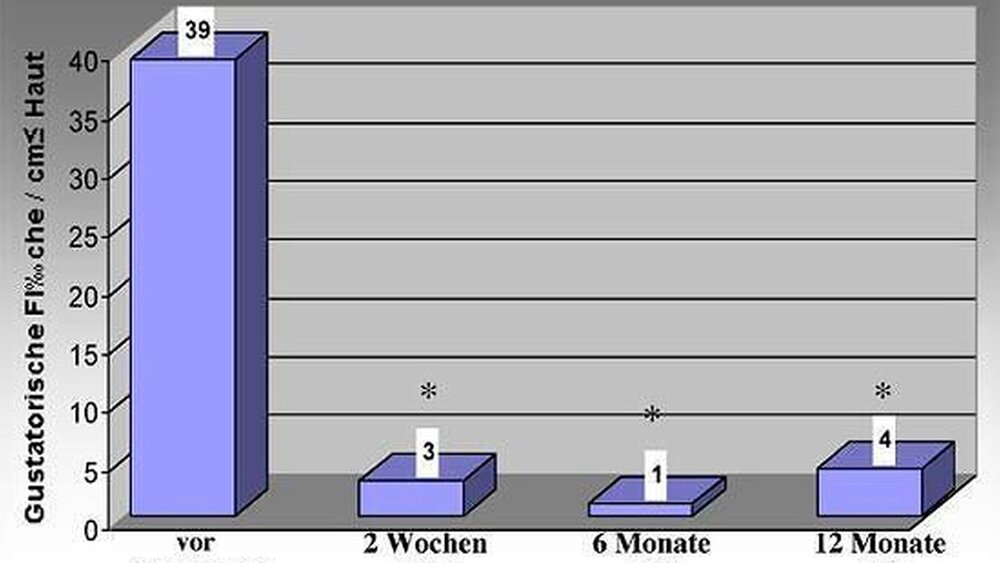
Vor der ersten Behandlung lag die Fläche des gustatorischen Hautareals bei durchschnittlich 39 cm2. Zwei Wochen nach Injektion von drei MU Botox® pro cm2 war die Fläche des gustatorischen Hautareals auf drei cm2 um 93 Prozent statistisch signifikant vermindert (Abbildung 6). Dieser Effekt war nach sechs Monaten sogar verstärkt nachweisbar (so genannter Treppen-effekt). Bei der Halbjahreskontrolle musste bei keinem der Patienten nachinjiziert werden, wobei ein Erfolg von nach wie vor 97 Prozent Reduktion messbar war. Nach weiteren sechs Monaten erfolgte eine erneute Kontrolluntersuchung, bei der sich ein leichtes Wiederauftreten des gustatorischen Schwitzens messen ließ. Allerdings war auch hier noch eine deutliche Reduktion um 90 Prozent zu verzeichnen. Diese (geringgradige) Zunahme des Schwitzens wurde von den Patienten subjektiv nicht wahrgenommen und war lediglich unter Anwendung des Tests nach Minor nachweisbar. Ein Grund dafür könnte einerseits eine injektionsbedingte unzureichende Wirkstoffkonzentration am Wirkort sein, etwa durch Auslassen des Hautareals (Haaransatz) oder durch fehlerhafte Injektion in tiefere Gewebsschichten. Vermutlich spielt auch die Variabilität des anatomischen Aufbaus von Gesichtshaut und behaarter Kopfhaut eine Rolle [Küttner et al. 2001].
Diskussion
Diese prospektiv angelegte Therapiestudie bei Patienten mit Frey-Syndrom hat gezeigt, dass bei einer Dosis von drei MU Botulinum Toxin A pro cm2 Hautfläche das gustatorische Schwitzen effektiv vermindert werden kann. Der Effekt ist auch ein Jahr nach Injektion mit einer mittleren Reduktion der schwitzenden Hautareale um 95 Prozent nachweisbar. Wir hatten in unserem Patientengut praktisch keinen Therapieversager bei nahezu fehlenden unerwünschten Nebenwirkungen zu verzeichnen – sieht man von der zum Teil sehr schmerzhaften intrakutanen Injektion ab. Die Häufigkeit des Frey-Syndroms nach operativen Eingriffen an der Ohrspeicheldrüse variiert in der Literatur mit Werten zwischen 2,6 Prozent bis zu 97,6 Prozent [Laage-Hellmann 1957]. Legt man als Maßstab für die Diagnose jedoch den Test nach Minor zugrunde, so kann in nahezu 100 Prozent der Fälle ein gustatorisches Schwitzen nachgewiesen werden. Dieses pathologische Schwitzen wurde einheitlich von all unseren Patienten als unangenehm und insbesondere bei den Mahlzeiten als störend empfunden. Dabei ist erwähnenswert, dass das Ausmaß der Beeinträchtigung des einzelnen Patienten nicht direkt von der Menge oder Fläche des gustatorischen Schwitzens abhängt, sondern vielmehr von der interindividuellen Bewertung der Symptomatik. Alle Patienten fühlten sich durch die Erkrankung mehr oder weniger gestört (Abbildung 5). Keiner der Patienten gab an, durch das Schwitzen nicht beeinträchtigt zu sein. Ähnliche Befunde werden auch von anderen Autoren berichtet. Aus diesem Grunde haben die Patienten einen großen Leidensdruck und grenzen sich nicht selten aus dem sozialen Leben aus, was mit einer deutlichen Einschränkung der Lebensqualität einhergeht. Die zur Behandlung des Frey-Syndroms in der Vergangenheit eingesetzten therapeutischen Maßnahmen haben die erwünschten Effekte nicht erzielt und können heute retrospektiv als nahezu wirkungslos bezeichnet werden (Tabelle 3). Dies mag mit dafür verantwortlich sein, dass man nicht selten beim genaueren Nachfragen von den Patienten mit Frey-Syndrom erfährt, dass sie von ihrem behandelnden Arzt außer den ohnehin nicht wirksamen lokalen Salbenanwendungen auf das Fehlen einer effektiven Therapie hingewiesen worden sind und daher zum Teil resigniert auch keinerlei Bemühungen unternommen haben, ihre soziale Beeinträchtigung zu überwinden.
Erst seit kurzem kann auf einen viel versprechenden Behandlungsansatz, der in der spezifischen Blockade der Sekretion des Neurotransmitters Acethylcholin beruht, zurückgegriffen werden, nämlich die Injektion von Botulinum Toxin in das betroffene Hautareal [Drobik et al. 1995]. Die typischen Symptome einer Vergiftung sind als Botulismus (lat. Botulus = Wurst) beschrieben. Infolge einer bakteriellen Lebensmittelvergiftung, insbesondere nach Verzehr von Wurstprodukten, kommt es initial zu einer unspezifischen Gastroenteritis, gefolgt von zentralnervösen Manifestationen, wie Lichtscheu, Akkomodationsstörungen, Doppelsehen, verminderter Speichelsekretion mit Schluckbeschwerden bis hin zur tödlichen Atemlähmung. Heute findet dieses „giftigste aller Gifte“ klinische Anwendung bei verschiedenen Krankheitsbildern. All diesen klinischen Anwendungen gemeinsam ist der spezifische Wirkmechanimus der Hemmung der Acethylcholinfreisetzung aus den präsynaptischen Nervenendigungen ([Dulguerov et al. 2000, Sellin 1981]; Abbildung 1) mit dem Ergebnis einer Lähmung
1. der quergestreiften Skelettmuskulatur (sympathisch cholinerge Innervation),
2. von parasympathisch (cholinerg) innervierten Strukturen (zum Beispiel Speicheldrüsen) sowie
3. der sympathisch cholinerg (!) innervierten Schweißdrüsen.
Damit ist der klinische Anwendungsbereich von Botulinum Toxin einfach nachvollziehbar. Eine tabellarische Übersicht der therapeutischen Anwendung von Botulinum Toxin im so genannten „Off-label-Gebrauch“ (Heilversuch) ist in Tabelle 5 zusammengefasst. Unter Off-label-Gebrauch versteht man die klinische Anwendung eines Arzneimittels, für das es noch keine gesetzliche Zulassung gibt. Insofern stellt die Anwendung von Botulinum Toxin beim Patienten einen Heilversuch dar. In jedem Falle muss der Patient bei der klinischen Anwendung von Botulinum Toxin zur Behandlung des gustatorischen Schwitzens vom behandelnden Arzt über diesen Sachverhalt aufgeklärt werden. Aufgrund der inzwischen bekannten medizinisch-wissenschaftlichen Erfolge der Botulinum Toxin Therapie zur Behandlung des Frey-Syndroms ist ein solcher Tatbestand für die klinische Anwendung beim Patienten gegeben. Dies kann inzwischen durch erste evidenzbasierte Studien untermauert werden [Naumann et al. 1997]. Es bleibt dennoch durch weitere prospektive klinische Studien abzuwarten, wann letztlich die Zulassung von Botulinum Toxin beim Frey-Syndrom als derzeit einzig wirksame Therapie erfolgen wird. Zugelassen ist das Medikament in Deutschland seit 1993 lediglich für die Indikationen Strabismus und Blepharospasmus.
Die Ergebnisse dieser prospektiven Untersuchung haben gezeigt, dass die intrakutane Injektion von Botulinum Toxin A das gustatorische Schwitzen bei unserem Patientengut signifikant vermindern kann. Ähnlich günstige Effekte konnten von zahlreichen anderen Autoren bereits nachgewiesen werden [Beerens und Snow 2002, Drobik et al. 1995, Dulguerov et al. 2000, Guntinas-Lichius 2002, Küttner et al. 2001, Laskawi et al. 1998, Umstadt 2002, von Lindern et al. 2000]. Dennoch ist man sich heute nicht völlig darüber im klaren, welche Dosis pro Hautfläche die ideale ist, um das Schwitzen möglichst lange bei maximaler Sicherheit für den Patienten zu blockieren. In der Literatur sind Dosen zwischen 0,5 bis zu zehn MU Botulinum Toxin pro cm2 Haut empfohlen worden. Höhere Dosierungen scheinen eine dosisabhängige Verlängerung des Effektes mit sich zu bringen, jedoch mit dem hohen Preis, die Gefahren unerwünschter Nebenwirkungen (Tabelle 4) vermehrt in Kauf zu nehmen [Laccourreye et al. 1998]. Offensichtlich scheint sich bei wiederholter Injektion von Botulinum Toxin beim Frey-Syndrom ein so genannter Treppeneffekt aufzubauen, so dass sich die Wirkung des Toxins längerfristig sogar verstärkt [Göbel et al. 2001]. Bekannt ist vor allem aus der Behandlung der axillären und/oder palmoplantaren Hyperhidrose, dass der Effekt auf diese Form der Hyperhidrose von drei Monaten bis zu anderthalb Jahren nach einmaliger Injektion anhalten kann [Breit und Heckmann 2000]. Unsere Untersuchungen legen bei einer Dosierung von drei MU pro cm2 Hautfläche eine Wirkdauer von mindestens einem Jahr nahe. Ähnlich unseren Beobachtungen führt die Behandlung der schwitzenden Hautareale mit Botulinum Toxin A bereits innerhalb von einer Woche zum vollständigen Sistieren des pathologischen Schwitzens. Die Patienten sind von da an nicht mehr in ihrer Lebensqualität eingeschränkt. Es wurde von keinem unserer Patienten nach der intrakutanen Injektion von unerwünschten Nebenwirkungen berichtet, sieht man von der schmerzhaften intrakutanen Injektion per se ab. Laskawi und Mitarbeiter haben diesbezüglich zur Verwendung einer Lidocain und Prilocain enthaltenden Salbenanwendung geraten [Laskawi et al. 2001].
Fazit:
Zusammenfassend lässt sich sagen, dass das Frey-Syndrom (aurikulotemporales Syndrom, gustastorisches Schwitzen) ausgesprochen häufig nach chirurgischen Eingriffen im Bereich der Ohrspeicheldrüse auftritt. Durch die erst junge Entdeckung von Botulinum Toxin als einem Therapeutikum kann dieses für den Patienten sehr beeinträchtigende Syndrom erstmals effektiv behandelt werden. Das Wissen um diese neue therapeutische Option sollte auch der Zahnarzt in seinem differentialdiagnostischen Armamentarium zur Aufklärung seiner Patienten bereit halten können. Die Therapie der Patienten sollte in dafür spezialisierten Kliniken erfolgen.
Hintergrund
Das Frey-Syndrom (aurikulotemporales Syndrom, gustatorisches Schwitzen, pathologisches Schwitzen) tritt gehäuft nach operativen Eingriffen oder Traumatisierung der Ohrspeicheldrüse (Glandula parotis) auf. Bis heute gibt es keine Erfolg versprechenden Behandlungsmethoden. Erst seit kurzem ist die intradermale Injektion von Botulinum Toxin A in die schwitzenden Hautareale über der Parotisregion als eine neue erfolgreiche Therapie bekannt geworden.
Patienten und Methode
Untersucht wurden zwölf Gesichtshälften bei zehn Patienten mit einem Durchschnittsalter von 50 Jahren (Minimum: 20, Maximum: 74). Die Entfernung der Ohrspeicheldrüse (Parotidektomie) erfolgte aufgrund von Adenomen, Lymphadenitiden, Sialadenitiden oder chronischen Parotitiden. Alle Patienten unterzogen sich dem Test nach Minor, welcher das gustatorische Hautareal über eine Jod-Stärke Reaktion sichtbar macht. In das schwitzende Hautareal wurde Botulinum Toxin A (Botox®, Merz & Co. GmbH und Co.) intradermal in einer Dosis von drei MU (Mouse Units) cm2 injiziert. Die Patienten wurden vor sowie zwei Wochen, sechs Monate sowie zwölf Monate nach Injektion erneut getestet.
Ergebnis
55 Prozent der Patienten fühlten sich in ihrer Lebensqualität sehr stark gestört, 45 Prozent fühlten sich beeinträchtigt. Das gustatorische Hautareal konnte durch Injektion von Botox® bei allen Patienten effektiv um 94 Prozent vermindert werden. Die Wirkung hielt mindestens bis zu einem Jahr nach der einmaligen Injektion an. Unerwünschte Nebenwirkungen wurden nicht beobachtet.
Schlussfolgerung
Bei Patienten mit gustatorischem Schwitzen stellt die Behandlung mit Botulinum Toxin A eine sichere und effektive Therapie dar.
PD Dr. Dirk NolteProf. Dr. Klaus-Dietrich WolfIris GollmitzerDenys LoeffelbeinKlinik für Mund-, Kiefer- undPlastische Gesichtschirurgie,KnappschaftskrankenhausBochum Langendreer,UniversitätsklinikIn der Schornau 23-25, 44892 Bochumdirk.nolte@ruhr-uni-bochum.de
\n
Parotidektomie
Operative Entfernung von
\n
Laterale P.
oberflächlichem Parotisanteil
\n
Konservative P.
oberflächlichem und tiefem Parotisanteil unter Erhalt der Äste des N. facialis
\n
Radikale (Totale) P.
oberflächlichem und tiefem Parotisanteil mit Resektion der Äste des N. facialis
\n
\n
Schwitzen(Hyperhidrosis, gustatory sweating)
\n
Hautrötung(Gustastory flushing)
\n
Kribbeln
\n
Schwellungsgefühl
\n
Hautbrennen
\n
\n
Therapeutische Maßnahmen
\n
I. Chirurgische Therapieansätze
[Lit.]
\n
■ Durchtrennung der die parasympathischen (sekretorischen) Fasern führenden Nerven
\n
– N. auriculotemporalis
[15]
\n
– N. tympanicus
[12]
\n
– N. glossopharyngeus
[11]
\n
– Sympathektomie
[5]
\n
■ Interpositionsplastiken zur räumlichen Trennung von Hautschweißdrüsen und innervierendem Nervengeflecht
\n
– M. sternocleidomastoideus (so genannte Rauch-Plastik)
[16]
\n
– Fascia lata
[27]
\n
– SMAS (Superficial Musculo-Aponeurotic System)
[2]
\n
– Alloplastische Materialien (Ethisorb, e-PTFE, lyophilisierte Dura)
[6]
\n
II. Physikalische Therapieansätze
\n
■ Strahlentherapie
\n
– Weiche Röntgenstrahlung (heute obsolet!)
[25]
\n
III. Pharmakologische Therapieansätze
\n
■ Anticholinergika (Scopolamin, Glycopyrroniumbromid)
[14, 18]
\n
■ Antihyperhidrotica (Dialuminiumchlorid)
[8]
\n
■ Botulinum Toxin A
[4]
\n
\n
Nebenwirkungen
\n
■ Schmerzen bei der Injektion
\n
■ Paralyse von Ästen des N. facialis (insbesondere periorbital und perioral)
\n
■ Neutralisierende Antikörperbildung (insbesondere bei hohen Dosierungen und wiederholten Injektionen in kurzen Abständen)
\n
\n
Klinische Anwendungsbereiche
\n
I. Lähmung der quergestreiften Skelettmuskulatur (sympathisch cholinerg)
\n
■ Neurologie
\n
Dystonien
Spasmus hemifacialis, oromandibuläre Dystonie, Meige-Syndrom, Schreibkrampf
\n
Spastizität
im Kindesalter, bei multipler Sklerose, nach Schlaganfall, posttraumatisch, nach zentraler Lähmung
\n
Tremor
\n
Tics
\n
Myoklonien
\n
Schmerzzustände
Spannungskopfschmerz, Migräne
\n
\n
■ Ophtalmologie Augenmuskelstörungen
Strabismus, Nystagmus, okulomotorische Nervenlähmung
\n
■ ZMK-Heilkunde/MKG-Chirurgie Bruxismus (Zähneknirschen)
\n
■ Plastisch-ästhetische Medizin Faltenkorrekturen
\n
II. Lähmung der glatten Muskulatur (parasympathisch cholinerg)
\n
■ Chirurgie
\n
Analfissur
\n
Achalasie
\n
Harnverhalt
\n
Sphinkter Oddi (Dysfunktion der Gallensekretionsstörung)
\n
Vaginismus
\n
III. Blockade autonomer Funktionen (parasympathisch cholinerg)
\n
■ Hyperhidrose
axillär, palmoplantar, fokal andere Lokalisationen
\n
\n
■ Tränen („Krokodilstränen“)
\n