Aktueller Stand des Lasereinsatzes in der Periimplantitis-Therapie
Zahnärztliche Implantate weisen hervorragende Langzeitresultate auf. Trotz bester Bemühungen um die Nachsorge lassen sich aber biologische oder technische Misserfolge in der prothetischen Belastungsphase nicht in allen Fällen vermeiden [Smedberg et al., 1993; Pjetturson et al., 2004]. Als wesentliches Problem der biologischen Misserfolge hat sich in den vergangenen Jahren die periimplantäre Infektion herausgestellt [Krekeler, 1996; Behneke und Behneke, 2004 a, b], da die periimplantären anatomischen Strukturen – im Gegensatz zur gingivalen Situation – als abwehrschwache Narbengewebe anzusehen sind [Berglundh et al., 1992 a, b; Ericsson, 1992; Lindhe et al., 1997]. Bei der Behandlung periimplantärer Infektionen besteht das Hauptproblem in der vollständigen Dekontamination zur Mundhöhle exponierter Implantatoberflächen, weil knöcherne Reappositionen nur an keimfreien Oberflächen zu erwarten sind. Eine mögliche Lösung dieses Problems könnte in der Anwendung von geeigneten Laserstrahlen bestehen. Im Rahmen des vorliegenden Beitrages sollen die aktuellen therapeutischen Konzepte zur Behandlung periimplantärer Infektionen unter besonderer Berücksichtigung der Laser-assistierten Implantat-Dekontamination dargestellt werden.
Definition
Bakterielle Infektionen mit einer entzündlichen Infiltration des Weichgewebes ohne Beteiligung des Knochens definiert man als periimplantäre Mukositis. Tritt zusätzlich ein entzündlich bedingter progressiver Knochenverlust auf, spricht man von einer Periimplantitis [Esposito et al., 1999; Spiekermann, 1994]. Die Klassifikation nach Spiekermann orientiert sich am röntgenologischen Befund und unterscheidet – je nach dem Umfang des Knochenverlustes – vier Klassen [Spiekermann, 1994]. Im Hinblick auf die therapeutischen Schwierigkeiten erscheint auch eine Klassifikation nach der Defektmorphologie sinnvoll. Dabei werden horizontale, schüsselförmige, trichterförmige und spaltförmige Defektformen unterschieden [Behneke und Behneke, 2004 b]. Während die schüsselförmigen Abbaukonfigurationen therapeutisch noch am leichtesten zu beeinflussen sind, bilden die trichter- und vor allem die spaltförmigen Knochenabbauten die größte Herausforderung.
Ätiologie
Die Ätiologie der Periimplantitis wird heute als multifaktoriell angesehen. Dabei sind mikrobielle, biomechanische und kofaktorielle Einflussgrößen zu nennen [Strub et al., 1994; Ratka-Krüger et al., 2001; Deppe, 2003 a].
Mikrobielle Infektion
Die destruierende Wirkung der bakteriellen Plaque konnte in tierexperimentellen Untersuchungen schon vor längerem eindeutig belegt werden [Ericsson et al., 1992; Jovanovic et al., 1993]. Die histologischen Befunde zeigten in der Gingiva und der periimplantären Mukosa ein entzündliches Zellinfiltrat. Beide Läsionen wiesen viele Ähnlichkeiten und Übereinstimmungen auf [Berglundh, 1992 a, b]. Die apikale Ausdehnung des entzündlichen Zellinfiltrates war in der periimplantären Schleimhaut aber größer als in der Gingiva. Die Bedeutung der mikrobiellen Infektion in der Ätiologie periimplantärer Destruktionen wurde auch in klinischen Untersuchungen bestätigt [Becker et al., 1990]. Zudem wurden an Implantaten von Patienten ohne Restbezahnung signifikant weniger bewegliche Stäbchen (0,4 Prozent) und Spirochäten (Null Prozent) festgestellt, was auf eine Depotfunktion von Zähnen für die Keime hinweist [Quirynen und Listgarten, 1990].
Biomechanische Überlastung
Die Rolle der biomechanischen Überlastung in der Ätiologie der Periimplantitis wird kontrovers diskutiert. Im Tiermodell wurde gezeigt, dass die Applikation eines okklusalen Traumas alleine keinen Knochenverlust erzeugen kann, sondern nur eine Plaqueakkumulation. Lagerte man aber bei bestehender plaquebedingter periimplantärer Entzündung zusätzlich ein okklusales Trauma auf, so zeigte sich ein stärkerer Knochenverlust als durch die alleinige Plaqueakkumulation [Strub, 1986]. Auch schräg auf osseointegrierte Implantate einwirkende Kräfte konnten im Tierexperiment keine histologisch feststellbaren Veränderung am Implantat- Knochen-Übergang bewirken [Celletti et al., 1995]. In einer weiteren Studie konnte dagegen gezeigt werden, dass massive Biegebelastungen auch ohne Plaqueakkumulation zur Knochendestruktion führen können [Isidor, 1996]. Die Mehrzahl der Autoren wertet aber die biomechanische Überbelastung eher als einen Kofaktor in der Ätiologie der Periimplantitis.
Kofaktoren
Für die Ausbildung beziehungsweise den Verlauf periimplantärer Entzündungen werden in der Literatur weitere mögliche Kofaktoren genannt, wie die Implantatform und -oberfläche sowie immunologische Störungen beziehungsweise Nikotinabusus [Spiekermann, 1994; Bain, 2003]. Die Bedeutung einer keratinisierten Schleimhaut wird kontrovers diskutiert; in eigenen Untersuchungen konnte aber ein günstiger Einfluss bei der Prophylaxe periimplantärer Infektionen festgestellt werden [Deppe et al., 2004 b].
Diagnostik
Eine periimplanäre Mukositis kann mithilfe klinischer Parameter diagnostiziert werden; die Diagnostik der Periimplantitis erfordert dagegen eine röntgenologische Untersuchung (Abb. 1).
Klinische Befunde
Die langfristige Beurteilung des periimplantären Lagergewebes wird durch Erhebung des klinischen Attachment-Levels ermöglicht (AL). Dieser Parameter ergibt sich durch Addition der Werte für die Sondierungstiefe (probing depth, PD) und der Distanz von Implantatschulter zu Marginalrand (DIM) [Buser, 1990 b]. Für die Implantologie modifizierte Mundhygieneindizes, wie der Plaqueindex (PLI) und der Sulkus-Blutungs- Index (SBI) [Mombelli et al., 1987], geben Auskunft über das Pflegeverhalten. Eine frühzeitige Prädiktion zu erwartender pathologischer Veränderungen des periimplantären Knochenlagers ist vermutlich bei erhöhten Werten der SFFR (Sulkusfluidfließrate) [Lange und Topoll, 1979] möglich [Behneke und Behneke, 2004 a]. Nach neueren Untersuchungen ist bei periimplantären Entzündungen zudem die Aktivität der Myeloperoxidase in der periimplantären Sulkusflüssigkeit erhöht, so dass laborchemische Methoden zunehmend an Bedeutung gewinnen könnten [Liskmann et al., 2004].
Zur Bewertung der Implantatmobilität (IM) können Messtechniken zum Einsatz kommen, die auf einer Implantatbelastung basieren. Hierfür hat sich das Periotest ®-Gerät (Fa. Siemens, D-Bensheim) bewährt [Behneke und Behneke, 2004 a]. Da die Methode als wenig sensitiv angesehen wurde, sind derzeit weitere Neuentwicklungen, wie die Resonanzfrequenzanalyse, in der klinischen Erprobung. Der klinische Nutzen von Mobilitätsmessungen ist aber umstritten, da auch an Implantaten mit erheblichem Knochenabbau noch Normwerte erzielt werden können.
Mikrobiologische Befunde
In der Therapie periimplantärer Infektionen können mikrobiologische Testverfahren wertvolle Hinweise für das geeignete Antibiotikum oder die Überprüfung des Behandlungserfolges liefern. Aufgrund des hohen Aufwandes sind diese jedoch keinesfalls als Standarddiagnostik anzusehen.
Röntgenologische Befunde
Die Beurteilung des Knochenumbaus über die Zeit erfolgt in der klinischen Routine mit Orthopantomogrammen beziehungsweise standardisierten Zahnfilmaufnahmen [Weischer et al., 1997; Deppe et al., 2004 a]. Aufwändigere Verfahren wie die Computertomographie sind meist auf die klinische Forschung beschränkt. Im Röntgenbild wird der Abstand zwischen einem standardisierten Referenzpunkt und dem Oberrand des Knochens ermittelt. Diese Strecke wird als DIB bezeichnet (DIB = distance implant shoulder bone contact) [Buser, 1990 b]. Röntgenologische Kontrollen werden neben dem Zeitpunkt der prothetischen Versorgung in jährlichen Abständen empfohlen, wobei nach komplikationslosem Verlauf auch längere Intervalle möglich sind [Behneke und Behneke, 2004 a]. Im ersten Jahr der funktionellen Belastung wird ein Knochenverlust von bis zu 0,5 Millimetern als physiologisch angesehen, während für den weiteren Verlauf stabile Verhältnisse vorliegen sollten.
Therapeutische Prinzipien
Die Therapie der Periimplantitis besteht zunächst in der Beseitigung der ätiologischen Faktoren und der Etablierung entzündungsfreier Verhältnisse [Meffert, 1992]. Im Idealfall sollte durch regenerative Maßnahmen eine Reosseointegration erreicht werden. Wenn auch im Gegensatz zur Parodontaltherapie „nur“ Knochen regeneriert werden muss, ergeben sich insbesondere an mikrostrukturierten Implantatoberflächen erhebliche therapeutische Schwierigkeiten [Wetzel et al., 1999].
Antimikrobielle Therapie
Zur Initialbehandlung haben sich Spülungen mit 0,1-prozentiger Chlorhexidinlösung bewährt [Krekeler, 1996]. Die Anwendung von Chlorhexidinpräparaten sollte auf maximal vier Wochen begrenzt werden aufgrund der bekannten Nebenwirkungen, wie etwa Beeinträchtigung der Geschmacksempfindung. Bei Persistenz der Entzündung wird eine systemische Gabe von Ornidazol, zwei mal 500 mg täglich über zehn Tage, empfohlen. Damit verliert die periimplantäre Flora ihre pathogene Potenz [Mombelli et al., 1992]. Alternativ kann eine Kombination von Amoxicillin (3 x 375 mg / Tag) und Metronidazol (3 x 250 mg / Tag) für insgesamt sieben Tage zur Anwendung kommen [Krekeler, 1996]. Wenngleich durch die antimikrobielle Therapie Verbesserungen der klinischen Parameter eintreten, sind Regenerationen des knöchernen Lagers nicht zu erreichen. Eine künftige Option ist in der Anwendung von resorbierbaren Antibiotikaträgern zu sehen (so genannten slow release devices) [Büchter et al., 2004].
Mechanische Implantat-Dekontamination
Die Entfernung der mikrobiellen Plaque und der Endotoxine auf der Implantatoberfläche stellt eine wichtige Voraussetzung für die Ausheilung der Entzündung und die anschließende knöcherne Regeneration des periimplantären Defektes dar. Zur mechanischen Belagentfernung werden Plastikscaler, Prophylaxewinkelstücke mit Polierkelchen und Ultraschallgeräte mit Plastikansätzen empfohlen [Rapley et al., 1990; Spiekermann, 1994; Strub et al., 1994]. Die Entfernung von Endotoxinen gelingt am besten mit Pulver-Wasserstrahlgeräten [Zablotsky et al., 1991] (Abb. 2). Allerdings ist zu beachten, dass Pulver-Wasserstrahlgeräte weder sterile noch isotonische Verhältnisse ermöglichen [Krekeler, 1996]. Zudem besteht bei Anwendung an der Spongiosa ein nicht unerhebliches Embolie-Risiko [Messier, 1989]. Zur Vorbeugung einer erneuten Plaqueakkumulation wird die Abtragung rauer Oberflächenstrukturen mithilfe diamantierter Schleifkörper und Gummipolierer als so genannte Implantoplastik empfohlen [Behneke und Behneke, 2004 b]. Dabei sollten Verprengungen von Titanpartikeln und Polierkörperanteilen in den umgebenden Knochen vermieden werden.
Laser-assistierte Dekontamination
Das Ziel der Laseranwendung besteht in der oberflächlichen Vaporisation der wässrigen Plaque beziehungsweise der thermischen Inaktivierung von Endotoxinen durch die einfallende Laserstrahlung ohne Erwärmung des Implantates selbst. Die Laseranwendung setzt aber genaue Kenntnisse der thermischen Laserwirkungen an Implantat und Knochen voraus, da bei unsachgemäßer Handhabung erhebliche Schäden resultieren können [Deppe, 2003 a; Walsh, 2003].
Untersucht man die derzeit in Medizin und Zahnheilkunde gebräuchlichen Lasersysteme bezüglich der genannten Anforderungen, so zeigen sich hinsichtlich der Hart und Weichgewebswirkung einschließlich des Sterilisationseffektes der CO2-Laser sowie der Er:YAG-Laser prinzipiell als geeignet. Die sterilisierende Wirkung des CO2-Lasers ist seit langem belegt [Zakariasen, 1986]. Titan weist im Emissionsbereich des CO2- Lasers (ë=10,6 μm) aber eine geringere Absorption auf als beim Er:YAG-Laser (ë=2,94 μm) [Thull, 1999]. Daher kann der CO2-Laser grundsätzlich für die vorliegende Indikation in der kombinierten Anwendung an Hart- und Weichgeweben sowie am Titan als sehr gut geeignet gelten. Tierexperimentelle und erste klinische Ergebnisse bestätigen diese Einschätzung (Abb. 3 bis 6) [Deppe et al., 2003 b]. Allerdings ist streng auf die Einhaltung gesicherter Parameter zu achten, da es sonst zu erheblichen Schäden an der Titanoberfläche beziehungsweise der Restosseointegration kommen kann.
Aufgrund der starken Absorption in Titan und den einhergehenden starken thermischen Schäden scheidet der Nd:YAG-Laser (ë=1,064 μm) für die Laser-Dekontamination derzeit aus [Block, 1992]. Positive Resultate liegen hingegen auch zur Anwendung der Diodenlaser (ë=810 nm beziehungsweise 980 nm) sowie des Er:YAG-Lasers vor [Bach et al., 2000, Keller, 2000, Romanos et al., 2000, Schwarz et al., 2003 und 2004, Sennhenn-Kirchner et al., 2002]. In einer klinischen Untersuchung konnte nach Anwendung eines Diodenlasers über einen Fünf- Jahres-Zeitraum die Rezidivquote auf sieben Prozent gesenkt werden [Bach et al., 2000]. Ebenso konnte der Er:YAG-Laser in klinischen Pilotstudien erfolgreich zur Periimplantitis- Therapie eingesetzt werden [Keller, 2000; Schwarz et al., 2004]. Eine interessante Neuentwicklung ist in einer Variante der photodynamischen Therapie zu sehen. Dazu werden photosensitive Farbstoffe aufgetragen, welche infolge der Bestrahlung mit einem geeigneten Laserlicht (ë=906 nm) zur Keimabtötung führen. In Verbindung mit nicht resorbierbaren Membranen wurde so ein mittlerer Knochengewinn von zwei Millimetern nach 9,5 Monaten erreicht [Haas et al., 2000]. Histologisch verifizierte Reappositionen liegen bislang allerdings nur für die CO2-Laser-Dekontamination vor [Deppe et al., 2001 und 2002] (Abb. 6).
Defektmanagement
Rein horizontale Knochenresorptionen ohne klinisch auffällige Entzündungszeichen und langsamen Verlauf können als Involutionsvorgänge gedeutet werden. Sie zwingen daher nicht zur Therapie; eine regelmäßige Kontrolle im üblichen Recall ist aber unerlässlich.
Röntgenologisch horizontale oder flache schüsselförmige Defekte mit chronisch progredientem Knochenabbau und erhöhten Entzündungsparametern, vergleichbar den Therapieklassen eins und zwei nach Spiekermann [Spiekermann, 1994], sind nach der Initialbehandlung meist chirurgisch-resektiv anzugehen. Die Dekontamination der Implantatoberflächen lässt sich mit Pulver- Wasserstrahlgeräten, vorteilhaft in Kombination mit einer CO2-Laserbestrahlung durchführen. Der Knochen selbst sollte angefrischt und nivelliert werden. Eine leichte Resektion der Mukoperiostlappen vereinfacht die apikale Verschiebung vor der Nahtversorgung. Bei einer mittleren Nachbeobachtungszeit von 17 Monaten hatte sich bei der chirurgisch-resektiven Therapie eine statistisch signifikante Überlegenheit der CO2-Laser-Dekontamination im Vergleich zur konventionellen Dekontamination ergeben [Deppe et al., 2003 b].
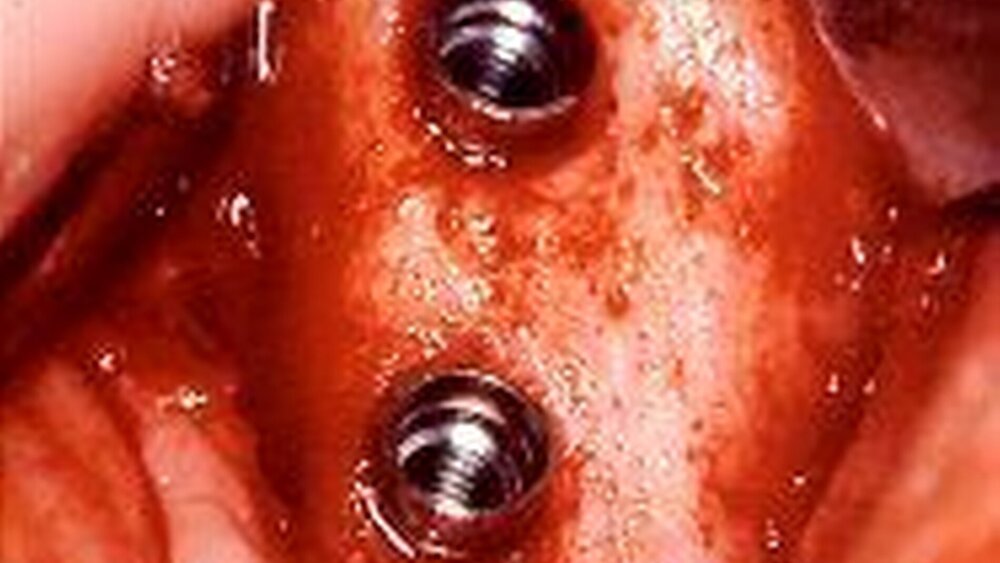
Für röntgenologisch trichter- und spaltförmige periimplantäre Defekte mit chronisch progredientem Knochenabbau und erhöhten Entzündungsparametern, vergleichbar den Therapieklassen drei und vier nach Spiekermann [Spiekermann, 1994], bieten sich chirurgisch-resektive oder augmentative Verfahren an [Buser et al., 1990 a]. Bei dieser Defektmorphologie erscheint die infrakrestale Dekontamination der Implantatoberflächen mithilfe der CO2-Laserbestrahlung besonders geeignet, da der grazile Laserstrahl auch engste Spalträume erreichen kann (Abb. 7 bis 11). Distale Flächen erfordern unter Umständen die Verwendung von Umlenkspiegeln, die auf das Handstück aufgeschraubt werden können.
Die Membrantechnik wird in dieser Indikation allerdings kontrovers diskutiert aufgrund der hohen Zahl an vorzeitigen Membranexpositionen, die sowohl nach konventioneller als auch Laser-assistierter Implantat- Dekontamination zu beobachten waren [Augthun et al., 1992; von Arx et al., 1997; Haas et al., 2000; Jovanovic et al., 1993]. Offenbar bedingen auch die derzeitigen Techniken der Laser-Dekontamination keinen vorhersagbaren Erfolg der Membrananwendung.
Bei Verwendung von Knochenersatzmaterialien ist derzeit ebenfalls kein vorhersagbarer Erfolg hinsichtlich histologisch verifi zierter Knochenreappositionen in der Literatur belegt [Grunder et al., 1993; Nociti et al., 2001]. Bessere Resultate bezüglich der Defektauffüllung waren mit blockförmigen autogenen Knochenspänen nach konventioneller Dekontamination zu erzielen; ohne Membranabdeckung gelang so eine rezidivfreie Defektauffüllung von 90 Prozent [Behneke et al., 2000, Behneke und Behneke, 2004 b].
Explantation
Zeigt sich im Verlauf der Behandlung, dass die Progredienz der Entzündung nicht zu stoppen ist, so sollte das Implantat zur Vermeidung weiterer Knochenresorptionen entfernt werden. Ist das Implantat bereits makroskopisch sichtbar gelockert, so sollte eine umgehende Entfernung erfolgen. Mit durchmesserabgestimmten Explantationsfräsen gelingt die Entfernung heute üblicher rotationssymmetrischer Implantate Substanz schonend. Auf eine ausreichende Aufklärung ist vor dem Eingriff zu achten (Frakturgefahr im Unterkiefer, Nervverletzung) und bei Belassen des Implantates ist auf den fortschreitenden Knochenverlust hinzuweisen. Zudem sollte geklärt werden, ob eine Erweiterung des ZE möglich ist oder ob eine Nachimplantation (gegebenenfalls mit Augmentation) erforderlich wird.
Zusammenfassung
Periimplantäre Infektionen führen unbehandelt zum Verlust des betroffenen Implantates. Mit den konventionell zur Verfügung stehenden Mitteln, wie Küretten, ist bei engen, spaltförmigen Defekten weder eine vollständige Entfernung des Granulationsgewebes noch eine Dekontamination der Implantatoberflächen möglich. Die infrakrestale Anwendung von Pulver-Wasserstrahlgeräten birgt infolge des hohen Drucks ein Embolierisiko. Auch die antibiotische Therapie ermöglicht keine Oberflächen- Dekontamination. Zudem ist eine mögliche Resistenzentwicklung von Keimen nicht zu unterschätzen.
Diese Probleme treten dagegen nicht auf bei den dargestellten modernen Laser-assistierten Verfahren. Insbesondere für infrakrestale, spaltförmige Defektkonfigurationen kann daher die Laser-Dekontamination wissenschaftlich abgesichert empfohlen werden, da der grazile Laserstrahl die Verdampfung von Plaque und Granulationsgewebe auch in der Tiefe schmaler Knochendefekte ermöglicht. Eine abschließende Bewertung der am besten geeigneten Laserwellenlängen und Behandlungsprotokolle ist aber derzeit noch nicht möglich. Problematisch erscheint weiterhin die vollständige Reinigung der Unterflächen von Gewindegängen.
Bei Augmentation periimplantärer Defekte ist derzeit noch keine Überlegenheit der Laser- Dekontamination gegenüber der konventionellen Dekontamination aus der Literatur heraus belegbar. Eine neue Option erschließt sich vermutlich durch Anwendung biologisch aktiver Substanzen, wie der Schmelz-Matrix-Proteine [Casati et al., 2002; Sculean et al., 2004] oder knocheninduzierender Proteine [Hürzeler et al., 1997; Deppe et al., 2003 c], welche in Kombination mit der Laser-Dekontamination aus heutiger Sicht ein Erfolg versprechendes Defektmanagement ermöglichen könnten.
Prof. Dr. Herbert DeppeKlinik und Poliklinik für Mund-, Kiefer- undGesichtschirurgieTechnische Universität München(Direktor: Prof. Dr. Dr. Dr. h.c. Hans-Henning Horch)Klinikum rechts der IsarIsmaninger Straße 2281675 Münchenherbert.deppe@lrz.tu-muenchen.de