Eine neue Herausforderung für die Zahnarztpraxis
Frank Schwarz, Jürgen Becker
Der sechste „European Workshop on Periodontology“ bestätigte die infektiöse Genese periimplantärer Infektionen [Lindhe et al., 2008].
Definition und diagnostische Kriterien
Periimplantäre Infektionen zeichnen sich grundsätzlich durch eine gemischte anaerobe Mikroflora aus, die von gram-negativen Bakterien dominiert wird.
Darüber hinaus wurden auch Mischinfektionen mit Staphylococcus aureus beschrieben [Mombelli Decaillet, 2011; Salvi et al., 2008; Persson Renvert, 2013]. Die klassischen parodontopathogenen Keime Aggregatibacter actinomycetemcomitans, Prevotella intermedia, Porphyromonas gingivalis und Treponema denticola sind nicht spezifisch mit periimplantären Infektionen assoziiert, da sie auch an klinisch und radiologisch unauffälligen Implantaten isoliert werden können [Casado et al., 2011].
Dagegen wurden die putativen Keime Tannerella forsythia, Campylobacter species und Peptostreptococcus micros in einen engen Zusammenhang mit der Diagnose Periimplantitis gebracht [Tabanella et al., 2009].
Das durch die Infektion verursachte, entzündliche Zellinfiltrat ist bei der Mukositis auf das periimplantäre Weichgewebe begrenzt. Bei der Periimplantitis erreicht dieses das knöcherne Implantatlager.
Klinisch imponiert in beiden Fällen die Blutung auf Sondierung (BOP), die bei der Periimplantitis von einer Zunahme der Sondierungstiefe (Pocketing) begleitet wird. Bei fortgeschrittenen Läsionen kann zudem eine putride Sekretion als diagnostisches Kriterium für eine Periimplantitis herangezogen werden (Tabelle 1). Um physiologische Remodellationsvorgänge von einer progredient verlaufenden, pathologischen Knochenresorption diagnostisch abgrenzen zu können, ist die Bewertung einer radiologischen Referenzaufnahme, die idealerweise zum Zeitpunkt der Eingliederung der Suprakonstruktion angefertigt wurde, erforderlich [Lang et al., 2011a].
Demnach ist die klinische Diagnose Periimplantitis durch das Vorliegen der oben genannten klinischen Parameter und durch eine über die physiologische Homeostase hinausgehende Zunahme der radiologisch dokumentierten periimplantären Transluzenz charakterisiert. Grundsätzlich können periimplantäre Infektionen durch das isolierte Betrachten klinischer oder radiologischer Momentaufnahmen nicht eindeutig diagnostiziert werden.
Klinische und radiologische Untersuchung
Weder mukosale noch periimplantäre Infektionen verursachen eine direkte Schmerzsymptomatik, so dass die subjektive Beschwerdefreiheit des Patienten nicht als diagnostisches Kriterium Verwendung finden sollte. Plötzlich auftretende Beschwerden beim Kauen können allerdings als Hinweis für eine Periimplantitis gewertet werden [Tabanella et al., 2009].
Bei der klinischen Untersuchung steht der kontrollierte Sondierungsvorgang ( 0,25 N) als essenzielle Basismaßnahme zur Unterscheidung von gesunden und erkrankten periimplantären Gewebestrukturen im Vordergrund [Lindhe et al., 2008].
Derzeit finden sich keine Hinweise in der Literatur, die einen schädigenden Einfluss konventioneller Parodontalsonden auf die Implantatoberfläche (zum Beispiel Aufrauhungen, Kratzer) dokumentieren und demnach die Verwendung alternativer Sondenmaterialien rechtfertigen würden. Das wiederholte Sondieren periimplantär gesunder Gewebestrukturen war in einer tierexperimentellen Studie jedoch mit einer Epitheltiefenproliferation und mit einer direkt assoziierten krestalen Knochenremodellation zur Wiedereinstellung der biologischen Breite verbunden [Schwarz et al., 2010a].
Um diese negativen mikrotraumatisierenden Effekte auf das subepitheliale Bindegewebe zu vermeiden, sollte sich die Sondierung initial auf den Ausdehnungsbereich des Epithels (etwa 1,5 mm) begrenzen. Ein über diese Referenz hinausgehender Sondierungsvorgang wäre nur bei vorliegender Blutungsneigung zu empfehlen. Fortgeschrittene periimplantäre Infektionen imponieren klinisch sehr häufig durch charakteristische Mukosahyperplasien und sind demnach in aller Regel einfach zu erkennen. Bei einer manifesten Periimplantitis konnte durch die Abnahme der Suprakonstruktion die Abschätzung des Ausmaßes der Knochenresorption während der Sondierung signifikant verbessert werden [Serino et al., 2013].
Die rechtfertigende Indikation zur Anfertigung einer Röntgenaufnahme ergibt sich aus einer klinischen Untersuchung, die die Verdachtsdiagnose Periimplantitis eindeutig begründet. Der intraorale Zahnfilm in Paralleltechnik sollte hierfür als Standardaufnahme bevorzugt werden [Lindhe et al., 2008]. Dreidimensionale bildgebende Verfahren (hier digitale Volumentomografie) bieten darüber hinaus die Möglichkeit, sowohl die Defektkonfiguration als auch die Ausdehnung der Knochenresorption besser darzustellen [Golubovic et al., 2012]. Diese ergänzenden Befunde können für die weitere Behandlungsplanung von klinischer Relevanz sein.
Mikrobiologische Testverfahren, die das klassische Spektrum der parodontalen Markerkeime abdecken, könnten mit Hinblick auf die spezifischen Mischinfektionen zu einer Unterschätzung der tatsächlichen Keimbesiedelung im infizierten periimplantären Bereich führen [Lang et al., 2011a].
Prävalenz und ätiologische Faktoren
Die Inzidenz und Prävalenz periimplantärer Infektionen wird kontrovers diskutiert und primär von den zugrunde liegenden diagnostischen Kriterien bestimmt. Nach einer funktionellen Belastungsphase von fünf bis zehn Jahren wurde die Prävalenz der Mukositis mit 50 Prozent auf Implantat- und 80 Prozent auf Patientenebene beziffert [Zitzmann Berglundh, 2008]. Die Prävalenz der Periimplantitis variierte zwischen zehn Prozent und 43 Prozent auf Implantat- sowie 20 Prozent und 56 Prozent auf Patientenebene [Mombelli et al., 2012; Zitzmann Berglundh, 2008]. Über das potenzielle Auftreten biologischer Komplikationen nach einer Implantatversorgung sollte daher (vergleiche Patientenrechtegesetz) unmissverständlich aufgeklärt werden.
Zahlreiche präklinische und klinische Untersuchungen konnten einen direkten kausalen Zusammenhang zwischen bakteriellen Plaque-Biofilmen und der Entstehung periimplantärer Infektionen belegen. Als weitere gut dokumentierte Risikoindikatoren gelten parodontale Vorerkrankungen und das Rauchen [Heitz-Mayfield, 2008]. Keine direkte Assoziation konnte bisher zur postmenopausalen Osteoporose [Dvorak et al., 2011] oder zu genetischen Polymorphismen [Dereka et al., 2012] gefunden werden.
Unter den lokalen Prädilektionsfaktoren müssen das Fehlen einer keratinisierten Mukosa [Lin et al., 2013], eine Implantatlokalisation im Oberkiefer [Koldsland et al., 2011] sowie versprengte Zementreste [Linkevicius et al., 2012] kritisch bedacht werden. Weiterhin konnten Restdefekte nach einer einzeitigen Augmentation von vestibulären Dehiszenzen nach vier Jahren mit der Diagnose Periimplantitis korreliert werden [Schwarz et al., 2012b]. Einen nicht unerheblichen Einfluss nehmen zudem iatrogene Faktoren, wie zum Beispiel fehlpositionierte Implantate oder insuffiziente prothetische Versorgungen ein [Lang et al., 2011a].
Pathogenese
Grundsätzlich ist die initiale Immunantwort des Wirtes auf eine Plaqueakkumulation im transmukosalen Bereich enossaler Implantate mit der an natürlichen Zähnen vergleichbar [Lang et al., 2011b]. Die strukturbiologischen Eigenheiten der periimplantären Mukosa (das heißt paralleler Kollagenfaserverlauf, reduzierte Vaskularisation) könnten aber mit einer erhöhten Anfälligkeit gegenüber bakteriellen Infektionen einhergehen [Salvi et al., 2012].
Die etablierte Periimplantitis zeigte ein im Vergleich zu einer Parodontitis weiter nach apikal reichendes, entzündliches Zellinfiltrat sowie ein vermehrtes Auftreten neutrophiler Granulozyten und Makrophagen [Berglundh et al., 2011] (Abbildungen 2a, b). Die hierdurch bedingte schnellere Progression einer manifesten Periimplantitis konnte durch eine unphysiologische okklusale Überbelastung [Naert et al., 2012] sowie die Exposition rauer Implantatoberflächen [Renvert et al., 2011b] weiter begünstigt werden.
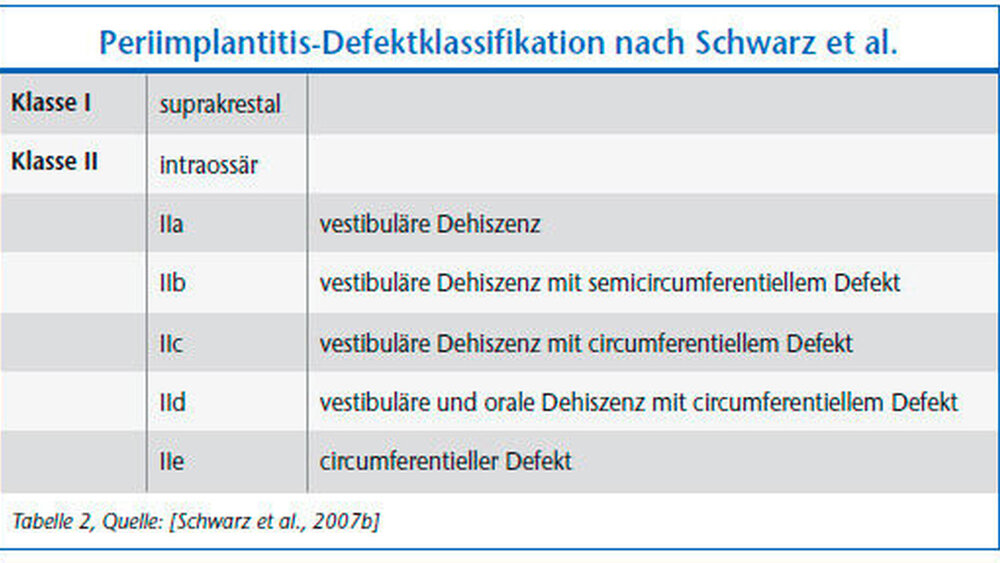
Die hieraus resultierenden periimplantären Knochendefekte lassen sich in definierbare Klassen untergliedern [Schwarz et al., 2007a]. Grundsätzlich kann man eine intraossäre (Klasse I) von einer supraalveolären (Klasse II) Defektkomponente unterscheiden.
Die supraalveoläre Komponente umfasst die Distanz zwischen der Rau-glatt-Grenze des Implantatkörpers und dem angrenzenden krestalen Anteil des periimplantären Alveolarknochens. Die intraossäre Komponente ist in etwa 55 Prozent der Fälle durch ein circumferentielles Abbaumuster charakterisiert. Die übrigen 45 Prozent verteilen sich auf Dehiszenzdefekte mit kombiniert semi- und circumferentiellem Knochenverlust. Fortgeschrittene Läsionen zeichnen sich sehr häufig (etwa 80 Prozent) durch eine kombinierte (Klasse I und II) Defekt- konfiguration aus [Schwarz et al., 2007a] (Tabelle 2).
Therapie der periimplantären Mukositis
Der Übergang von einer Mukositis hin zu einer initialen Periimplantitis ist fließend und weder klinisch noch radiologisch eindeutig darstellbar. Daher sind antiinfektiös gerichtete Therapieansätze bereits bei geringsten Anzeichen für eine periimplantäre Infektion indiziert. Durch die Intensivierung der Mundhygienemaßnahmen konnte nach drei Wochen eine mikrobiologische und immunologische (Matrixmetalloproteinase 8) Reversibilität experimentell induzierter Mukositis-Läsionen im Menschen erreicht werden [Salvi et al., 2012].
Weder der adjuvante Einsatz einer lokalen Applikation von Chlorhexidindigluconat noch eine systemische Antibiose konnten mit einem klinischen oder mikrobiologischen Vorteil gegenüber der mechanischen Therapie alleine belegt werden [Hallstrom et al., 2012; Porras et al., 2002]. Ein konventionelles mechanisches Debridement kann demnach als effektive Maßnahme zur initialen Therapie der Mukositis empfohlen werden [Klinge Meyle, 2012].
Therapie der Periimplantitis
Zahlreiche prospektive randomisierte klinische Vergleichsstudien belegen, dass ein konventionelles mechanisches Debridement mittels Handinstrumenten und lokaler Applikation von Chlorhexidindigluconat (das heißt Karbon/Plastikküretten) eine nur begrenzte Effektivität bei der nichtchirurgischen Therapie der Periimplantitis zu haben scheint [Klinge Meyle, 2012].
Ähnliche Ergebnisse wurden auch für modifizierte Ultraschallsysteme beobachtet [Karring et al., 2005; Renvert et al., 2009]. Durch den adjuvanten Einsatz eines Chlorhexidin-haltigen Chips, lokaler Antibiotika, einer antimikrobiellen photodynamischen Therapie sowie einer Monotherapie mittels eines Er:YAG-Lasers oder eines modifizierten Pulverstrahlgeräts konnten dagegen die klinischen und mikrobiologischen Ergebnisse temporär (drei bis sechs Monate) verbessert werden [Sahm et al., 2011; Renvert, 2008; Schar et al., 2013; Machtei et al., 2012; Schwarz et al., 2006a; Schwarz et al., 2005b].
Die Stabilität des Behandlungserfolgs ( sechs Monate) scheint aber insbesondere bei fortgeschrittenen Läsionen limitiert zu sein [Renvert et al., 2011a; Deppe et al., 2013; Schwarz et al., 2006a]. Diese Rezidivneigung nach einem nichtchirurgischen Therapieverfahren könnte durch die nur unzureichende Entfernung bakterieller Plaque-Biofilme von strukturierten Implantatoberflächen [Schwarz et al., 2009a; Schwarz et al., 2006c; Schwarz et al., 2005a] erklärt werden. Daneben ist die vorwiegend bindegewebige Defektheilung mit einer fortwährenden Exposition strukturierter Implantatanteile (Mikro- und Makrodesign) verbunden [Schwarz et al., 2006b], die ihrerseits die biologische Rekontamination und damit Progression der Läsion fördern [Renvert et al., 2011b].
Bisherige klinische Untersuchungen deuten darauf hin, dass eine chirurgische Intervention zu besseren Behandlungsergebnissen führen kann als die nichtchirurgische Therapie [Klinge Meyle, 2012]. Insbesondere chirurgisch-augmentative Verfahren können nach einer vollständigen Entfernung des Granulationsgewebes und der Dekontamination der Implantatoberfläche zu guten Langzeitergebnissen mit einem derzeitigen Beobachtungsintervall von bis zu vier Jahren führen [Schwarz et al., 2009b; Roos-Jansaker et al.,2011]. Hierbei zeigte insbesondere ein xenogenes Knochenersatzmaterial boviner Herkunft eine bessere Effektivität als autogene oder alloplastische Transplantate [Schwarz et al., 2009b; Aghazadeh et al., 2012; Schwarz et al., 2008]. Das klinische Behandlungsergebnis konnte langfristig weder durch den Einsatz einer Barriere-Membran noch durch die Methode der Oberflächenreinigung und Dekontamination weiter verbessert werden [Roos-Jansaker et al., 2011; Deppe et al., 2007; Schwarz et al., 2012a; Khoury, 2001].
Demgegenüber wurden direkte Einflüsse der Implantatoberflächenstruktur sowie der Defektkonfiguration auf die Wundheilung nach chirurgisch-regenerativer Therapie beschrieben. Insbesondere moderat raue Implantatoberflächen mit circumferentiellen intraossären Defekten und einer nur minimalen suprakrestalen Komponente (bis ein Millimeter) scheinen das beste biologische Kompartiment für chirurgisch-augmentative Verfahren zu bieten [Schwarz et al., 2010b; Roccuzzo et al., 2011].
Bei fortgeschrittenen Defekten können chirurgisch-augmentative Maßnahmen mit resektiven (das heißt Implantatplastik) Verfahren kombiniert werden [Schwarz et al., 2011a; Romeo, 2004; Romeo, 2007]. Hierbei werden die Makro- und die Mikrostruktur des Implantatkörpers in den Bereichen geglättet, die sich außerhalb der physiologischen Barriere (Klasse I: Dehiszenzen / Klasse II 1 mm) für derzeitige Augmenta-tionsverfahren befinden.
Tierexpermentelle und klinische Daten belegen, dass durch diese chirurgische Kombinationstherapie eine histologisch nachweisbare Knochenregeneration/Knochen-Implantat-Wiederanlagerung und eine hiermit verbundene klinische Langzeitstabilität bei fortgeschrittenen und komplexen Defektkonfigurationen erzielt werden kann [Schwarz et al., 2012a; Schwarz et al., 2011b]. Die mit chirurgischen Eingriffen einhergehende mukosale Rezessionsbildung ist durch eine simultane Volumenaugmentation unter Verwendung eines Bindegewebstransplantats oder einer prokinen Kollagenmatrix kompensierbar und ermöglicht demnach auch eine Erweiterung des Indikationsbereichs auf die ästhetische Zone [Schwarz et al., 2013b; Schwarz et al., 2013a] (Abbildungen 3a bis h).
Grundlegend sollten chirurgische Verfahren nur nach vorausgehender nichtchirurgischer Initialtherapie sowie kritischer Abwägung systemischer und lokaler Risikofaktoren in Erwägung gezogen werden. Eine absolute Indikation zur Explantation stellt der vollständige Verlust der Osseointegration dar.
Prof. Dr. med. dent. Frank SchwarzProf. Dr. med. dent. Jürgen BeckerPoliklinik für Zahnärztliche Chirurgie und Aufnahme,Westdeutsche KieferklinikHeinrich-Heine-UniversitätMoorenstr. 540225 DüsseldorfFrank.Schwarz@med.uni-duesseldorf.de
Fazit für die Praxis
• Risikofaktoren für periimplantäre Infektionen müssen bereits in der Planungsphase einer Implantatversorgung berücksichtigt werden.
• Patienten müssen über mögliche biologische Komplikationen aufgeklärt werden.
• Ein patientenspezifisches Recallintervall sollte die diagnostischen Kriterien für periimplantäre Infektionen engmaschig kontrollieren und einen Therapiebedarf rechtzeitig feststellen.
• Die perimplantäre Mukositis kann reversibel therapiert werden.
• Die Therapie der Periimplantitis gestaltet sich häufig komplexer. Während nichtchirurgische Interventionen die Progression initialer Läsionen limitieren können, sind refraktäre oder fortgeschrittene Läsionen derzeit nur durch chirurgisch-augmentative/resektive Therapieverfahren zu kontrollieren.
• Die Explantation stellt für die meisten Patienten eine nicht akzeptable Therapiealternative dar.