Das Dynamische Digitale Modell (DDM) als fünfte Dimension
Die Grundlage für das Dynamische Digitale Modell (DDM) ist das Prinzip der schnellen intraoralen 3-D-Erfassung. Mit den derzeitigen auf dem Markt befindlichen Intraoralscannern ist es möglich, sehr schnell intraorale Oberflächen in 3-D zu erfassen [Sfondrini et al., 2018; Joda et al., 2017]. Mit den im Scankopf eingebauten optischen Mess-Systemen können allerdings jeweils immer nur Ausschnitte im Sinne von Einzelaufnahmen des Kiefer- beziehungsweise Zahnbogens dreidimensional erfasst werden, die der Größe des „Scanfensters“ entsprechen. Jede Einzelaufnahme stellt ein mehr oder weniger genaues dreidimensionales Abbild des jeweiligen Abschnitts der Mundhöhle dar.
Die aufgenommene Oberfläche wird durch aneinander gesetzte Dreiecke am Computer-Bildschirm beschrieben. Ebene Flächen können durch entsprechend große Dreiecke definiert werden. Dagegen müssen geometrische Umbrüche wie Inzisalkanten oder Präparationsgrenzen durch entsprechend kleine Dreiecke, die in definierten Winkeln zueinander angeordnet sind, dargestellt werden. Jedes Dreieck ist über drei Eckpunkte „aufgespannt“ (codiert). Die Eckpunkte ihrerseits sind jeweils durch eine x-, y- und z-Koordinate in einem definierten 3-D-Koordinatensystem positioniert. In ihren Knotenpunkten aneinanderstoßende Dreiecke haben selbstverständlich denselben Eckpunkt gemeinsam. Diese durch Dreiecke und mit dem entsprechenden Code beschriebenen Oberflächenstrukturen werden „stl“-Datensätze (Dateiformat: surface tesselation language) genannt und liegen fast allen Oberflächendatensätzen zugrunde, die mit Intraoralscannern aufgenommen werden. Am Bildschirm sind die Dreiecksstrukturen für den Anwender aufgrund von weiteren Darstellungs-Programmierungen nicht erkennbar. Zusätzliche Informationen wie die „Echtfarbendarstellung“ vervollständigen die Visualisierung.
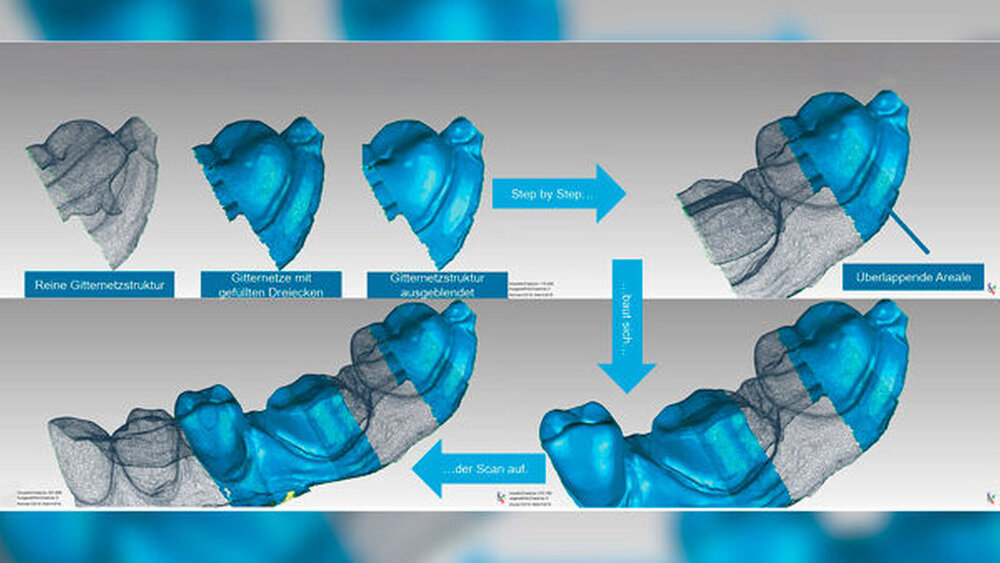
Zurück zu unseren Einzelaufnahmen: Um eine Gesamtkieferaufnahme zu erstellen, müssen die Einzelaufnahmen – unabhängig davon, wie viele in der Sekunde vom jeweiligen Scanner erstellt werden – zusammengesetzt werden. Voraussetzung dafür ist, dass Einzelaufnahmen, die zusammengesetzt werden sollen, zu einem gewissen Grad identische (korrespondierende) Oberflächen aufweisen. Die Algorithmen in der Software „suchen“ nach diesen korrespondierenden Arealen. Sind diese identifiziert, werden sie bestmöglich zur Überlagerung gebracht, wie in Abbildung 1 gezeigt. Dieser Vorgang wird als Registrierung bezeichnet. Je markanter die korrespondierenden Areale sind, desto zuverlässiger funktioniert das Registrieren der Einzelaufnahmen.
So können markante Höckerreliefs von Molaren durch die in der Aufnahmesoftware implementierten Algorithmen zuverlässiger registriert werden als strukturlose, steil abfallende Frontzahnareale oder gar plane, zahnlose Mundschleimhautabschnitte [Reich und Wöstmann, 2018]. Durch den Registrierungsprozess können nun die Einzelaufnahmen zu einem Gesamtmodell zusammengesetzt werden. Das Zusammenfügen der Einzelaufnahmen zu einem Modell wird als „Stitching“ („heften“) bezeichnet. Die digitalen 3-D-Modelle können für die unterschiedlichsten Indikationen erstellt werden. Als erstes denken wir natürlich an Arbeitsmodelle zur Herstellung von Zahnersatz. Dieser Aspekt soll hier aber völlig ausgeklammert werden, denn die Benutzerfreundlichkeit der modernen Scanner gestaltet die digitale 3-D-Erfassung der bezahnten Bereiche der Mundhöhle derart einfach, dass der Intraoralscanner viel mehr Einsatzmöglichkeiten bietet.
Das digitale 3-D-Modell für Befundung, Diagnose, Planung, Monitoring
Das ist jetzt schon möglich
Das digitale 3-D-Modell hat das Potenzial, das Basiswerkzeug für Befundung, Diagnose, Planung und Monitoring zu werden, denn die mit dem Scanner erstellten Modelle stellen die Drehscheibe für die vierte Dimension dar – sie bieten weit mehr als eine bloße dreidimensionale Darstellung der Mundhöhle.
Beispiel 1: Visualisierung schafft Mehrwert
Die 3-D-Visualisierung bietet erhebliche Vorteile hinsichtlich interdisziplinärer Planung und Diagnose.
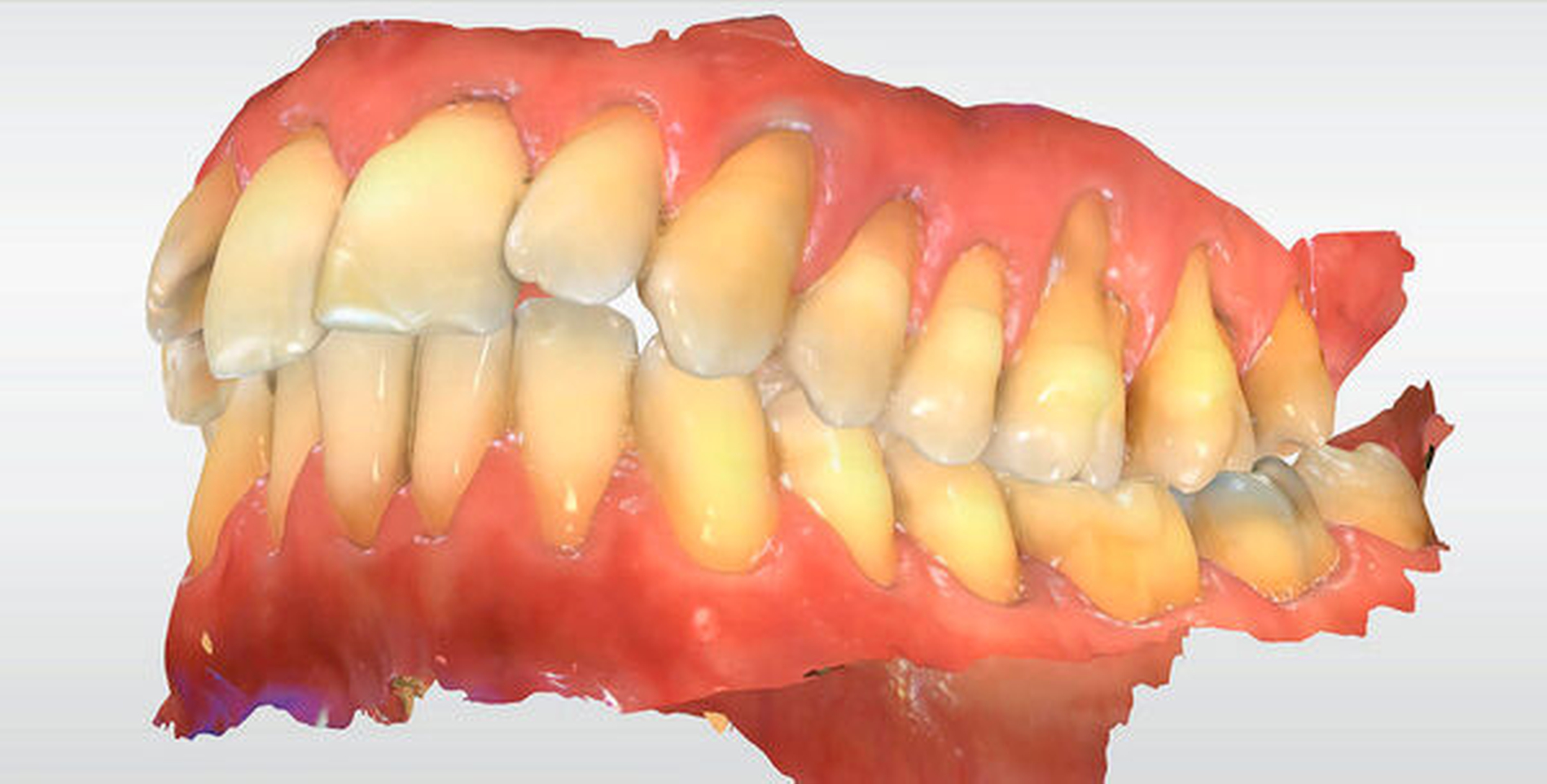
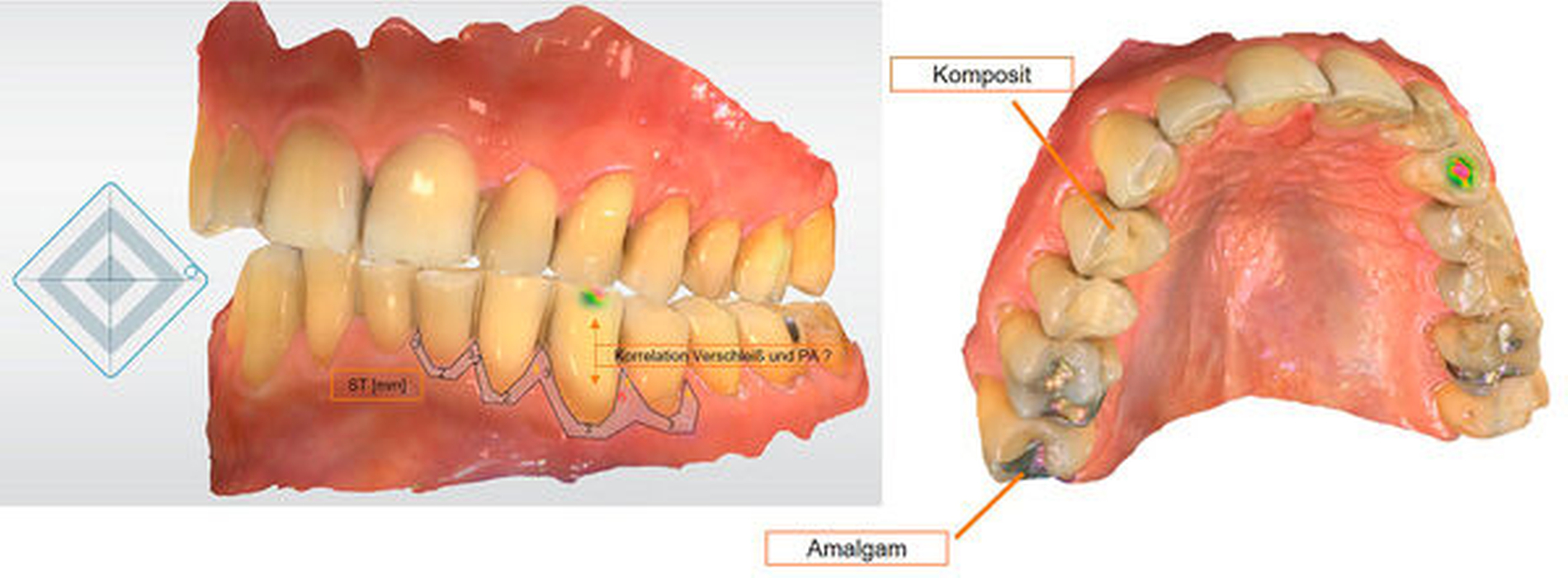
Die bei der Vorstellung des Patienten in Abbildung 2 festgestellten Rezessionen können in Echtfarben und gleichzeitig dreidimensional dargestellt werden, die Modelle können in alle Raumrichtungen gedreht, in Okklusion oder getrennt analysiert werden. Ein Hineinzoomen in interessierende Bereiche ermöglicht die spezielle Analyse. Die Animation oder das manuelle Bewegen der Modelle – hier über Mittelwerte berechnet– gestattet die Identifikation von Parafunktionen. Häufig dem Patienten nicht bewusste und teils extreme Parafunktionen, die zu starken Schlifffacetten führen, können ihm so visualisiert werden.
Abbildung 3 zeigt eine solche Visualisierung. Die Bewegung der Modelle zueinander – also eine zeitabhängige Simulation (zum Beispiel von Interkuspidation bis in eine Laterotrusionsposition) – stellt eine Variante der vierten Dimension dar. Die Bilder und Animationen können vom Parodontologen hinsichtlich der Therapiefähigkeit und -notwendigkeit beurteilt werden. Der Kieferorthopäde kann die Notwendigkeit und den Aufwand einer funktionellen Verbesserung durch sein Fachgebiet abschätzen und den Bedarf weiterer diagnostischer Maßnahmen definieren. Dem Patienten wiederum können die Befunde und möglichen Therapien visualisiert werden.
Beispiel 2: Implantatplanung
Für die geführte Implantologie können 3-D-Modelle hervorragend für ein 3-D-Setup zur prothetischen Planung verwendet werden. Die Oberflächen des Intraoralscans können mit der digitalen Volumentomografie fusioniert werden. Diese Registrierung von DVT und 3-D-Oberflächendatensatz ist bei entsprechend vorhandenen korrespondierenden Strukturen, meist artefaktfreie Restzähne, möglich. Somit lassen sich die Implantate sowohl zum prothetischen Setup als auch zu den schonungspflichtigen Strukturen, die in der DVT abgebildet sind, virtuell ausrichten. Auf Basis dieser Planung lässt sich die Schablone für die geführte Implantatinsertion herstellen oder es lassen sich die Daten für die dynamische Implantat-OP generieren.
Beispiel 3: Monitoring
In Abbildung 4 werden die 3-D-Intraoralscans einer Patientin gezeigt, aufgenommen bei den jährlichen Recalls, um den Verschleiß über die Zeit zu überwachen (also die klassische vierte Dimension). Mithilfe entsprechender Analysesoftware ist es möglich, die Modelle zu überlagern (registrieren). Dieser Vorgang ist ähnlich dem oben beschriebenen Suchen nach korrespondierenden Flächen beim Zusammensetzen von Einzelaufnahmen. Auch beim Überlagern von zwei Modellen zum Zweck des Oberflächenvergleichs wird nach identischen korrespondierenden Strukturen gesucht, diesmal nur jeweils in zwei bereits vorhandenen 3-D-Modellen.
Die Software nähert bei der Registrierung die zu überlagernden Modelle immer weiter zueinander an, indem bei den Annäherungsschritten jeweils nach den besten übereinstimmenden Strukturen gesucht wird (Best-Fit-Algorithmus), bis eine optimale Zuordnung gefunden ist. Bildlich kann sich ein „Einrütteln“ der Modelle zueinander vorgestellt werden. Nach Beendigung dieses Zuordnungsprozesses kann dann das eine Modell relativ gesehen an einigen Stellen geringfügig über dem anderen Modell zu liegen kommen. In anderen Bereichen kann es umgekehrt sein.
Ist über die Zeit Verschleiß aufgetreten, so liegen die Verschleißareale, die auf dem Follow-up-Modell (= das zu einem späteren Zeitpunkt erstellte Modell) abgebildet sind, unterhalb der Oberfläche des Baselinemodells (= das Modell, das zuerst erstellt wurde). Diese Unterschiede können durch eine farbcodierte Darstellung visualisiert oder auch metrisch erfasst werden. Diese Farbdarstellung ist für den Betrachter nahezu selbsterklärend. In der Literatur gibt es vermehrt Hinweise darauf, dass Verschleißmessungen auf der Basis von mit einem Intraoralscanner erhobenen Daten durchgeführt werden können [Kumar et al., 2019; Hsu et al., 2020; O‘Toole et al., 2020; Hartkamp et al., 2017; Hartkamp et al., 2017a; Kühne et al., 2021].
Es müssen aber auch einige Dinge beachtet werden:
Beim Registrierungsprozess können Schwellenbereiche entweder manuell oder softwareseitig definiert werden, so dass Oberflächen für den Überlagerungsprozess nicht mehr berücksichtigt werden, wenn sie von ihren vermeintlich korrespondierenden Oberflächen im Vergleichsmodell zu sehr abweichen. Somit werden ein zu „tiefes“ Einrütteln und eine zu geringe Berechnung der Distanzunterschiede im Bereich der Verschleißareale verhindert [Kühne et al., 2021]. Im besten Fall weisen Gesamtkieferaufnahmen bezahnter Kiefer in In-vitro-Versuchen eine mittlere positive und negative Abweichung zum Original von circa 30 µm auf [Reich et al., 2020; Ender et al., 2019]. Da prinzipiell mit einem Verzug beider zu überlagernden Modelle auch in gegensätzliche Richtungen gerechnet werden kann, birgt eine Gesamtkieferüberlagerung stets die Gefahr von Fehlinformationen. Somit wäre es für den Fall von Verschleißmonitoring in der Zukunft wünschenswert, wenn der Zahnbogen automatisch segmentiert würde und die einzelnen Zähne nach einer groben Vorüberlagerung dann getrennt analysiert würden. Damit wäre der Fehlereinfluss eines Gesamtkieferverzugs eliminiert.
Zusätzlich schließt die Segmentierung des Zahnbogens und somit der Vergleich desselben Einzelzahns zum Zeitpunkt Baseline und Follow-up eine weitere Fehlerquelle: die der Zahnwanderung. Obwohl diese aufgrund charakteristischer flächiger Farbkodierungen häufig visuell detektiert werden kann, ist sie für die korrekte Verschleißmessung ein nicht zu unterschätzendes Phänomen.
Beispiel 4: Zahnwanderungen identifizieren
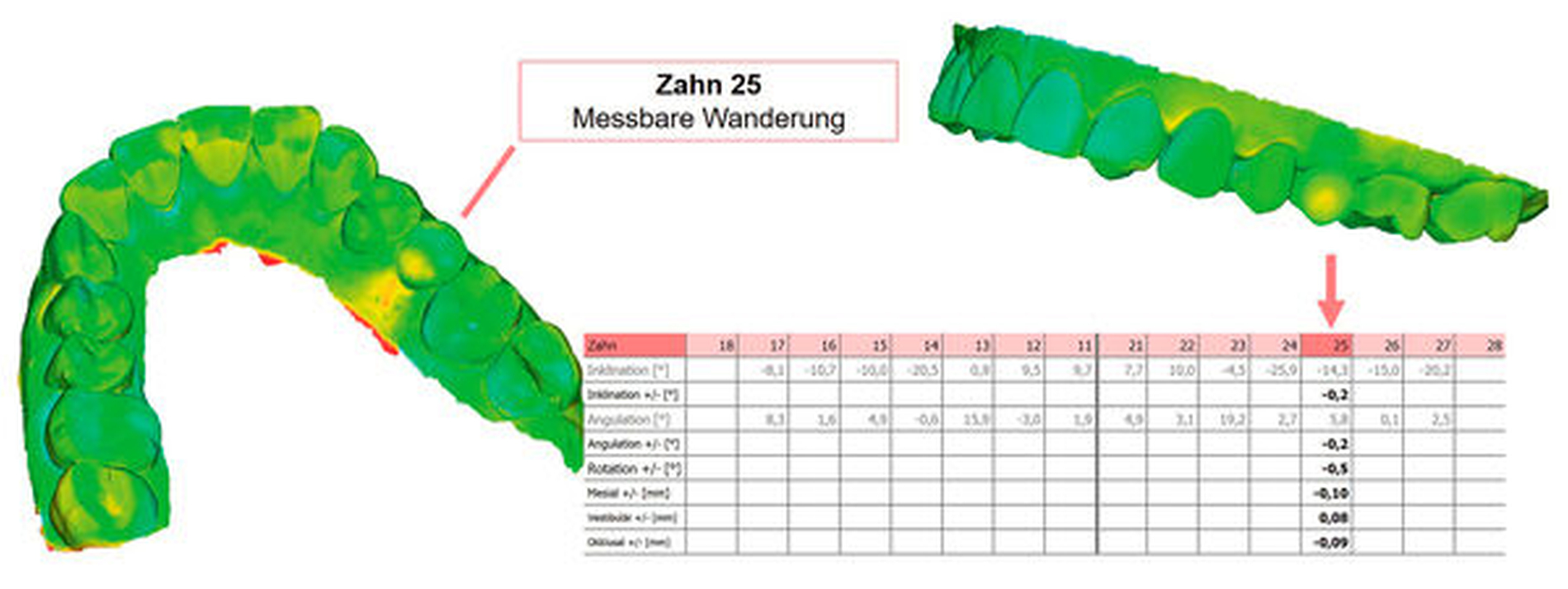
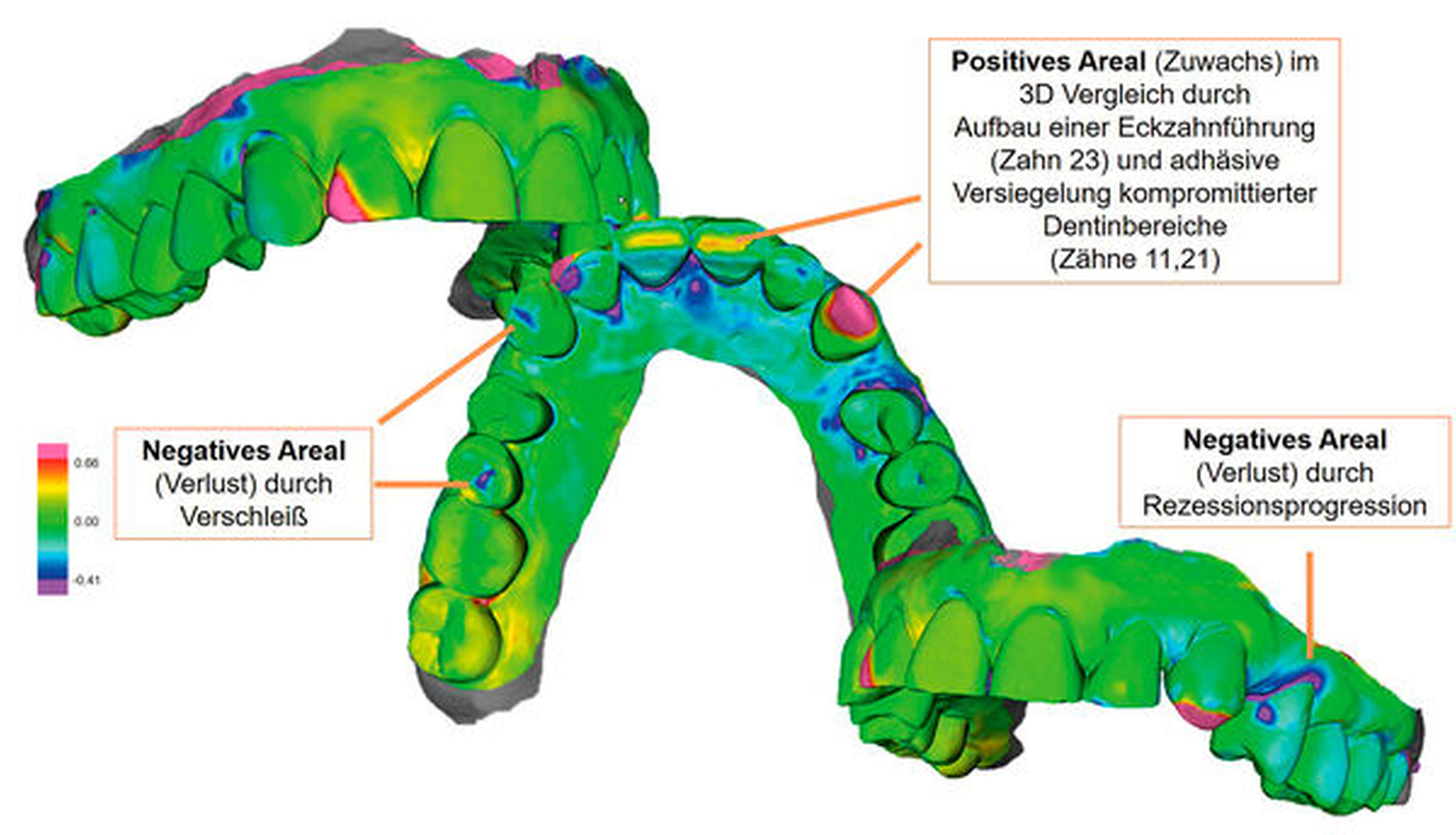
Auch die Analyse von Zahnwanderungen stellt die Berücksichtigung der vierten Dimension dar. Allerdings muss für die Detektion von Zahnwanderungen eine andere Messstrategie angewandt werden. Gibt es im Zahnbogen Areale, bei denen davon ausgegangen werden kann, dass sie wenig oder gar keinen Wanderungstendenzen unterliegen, können diese als Referenzareale definiert werden, so dass Baseline- und Follow-up-Modell nur über diese Strukturen überlagert (registriert) werden. Implantatsuprakonstruktionen stellen solche Areale dar. Sind keine „wanderungsresistenten“ Kieferabschnitte vorhanden, muss der Gesamtkiefer überlagert werden. Wanderungen lassen sich dann anhand charakteristischer Farbcodierungen identifizieren. Ein beispielsweise nach bukkal gewanderter Zahn weist in Relation zu den Nachbarzähnen eine vestibuläre „Substanzzunahme“ und eine orale „Substanzabnahme“ auf (Abbildung 5).
Beispiel 5: Monitoring des Weichgewebes
Selbstverständlich ist auch das Monitoring von Rezessionen oder Dimensionsänderungen der Mundschleimhaut möglich. Weist ein Patient kompromittierte Schleimhautverhältnisse auf, so können die Veränderungen dokumentiert und einfach visualisiert werden. Das Auftreten von gingivalen Schwellungen kann im Rahmen von jährlichen Routinescans ebenso detektiert werden wie der Erfolg von Hygienemaßnahmen oder das Beseitigen von iatrogenen Reizen.
Das Überlagern von digitalen 3-D-Modellen ist bei einigen Intraoralscannern bereits implementiert, beziehungsweise durch Zusatzmodule „zubuchbar“.
Das digitale 3-D-Modell als „01-Korrelat“ – ein nahes Zukunftsszenario
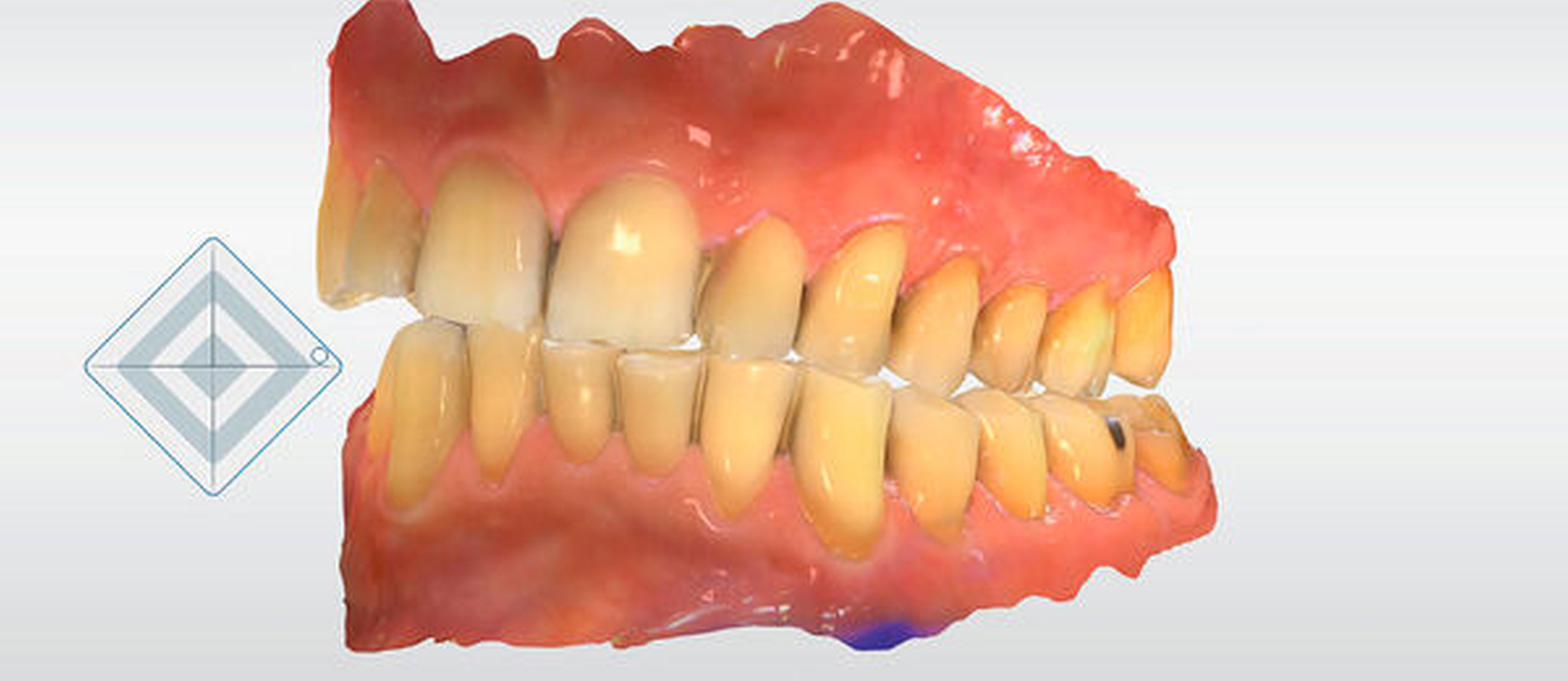
Da der Intraoralscan beim bezahnten Kiefer mit den Scannern der neuen Generation sehr anwenderfreundlich ist und ein Befundscan im Standardfall von einer einzigen Person durchgeführt werden kann, ist es in einigen Praxen, in denen ohnehin Intraoralscanner vorhanden sind, mittlerweile üblich, anlässlich der jährlichen Routinekontrolle auch einen 3-D-Scan zu erstellen. Zusätzlich werden zurzeit ein 01-Befund und ein Parodontalscreening durchgeführt. Der 01-Befund und der Intraoralscan stellen eine sich zum Teil überschneidende Doppeldokumentation dar. Zu erwarten ist, dass es möglich sein wird, in den Intraoralscan eine Art Vorbefund zu integrieren: Nach automatisierter Zahnschema-Identifikation können Restaurationen anhand der lichtoptischen Erfassung aufgrund der unterschiedlichen Oberflächeneigenschaften von natürlicher Zahnhartsubstanz abgegrenzt und sogar in ihrer Art identifiziert werden. Der Behandler muss jetzt noch die Suffizienz der Restaurationen klinisch überprüfen. In einigen Intraoralscannern sind Systeme auf Basis der Transilluminations- und der Fluoreszenzmethodik zur Kariesdetektion auf natürlichen Zahnhartsubstanzflächen bereits integriert [Suese, 2020]. Auch der parodontale Gesamtbefund beziehungsweise einzelne kritische Sulkussondierungstiefen könnten ins 3-D-Modell in Echtzeit integriert und vor allem in Relation zum Gingivaverlauf visualisiert werden (Abbildung 6). Ebenso könnten digitale 2-D-Röntgenbilder einbezogen werden.
Dieser nun in 3-D visualisierte Befund des Patienten wird über eine entsprechende Schnittstelle in der elektronischen Karteikarte gespeichert. Durch das jährliche Befundupdate können die 3-D-Befundmodelle in einer Timeline eingeblendet werden. Jetzt können die interessierenden Teilaspekte wie zum Beispiel die Sulkussondierungstiefen ausgewählt und deren Entwicklung über die Zeit durch Überlagerung visualisiert werden. Natürlich ist hier auch die Implementierung einer automatisierten Hilfestellung zur Erkennung von Veränderungen denkbar. Auf diese Weise gelingt ein zuverlässiges, schnelles und anwenderfreundliches computergestütztes 3-D-Monitoring unserer Patienten über die Zeit.
Das digitale 3-D-Modell und der codierte Patient
Mögliche und wünschenswerte Entwicklungen
Voraussetzung für die Integration aller intraoralen Befunde im dreidimensionalen Modell ist die Einbettung des Intraoralscanners unabhängig vom Hersteller in die jeweilige Praxisverwaltungssoftware. Dies bedeutet, dass beim Einschalten des Scanners sämtliche Patientendaten ausgetauscht werden können: Die Karteikarte des Patienten und die Scannersoftware sind stets auf demselben Stand, eine getrennte Eingabe von Personendaten ist nicht mehr notwendig. Anamnesen, allgemeinmedizinische Befunde, zahnmedizinische Befunde und auch Texteinträge werden in ein allgemeingültiges maschinenlesbares Format kodiert.
Im Bereich der Medizin existiert beispielsweise SNOMED (Systematized Nomenclature of Medicine Clinical Terms) als ein solcher Code. Dabei handelt es sich um eine Nomenklatur (Terminologie). Die Basis stellen sogenannte Konzepte dar. Diese können als medizinische Bedeutungseinheiten bezeichnet werden. Die den Bedeutungseinheiten zugeordneten Begriffe sind eindeutig in einen jeweils spezifischen Zahlencode übersetzt und in Hierarchien angeordnet. Zudem sind die Konzepte logisch verknüpft. Auch diese Verknüpfungen sind über Relationscodes numerisch beschrieben.
Dynamisches Digitales Modell (DDM)
Die visionäre Idee des DDM ist in einer Arbeitsgruppe aus Hochschulmitarbeitern, engagierten Zahnärzten und Industrievertretern rund um den AG-Keramik-Vorstandsvorsitzenden Dr. Bernd Reiss entstanden. Im Mittelpunkt steht die Möglichkeit, mit einem Intraoralscanner zu jedem zahnärztlichen Recall ein 3-D-Modell der Gebisssituation der Patienten zu erstellen und dieses mit den vorangegangenen Scanmodellen zu vergleichen.
Auf diese Weise entsteht ein engmaschiges Monitoring, das Veränderungen frühzeitig identifiziert. Über die Einbindung allgemeinmedizinischer Daten und gegebenenfalls von Algorithmen künstlicher Intelligenz lassen sich weitergehende diagnostische und therapeutische Informationen generieren. Die Implementierung eines solchen Konzepts könnte die zahnärztliche Arbeit signifikant erleichtern und die Patientenversorgung verbessern, wobei die durch die Digitalisierung und Datenverknüpfung entstehenden Möglichkeiten in ihrer Gänze heute noch gar nicht absehbar sind.
Ein ähnliches Schema wäre für die Zahnmedizin vorstellbar und soll an folgendem Beispiel entwickelt werden: Der 3-D-Scan könnte eine Bedeutungseinheit darstellen. Damit lassen sich mithilfe der Scannersoftware automatisiert Oberflächenveränderungen wie <Gingivarezessionen>, <Schlifffacetten>, <zervikale Defekte>, <Dentinverschleiß>, <altersuntypische Verschleißareale>, <Verdacht auf Approximalkaries>, <Verdacht auf Fissurenkaries>, <ungewöhnliche farbliche Mundschleimhautveränderungen> dokumentieren und analysieren. Sämtliche Begriffe sind in einen spezifischen Zahlencode übersetzt.
Die Medikamentenanamnese, die allgemeinmedizinische Allgemeinanamnese, die spezielle Anamnese und der Mundschleimhautbefund stellen einige weitere Bedeutungseinheiten dar, die ebenfalls wieder mit hierarchisch angeordneten Begriffen „befüllt“ sind. Ein Beispiel für einen hierarchischen Verzeichnisbaum der Medikamentenanamnese könnte sein:
1. Ebene: <Blutdrucksenker>
2. Ebene: <Diuretika>, <Betablocker>, <Kalziumantagonisten>, <ACE Hemmer>, <AT1-Antagonisten>
3. Ebene: entsprechende Medikamente
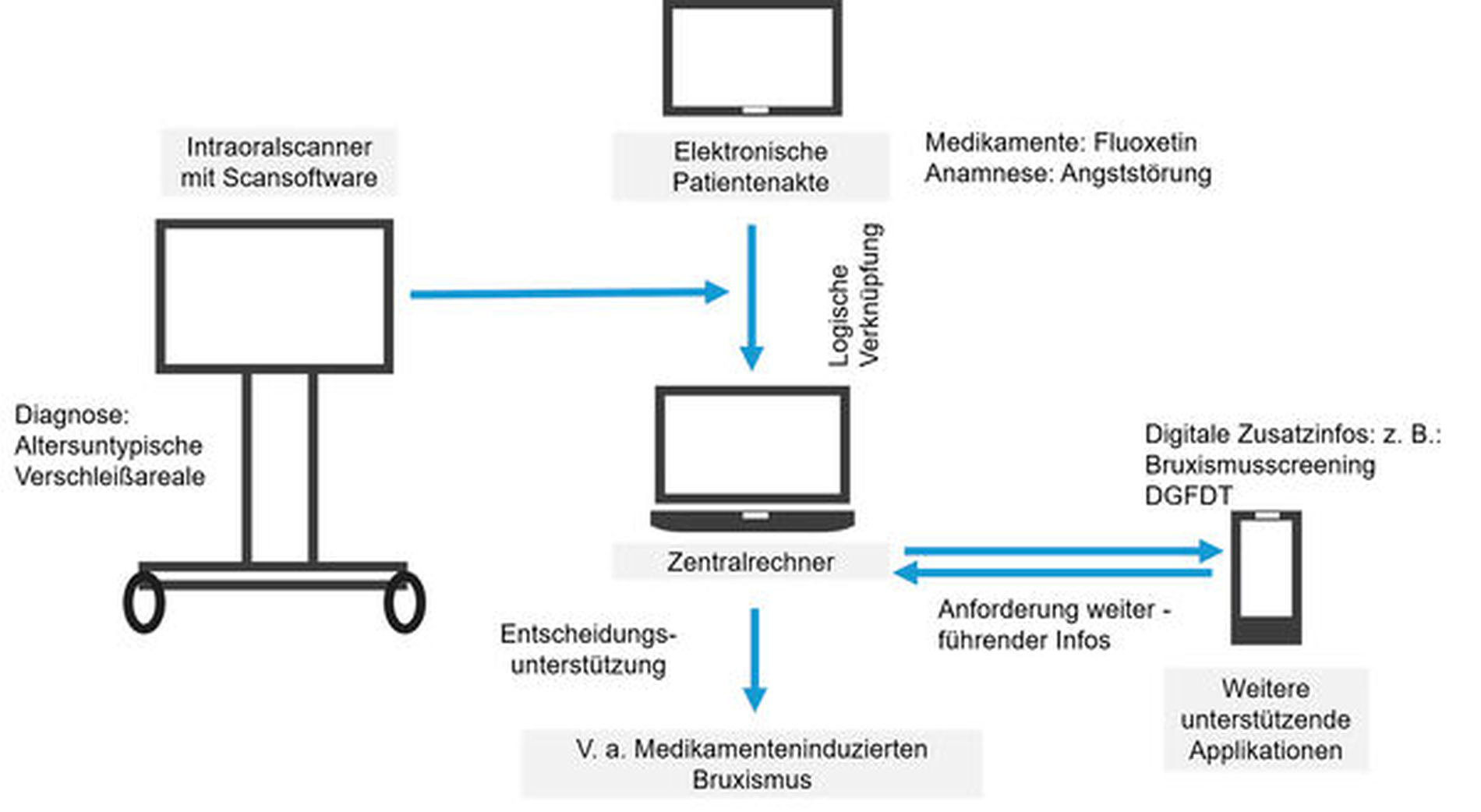
Durch logische Verknüpfung der Bedeutungseinheiten und der Begriffe ist dann eine diagnostische Hilfestellung möglich wie zum Beispiel: Im 3-D-Scan werden von der Scannersoftware altersuntypische Verschleißfacetten detektiert, in der Medikamentenanamnese ist ein Serotoninwiederaufnahmehemmer (zum Beispiel Fluoxetin) hinterlegt. Richtigerweise ist bei der Allgemeinanamnese eine Angststörung des Patienten dokumentiert. Durch logische Verknüpfung weist die Dokumentationssoftware darauf hin, dass die Diagnose <Medikamenten-induzierter Bruxismus> gestellt werden könnte (Abbildung 7). Als weiterführende Diagnostik wird beispielsweise der digitalisierte Bruxismus-Screening-Bogen der Deutschen Gesellschaft für Funktionsdiagnostik und -therapie (DGFDT) vorgeschlagen, der nun vom Patienten nach entsprechend empathischer Aufklärung direkt auf einem Tablet beantwortet werden kann.
Der digitale Einzeldatensatz und das große Ganze
Das im vorhergehenden Abschnitt geschilderte kausale Szenario kann durchaus auch ohne Computerunterstützung vom aufmerksamen Zahnarzt „erdacht“ werden. Durch Vernetzung unserer zahnmedizinischen Konzepte mit denen der Allgemeinmedizin ergibt sich die Chance, dass wir als Zahnärzte auch weit über die Zahnmedizin hinausgehende Verknüpfungen und diagnostische Hinweise ermitteln könnten. Diese Verlinkung mit allgemeinmedizinischen Daten stellt die fünfte Dimension dar. Dafür sind zwei Dinge essenziell: Die Vernetzung der allgemeinmedizinischen elektronischen Patientenakte mit zahnmedizinischen Befunden muss über eine einheitliche Schnittstelle gewährleistet sein. Kausale Verknüpfungen und daraus resultierende Diagnosehilfestellungen sind nur möglich, wenn über entsprechende Auswertungsstrategien wie neuronale Netze das Analysieren riesiger Datenmengen anonymisierter Patientenfälle ermöglicht wird.
Dabei gilt aber die Prämisse, dass sämtliche Diagnosehilfesysteme nur eine Unterstützung für die genuin zahnärztliche Tätigkeit am individuellen Patientenfall darstellen können. Auch moderne Technologien sind kein Selbstzweck oder gar eine künstliche Intelligenz, an die die ärztliche Verantwortung delegierbar wäre – sie sind nicht selbst Lösung, sondern bleiben ein Hilfsmittel in der Hand des Zahnarztes.
Univ.-Prof. Dr. Med. Dent. Sven Reich
Oberarzt an der Klinik für Zahnärztliche
Prothetik und Biomaterialien, Zentrum
für Implantologie der Uniklinik RWTH Aachen
Pauwelsstr. 30, 52074 Aachen
Christina Kühne
Klinik für Zahnärztliche Prothetik
und Biomaterialien,
Zentrum für Implantologie,
Uniklinik Aachen
Literaturliste
1. Sfondrini MF, Gandini P, Malfatto M, Di Corato F, Trovati F, Scribante A. Computerized Casts for Orthodontic Purpose Using Powder-Free Intraoral Scanners: Accuracy, Execution Time, and Patient Feedback. Biomed Res Int. 2018;2018:4103232.
2. Joda T, Lenherr P, Dedem P, Kovaltschuk I, Bragger U, Zitzmann NU. Time efficiency, difficulty, and operator's preference comparing digital and conventional implant impressions: a randomized controlled trial. Clin Oral Implants Res. 2017;28(10):1318-23.
3. Reich S, Wöstmann B. Digitale Abformmethoden. In: Werkstoffe in der Zahnmedizin Moderne Materialien und Technologien; Hrsg: Rosentritt, M; Ilie, N; Lohbauer, U. 2018.
4. Kumar S, Keeling A, Osnes C, Bartlett D, O'Toole S. The sensitivity of digital intraoral scanners at measuring early erosive wear. J Dent. 2019;81:39-42.
5. J FE-U, Hsu SM, Bohorquez AC, Abdulhameed N, Scheiffele GW, Kim M, et al. Novel methodology for measuring intraoral wear in enamel and dental restorative materials. Clin Exp Dent Res. 2020.
6. O'Toole S, Bartlett D, Keeling A, McBride J, Bernabe E, Crins L, et al. Influence of Scanner Precision and Analysis Software in Quantifying Three-Dimensional Intraoral Changes: Two-Factor Factorial Experimental Design. J Med Internet Res. 2020;22(11):e17150.
7. Hartkamp O, Peters F, Bothung H, Lohbauer U, Reich S. Optical profilometry versus intraoral (handheld) scanning. Int J Comput Dent. 2017;20(2):165-76.
8. Hartkamp O, Lohbauer U, Reich S. Antagonist wear by polished zirconia crowns. Int J Comput Dent. 2017;20(3):263-74.
9. Kühne C, Lohbauer U, Raith S, Reich S. Measurement of Tooth Wear by Means of Digital Impressions: An In-Vitro Evaluation of Three Intraoral Scanning Systems. Appl Sci doiorg/103390/app11115161 2021.
10. Reich S, Yatmaz B, Raith S. Do „cut out-rescan“ procedures have an impact on the accuracy of intraoral digital scans? J Prosthet Dent. 2020.
11. Ender A, Zimmermann M, Mehl A. Accuracy of complete- and partial-arch impressions of actual intraoral scanning systems in vitro. Int J Comput Dent. 2019;22(1):11-9.
12. Suese K. Progress in digital dentistry: The practical use of intraoral scanners. Dent Mater J. 2020;39(1):52-6.