Sekretorisches Mamma-analoges Speicheldrüsenkarzinom
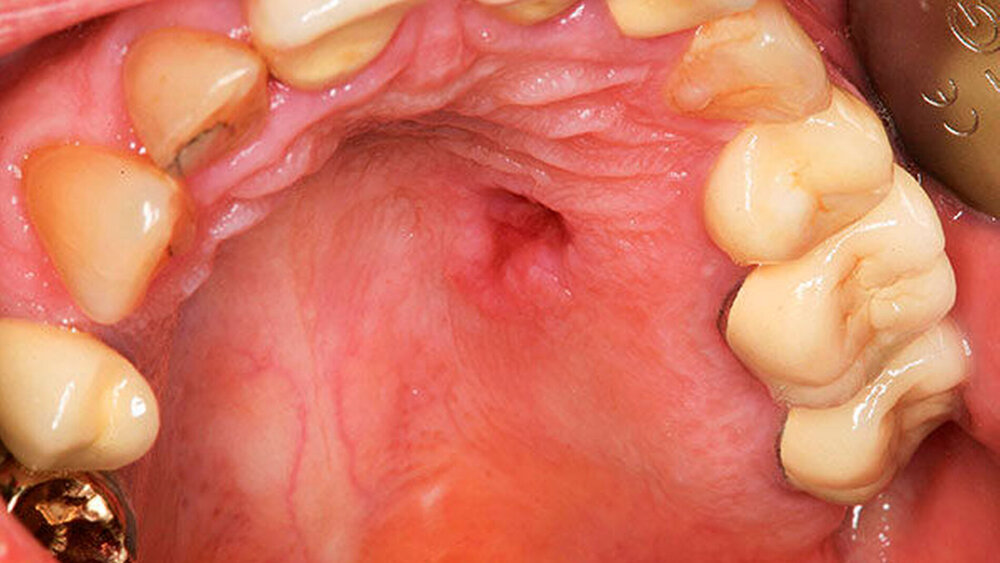
Mit einem histopathologisch alio loco gesicherten Low-grade-Adenokarzinom der kleinen Speicheldrüsen des linken Hartgaumens, das nach konsiliarpathologischer Mitbeurteilung als sekretorisches Karzinom eingestuft wurde, stellte sich eine 51 Jahre alte Frau in der Klinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz, vor. Bei Aufnahme imponierte eine 0,5 cm große Induration des linken Hartgaumens Regio 24/25 bei Zustand nach Probenentnahme alio loco (Abbildung 1).
Anamnestisch konnte eruiert werden, dass die Neoplasie erstmals vor sechs Wochen als „weißer Pickel“ aufgefallen war. Nach Abklärung über den Hauszahnarzt erfolgte die Dignitätssicherung bei einem niedergelassenen Mund-, Kiefer- und Gesichtschirurgen und die Zuweisung in unsere Klinik zur weiteren Therapie. Allgemeinanamnestisch imponierte keine relevante Grunderkrankung bei Zustand nach Appendektomie und Hysterektomie bei benignen Befunden. Es bestand keine Dauermedikation.
In der klinischen Befundung zeigte sich die beschriebene Induration als nicht schmerzhaft bei intakter peripherer Durchblutung, Motorik und Sensibilität. Die prothetisch und konservierend versorgte Bezahnung und die sonstige Mundschleimhaut zeigten sich ebenfalls ohne pathologischen Befund. Zusätzlich konnte weder klinisch noch sonografisch ein Anhalt auf eine Lymphknotenmetastasierung eruiert werden. Bei nachgewiesener Malignität wurde das Staging eingeleitet. Die Computertomografie Kopf/Hals ergab analog zur Sonografie kein Anhalt auf malignomsuspekte Lymphknoten. Der Primärbefund konnte CT-morphologisch nicht dargestellt werden. In der Computertomografie von Thorax und Abdomen fanden wir ebenfalls keinen Hinweis auf Malignität bei einzelnen kleinen pulmonalen Verdichtungen zur Verlaufskontrolle.
Nach der präoperativen Vorstellung der Patientin im interdisziplinären Kopf-Hals-Tumorboard wurde die Empfehlung zur lokalen chirurgischen Resektion des Primarius mit Sicherheitsabstand gegeben. Die Möglichkeit einer vollständigen Entfernung aller Lymphknoten und -bahnen einschließlich des umgebenden Fett- und Bindegewebes der ipsilateralen Halsseiten im Sinne einer prophylaktischen, selektiven Neck Dissection wurde mit der Patientin kritisch diskutiert, die sich in der Folge gegen den Halslymphknoteneingriff und für eine sonografische Nachbeobachtung entschied. Aufgrund der geringen klinischen Tumorgröße einigten wir uns im Konsens mit der Patientin auf eine Tumorresektion mit sekundärer Granulation.
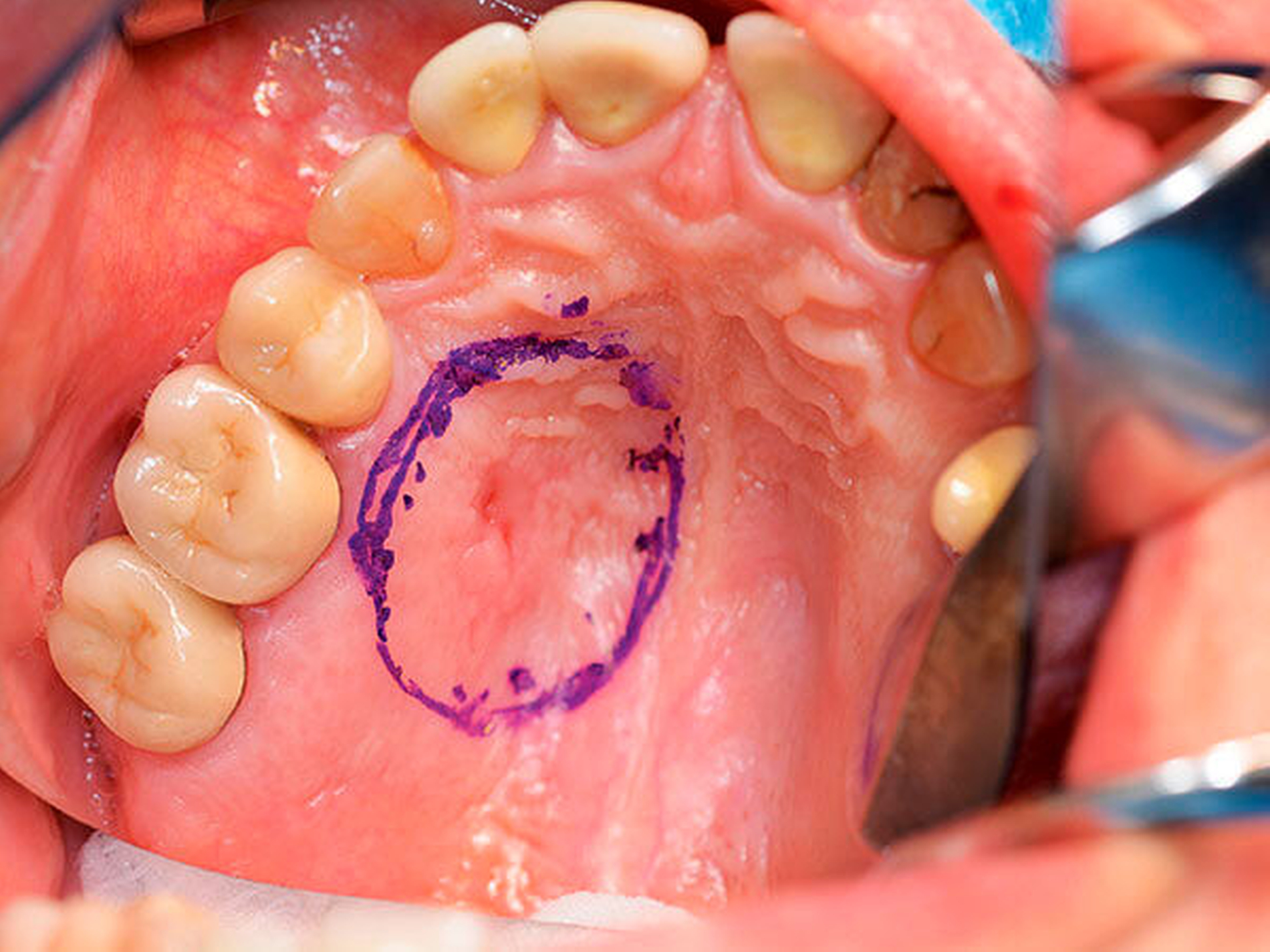
Nach ausführlicher Aufklärung über den Eingriff, Risiken, mögliche Komplikationen, Behandlungsalternativen und die Folgetherapie erfolgte die Operation in Intubationsnarkose (Abbildung 2). Nach der Tumorresektion wurde die Nachresektion des Hartgaumens zur Tiefe mittels Abtragung des kortikalen Knochens durchgeführt. Zur Infektions- und Blutungsprophylaxe wurde postoperativ eine präoperativ angefertigte Verbandplatte eingegliedert.
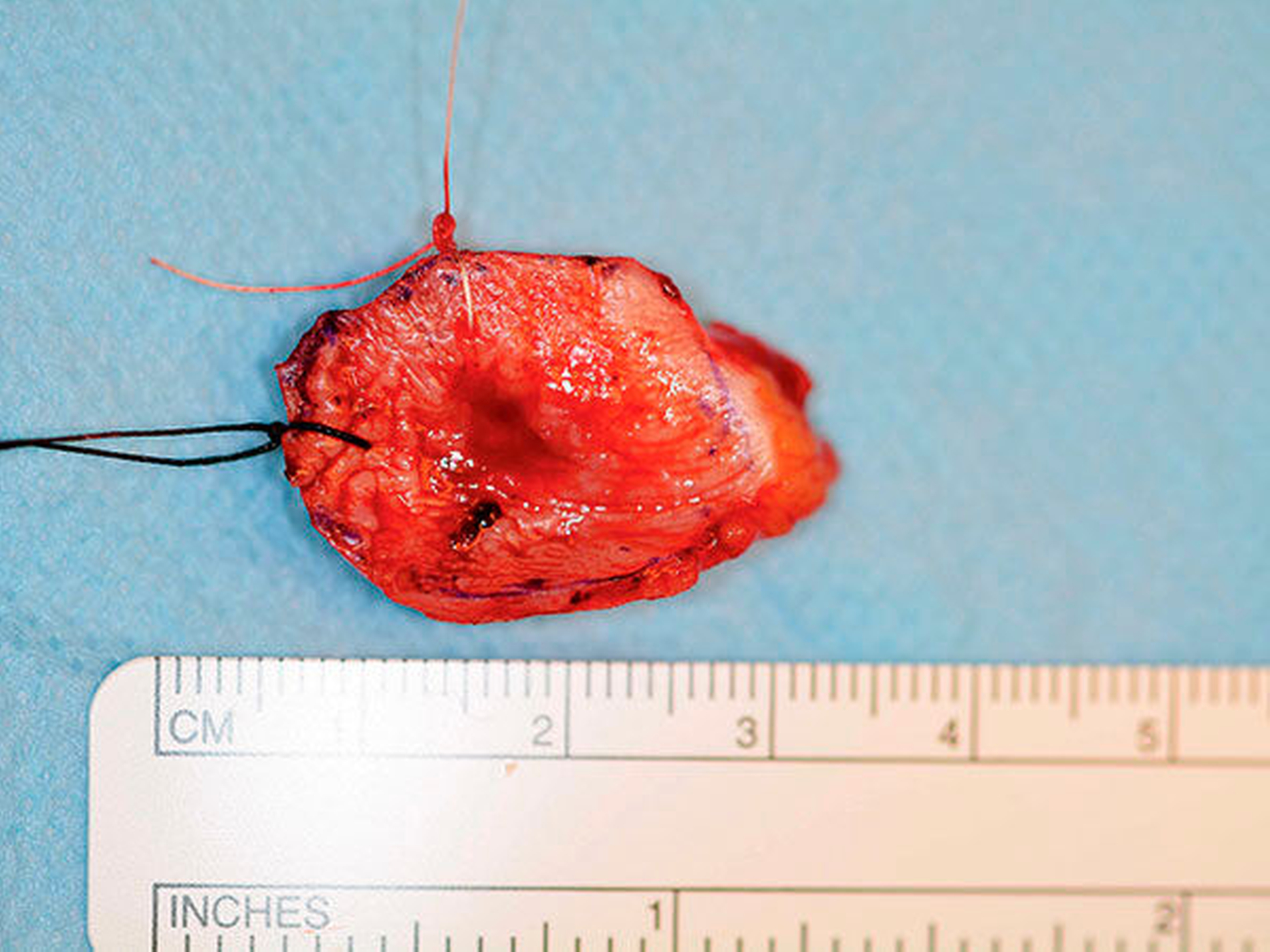
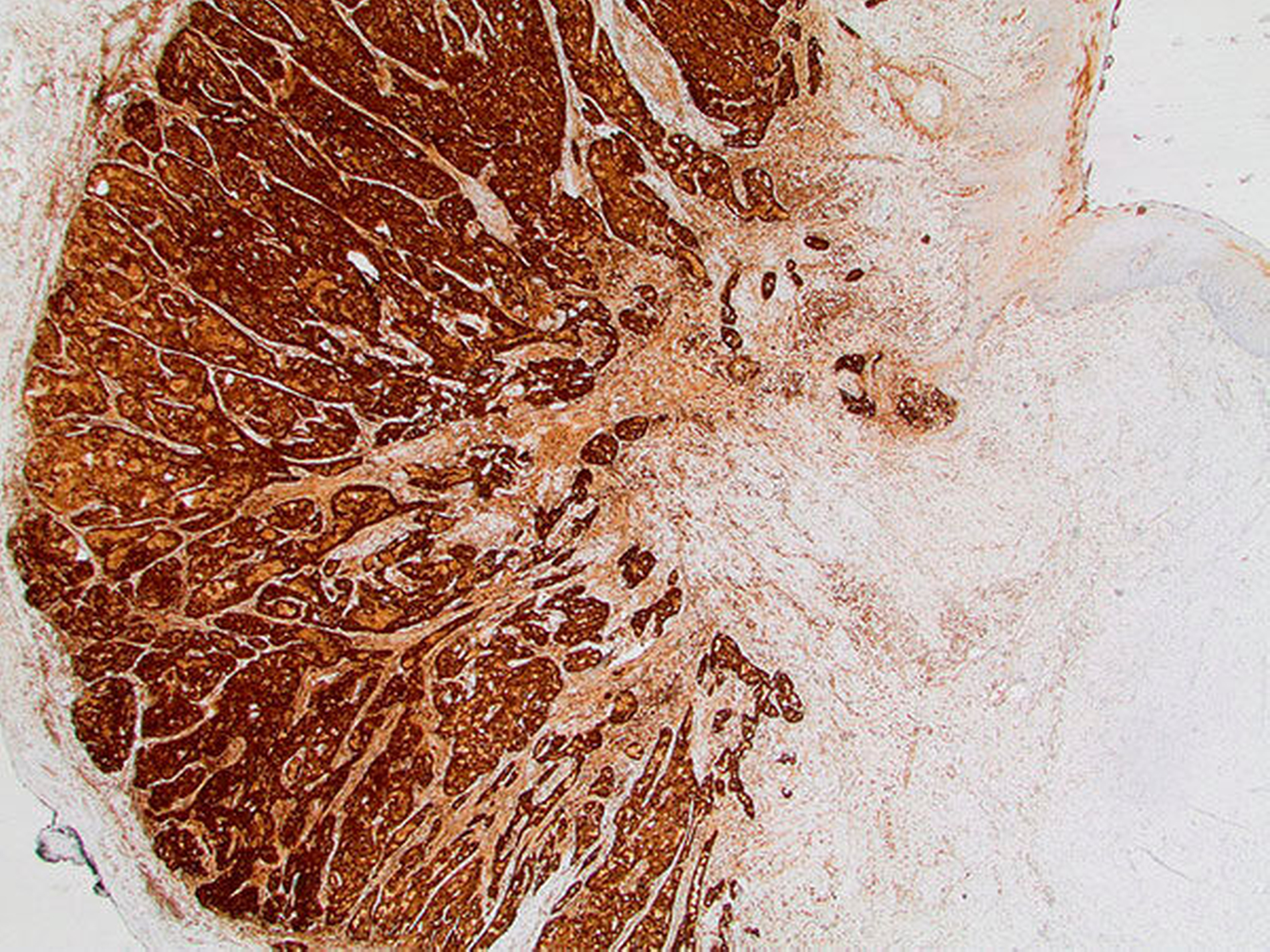
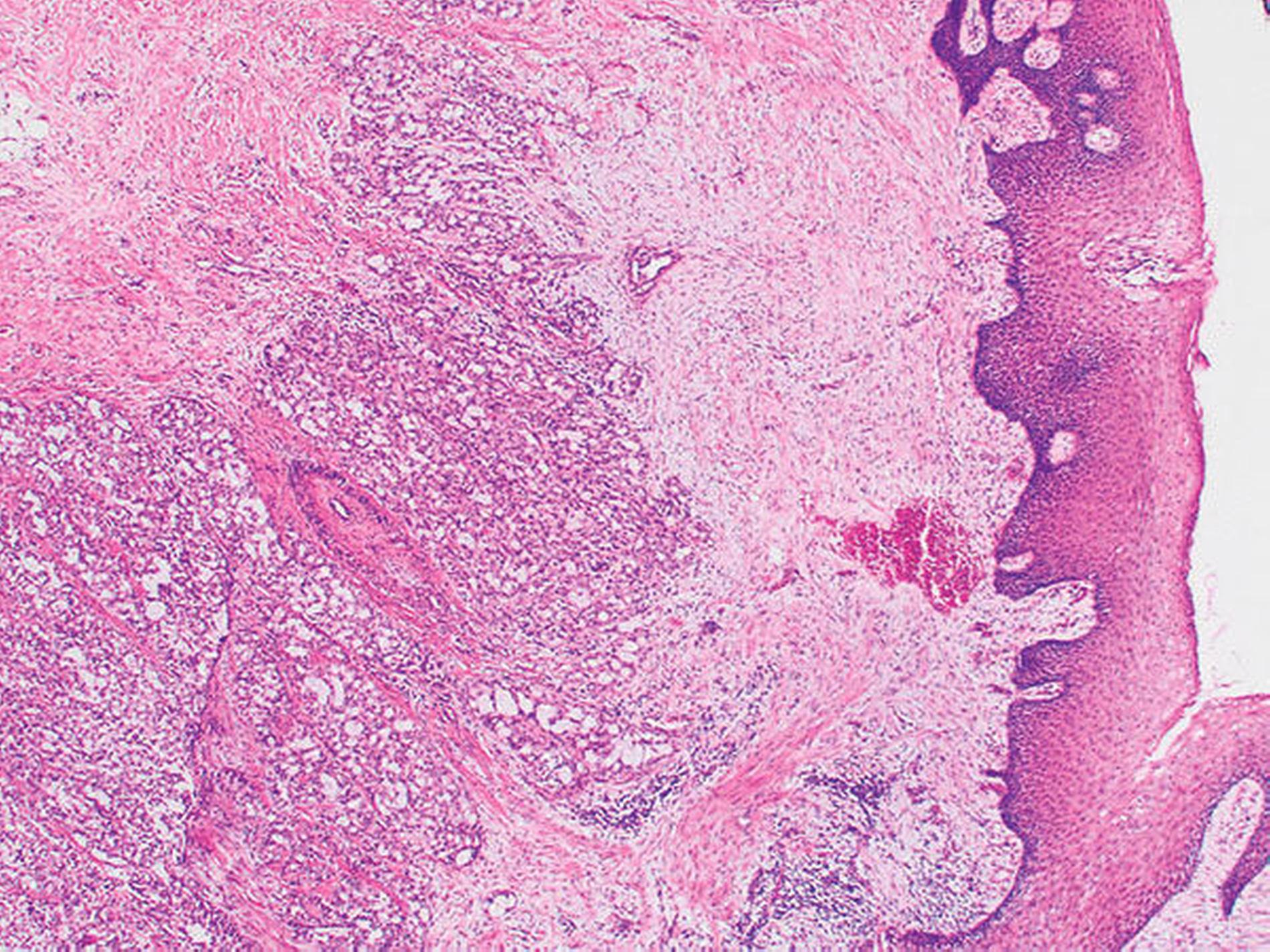
Die histopathologische Beurteilung des Resektionspräparats ergab einen 0,5 cm x 0,6 cm x 0,5 cm großen, ulzerierenden, läppchenartig aufgebauten Tumor mit soliden, mikrozystischen und tubulären Strukturen (Abbildung 3). Es zeigten sich weder Lymphgefäßeinbrüche noch eine Perineuralscheideninfiltration. Die Mindestabstände des in toto resezierten Tumors waren zur Tiefe (zum Knochen) unter 0,1 cm, nach lateral 0,3 cm und nach medial 0,7 cm, nach anterior sowie nach posterior mindestens 0,7 cm. In der ergänzenden Immunhistochemie zeigten Mammoglobin, CK7, GATA-3, GCDFP-15 und S-100 eine Co-Expression. In der Zusammenschau der Befunde wurde der Tumor nach aktueller TNM-Klassifikation von 2017 als pT1, pNX, L0, V0, Pn0, R0 (Mamma-analoges sekretorisches Karzinom) klassifiziert.
Der postoperative Heilungsverlauf gestaltete sich unter antibiotischer und analgetischer Abdeckung komplikationslos, so dass die Patientin nach ausführlicher Aufklärung über Handhabung und Reinigung der Verbandplatte am dritten postoperativen Tag in die ambulante Nachsorge entlassen werden konnte. In der obligaten postoperativen Tumorboardvorstellung wurde bei knapper R0-Resektion nach lateral mit 0,3 mm Sicherheitsabstand eine adjuvante Radiatio diskutiert. Trotz der ambivalenten Datenlage zur Strahlentherapie beim sekretorischen Karzinom der Speicheldrüsen wurde die Empfehlung zur adjuvanten Radiatio ausgesprochen. Nach ausführlicher Aufklärung der Patientin und Ablehnung einer weiteren Therapie wurde sich jedoch im Konsens zur engmaschigen klinischen Nachkontrolle entschlossen.
Diskussion
Speicheldrüsentumore machen etwa 5 Prozent aller Neoplasien der Kopf-Hals-Region aus. Die Ätiologie ist bisher nicht zur Gänze geklärt, diskutiert wird der pathogene Einfluss onkogener Viren wie Eppstein-Barr- oder humaner Papilloma-Viren sowie eine Strahleneinwirkung. Epidemiologisch handelt es sich um eine komplexe Tumorentität unterschiedlicher Primärlokalisationen mit diversen Subtypisierungen und Graduierungsmustern, die das biologische Verhalten und Malignitätsmerkmal stark beeinflussen [Badlani et al., 2017; Mifsud et al., 2017]. Insbesondere Tumoren der kleinen Speicheldrüsen stellen differenzialdiagnostisch eine besondere Herausforderung dar, da maligne Entartungen hier mit etwa 50 Prozent überproportional repräsentiert sind. Diese zeigen sich zusätzlich häufig hochdifferenziert mit starken entzündlichen Überlagerungen [Ihrler et al., 2018].
In der aktualisierten WHO-Klassifikation von 2017 von Kopf-Hals-Tumoren werden 20 maligne Entitäten der Speicheldrüsen aufgeführt. Hierbei wurden einige seltene undifferenzierte und neuroendokrine Karzinome zusammengefasst und mit dem (Mamma-analogen) sekretorischen Karzinom eine neue Entität aufgenommen [Ihrler et al., 2018]. Die Erstbeschreibung dieses Subtyps erfolgte erstmals von der Arbeitsgruppe um Skalova et al. 2010 [Skalova et al., 2010]. Namensgebend ist die histologische und genetische Anlehnung dieser Tumoren zu sekretorischen Karzinomen der Mamma, insbesondere durch die pathognomische Gen-Translokation t(12;15)(p13;q25) und die Fusion von ETV6-NTRK3. Außerdem imponieren überlappende zytologische Features mit anderen Low-grade-Speicheldrüsenkarzinomen wie dem adenoidzystischen Karzinom oder dem Mukoepidermoidkarzinom [Gonzalez et al., 2018].
Aufgrund der schwierigen Abgrenzung erfolgte die Zuteilung bis dato in den meisten Fällen zu den „nicht näher bezeichneten Azinuszellkarzinomen“. In der Abgrenzung zu dieser Entität scheint vor allem die positive immunhistochemische Anfärbung auf Mammaglobin und S-100 von sekretorischen Karzinomen von differenzialdiagnostischer Bedeutung [Bissinger et al., 2017; Woo et al., 2017]. Die Datenlage zu dieser „neuen“ Entität ist bis dato ambivalent und ohne eindeutige Evidenz für prognostische und therapeutische Zusammenhänge.
In einem systematischen Review aus 2017 von Khalele et al. konnten weltweit nur 279 Fälle analysiert werden. Die am häufigsten betroffenen Lokalisationen scheinen die Glandula parotidea (68 Prozent), die Wangenschleimhaut (9 Prozent), die Glandula submandiubularis (8 Prozent), Unter- (5 Prozent) und Oberlippe (4 Prozent) sowie der harte Gaumen (4 Prozent) zu sein. Andere Studien beschreiben ein gehäuftes Auftreten insbesondere in den kleinen Speicheldrüsen. Eine spezifische Geschlechterverteilung zeigt sich nicht, der Altersgipfel liegt bei 40 bis 50 Jahren, wobei 12 Prozent der Fälle in einer pädiatrischen Population auftraten [Khalele, 2017].
Obwohl als „Low-grade-Karzinom mit generell guter Prognose“ seitens der WHO eingestuft, zeigen sich ebenfalls ambivalente Daten zum Malignitätspotenzial sekretorischer Karzinome mit lymphogenen Metastasierungsraten bis zu 20 Prozent [Kennedy, 2018]. Eine Perineuralscheideninfiltration ist sogar mit bis zu 43 Prozent beschrieben [Badlani et al., 2017].
Goldstandard der Therapie ist die chirurgische Resektion des Primarius. Bisher liegt keine gesicherte Evidenz für eine Erweiterung der Therapie im Sinne einer prophylaktischen Neck Dissection oder adjuvanten Radio(chemo)therapie vor, diskutiert werden solche Maßnahmen aber insbesondere bei high-grade-sekretorischen Karzinomen und/oder fortgeschrittenen Tumorstadien [Inaki et al., 2017]. Auch könnten zukünftig Thyrosinkinaseinhibitoren in progredienten Fällen therapeutisch genutzt werden. Weitere molekularpathologische Charakterisierungen dieser seltenen Tumroentität sind daher obligat [Seethala et al., 2017; Skalova et al., 2018].
Zusammenfassend zeigt dieser Fall, dass bei Tumoren der kleinen Speicheldrüsen eine maligne Entartung häufig vorkommt. Durch immer hochwertigere diagnostische Möglichkeiten kann eine exakte Subtypisierung der Entität erfolgen, die relevanten Einfluss auf Therapie und Prognose des Patienten hat.
Dr. med. dent. Sebastian Blatt
Wissenschaftl. Mitarbeiter
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie
Universitätsmedizin Mainz
Univ.-Prof. Dr. med. Stephan Macher-Göppinger
Geschäftsführender Oberarzt
Insitut für Pathologie
Universitätsmedizin Mainz
PD Dr. med. Dr. med. dent. Peer W. Kämmerer, MA, FEBOMFS
Leitender Oberarzt / Stellvertretender Direktor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Fazit für die Praxis
Tumore der kleinen Speicheldrüsen sind oft maligne und bergen differenzialdiagnostische Schwierigkeiten.
In die WHO-Klassifikation von 2017 wurde das sekretorische Karzinom als „neue“ Entität der Speicheldrüsenkarzinome aufgenommen.
Therapie der Wahl bleibt bis dato die Chirurgie.
Molekularpathologische Untersuchungen gewinnen an Bedeutung für Diagnostik und Therapie.
Literatur:
Badlani J, Gupta R, Balasubramanian D, Smith J, Luk P, Clark J: Primary salivary gland malignancies: a review of clinicopathological evolution, molecular mechanisms and management. ANZ J Surg, 2017.
Bissinger O, Gotz C, Kolk A, Bier HA, Agaimy A, Frenzel H, Perner S, Ribbat-Idel J, Wolff KD, Weichert W, Mogler C: Mammary analogue secretory carcinoma of salivary glands: diagnostic pitfall with distinct immunohistochemical profile and molecular features. Rare Tumors 9: 7162, 2017.
Gonzalez MF, Akhtar I, Manucha V: Additional diagnostic features of mammary analogue secretory carcinoma on cytology. Cytopathology 29: 100-103, 2018.
Ihrler S, Guntinas-Lichius O, Haas C, Mollenhauer M: [Updates on tumours of the salivary glands : 2017 WHO classification]. Pathologe 39: 11-17, 2018.
Inaki R, Abe M, Zong L, Abe T, Shinozaki-Ushiku A, Ushiku T, Hoshi K: Secretory carcinoma - impact of translocation and gene fusions on salivary gland tumor. Chin J Cancer Res 29: 379-384, 2017.
Kennedy RA: WHO is in and WHO is out of the mouth, salivary glands, and jaws sections of the 4th edition of the WHO classification of head and neck tumours. Br J Oral Maxillofac Surg 56: 90-95, 2018.
Khalele BA: Systematic review of mammary analog secretory carcinoma of salivary glands at 7 years after description. Head Neck 39: 1243-1248, 2017.
Mifsud M, Eskander A, Irish J, Gullane P, Gilbert R, Brown D, de Almeida JR, Urbach DR, Goldstein DP: Evolving trends in head and neck cancer epidemiology: Ontario, Canada 1993-2010. Head Neck 39: 1770-1778, 2017.
Seethala RR, Stenman G: Update from the 4th Edition of the World Health Organization Classification of Head and Neck Tumours: Tumors of the Salivary Gland. Head Neck Pathol 11: 55-67, 2017.
Skalova A, Vanecek T, Martinek P, Weinreb I, Stevens TM, Simpson RHW, Hyrcza M, Rupp NJ, Baneckova M, Michal M, Jr., Slouka D, Svoboda T, Metelkova A, Etebarian A, Pavelka J, Potts SJ, Christiansen J, Steiner P, Michal M: Molecular Profiling of Mammary Analog Secretory Carcinoma Revealed a Subset of Tumors Harboring a Novel ETV6-RET Translocation: Report of 10 Cases. Am J Surg Pathol 42: 234-246, 2018.
Skalova A, Vanecek T, Sima R, Laco J, Weinreb I, Perez-Ordonez B, Starek I, Geierova M, Simpson RH, Passador-Santos F, Ryska A, Leivo I, Kinkor Z, Michal M: Mammary analogue secretory carcinoma of salivary glands, containing the ETV6-NTRK3 fusion gene: a hitherto undescribed salivary gland tumor entity. Am J Surg Pathol 34: 599-608, 2010.
Woo HY, Choi EC, Yoon SO: Diagnostic Approaches for Salivary Gland Tumors with Secretory and Microcystic Features. Head Neck Pathol, 2017.