Biofilm auf Implantaten und Abutments
Enossale Implantate kommen in der zahnärztlichen Praxis zur Rehabilitation zahnloser Kieferabschnitte immer häufiger zum Einsatz. Heute besitzen Patienten zehnmal häufiger Zahnimplantate als noch im Jahr 1997 [Jordan/Micheelis, 2016]. Wurden vor zwanzig Jahren jährlich rund 380.000 Implantate in Deutschland gesetzt, ist diese Zahl mittlerweile auf circa 1,3 Millionen Implantate gestiegen [zm-online, 2018]. Dabei können Implantate festsitzenden (83 Prozent der in der DMS V untersuchten Implantatträger) und abnehmbaren prothetischen Zahnersatz verankern (15 Prozent) sowie im Sinne der Pfeilervermehrung für kombinierte Versorgungen genutzt werden (2 Prozent) [Jordan/Micheelis, 2016].
Die Ansprüche an Implantate und die zugehörigen Suprakonstruktionen sind hoch: Neben ästhetischen Gesichtspunkten, einer zuverlässigen Stabilität, einer guten Osseointegration und ausgezeichnetem Kaukomfort spielen eine leichte Reinigungsfähigkeit sowie eine geringe Biofilmadhärenz eine entscheidende Rolle für die Langlebigkeit der Versorgung [Zhao et al., 2014]. Zahlreiche Forschungsgruppen haben die Überlebensraten von Implantaten untersucht und fanden heraus, dass sich über 90 Prozent der Implantate nach zehn Jahren noch in situ befanden [Howe et al., 2019; Srinivasan et al., 2017; Norowski/Bumgardner, 2009]. Dennoch können mechanische sowie biologische Komplikationen im Zusammenhang mit Implantatversorgungen herausfordernd sein. Zu den biologischen Komplikationen zählen unter anderem periimplantäre Erkrankungen. Deren Ursachen sind vielfältig, wobei Biofilm-bedingte Entzündungen infolge einer insuffizienten Mundhygiene eine zentrale Rolle einnehmen.
Klinische Relevanz oraler Biofilme auf implantatgetragenen Restaurationen
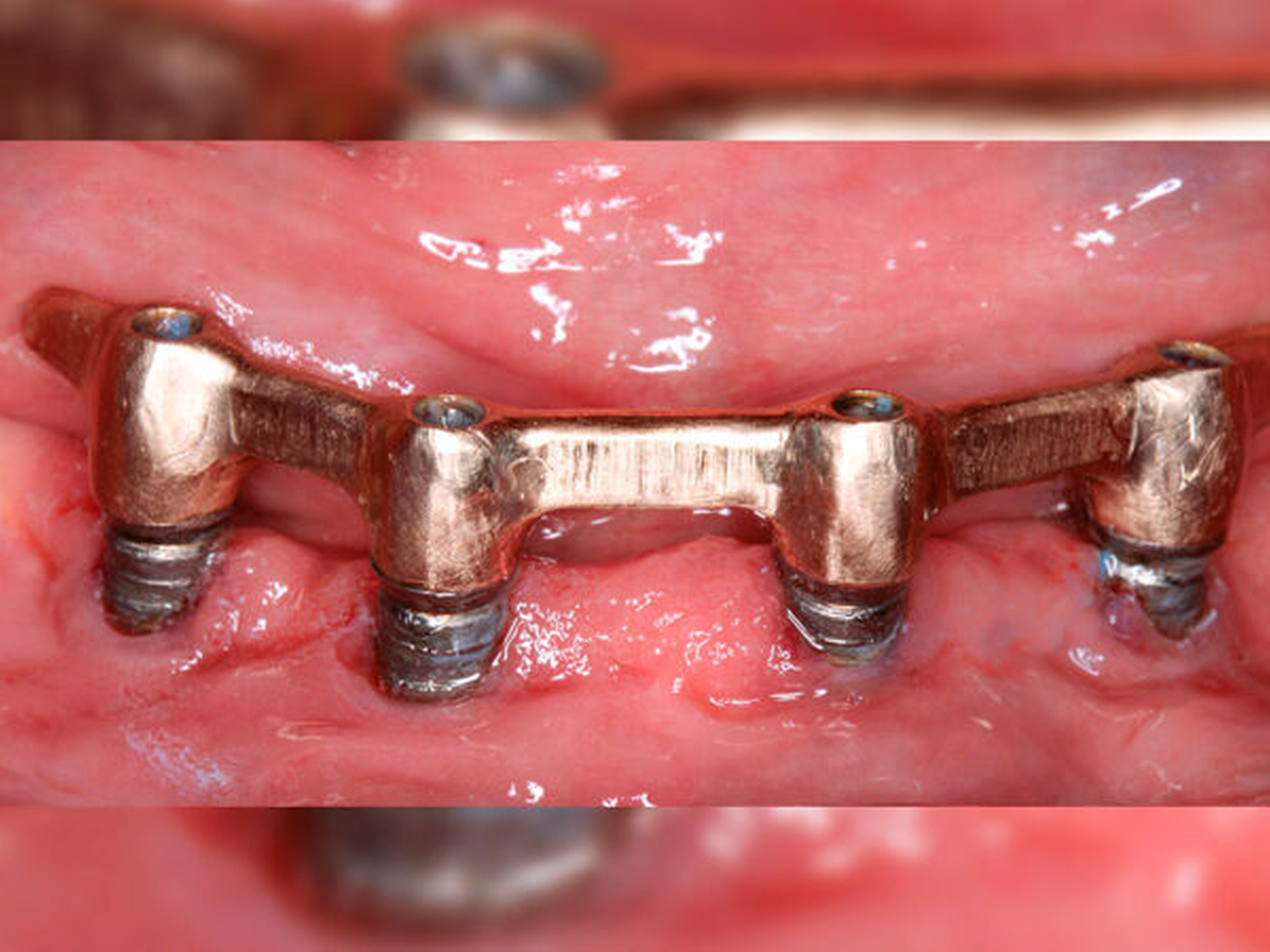
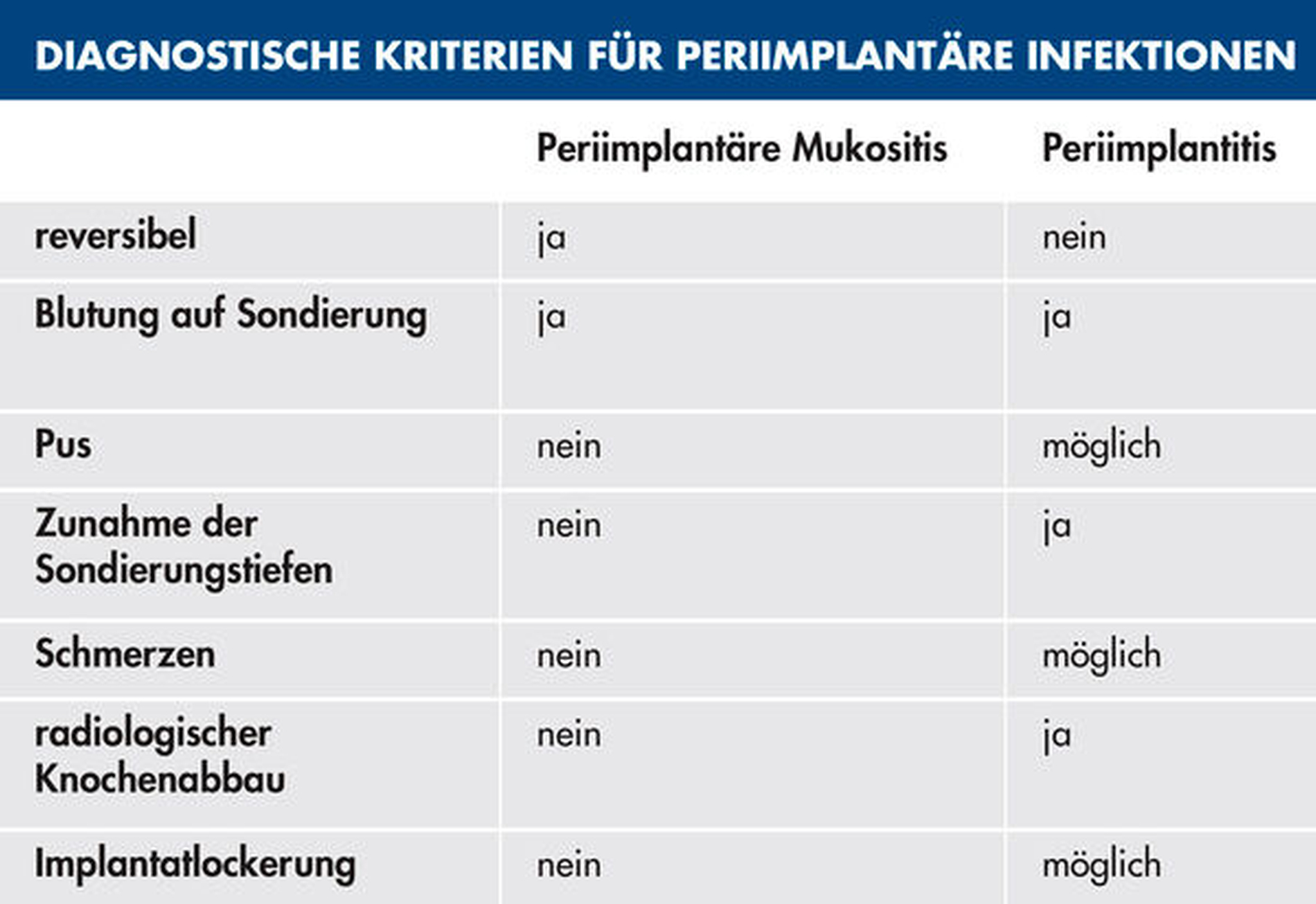
Wird der Biofilm um Implantate nicht entfernt (Abbildung 1), so kann die Entstehung einer periimplantären Mukositis oder Periimplantitis die Folge sein. Während die periimplantäre Mukositis eine reversible Entzündung des suprakrestalen Weichgewebes darstellt, ist bei der Periimplantitis zusätzlich der das Implantat umgebende Knochen betroffen [Lindhe/Meyle, 2008]. Letztere ist nur bedingt reversibel und geht mit erhöhten Taschentiefen, Knochenverlust, gegebenenfalls Pusbildung sowie im Endstadium mit Implantatlockerung und Implantatverlust einher. Mehr als 50 Prozent der Zahnimplantate sind von einer periimplantären Mukositis betroffen [Heitz-Mayfield/Salvi, 2018]; jedes zehnte Implantat und jeder fünfte Patient mit Implantaten entwickeln nach einer Tragedauer von fünf bis zehn Jahren eine Periimplantitis [Mombelli et al., 2012]. Es ist anzunehmen, dass die periimplantäre Mukositis eine Vorstufe der Periimplantitis darstellt und unbehandelt zur Ausprägung eben dieser führt. Studien haben gezeigt, dass der Übergang von einer periimplantären Mukositis zur initialen Periimplantitis fließend ist und weder klinisch, radiologisch, mikrobiologisch noch immunologisch eindeutig diagnostiziert werden kann [Klinge/Meyle, 2012]. Eine weitere Untersuchung ergab, dass die Behandlung der Mukositis nach zwölf Wochen lediglich bei 70 Prozent der Patienten zur vollständigen Ausheilung führte [Bunk et al., 2020]. Erschwerend kommt hinzu, dass periimplantäre Erkrankungen im Vergleich zu parodontalen Erkrankungen eine höhere Progredienz aufweisen und sich die Therapie nicht einfach darstellt.
Aufgrund der stetig steigenden Zahl inserierter Implantate ist damit zu rechnen, dass Zahnarztpraxen auch in Zukunft gehäuft mit der Erkennung und Therapie periimplantärer Erkrankungen konfrontiert sein werden. Somit obliegt es dem zahnärztlichen Behandlungsteam, ein besonderes Augenmerk auf die Erkennung, Vermeidung und Entfernung von Biofilmen auf implantatgetragenen Restaurationen zu richten. Nur so können biologische Komplikationen rechtzeitig bemerkt und behandelt sowie eine erfolgreiche Langzeittherapie mit Implantaten ermöglicht werden.
Welche Faktoren beeinflussen die Anheftung von Biofilmen auf Implantat- und Abutmentoberflächen?
Parodontaler Zustand
Grundsätzlich beeinflussen der Zahnstatus sowie der parodontale Zustand der Restbezahnung die mikrobielle Kolonisation von Implantatoberflächen [Safii et al., 2010]. Das Risiko für die Entstehung periimplantärer Erkrankungen ist bei parodontal vorerkrankten Patienten signifikant höher als bei parodontal Gesunden [Safii et al., 2010]. Zwar konnten in vielen Studien parodontale Pathogene auf implantären Oberflächen nachgewiesen werden [Mombelli/Décaillet, 2011], jedoch sind Bakterien, die mit der Entstehung von Parodontitis assoziiert werden, nicht zwangsläufig auch an der Entstehung periimplantärer Erkrankungen beteiligt. Insgesamt sind sowohl Biofilme auf Implantat- als auch auf Zahnoberflächen sehr komplex und sollten als separate Ökosysteme angesehen werden. Hervorzuheben ist hierbei, dass die Periimplantitis in aller Regel eine schnellere Progredienz zeigt als die Parodontitis [Dhir et al., 2013]. Allgemein gilt, dass eine prothetische Rehabilitation mit Implantaten nur bei parodontal stabilen Verhältnissen in Erwägung gezogen werden sollte.
Werkstoff – Implantat
Klassischerweise werden Implantate nach wie vor aus Titan gefertigt. Titanimplantate zeichnen sich durch eine gute mechanische Stabilität sowie eine hervorragende Biokompatibilität und Osseointegration aus. Als metallfreie Alternative werden mittlerweile auch verschiedenste ein- oder zweiteilige Keramik-Implantatsysteme auf dem Dentalmarkt angeboten. Üblicherweise handelt es sich hierbei um Zirkoniumdioxidkeramiken. Neben einer guten Biokompatibilität weisen diese eine mit Titanimplantaten vergleichbare Osseointegration auf [Gross et al., 2021]. Weiterhin sind Implantate aus Polyaryletherketonen (PAEK; zum Beispiel WIN! PEEK, Champions-Implants GmbH) sowie Titan-Zirkonium-Legierungen erhältlich (zum Beispiel Roxolid, Straumann). Bei Letzteren handelt es sich um binäre Hybrid-Legierungen, die zu rund 85 Prozent aus Titan und zu 15 Prozent aus Zirkonium bestehen und die positiven Eigenschaften beider Werkstoffe in einem Implantatmaterial vereinen sollen.
Die Pellikel- und Biofilmbildung auf Implantatoberflächen erfolgt ähnlich wie die auf Zähnen. Allerdings ist die Zusammensetzung der Pellikel auf Implantatoberflächen abhängig vom Material. Es kommt zu einer selektiven Adhäsion von Pellikelproteinen in Abhängigkeit von deren Affinität zur Substratoberfläche, wodurch die Oberflächeneigenschaften durch die Pellikel zumindest teilweise hindurch übermittelt werden (sogenannter Durchscheineffekt). Somit unterscheidet sich auch der Einfluss der Pellikel auf die nachfolgende Anbindung von Mikroorganismen je nach Oberflächeneigenschaften [Teughels et al., 2006]. Eine brasilianische Forschungsgruppe identifizierte im Rahmen einer Laboruntersuchung die Pellikelzusammensetzungen auf Titan, Zirkoniumdioxid und Hydroxylapatit. Während die Pellikelkomposition und folglich die bakteriellen Bindungseigenschaften von Titan und Zirkoniumdioxid ähnlich waren, zeigten beide Materialien im Vergleich zu Hydroxylapatit signifikante Unterschiede [Lima et al., 2008].
Grundsätzlich sind die Ergebnisse aus Untersuchungen periimplantärer Pellikel und Mikroorganismen sehr heterogen und teilweise widersprüchlich [Sahrmann et al., 2020]. Dies liegt nicht zuletzt daran, dass eine Vielzahl unterschiedlicher Methoden zur Untersuchung von Mikroorganismen zur Verfügung steht, deren Ergebnisse kaum miteinander vergleichbar sind [Padial-Molina et al., 2016]. Weiterhin sind Erkenntnisse aus Laboruntersuchungen nicht zwingend in die Klinik übertragbar. Die für klinische Studien erforderlichen Probeentnahmen aus meist engen periimplantären Taschen gestalten sich häufig schwierig. Hierfür werden sterile Papierspitzen verwendet, die meist nur planktonisch verfügbare Mikroorganismen aufnehmen können und daher keine Untersuchung typischer, in Biofilmen organisierter Bakterien zulassen. Darüber hinaus können nur Mikroorganismen identifiziert werden, nach denen gezielt gesucht wird. Bisher konzentrierten sich viele Studien auf die Detektion typischer parodontalpathogener Mikroorganismen in periimplantären Taschen. Zwar scheinen parodontalpathogene Keime an der Entstehung periimplantärer Entzündungen beteiligt zu sein, jedoch wurden auch vermehrt andere, mit parodontaler Gesundheit assoziierte oder untypische Bakterienstämme in entzündeten periimplantären Taschen nachgewiesen [Lafaurie et al., 2017]. Gegenwärtig ist eine evidenzbasierte Schlussfolgerung hinsichtlich der für periimplantäre Gesundheit beziehungsweise Krankheit typischen oder materialspezifischen Mikroorganismen nicht abschließend möglich.
Werkstoff – Abutment
Da das Abutment der Bestandteil der implantatgetragenen Versorgung ist, der mit der Mundhöhle in Berührung kommt und in vielen Fällen in ausgedehntem Kontakt mit der Gingiva steht, ist dessen Oberfläche für die Anheftung von Biofilmen von großer Bedeutung. Dies gilt in besonderem Maß für Restaurationen auf Knochenniveau. Als mögliche Abutmentmaterialien kommen Titan, Zirkoniumdioxid, PAEK und – insbesondere für provisorische Versorgungen – Polymethylmethacrylat (PMMA) zum Einsatz (Abbildung 2). Die Ergebnisse bisheriger Untersuchungen hinsichtlich der Biofilmformation auf Abutmentwerkstoffen sind widersprüchlich. Während Zhao et al. bei einer Laborstudie mehr Biofilmanheftung auf Zirkoniumdioxid- als auf Titanoberflächen nachwiesen, zeigten Degidi et al. klinisch stärkere Biofilm-bedingte Entzündungsprozesse um Titan- als um Zirkoniumdioxidoberflächen [Zhao et al., 2014; Degidi et al., 2006]. Ein möglicher Grund kann die unterschiedliche Verarbeitung der in den Studien verwendeten Materialien sein. Somit lässt sich mutmaßen, dass weniger die Zusammensetzung eines Abutmentmaterials als vielmehr seine Oberflächenbeschaffenheit eine entscheidende Rolle für die Anheftung von Biofilmen spielt. Allerdings ist die Datenlage auch diesbezüglich uneinheitlich.
Eine Forschungsgruppe konnte im klinischen Setting nachweisen, dass gefrästes Titan und gefrästes Zirkoniumdioxid weniger Biofilmanheftung an deren Oberflächen zeigten als gegossenes Titan [Do Nascimento et al., 2014]. Eine andere klinische Untersuchung stellte keine signifikanten Unterschiede in der Bioadhäsion auf Titan- und Zirkoniumdioxidabutments bei vergleichbarer Oberflächenrauigkeit fest [van Brakel et al., 2011]. Studien zur Biofilmakkumulation auf PAEK-Werkstoffen sind noch rar. Wenige Untersuchungen im Labor und in der Klinik geben jedoch Hinweise darauf, dass die Anzahl an Mikroorganismen auf PAEK mit der auf Zirkoniumdioxid und Titan vergleichbar ist [Hahnel et al., 2015; Volpe et al., 2008].
Werkstoff – Exkurs Materialweiterentwicklungen
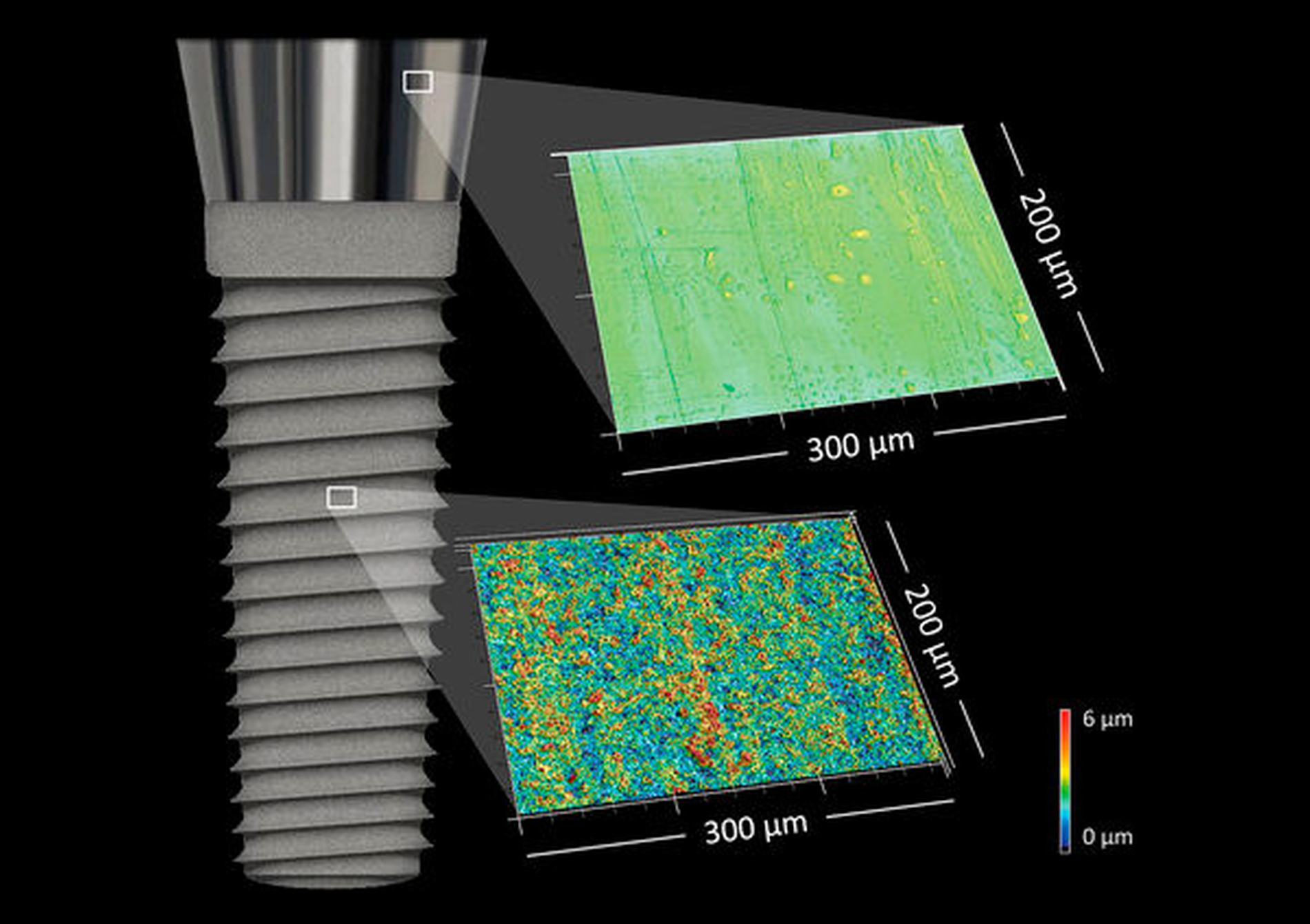
Die Oberflächeneigenschaften des Implantat- und Abutmentmaterials spielen für die Osseointegration, das epitheliale Attachment sowie die Biofilmadhäsion eine bedeutende Rolle. Vereinfacht kann man festhalten, dass raue Oberflächen für die Osseointegration und das epitheliale Attachment von Vorteil sind. Gleichzeitig können raue Oberflächen mehr Biofilm akkumulieren. Leider kann man jedoch nicht sicherstellen, dass Implantatoberflächen ausschließlich mit menschlichen Gewebszellen in Berührung kommen, da bereits während des chirurgischen Eingriffs Mikroorganismen auf die Implantatoberfläche verschleppt werden können. Es beginnt ein sogenannter Wettlauf um die Oberfläche zwischen Wirtszellen und Mikroorganismen (Race for the surface). Kommt es im zeitlichen Verlauf zu einem periimplantären Knochenabbau, der eine Freilegung rauer Implantatoberflächen mit sich bringt, stellen diese in besonderem Maß Prädilektionsstellen für die Akkumulation von Biofilmen dar (Abbildung 3).
Neben einer möglichst sterilen Arbeitsweise bei der Implantation gibt es weitere Überlegungen, wie dieser Wettlauf um die Implantatoberfläche durch Wirtszellen gewonnen werden kann. Eine Laboruntersuchung einer finnisch-spanischen Arbeitsgruppe konnte zeigen, dass die Vorbehandlung der Implantatoberfläche mit humanen Zellen eine deutliche Reduktion der bakteriellen Besiedlung im Vergleich zu nicht vorbehandelten Implantaten bewirkte [Pérez-Tanoira et al., 2017]. Eine Reduktion der Bakterienadhäsion zeigten auch mit Titannitrid (TiN) beschichtete Implantate bei gleichzeitig unveränderter Affinität zu Knochenzellen [Annunziata et al., 2011]. Weiterhin kann eine günstige Werkstoffoberfläche die Anheftung von Bakterien und Pilzen minimieren. Beispielsweise beherbergen Materialien mit einer flachen oder rillenförmigen Oberflächentopografie weniger Biofilm als Materialien mit einer irregulären Oberflächenbeschaffenheit [Xing, 2015]. Untersuchungen haben gezeigt, dass glatte [Zhao, 2014], aber dennoch texturierte Oberflächen [Quirynen, 2002] ein optimales Attachment des periimplantären Gewebes ans Implantat ermöglichen. Zudem können Fluorid-modifizierte Titanimplantate zum Einsatz kommen, die einen erhöhten Knochen-Implantat-Kontakt aufweisen und somit günstige klinische Ergebnisse erzielen [Pham et al., 2020].
Einen weiteren interessanten Ansatz stellen antimikrobiell wirksame Biomaterialien dar [Ramburrun et al., 2021]. Dabei können antibakterielle Substanzen entweder im Werkstoff integriert sein oder den Werkstoff beschichten. Antimikrobielle Agenzien können durch ihre Freisetzung Mikroorganismen abtöten, hemmen oder in deren Adhäsion und Vermehrung beeinträchtigen. Der Nachteil integrierter antibakterieller Substanzen ist, dass der antibakterielle Effekt meist zeitlich begrenzt ist, da sich der Wirkstoff verbraucht. Zudem können durch Wirkstofffreisetzung Porositäten innerhalb des Werkstoffs entstehen, die wiederum die mechanischen Eigenschaften negativ beeinflussen können. Antibakterielle Beschichtungen wie beispielsweise Antifouling-Polymerbeschichtungen wirken wiederum entweder kontaktabtötend oder hemmen die Adhäsion und Vermehrung von Mikroorganismen. Zwar können durch äußere Einflüsse diese Beschichtungen mit der Zeit abgetragen oder inaktiviert werden, jedoch haben sie den Vorteil, wieder aufgetragen beziehungsweise durch eine spezielle Behandlung reaktiviert werden zu können [Ramburrun et al., 2021; Wu et al., 2021]. Kommt es infolge periimplantärer Infektionen zur Freilegung rauer, ehemals mit Knochen bedeckter Implantatoberflächen, so könnte der Auftrag antibakterieller Beschichtungen eine Alternative zur Implantatplastik (auch Implantoplastik genannt) darstellen. Auf diese Weise könnten bakterielle Besiedlungen von Implantatoberflächen und die Entstehung Biofilm-assoziierter Erkrankungen minimiert und die Lebensdauer implantatgetragener Restaurationen erhöht werden.
Der Einsatz antibakterieller Substanzen sollte jedoch kritisch abgewogen werden, da diese eine Resistenzentwicklung der Mikroorganismen fördern können. Zudem muss stets eine Balance zwischen antibakteriellem und zytotoxischem Effekt gefunden werden. Eine Hannoveraner Arbeitsgruppe untersucht gegenwärtig weitere Methoden zur Modifizierung potenzieller Implantatwerkstoffe. Das Prinzip der sogenannten gleitfähigen, flüssigkeitsdurchsetzten porösen Oberflächen (slippery liquid-infused porous surfaces; kurz SLIPS) wurde nach dem biologischen Vorbild der fleischfressenden Kannenpflanze entwickelt. Diese bildet auf dem Saum um die Öffnung ihrer Fallenblätter einen Flüssigkeitsfilm, der ein Anhaften von Insekten verhindert und das Hineingleiten der Beute in die Pflanze fördert. Auf dentalen Werkstoffen kann eine SLIPS-Oberfläche durch Oberflächenstrukturierung (beispielsweise mittels Laserablation), eine chemische Modifizierung und die Zugabe von Gleitmitteln geschaffen werden. Zwar konnte auf derart modifizierten Oberflächen eine deutliche Reduktion bakterieller Adhäsion nachgewiesen werden, gleichzeitig kam es jedoch zu einer starken Hemmung der Anheftung menschlicher Zellen. Zudem sind teilweise toxische Substanzen für die Herstellung von SLIPS-Oberflächen notwendig, weshalb dieses Prinzip bisher nicht auf dem Dentalmarkt eingeführt werden konnte [Doll et al., 2017].
Weitere vielversprechende Strategien zur Schaffung antibakterieller Implantatoberflächen wurden in der aktuellen Übersichtsarbeit einer ungarischen Forschungsgruppe beleuchtet [Körtvélyessy et al., 2021]. Eine diskutierte Methode basiert auf der Bindung natürlicher antibakterieller Peptide (AMP) an Implantatoberflächen. Diese sind in der Lage, sowohl grampositive als auch gramnegative Bakterien zu zerstören. Weiterhin können andere Peptide insbesondere im transmukosalen Implantatbereich die Anlagerung von Gingivaepithelzellen und Bindegewebszellen ans Implantat erleichtern. Diese Wirtszellen bilden wiederum AMP, die eine Weichgewebsversiegelung bewirken und somit verhindern, dass orale Bakterien in den apikalen osseointegrierten Anteil des Implantats vordringen [Körtvélyessy et al., 2021]. In der Konsequenz sinkt das Risiko für die Entstehung periimplantärer Infektionen. Eine weitere Forschungsgruppe untersuchte und identifizierte Oberflächenproteine des Staphylococcus epidermidis. Dieser Bakterienstamm ist stark mit periimplantären Infektionen vergesellschaftet [Bürgers et al., 2018]. Ziel der detaillierten Analyse des bakteriellen Oberflächenproteoms ist die Entwicklung eines Impfstoffs gegen periimplantäre Infektionen.
Implantattypen und -systeme
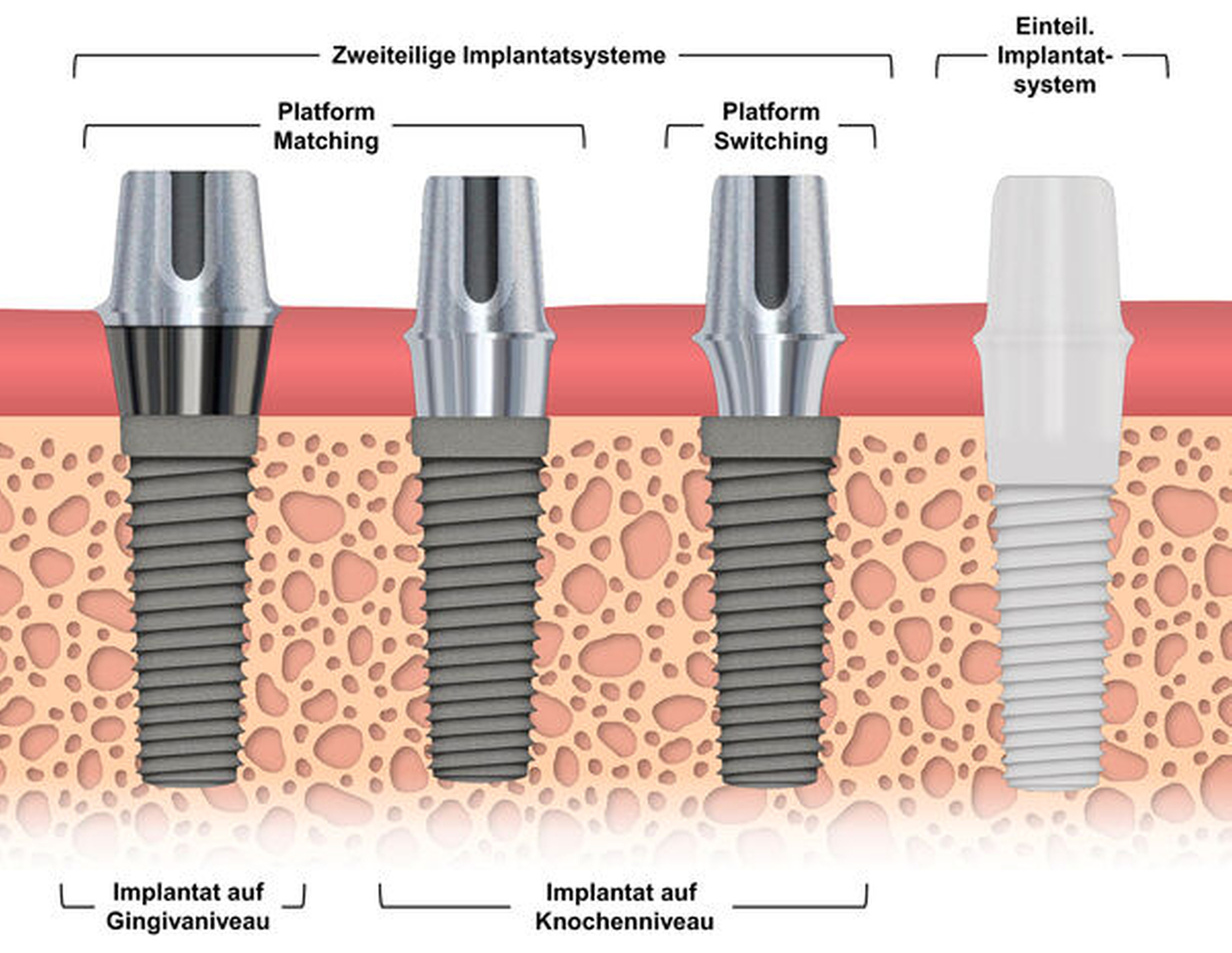
Es lassen sich unterschiedliche Implantattypen und -systeme unterscheiden (Abbildung 4). Implantate, die auf der Höhe des Knochenniveaus enden, bestehen aus einem texturierten Körper. Diese „raue“ Oberfläche ermöglicht eine engmaschige Umbauung des Implantats mit Knochen. Implantate, die auf Gingivaniveau eingebracht werden, besitzen zusätzlich zu einem texturierten Körper einen glatt polierten Hals, der auf Schleimhautniveau endet. Letzterer soll aufgrund der geringen Oberflächenrauigkeit eine reduzierte Anheftung von Biofilmen erzielen. In diversen Studien wurde ein höherer Knochenverlust um glatte Implantathälse nachgewiesen als um raue [Zhang/Yue, 2021; Chappuis et al., 2016; Bratu et al., 2009; Shin et al., 2006]. Festhalten lässt sich, dass Oberflächen, die mit Knochen in Kontakt kommen, für eine optimale Osseointegration vorzugsweise rau beziehungsweise texturiert sein sollten. Materialoberflächen, die wiederum mit Schleimhaut in Kontakt kommen (Implantathals, Abutment), sollten möglichst hochglanzpoliert sein, um die Akkumulation von Biofilmen zu minimieren (Abbildung 5).
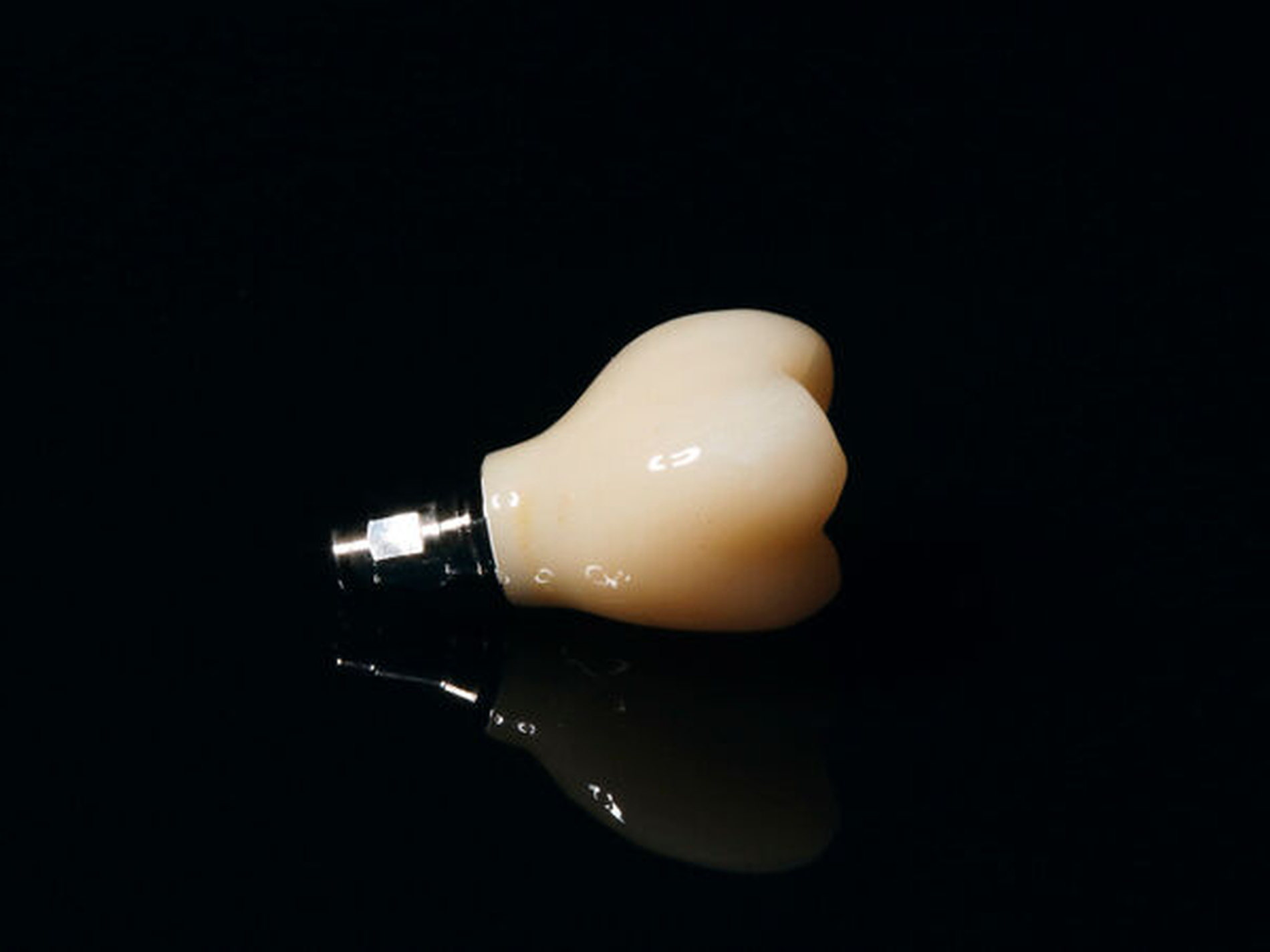
Darüber hinaus wird zwischen ein- und zweiteiligen Implantatsystemen unterschieden (Abbildung 4). Bei einteiligen Implantatsystemen ist das Abutment mit dem Implantat verbunden. Dies hat den Vorteil, dass durch die Abwesenheit von Mikrolücken zwischen Implantat und Abutment potenzielle Nischen für die Biofilmakkumulation reduziert werden. Bei klassischen zweiteiligen Implantatsystemen wird zunächst das Implantat eingebracht und dieses nach der Einheilperiode mit einem Abutment versehen. Das zweiteilige System hat wiederum den Vorzug, dass die prothetischen Versorgungsmöglichkeiten größer sind und der prothetisch nutzbare Raum durch gegebenenfalls abgewinkelte Abutments sinnvoller genutzt werden kann. Eine weitere Möglichkeit zur Vermeidung von Mikronischen besteht in der Verwendung von Abutmentkronen (Abbildung 6). Dabei werden das Abutment und die Krone im zahntechnischen Labor durch Verklebung miteinander verbunden und die Klebefuge gut poliert. Hinsichtlich der Implantatüberlebensrate und des marginalen Knochenverlusts konnten jedoch keine signifikanten Unterschiede zwischen ein- und zweiteiligen Systemen nachgewiesen werden [de Oliveira Limírio et al., 2020].
Zweiteilige Implantatsysteme können grundsätzlich ein sogenanntes Platform Matching oder Platform Switching aufweisen (Abbildung 4). Während beim Konzept des Platform Matching Implantat und Abutment bündig abschließen, verwendet man beim Platform Switching ein Abutment, dessen Durchmesser kleiner ist als der des Implantats. Grundsätzlich können an der Übergangsstelle von Implantat zu Abutment in Funktion Mikrobewegungen stattfinden, die zum Knochenverlust führen [Zipprich et al., 2007]. Zusätzlich bietet der Übergang von Implantat zu Abutment eine potenzielle Nische für die Ansammlung von Biofilmen, die den Knochenerhalt beeinträchtigen kann. Mit der Methode des Platform Switching soll diesen Effekten entgegengewirkt werden, indem der Spalt nach zentral (knochenfern) verlagert wird. Mehrere Übersichtsarbeiten bestätigen einen verbesserten Erhalt des krestalen Knochenniveaus bei Anwendung dieses Konzepts [Gupta et al., 2019]; allerdings scheint es keinen Vorteil im Hinblick auf Bioadhäsionsprozesse zu bewirken [Canullo et al., 2015]. Weiterhin steigt das Weichgewebsvolumen im Bereich des Durchmesser-reduzierten Aufbaus und verbessert das ästhetisch wichtige Emergenzprofil, also die Form der Gingiva an der Austrittsstelle des Implantats.
Befestigung
Während verschraubte Rekonstruktionen überwiegend Komplikationen technischer Art zeigten, wiesen zementierte Versorgungen vermehrt biologische Komplikationen auf [Sailer et al., 2012]. Bei der Zementierung von Zahnersatz auf Implantaten sollte daher streng auf die Zugänglichkeit des Übergangs von Versorgung und Abutment geachtet werden, um eine gründliche Überschussentfernung des Befestigungsmaterials zu gewährleisten. Kommt es zum Verbleib von Zementresten im Sulkus, führt dies zu einer Entzündung des periimplantären Gewebes (Zementitis). Diese Entzündung kann unbehandelt zu Knochenverlust, Suppuration und im schwerwiegenden Fall zum Implantatverlust führen [Mombelli/Décaillet, 2011]. Zudem scheint das Befestigungsmaterial eine Rolle bei der Entstehung einer Zementitis zu spielen. Eine Ein-Jahres-Untersuchung fand heraus, dass es bei Methacrylat-basierten Befestigungsmaterialien häufiger zum Zementverbleib und zur Pusbildung kam als bei eugenolhaltigen Zinkoxidzementen [Korsch et al., 2018]. Darüber hinaus wurden Suppurationen an allen Methacrylat-befestigten Versorgungen mit Überschuss, aber auch an einigen ohne Überschuss festgestellt. Untersuchungen der mikrobiellen Proben wiesen unabhängig vom Vorhandensein von Zementresten bei Methacrylat-befestigten Versorgungen signifikant mehr Parodontalpathogene nach als bei Restaurationen, die mit Eugenol-haltigem Zinkoxidzement fixiert wurden. Befindet sich die Schnittstelle zwischen Implantat und Abutment tief subgingival, so dass keine adäquate Versäuberung möglich ist, sollte eine verschraubte Befestigung erwogen werden. Zudem sind verschraubte Implantatversorgungen leichter zu entfernen, so dass sowohl technische als auch biologische Komplikationen leichter behandelt werden können. Zwar konnte bisher keine der Fixationsmethode als eindeutig überlegen bestätigt werden, jedoch kann die Verschraubung aufgrund ihrer höheren biologischen Verträglichkeit gegenüber der Zementierung präferiert werden [Sailer et al., 2012].
Therapieoptionen bei periimplantären biofilm-assoziierten Entzündungen
Bereits bei der Implantatberatung sollte der Patient über die Wichtigkeit der häuslichen und der professionellen Mundhygiene aufgeklärt werden. Diese reduzieren das Risiko für die Entstehung Biofilm-assoziierter Erkrankungen und tragen somit maßgeblich zum Erfolg und zur Langlebigkeit der Implantatversorgung bei. Vor einer implantologischen Versorgung sind alle systemischen und lokalen Risikofaktoren des Patienten durch den Zahnarzt zu identifizieren [Schwarz/Becker, 2016]. Bestehen Risikofaktoren für die Entwicklung periimplantärer Infektionen, wie beispielsweise Rauchen, eine parodontale Vorerkrankung oder ein instabiler Diabetes mellitus, ist eine engmaschigere individualprophylaktische Betreuung implantologisch versorgter Patienten angezeigt. Zudem sollte das Praxisteam auf diagnostische Kenngrößen periimplantärer Erkrankungen sensibilisiert sein und bei Kontrollsitzungen entsprechende Untersuchungen durchführen, um etwaige Entzündungen frühzeitig erkennen und behandeln zu können (Tabelle 1). Um einen Vergleich zur Ausgangssituation zu ermöglichen, wird die Erhebung der periimplantären Sondierungstiefen sowie des radiologischen Knochenniveaus idealerweise zum Zeitpunkt der Eingliederung der Suprakonstruktion empfohlen (beziehungsweise bei röntgenologischer Kontrolle im Rahmen der Implantatabformung / alternativ nach Implantation). Weiterhin ist auf eine parodontalhygienische Gestaltung der Suprakonstruktion zu achten.
Empfehlungen für Patienten
Die allgemein geltenden Empfehlungen zur häuslichen Mundhygiene werden gleichermaßen für Patienten mit und ohne Implantate ausgesprochen. Dabei sollte der Fokus auf der mechanischen Biofilmkontrolle (Zähneputzen und Reinigung der Interdentalräume) liegen. Studien zufolge ist allein durch die mechanische Reinigung die Ausheilung einer Mukositis möglich. Adjuvante Antiseptika und Antibiotika bieten wiederum keine eindeutige Verbesserung klinischer Entzündungszeichen [Jepsen et al., 2015]. Weiterhin weiß man, dass gut etablierte Biofilme häufig sowohl gegen das Immunsystem des Patienten als auch gegen eine unterstützende antibiotische Behandlung resistent sind [Davies, 2003], so dass die mechanische Reinigung Behandlungsoption der ersten Wahl bleibt. Ist eine mechanische Biofilmentfernung nicht oder nur eingeschränkt möglich, etwa nach operativen Eingriffen in der Mundhöhle wie beispielsweise der Implantatinsertion oder -freilegung, so kann temporär eine unterstützende Verwendung chemischer Reinigungsmethoden in Form sanfter Mundspüllösungen ratsam sein.
Empfehlungen für Zahnärzte
Deuten klinische Parameter auf das Vorliegen einer Periimplantitis hin, so sollten zusätzlich zur mechanischen professionellen Implantatreinigung adjuvante Therapien erwogen werden. Hierbei stellen die Er:YAG-Lasertherapie, das Glycin-gestützte Air-Polishing, die lokale Einmalgabe von Doxycyclin, die Mehrfachgabe von Chlorhexidin-Chips sowie die photodynamische Therapie evidenzbasierte adjuvante nichtchirurgische Therapiealternativen der Periimplantitis dar.
Führt die nichtchirurgische Periimplantitistherapie nicht zum gewünschten Behandlungserfolg (Sondierungstiefen < 6 mm) [Schwarz et al., 2015], sollten frühzeitig chirurgische Maßnahmen eingeleitet werden. Bei der chirurgischen Therapie einer Periimplantitis können verschiedene Verfahren zum Einsatz kommen, wobei laut aktuellem Stand der Wissenschaft keine der Therapien als eindeutig überlegen identifiziert werden kann (Tabelle 2) [Schwarz/Becker, 2016].
Fazit
Insbesondere Stellen, die durch routinemäßiges Zähneputzen und regelmäßige Interdentalraumpflege nicht ausreichend erreicht werden können, wie beispielsweise die Grenzflächen zwischen den Komponenten mehrteiliger Implantatsysteme, sind Prädispositionsstellen für die Entstehung eines infektiösen Biofilms. Um eine Reduktion der Biofilmbesiedlung zu erreichen, ist die Weiterentwicklung von Implantat- und Abutmentmaterialien sowie von antibakteriellen Oberflächenmodifikationen, aber auch von Befestigungsmaterialien von Bedeutung.
Grundsätzlich kann material- und produktionsunabhängig an jedem Implantatsystem Biofilm entstehen. Neben dem Biofilm werden aktuell noch weitere Faktoren als Ursache für die Manifestation einer Mukositis beziehungsweise Periimplantitis untersucht. So wird auch der immunmodulatorische Einfluss von Ionen und Partikeln, die durch Biokorrosion oder mechanische Manipulation aus dem Implantat ins periimplantäre Gewebe gelangen, als potenzielle Ursache diskutiert.
Dr. Med. Dent. Elena Günther
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig, Liebigstr. 12, Haus 1, 04103 Leipzig
elena.guenther@medizin.uni-leipzig.de
Prof. Dr. Med. Dent. Sebastian Hahnel
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig, Liebigstr. 12, Haus 1, 04103 Leipzig
Ronald Lüdtke
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig, Liebigstr. 12, Haus 1, 04103 Leipzig
Florian Fuchs, M. SC.
Poliklinik für Zahnärztliche Prothetik und Werkstoffkunde,
Universitätsklinikum Leipzig, Liebigstr. 12, Haus 1, 04103 Leipzig
Dr. Med. Dent. Anuschka Roesner
Klinik für Zahnärztliche Prothetik, Department für Zahn-, Mund- und Kieferheilkunde,
Universitätsklinikum Freiburg, Hugstetter Str. 55, 79106 Freiburg
Literaturliste
Annunziata, M., Oliva, A., Basile, M.A., Giordano, M., Mazzola, N., Rizzo, A., Lanza, A., Guida, L. (2011): The effects of titanium nitride-coating on the topographic and biological features of TPS implant surfaces. in: J Dent, 39, 11, S. 720–28.
Barwacz, C.A., Brogden, K.A., Stanford, C.M., Dawson, D.V., Recker, E.N., Blanchette, D. (2015): Comparison of pro-inflammatory cytokines and bone metabolism mediators around titanium and zirconia dental implant abutments following a minimum of 6 months of clinical function. in: Clin Oral Implants Res, 26, 4, e35-e41.
Bratu, E.A., Tandlich, M., Shapira, L. (2009): A rough surface implant neck with microthreads reduces the amount of marginal bone loss: a prospective clinical study. in: Clin Oral Implants Res, 20, 8, S. 827–32.
Bunk, D., Eisenburger, M., Häckl, S., Eberhard, J., Stiesch, M., Grischke, J. (2020): The effect of adjuvant oral irrigation on self-administered oral care in the management of peri-implant mucositis: A randomized controlled clinical trial. in: Clin Oral Implants Res, 31, 10, S. 946–58.
Bürgers, R., Morsczeck, C., Felthaus, O., Gosau, M., Beck, H.C., Reichert, T.E. (2018): Induced surface proteins of Staphylococcus corrected epidermidis adhering to titanium implant substrata. in: Clin Oral Investig, 22, 7, S. 2663–68.
Canullo, L., Penarrocha-Oltra, D., Soldini, C., Mazzocco, F., Penarrocha, M., Covani, U. (2015): Microbiological assessment of the implant-abutment interface in different connections: cross-sectional study after 5 years of functional loading. in: Clin Oral Implants Res, 26, 4, S. 426–34.
Chappuis, V., Bornstein, M.M., Buser, D., Belser, U. (2016): Influence of implant neck design on facial bone crest dimensions in the esthetic zone analyzed by cone beam CT: a comparative study with a 5-to-9-year follow-up. in: Clin Oral Implants Res, 27, 9, S. 1055–64.
Davies, D. (2003): Understanding biofilm resistance to antibacterial agents. in: Nat Rev Drug Discov, 2, 2, S. 114–22.
de Oliveira Limírio, João Pedro Justino, Lemos, C.A.A., de Luna Gomes, Jéssica Marcela, Minatel, L., Alves Rezende, Maria Cristina Rosifini, Pellizzer, E.P. (2020): A clinical comparison of 1-piece versus 2-piece implants: A systematic review and meta-analysis. in: J Prosthet Dent, 124, 4, S. 439–45.
Degidi, M., Artese, L., Scarano, A., Perrotti, V., Gehrke, P., Piattelli, A. (2006): Inflammatory infiltrate, microvessel density, nitric oxide synthase expression, vascular endothelial growth factor expression, and proliferative activity in peri-implant soft tissues around titanium and zirconium oxide healing caps. in: J Periodontol, 77, 1, S. 73–80.
Dhir, S., Mahesh, L., Kurtzman, G.M., Vandana, K.L. (2013): Peri-implant and periodontal tissues: a review of differences and similarities. in: Compend Contin Educ Dent, 34, 7, e69-75.
Do Nascimento, C., Pita, M.S., Fernandes, Flávio Henrique Nogueira Carriço, Pedrazzi, V., de Albuquerque Junior, Rubens Ferreira, Ribeiro, R.F. (2014): Bacterial adhesion on the titanium and zirconia abutment surfaces. in: Clin Oral Implants Res, 25, 3, S. 337–43.
Doll, K., Fadeeva, E., Schaeske, J., Ehmke, T., Winkel, A., Heisterkamp, A., Chichkov, B.N., Stiesch, M., Stumpp, N.S. (2017): Development of Laser-Structured Liquid-Infused Titanium with Strong Biofilm-Repellent Properties. in: ACS Appl Mater Interfaces, 9, 11, S. 9359–68.
Gross, C., Nelson, K., Schmelzeisen, R., Fretwurst, T. (2021): Wahl des Implantatmaterials. in: DFZ, 65, 7-8, S. 82–87.
Gupta, S., Sabharwal, R., Nazeer, J., Taneja, L., Choudhury, B.K., Sahu, S. (2019): Platform switching technique and crestal bone loss around the dental implants: A systematic review. in: Ann Afr Med, 18, 1, S. 1–6.
Hahnel, S., Wieser, A., Lang, R., Rosentritt, M. (2015): Biofilm formation on the surface of modern implant abutment materials. in: Clin Oral Implants Res, 26, 11, S. 1297–301.
Heitz-Mayfield, L.J.A., Salvi, G.E. (2018): Peri-implant mucositis. in: J Periodontol, 89 Suppl 1, S257-S266.
Howe, M.-S., Keys, W., Richards, D. (2019): Long-term (10-year) dental implant survival: A systematic review and sensitivity meta-analysis. in: J Dent, 84, S. 9–21.
Jepsen, S., Berglundh, T., Genco, R., Aass, A.M., Demirel, K., Derks, J., Figuero, E., Giovannoli, J.L., Goldstein, M., Lambert, F., Ortiz-Vigon, A., Polyzois, I., Salvi, G.E., Schwarz, F., Serino, G., Tomasi, C., Zitzmann, N.U. (2015): Primary prevention of peri-implantitis: managing peri-implant mucositis. in: J Clin Periodontol, 42 Suppl 16, S152-7.
Jordan, A.R., Micheelis, W. (2016): Fünfte Deutsche Mundgesundheitsstudie (DMS V).
Klinge, B., Meyle, J. (2012): Peri-implant tissue destruction. The Third EAO Consensus Conference 2012. in: Clin Oral Implants Res, 23 Suppl 6, S. 108–10.
Korsch, M., Marten, S.-M., Walther, W., Vital, M., Pieper, D.H., Dötsch, A. (2018): Impact of dental cement on the peri-implant biofilm-microbial comparison of two different cements in an in vivo observational study. in: Clin Implant Dent Relat Res, 20, 5, S. 806–13.
Körtvélyessy, G., Tarjányi, T., Baráth, Z.L., Minarovits, J., Tóth, Z. (2021): Bioactive coatings for dental implants: A review of alternative strategies to prevent peri-implantitis induced by anaerobic bacteria. in: Anaerobe, 70, S. 102404.
Lafaurie, G.I., Sabogal, M.A., Castillo, D.M., Rincón, M.V., Gómez, L.A., Lesmes, Y.A., Chambrone, L. (2017): Microbiome and Microbial Biofilm Profiles of Peri-Implantitis: A Systematic Review. in: J Periodontol, 88, 10, S. 1066–89.
Lima, Emilena Maria Castor Xisto, Koo, H., Vacca Smith, A.M., Rosalen, P.L., Del Bel Cury, Altair Antoninha (2008): Adsorption of salivary and serum proteins, and bacterial adherence on titanium and zirconia ceramic surfaces. in: Clin Oral Implants Res, 19, 8, S. 780–85.
Lindhe, J., Meyle, J. (2008): Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. in: J Clin Periodontol, 35, 8 Suppl, S. 282–85.
Mombelli, A., Décaillet, F. (2011): The characteristics of biofilms in peri-implant disease. in: J Clin Periodontol, 38 Suppl 11, S. 203–13.
Mombelli, A., Müller, N., Cionca, N. (2012): The epidemiology of peri-implantitis. in: Clin Oral Implants Res, 23 Suppl 6, S. 67–76.
Norowski, P.A., Bumgardner, J.D. (2009): Biomaterial and antibiotic strategies for peri-implantitis: a review. in: J Biomed Mater Res B Appl Biomater, 88, 2, S. 530–43.
Padial-Molina, M., López-Martínez, J., O'Valle, F., Galindo-Moreno, P. (2016): Microbial Profiles and Detection Techniques in Peri-Implant Diseases: a Systematic Review. in: J Oral Maxillofac Res, 7, 3, e10.
Pérez-Tanoira, R., Aarnisalo, A.A., Eklund, K.K., Han, X., Soininen, A., Tiainen, V.-M., Esteban, J., Kinnari, T.J. (2017): Prevention of Biomaterial Infection by Pre-Operative Incubation with Human Cells. in: Surg Infect (Larchmt), 18, 3, S. 336–44.
Pham, M.H., Haugen, H.J., Reseland, J.E. (2020): Fluoride Modification of Titanium Surfaces Enhance Complement Activation. in: Materials (Basel), 13, 3.
Pontoriero, R., Tonelli, M.P., Carnevale, G., Mombelli, A., Nyman, S.R., Lang, N.P. (1994): Experimentally induced peri-implant mucositis. A clinical study in humans. in: Clin Oral Implants Res, 5, 4, S. 254–59.
Ramburrun, P., Pringle, N.A., Dube, A., Adam, R.Z., D'Souza, S., Aucamp, M. (2021): Recent Advances in the Development of Antimicrobial and Antifouling Biocompatible Materials for Dental Applications. in: Materials (Basel), 14, 12.
Safii, S.H., Palmer, R.M., Wilson, R.F. (2010): Risk of implant failure and marginal bone loss in subjects with a history of periodontitis: a systematic review and meta-analysis. in: Clin Implant Dent Relat Res, 12, 3, S. 165–74.
Sahrmann, P., Gilli, F., Wiedemeier, D.B., Attin, T., Schmidlin, P.R., Karygianni, L. (2020): The Microbiome of Peri-Implantitis: A Systematic Review and Meta-Analysis. in: Microorganisms, 8, 5.
Sailer, I., Mühlemann, S., Zwahlen, M., Hämmerle, C.H.F., Schneider, D. (2012): Cemented and screw-retained implant reconstructions: a systematic review of the survival and complication rates. in: Clin Oral Implants Res, 23 Suppl 6, S. 163–201.
Schwarz, F., Becker, J. (2015): Periimplantäre Infektionen, Ein Update zur Epidemiologie, Ätiologie, Diagnostik, Prävention und Therapie. in: Quintessenz Implantologie, 23, S. 1–13.
Schwarz, F., Becker, J. (2016): Die Behandlung periimplantärer Infektionen an Zahnimplantaten, S3-Leitlinie (Langversion). www.awmf.org/uploads/tx_szleitlinien/083-023l_S3_Periimplant%C3%A4re_Infektionen_2016-08-abgelaufen.pdf (14.08.2021)
Schwarz, F., Schmucker, A., Becker, J. (2015): Efficacy of alternative or adjunctive measures to conventional treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. in: Int J Implant Dent, 1, 1, S. 22.
Shin, Y.-K., Han, C.-H., Heo, S.-J., Kim, S., Chun, H.-J. (2006): Radiographic evaluation of marginal bone level around implants with different neck designs after 1 year. in: Int J Oral Maxillofac Implants, 21, 5, S. 789–94.
Srinivasan, M., Meyer, S., Mombelli, A., Müller, F. (2017): Dental implants in the elderly population: a systematic review and meta-analysis. in: Clin Oral Implants Res, 28, 8, S. 920–30.
Teughels, W., van Assche, N., Sliepen, I., Quirynen, M. (2006): Effect of material characteristics and/or surface topography on biofilm development. in: Clin Oral Implants Res, 17 Suppl 2, S. 68–81.
van Brakel, R., Cune, M.S., van Winkelhoff, A.J., Putter, C. de, Verhoeven, J.W., van der Reijden, W. (2011): Early bacterial colonization and soft tissue health around zirconia and titanium abutments: an in vivo study in man. in: Clin Oral Implants Res, 22, 6, S. 571–77.
Volpe, S., Damiano, V., Peter, A., Jan, G., Lars, S. (2008): Comparison of early bacterial colonization of PEEK and titanium healing abutments using real-time PCR. in: Albrektsson, T.: Applied Osseointegration Research, Clinical Performance and Enhanced Stability, Göteborg, Schweden.
Wu, S., Xu, J., Zou, L., Luo, S., Yao, R., Zheng, B., Liang, G., Wu, D., Li, Y. (2021): Long-lasting renewable antibacterial porous polymeric coatings enable titanium biomaterials to prevent and treat peri-implant infection. in: Nat Commun, 12, 1, S. 3303.
Zhang, Q., Yue, X. (2021): Marginal Bone Loss around Machined Smooth Neck Implants Compared to Rough Threaded Neck Implants: A Systematic Review and Meta-Analysis. in: J Prosthodont, 30, 5, S. 401–11.
Zhao, B., van der Mei, Henny C, Subbiahdoss, G., Vries, J. de, Rustema-Abbing, M., Kuijer, R., Busscher, H.J., Ren, Y. (2014): Soft tissue integration versus early biofilm formation on different dental implant materials. in: Dent Mater, 30, 7, S. 716–27.
Zipprich, H., Paul, W., Bodo, L., Hans-Christoph, L. (2007): Erfassung, Ursachen und Folgen von Mikrobewegungen am Implantat-Abutment-Interface. in: Implantologie, 15, 1, S. 31–46.
zm online (2018): 1,3 Millionen Zahnimplantate pro Jahr. www.zm-online.de/news/zahnmedizin/13-millionen-zah