Vom Abszess im Unterkiefer zur Intensivstation
Ein 51-Jähriger stellte sich nach Konsultation eines niedergelassenen MKG-Chirurgen in der Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz mit einem perimandibulären Abszess des linken Unterkiefers vor. Der Patient berichtete von einem prolongierten Verlauf über eine Woche mit Schmerz- und Schwellungszunahme im Bereich der linken Wange. Bei Progredienz und Ausbreitungstendenz erfolgte daraufhin die Vorstellung in unserer Klinik.
Es präsentierte sich ein Patient in gemindertem Allgemeinzustand. Anamnestisch konnten ein Diabetes mellitus Typ 2, eine Colitis Ulcerosa, eine einseitige Nierenhypoplasie sowie eine Koronare Herzkrankheit mit einem erfolgten Aortenklappenersatz und aortocoronarem Venenbypass eruiert werden. Es bestand eine ausgeprägte submandibuläre Schwellung des linken Unterkiefers mit einer kaudalen Ausbreitung bis an das Jugulum heranreichend. Zum Aufnahmezeitpunkt gab der Mann bereits starke Schluckbeschwerden und Dyspnoe an. Die orale Inspektion war aufgrund der stark reduzierten Schneidekantendistanz von circa 15 mm erschwert. Es zeigte sich jedoch ein stark angehobener Mundboden in Kombination mit einem verstrichenen Vestibulum im Bereich des dritten Quadranten.
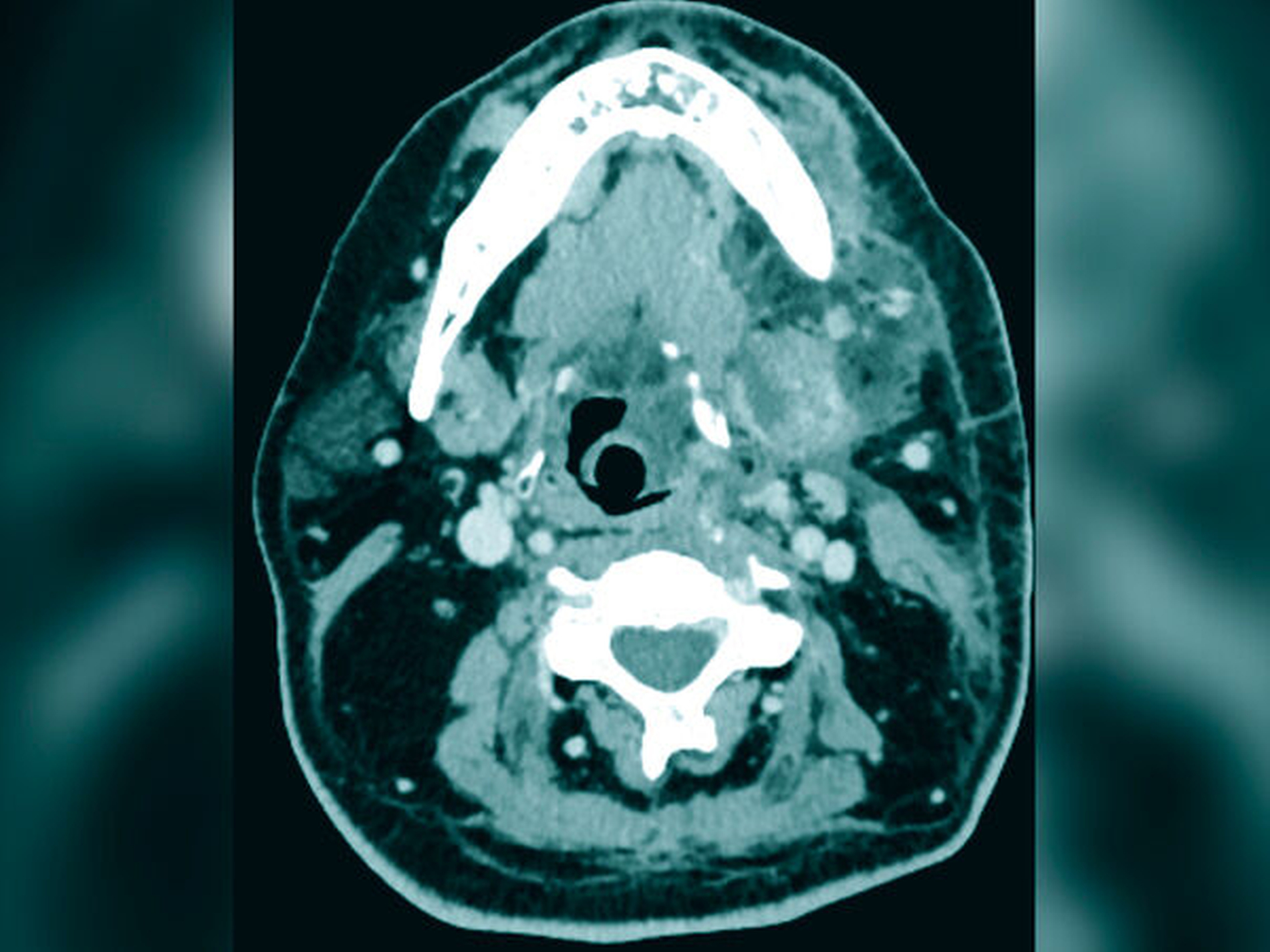
Eine angefertigte Panoramaschichtaufnahme zeigte ein konservierend und prothetisch unvollständig versorgtes Gebiss mit einem wurzelkanalbehandelten Zahn 36 und einer apikalen Osteolyse (Abbildung 1). Angesichts des ausgedehnten Abszessgeschehens wurde eine notfallmäßige Computertomografie zur erweiterten Diagnostik durchgeführt. Hier zeigte sich ein großflächiger Abszess des linken Unterkiefers mit einer Ausbreitung in die Tonsillenregion sowie in die Halslogen mit begleitenden einschmelzenden Prozessen (Abbildung 2). Zusätzlich zeigten sich im initial angefertigten Blutbild des Patienten ein Procalcitonin von 10 ng/ml, eine Blutglukose von 1.034 mg/dl sowie ein HBA1c-Wert von 13 Prozent. In der Zusammenschau der Befunde konnte somit von einem beginnenden septischen Krankheitsbild ausgegangen werden.
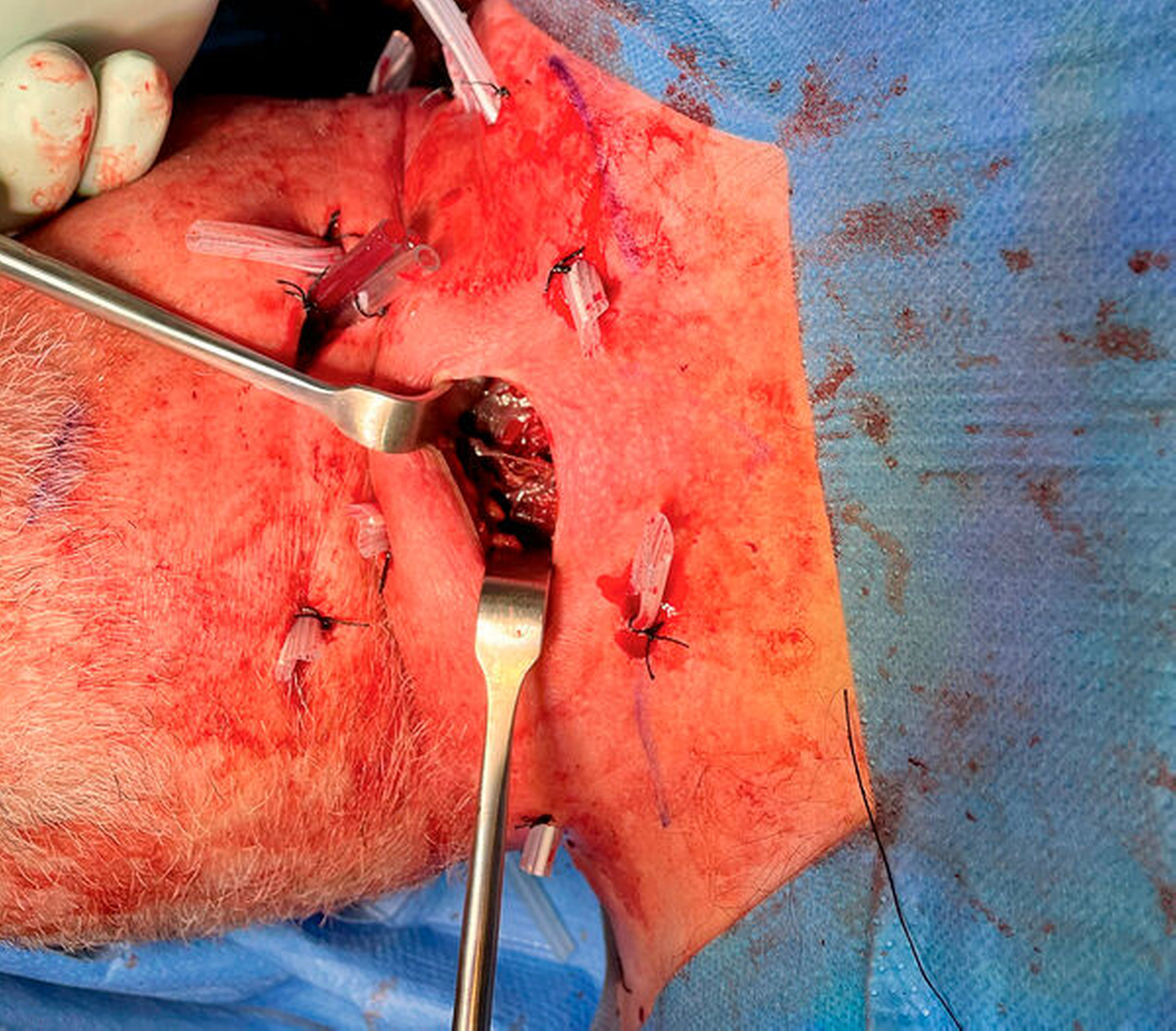
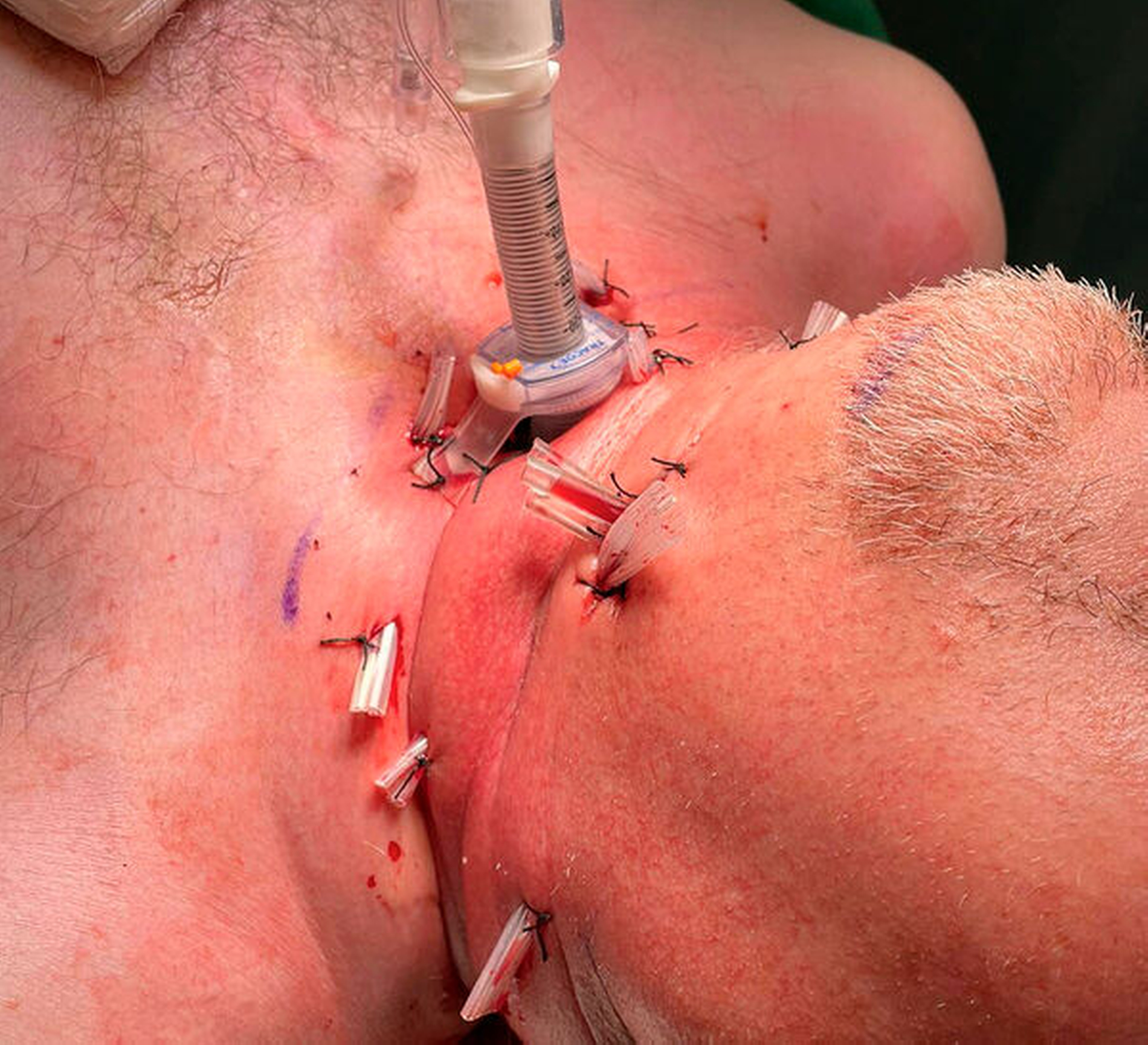
Es bestand die Indikation zur notfallmäßigen chirurgischen Intervention mittels Abszessdrainage. Hierzu erfolgten zunächst die Eröffnung der submandibulären und der perimandibulären Kompartimente über eine extraorale Schnittführung sowie die Extraktion des Zahnes 36. Darüber hinaus wurden die zervikalen und die jugulären Muskelfaszien zur weiteren Entlastung des entzündlichen Geschehens eröffnet. Bei der Drainage zeigte sich neben dem erwarteten Pus- und Blutabgang auch der Abgang von nekrotisch verändertem Muskelgewebe und gebildetem Gas nahezu im gesamten Halsbereich (Abbildung 3). Nach dem Debridement wurde der Wundbereich großzügig gespült. Abschließend wurden multiple Drainagen in die eröffneten Logen eingebracht und mittels Annaht fixiert (Abbildung 4).
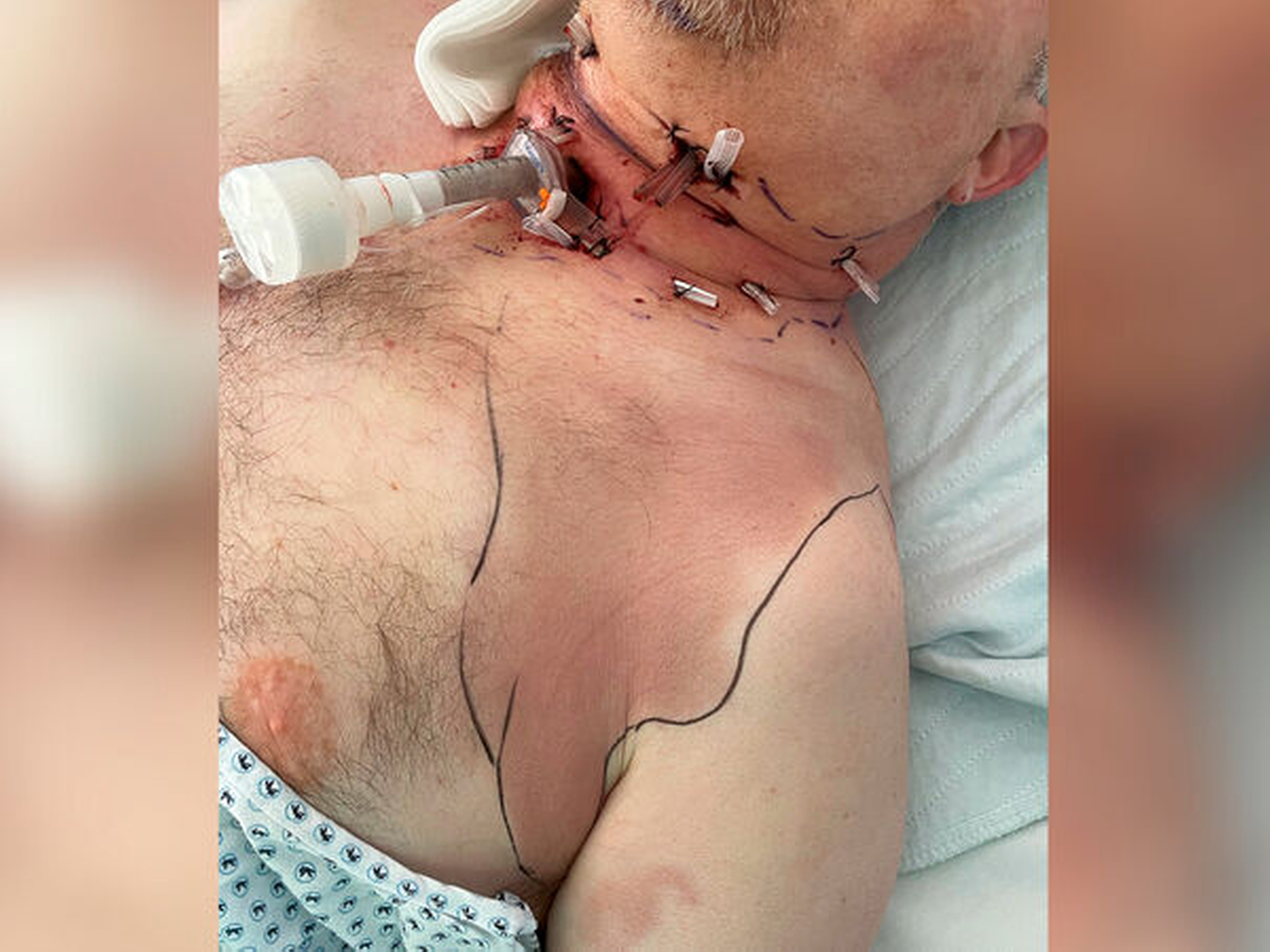
Bereits bei der anästhesiologischen Einleitung war das Airway-Management mit fiberoptischer Intubation erschwert. Daher erfolgte die intraoperative Entscheidung zur Tracheotomie des Patienten zwecks Atemwegssicherung. Postoperativ wurde der Patient bei einem beginnend septischen Krankheitsbild auf die Intensivstation übernommen. Die intraoperativ gewonnenen Wundabstriche zeigten neben Staphylokokken auch zahlreiche grampositive und -negative Anaerobier wie Prevotella buccae und Bifidobacterium dentium. Nach Rückübernahme auf die Normalstation erfolgte zunächst die intensivierte antibiotische Therapie mit Tazobactam und Imipenem, die in enger Absprache mit der mikrobiologischen Abteilung in domo nach Antibiogramm im Verlauf auf Ciprofloxacin und Metronidazol umgestellt wurde. Laborkontrollen der Infektionsparameter und der Elektrolyte wurden täglich durchgeführt. Postinterventionell zeigte der Patient Zeichen einer kardialen Dekompensation mit generalisierten Ödemen und verminderter Belastbarkeit. Eine Endokarditis konnte durch mehrere Vorstellungen in der kardiologischen Klinik der Universitätsmedizin jedoch ausgeschlossen werden. Ein erneutes Aufflammen der klinischen und der laborchemischen Infektionsparameter erforderte ein erneutes Eröffnen der zervikalen Logen und die Drainage von nekrotischen Gewebe (Abbildung 5). Unter täglichen Verbandswechseln und ausgedehnten Spülungen konnte der Patient vom Tracheostoma entwöhnt und sämtliche Drainagen konnten entfernt werden. Nach einem prolongierten Aufenthalt von vier Wochen wurde der Patient in die ambulante Nachsorge entlassen.
Die nekrotisierende Fasziitis bezeichnet eine progressive und destruierende Infektion des Weichgewebes mit erheblicher Morbidität und Mortalität [Oguz und Yilmaz, 2012]. Die Inzidenz dieser Erkrankung im Kopf-Hals-Bereich ist nicht sicher bekannt. Sie wird je nach Literatur mit 4–400/100.000 angegeben und kann daher als selten angesehen werden [Wolfet al., 2010; Chou et al., 2020]. Häufiger findet sich das Krankheitsbild im Bereich der Extremitäten, des Abdomens und der Leistengegend. Immunkomprimierende Faktoren wie Diabetes mellitus, Alkoholismus, chronisches Nierenversagen, Infektionserkrankungen oder Adipositas erhöhen das Risiko zur Entwicklung einer nekrotisierenden Fasziitis erheblich [Weiss et al., 2011]. Ein schlecht eingestellter Diabetes mellitus findet sich hierbei als häufigste Begleiterkrankung in Patienten mit einer nekrotisierenden Fasziitis im Kopf-Hals-Bereich [Cheng et al., 2015; Gunaratne et al., 2018]. Dentogene oder pharyngeale Prozesse sind als die häufigsten Ursachen der Erkrankung beschrieben. Hierzu zählen beispielsweise entzündliche Prozesse in der Mundhöhle, allen voran Entzündungen im Bereich der Unterkiefermolaren [Bahu et al., 2001; Kämmerer et al., 2017]. Weitere mögliche Ursachen sind die Pharyngitis, die Tonsillitis, eine Speicheldrüseninfektion, eine Bestrahlung im Kopf-Hals-Bereich oder auch Traumata mit ausgeprägter Weichgewebsbeteiligung [Siegberg et al., 2021].
Die Symptome der nekrotisierenden Fasziitis sind vor allem in frühen Stadien der Erkrankung eher unspezifisch und lassen sich oft nur schwer von anderen entzündlichen Prozessen abgrenzen. Dies beinhaltet uncharakteristische Schmerzen in Kombination mit einer Schwellung und Rötung. Eine Hautbeteiligung bleibt häufig aufgrund der guten Durchblutung klinisch inapparent. Bei voranschreitender Infektion lassen sich systemische Symptome wie Fieber und eine Reduzierung des Allgemeinzustands gegebenenfalls in Kombination mit kutanen Symptomen wie Blasenbildung oder Krepitationen erheben. Engmaschige klinische Kontrollen sind deshalb unbedingt erforderlich, um rechtzeitig zu intervenieren. Unbehandelt führt die Erkrankung in der Regel zum septischen Schock mit Multiorganversagen. Häufige Komplikationen im Bereich der Kopf-Hals-Kompartimente sind eine absteigende nekrotisierende Mediastinitis und vaskuläre Komplikationen mit Thrombosen oder Aneurysmen der Halsgefäße [Petitpas et al., 2012].
Im initialen Stadium ist eine rasche Diagnosefindung entscheidend für die Prognose der Patienten. Eine erweiterte Diagnostik mittels Computertomografie ist schnellstmöglich anzustreben. Die radiologische Symptomatik zeigt neben Abszessformationen – wie im vorgestellten Fall – vor allem Lufteinschlüsse und Einschmelzungen mit Flüssigkeitsansammlungen in den tieferen Faszienanteilen. Das umgebende Fettgewebe und die umgebende Muskulatur stellen sich oftmals verdickt dar [Fais et al., 2018]. Obgleich diese radiologischen Phänomene pathognomonisch für die Erkrankung sind, finden sie sich nicht in allen Patienten. Eine chirurgische Exploration führt in der Regel zur Diagnose. Bei Eröffnung der Kompartimente lassen sich neben Pus und Blut auch nekrotische Muskulatur und subkutanes Gewebe darstellen.
Die erfolgreiche Therapie der nekrotisierenden Fasziitis umfasst ein multidisziplinäres Therapieregime. Eine frühe Diagnose, eine kalkulierte Hochdosisantibiotikatherapie sowie ein ausgedehntes Wunddebridement gehören zum Standard in der Therapie. Entscheidend ist hierbei in erster Linie ein zeitnahes und ausgedehntes chirurgisches Wunddebridement, das nicht selten im Erkrankungsverlauf wiederholt werden muss. Bei fulminanten Verläufen sollte an eine Atemwegssicherung mittels Tracheotomie gedacht werden, auch um erschwerte Reintubationen bei erneuter chirurgischer Wundtoilette zu vermeiden. In vielen Fällen ist eine intensivmedizinsche Behandlung der Patienten unabdingbar [Kämmerer et al., 2017; Goetze und Kämmerer, 2020]. Zusätzliche Therapieformen wie eine hyperbare Sauerstofftherapie können ebenfalls zum Einsatz kommen [Flanagan et al., 2009].
Die antibiotische Therapie wird in der Regel durch eine kalkulierte Antibiose mit Wirkungsspektrum im grampositiven, im gramnegativen sowie im anaeroben Bereich durchgeführt. Eine Anpassung der Therapie kann nach Erstellung eines Antibiogramms nach intraoperativem Abstrich und Gewebeproben durchgeführt werden. Ursächlich finden sich in den meisten Fällen Streptokokken oder Mischinfektion mit aerob-anaerobem Erregerspektrum. Je nach Fokus können bei odontogenen Infektionsgeschehen oftmals Erreger wie Prevotella- oder Bacteroidesstämme nachgewiesen werden.
Literaturliste
Bahu, S. J., T. Y. Shibuya, R. J. Meleca, R. H. Mathog, G. H. Yoo, R. J. Stachler and J. G. Tyburski (2001). „Craniocervical necrotizing fasciitis: an 11-year experience.“ Otolaryngol Head Neck Surg 125(3): 245-252.
Cheng, N. C., H. C. Tai, S. C. Chang, C. H. Chang and H. S. Lai (2015). „Necrotizing fasciitis in patients with diabetes mellitus: clinical characteristics and risk factors for mortality.“ BMC Infect Dis 15: 417.
Chou, P. Y., Y. H. Hsieh and C. H. Lin (2020). „Necrotizing fasciitis of the entire head and neck: Literature review and case report.“ Biomed J 43(1): 94-98.
Fais, P., A. Viero, G. Viel, R. Giordano, D. Raniero, S. Kusstatscher, C. Giraudo, G. Cecchetto and M. Montisci (2018). „Necrotizing fasciitis: case series and review of the literature on clinical and medico-legal diagnostic challenges.“ Int J Legal Med 132(5): 1357-1366.
Flanagan, C. E., O. O. Daramola, R. H. Maisel, C. Adkinson and R. M. Odland (2009). „Surgical debridement and adjunctive hyperbaric oxygen in cervical necrotizing fasciitis.“ Otolaryngol Head Neck Surg 140(5): 730-734.
Goetze, E. and P. W. Kämmerer (2020). „Der besondere Fall mit CME: Nekrotisierende Fasziitis nach dentogenem Infekt.“ Zahnärztliche Mitteilungen 110(8): 64-67.
Gunaratne, D. A., E. A. Tseros, Z. Hasan, A. S. Kudpaje, A. Suruliraj, M. C. Smith, F. Riffat and C. E. Palme (2018). „Cervical necrotizing fasciitis: Systematic review and analysis of 1235 reported cases from the literature.“ Head Neck 40(9): 2094-2102.
Kämmerer, P. W., T. Schürholz and B. Frerich (2017). „Der besondere Fall mit CME – Nekrotisierende Fasziitis odontogenen Ursprungs.“ Zahnärztliche Mitteilungen 107(14): 30-34.
Oguz, H. and M. S. Yilmaz (2012). „Diagnosis and management of necrotizing fasciitis of the head and neck.“ Curr Infect Dis Rep 14(2): 161-165.
Petitpas, F., J. P. Blancal, J. Mateo, I. Farhat, W. Naija, R. Porcher, C. Beigelman, M. Boudiaf, D. Payen, P. Herman and A. Mebazaa (2012). „Factors associated with the mediastinal spread of cervical necrotizing fasciitis.“ Ann Thorac Surg 93(1): 234-238.
Siegberg, F., P. W. Kämmerer and D. Thiem (2021). „Der besondere Fall mit CME: Nekrotisierende Fasziitis der Galea aponeurotica nach Rohheitsdelikt.“ Zahnärztliche Mitteilungen 111(56-59).
Weiss, A., P. Nelson, R. Movahed, E. Clarkson and H. Dym (2011). „Necrotizing fasciitis: review of the literature and case report.“ J Oral Maxillofac Surg 69(11): 2786-2794.
Wolf, H., M. Rusan, K. Lambertsen and T. Ovesen (2010). „Necrotizing fasciitis of the head and neck.“ Head Neck 32(12): 1592-1596.