Das primär kutane Lymphom – eine Differenzialdiagnose maligner Weichteiltumoren
Eine 90-jährige Patientin stellte sich erstmals im September 2021 mit einer zunehmenden Raumforderung supraorbital beidseitig sowie temporal links in der Mund-, Kiefer- und Gesichtschirurgischen Ambulanz des Universitätsklinikums Freiburg vor. Die Patientin berichtete, dass die Schwellung am medialen Augenlidbereich das Gesichtsfeld stark einschränke (Abbildung 1). Die Allgemeinanamnese war bis auf eine arterielle Hypertonie unauffällig. Als Eigenmedikation gab die Patientin lediglich die Einnahme von Antihypertensiva an. Die Einnahme von Antikoagulantien war vorab verneint worden.
Klinisch zeigte sich eine harte, indurierte, nicht verschiebliche Raumforderung am Jochbogen und temporal links. In der Sonografie stellte sich die Veränderung als echoreich und unscharf begrenzt dar. Zudem waren zervikal multiple vergrößerte Lymphknoten erkennbar.
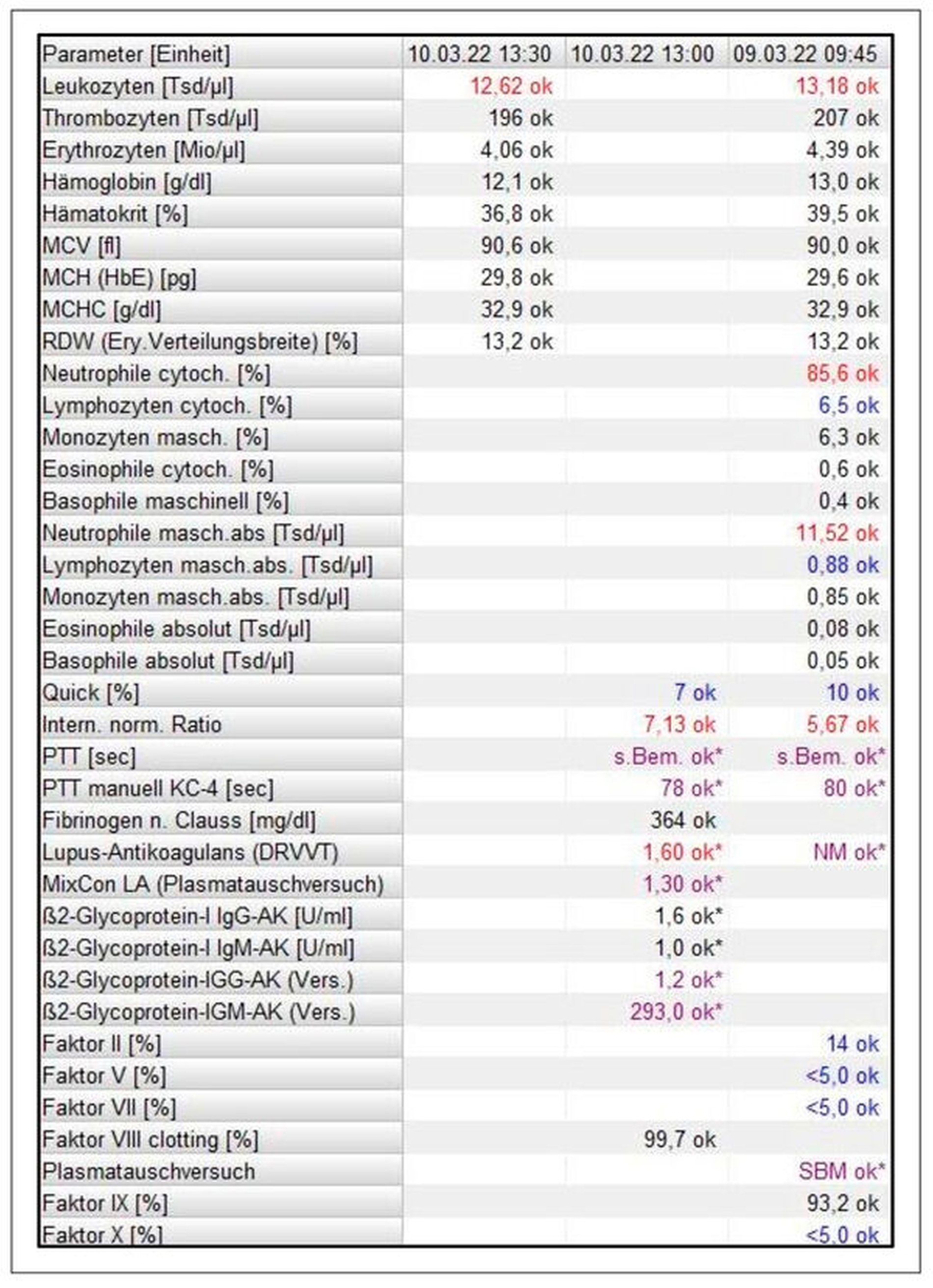
In der am Vorstellungstag durchgeführten CT-Bildgebung zeigte sich eine linksführende Weichgewebevermehrung in der Wange mit Ausdehnung nach periorbital und in die Parotisloge, radiologisch prinzipiell vereinbar mit einem mesenchymalen Tumor wie zum Beispiel einem fibrösen Histiocytom. Die laborchemische Untersuchung ergab einen INR-Wert (International Normalized Ratio – Maß für die Dauer der Blutgerinnung) von 5,59 (Quick 9 Prozent) und eine PTT (Partielle Thromboplastinzeit – Test auf Blutgerinnungsstörungen) von 90 Sekunden. Eine stationäre Aufnahme zur weiteren Diagnostik des lebensbedrohlich erhöhten INR und der unklaren Raumforderung wurde trotz ausführlicher Aufklärung von der Patientin und den Angehörigen abgelehnt.
Im Februar 2022 erfolgte die Wiedervorstellung der Patientin mit starker Größenprogredienz der bekannten Raumforderung. Sie berichtete, zwischenzeitlich heimatnah bei unterschiedlichen Ärzten vorstellig geworden zu sein; jedoch habe bisher keine Diagnose gestellt werden können.
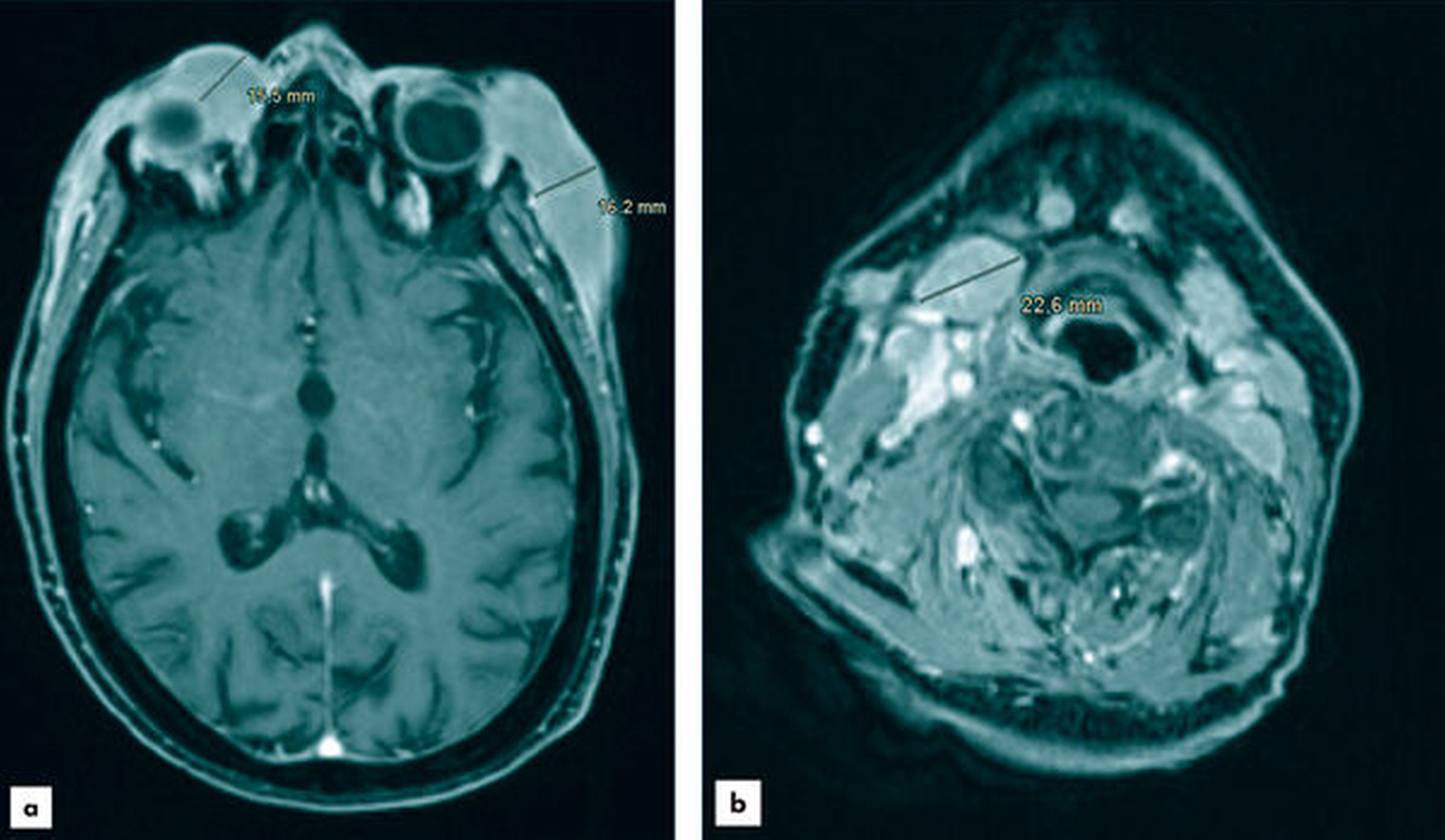
In der im Rahmen des nun erfolgten stationären Aufenthalts durchgeführten MRT-Bildgebung war die Raumforderung temporal links im Vergleich zur Voruntersuchung stark größenprogredient. Zervikal waren weiterhin beidseitig pathologisch vergrößerte Lymphknoten darstellbar (Abbildung 2).
Im Aufnahmelabor imponierte erneut eine INR-Erhöhung auf 7,1 (Quick 7 Prozent). Als Ursache für diesen Wert konnte das Vorhandensein eines den INR-Wert verfälschenden Lupus-Antikoagulans identifiziert werden (Abbildung 3). Eine in Lokalanästhesie durchgeführte Probenentnahme von temporal ergab in der histopathologischen Aufarbeitung ein kutanes Lymphom vom Keimzentrumstyp mit der Tumorformel cT2 cN2 M0. Die anschließende Weiterbehandlung nach Diagnosesicherung erfolgte auf Patientenwunsch heimatnah beim niedergelassenen Onkologen.
Diskussion
Das kutane Lymphom gehört zur Gruppe der sogenannten extranodalen Non-Hodgkin-Lymphome [Dippel et al., 2021]. Die Inzidenz in der Bundesrepublik Deutschland wird auf circa 800 Neuerkrankungen pro Jahr geschätzt [Assaf et al., 2007]. Das entspricht einer Inzidenzrate von etwa 1:100.000, womit es zu den sogenannten seltenen Erkrankungen gehört. Unterschieden werden kutane T-Zell-Lymphome, die in circa 73 Prozent der kutanen Lymphome vorkommen, von kutanen B-Zell-Lymphomen, die circa 22 Prozent der kutanen Lymphome ausmachen [Inhoff & Dippel, 2011].
Die kutanen T-Zell-Lymphome werden in Untergruppen unterteilt, zum Beispiel Mycosis fungoides, die bei 62 Prozent aller T-Zell-Lymphome diagnostiziert wird und sich anfangs durch eine rote, fleckige Schuppung der Haut äußert. Abhängig vom Tumorstadium kommen topische Therapien, eine Lichttherapie, eine Radiotherapie oder eine systemische Therapie als Behandlungsmethoden infrage [Dippel et al., 2021; Inhoff & Dippel, 2011].
Die kutanen B-Zell-Lymphome werden nach aktueller WHO-EORTC-Klassifikation [Willemze et al., 2019] in drei Haupttypen unterteilt. Zwei Untergruppen weisen eine Fünf-Jahres-Überlebensrate von ³ 95 Prozent auf. Dabei handelt es sich um das oben beschriebene primäre kutane Lymphom vom Keimzentrumstyp (Follikuläres Lymphom) und das primär kutane Marginalzonenlymphom. Das primär kutane diffus-großzellige B-Zell-Lymphom als dritter Haupttypus hat eine Fünf-Jahres-Überlebensrate von 55 Prozent [Inhoff & Dippel, 2011].
Das primär kutane Lymphom vom Keimzentrumstyp tritt meist ab dem 60. Lebensjahr auf. Frauen sind in einem Verhältnis von 1,3:1 häufiger betroffen als Männer [Fink-Puches et al., 2002]. Klinisch äußert sich die Krankheit meist durch > 3 cm große, bläulich-rote Plaques, die einzeln oder in Gruppen auftreten können. Sie treten vermehrt am Nacken oder am Stamm, am behaarten Kopf sowie im Stirnbereich auf und ulzerieren selten [Inhoff & Dippel, 2011; Willemze et al., 2019].
Zur Diagnostik eines primär kutanen B-Zell-Lymphoms ist eine Probebiopsie in ausreichender Größe für immunhistochemische Untersuchungen unerlässlich. Neben dem Wachstumsmuster des malignen Infiltrats wird die Morphologie der neoplastischen B-Zell-Population untersucht [Inhoff & Dippel, 2011]. Zusätzlich zur initialen histologischen Diagnosesicherung sind Laboruntersuchungen, bildgebende Verfahren wie CT, PET-CT oder auch MRT erforderlich, um das Ausbreitungsstadium des Malignoms exakt definieren zu können. Analog zu anderen Malignomen erfolgt die abschließende Stadieneinteilung mittels TNM-Klassifikation. Hierbei werden insgesamt drei T-Stadien unterschieden (T1 = solitärer/isolierter Hautbefall; T2 = regional/gruppiert auf einen Bereich begrenzt; T3 = generalisierter Hautbefall, multiple Herde) [Dippel et al., 2021; Kim et al., 2007].
Die Therapie kutaner Lymphome erfolgt nach der deutschen Leitlinie [Stadler et al., 2008] und der TNM-Klassifikation der ISCL/EORTC-Konsensusempfehlung [Kim et al., 2007]. Unabhängig vom T-Stadium ist die Radiotherapie Therapie der ersten Wahl; bei T1- und T2-Malignomen ist zusätzlich die Totalexzision möglich. Als Therapie der zweiten Wahl kommen intraläsional appliziertes Rituximab, ein auf CD20 positive B-Zellen spezialisierter Antikörper und das Zytokin Interferon-a (IFN-a), ebenfalls intraläsional appliziert, infrage. Bei multiplen Läsionen sowie systemischer Ausbreitung ist die intravenöse Gabe von Rituximab gegebenenfalls in Kombination mit anderen Chemotherapeutika Therapie der Wahl [Stadler et al., 2008]. Durch alleinige Radiotherapie kann meist eine Remission erzielt werden, allerdings treten bei 40 bis 50 Prozent der Patienten Rezidive auf [Senff et al., 2008]. In der deutschen Leitlinie zur Behandlung kutaner Lymphome [Stadler et al., 2008] werden keine evidenzbasierten Nachsorgeempfehlungen genannt, in den ersten drei Jahren nach Diagnosestellung wird jedoch eine ausgiebige Ganzkörperinspektion im dreimonatigen Intervall als Nachsorge empfohlen [Inhoff & Dippel, 2011]. Dieses Intervall kann individuell auf ein sechsmonatiges Intervall ab dem vierten Jahr ausgedehnt werden.
Lupus-Antikoagulantien gehören zur Gruppe der Antiphospholipid-Antikörper (APL-AK) und kommen in etwa ein bis fünf Prozent bei gesunden Erwachsenen beziehungsweise zu zwölf bis 34 Prozent bei Patienten mit systemischem Lupus Erythematodes (SLE) vor [Creagh & Greaves, 1991; Gezer, 2003; Tripodi, 2007]. Im Blut zirkulierende APL-AK können Gerinnungsparameter beeinflussen und somit Gerinnungstests stören [Chaturvedi & McCrae, 2017]. Als Phospholipid-bindende IgG- und/oder IgM-Antikörper führen sie hierbei zu einer Verlängerung von Phospholipid-abhängigen Gerinnungstests [Uthman et al., 2019]. Für die Diagnose wegweisend ist neben einer Thrombozytopenie, eine Quick-Wert-Erniedrigung oder auch eine aPTT-Verlängerung [Molhoek et al., 2018]. Das Antiphospholipid-Syndrom selbst wird differenziert in ein primäres Syndrom ohne Grunderkrankung und ein sekundäres Syndrom bei Vorerkrankungen. Auslösende Grunderkrankungen können rheumatoider Natur (zum Beispiel rheumatoide Arthritis), Infektionserkrankungen (zum Beispiel HIV) oder Malignome (paraneoplastisches Syndrom) sein.
Fazit
Bei multilokulär auftretenden Raumforderungen, gegebenenfalls verbunden mit bilateraler Lymphadenopathie, sollten systemische Erkrankungen wie Lymphome als Ursache berücksichtigt werden. Im Rahmen paraneoplastischer Syndrome auftretende unklare Laborwertveränderungen geben weitere Hinweise für die systemische Genese der Raumforderungen. Zur Diagnosesicherung sind Probebiopsien unerlässlich. Bei im Labor auffällig veränderten Gerinnungsparametern trotz unauffälliger Allgemeinanamnese sollten Autoimmunerkrankungen wie zum Beispiel das Antiphospholipid-Syndrom als Differenzialdiagnose in Betracht gezogen werden.
Literaturliste
Assaf, C., Gellrich, S., Steinhoff, M., Nashan, D., Weiße, F., Dippel, E., Coors, E., Stein, A., Gollin, P., Henke, U., Adam-Murati, S., Koch, A., Klemke, C.-D., Stadler, R., Sterry, W., 2007. Cutaneous lymphomas in Germany: an analysis of the Central Cutaneous Lymphoma Registry of the German Society of Dermatology (DDG). JDDG 5, 662–668. doi.org/10.1111/j.1610-0387.2007.06337.x
Chaturvedi, S., McCrae, K.R., 2017. Diagnosis and management of the antiphospholipid syndrome. Blood Rev. 31, 406–417. doi.org/10.1016/j.blre.2017.07.006
Creagh, M.D., Greaves, M., 1991. Lupus anticoagulant. Blood Rev. 5, 162–167. doi.org/10.1016/0268-960x(91)90033-9
Dippel, E., Assaf, C., Becker, J.C., Bergwelt-Baildon, M. von, Bernreiter, S., Cozzio, A., Eich, H.Th., Elsayad, K., Follmann, M., Grabbe, S., Hillen, U., Klapper, W., Klemke, C.-D., Loquai, C., Meiss, F., Mitteldorf, C., Wehkamp, U., Nashan, D., Nicolay, J.P., Oschlies, I., Schlaak, M., Stranzenbach, R., Moritz, R., Stoll, C., Vag, T., Weichenthal, M., Wobser, M., Stadler, R., 2021. S2k - Leitlinie - Kutane Lymphome (ICD10 C82 - C86).
Fink-Puches, R., Zenahlik, P., Bäck, B., Smolle, J., Kerl, H., Cerroni, L., 2002. Primary cutaneous lymphomas: applicability of current classification schemes (European Organization for Research and Treatment of Cancer, World Health Organization) based on clinicopathologic features observed in a large group of patients. Blood 99, 800–805. doi.org/10.1182/blood.v99.3.800
Gezer, S., 2003. Antiphospholipid syndrome. Dis. Mon. 49, 696–741. doi.org/10.1016/j.disamonth.2003.10.001
Inhoff, O., Dippel, E., 2011. Primär kutane B-Zell-Lymphome. Aktuelle Dermatol. 37, 47–56. doi.org/10.1055/s-0030-1256016
Kim, Y.H., Willemze, R., Pimpinelli, N., Whittaker, S., Olsen, E.A., Ranki, A., Dummer, R., Hoppe, R.T., ISCL and the EORTC, 2007. TNM classification system for primary cutaneous lymphomas other than mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the Cutaneous Lymphoma Task Force of the European Organization of Research and Treatment of Cancer (EORTC). Blood 110, 479–484. doi.org/10.1182/blood-2006-10-054601
Molhoek, J.E., de Groot, P.G., Urbanus, R.T., 2018. The Lupus Anticoagulant Paradox. Semin. Thromb. Hemost. 44, 445–452. doi.org/10.1055/s-0037-1606190
Senff, N.J., Noordijk, E.M., Kim, Y.H., Bagot, M., Berti, E., Cerroni, L., Dummer, R., Duvic, M., Hoppe, R.T., Pimpinelli, N., Rosen, S.T., Vermeer, M.H., Whittaker, S., Willemze, R., European Organization for Research and Treatment of Cancer, International Society for Cutaneous Lymphoma, 2008. European Organization for Research and Treatment of Cancer and International Society for Cutaneous Lymphoma consensus recommendations for the management of cutaneous B-cell lymphomas. Blood 112, 1600–1609. doi.org/10.1182/blood-2008-04-152850
Stadler, R., Assaf, C., Klemke, C.-D., Nashan, D., Weichenthal, M., Dummer, R., Sterry, W., 2008. Short German guidelines: cutaneous lymphomas. J. Dtsch. Dermatol. Ges. J. Ger. Soc. Dermatol. JDDG 6 Suppl 1, S25-31. doi.org/10.1111/j.1610-0387.2008.06710.x
Tripodi, A., 2007. Laboratory Testing for Lupus Anticoagulants: A Review of Issues Affecting Results. Clin. Chem. 53, 1629–1635. doi.org/10.1373/clinchem.2007.089524
Uthman, I., Noureldine, M.H.A., Ruiz-Irastorza, G., Khamashta, M., 2019. Management of antiphospholipid syndrome. Ann. Rheum. Dis. 78, 155–161. doi.org/10.1136/annrheumdis-2018-213846
Willemze, R., Cerroni, L., Kempf, W., Berti, E., Facchetti, F., Swerdlow, S.H., Jaffe, E.S., 2019. The 2018 update of the WHO-EORTC classification for primary cutaneous lymphomas. Blood 133, 1703–1714. doi.org/10.1182/blood-2018-11-881268