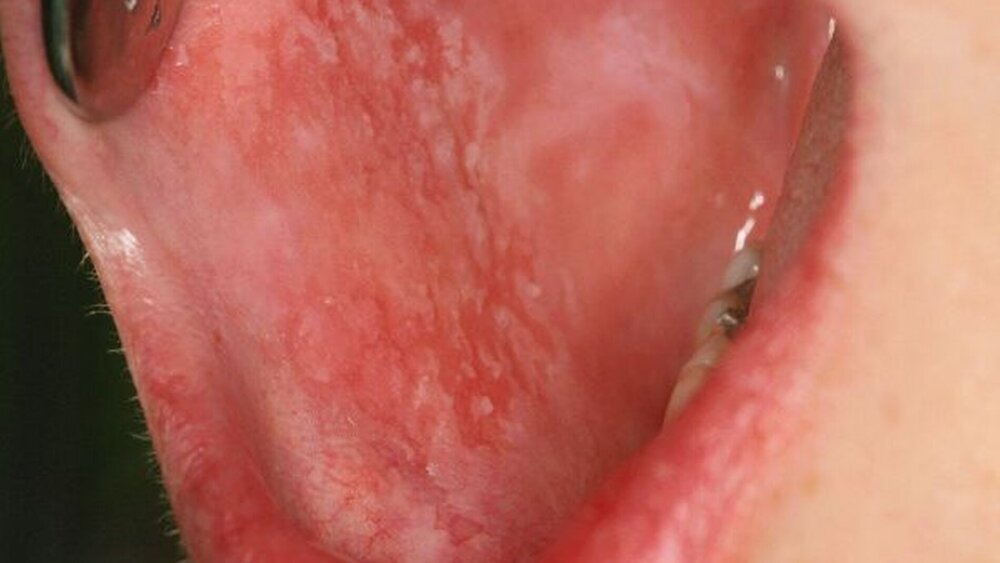
Orale Manifestation von Morbus Crohn
Morbus Crohn (MC) gehört neben Colitis ulcerosa (CU) zu den chronisch entzündlichen Darmerkrankungen, die im Wesentlichen auf einer Dysregulation der mukosalen Immunantwort basieren. Im Vergleich zur CU, die bevorzugt auf das Rektum und den linksseitigen Dickdarm beschränkt bleibt, kann MC grundsätzlich in jedem Abschnitt des Gastrointestinaltrakts auftreten, jedoch gehäuft im distalen Ileum (Enteritis regionalis). Dabei ist ein diskontinuierlicher, granulomatöser Befall der gesamten Darmwand mit Bildung von Fisteln, Ulzerationen, Verdickungen und Stenosen charakteristisch.
Am häufigsten tritt MC in den Ländern Nordeuropas, in Großbritannien und in den USA auf [Probert et al., 1993; Kappelmann et al., 2007] und beginnt in etwa zwischen dem 15. und dem 30. Lebensjahr. Europaweit wird die Prävalenz auf etwa 150 pro 100 000 Einwohner geschätzt. Die Inzidenz hatte seit Beginn des 20. Jahrhunderts in den Industrieländern eine Zunahme verzeichnet.
Klinische Charakteristika
Typischerweise hat der MC einen schubartigen Verlauf. Neben unspezifischen Symptomen wie Müdigkeit oder Fieber können Schmerzen und Krämpfe im Unterbauch sowie (unblutige) Durchfälle auftreten. Begleitet werden diese Erscheinungen häufig von Appetitlosigkeit und Gewichtsverlust. Im Laborbefund sind die Entzündungsparameter (CRP, BSR, Thrombozytose) erhöht. Die Diagnose wird neben klinischem Verlauf, Labor und röntgenologischen Befunden letztlich endoskopisch gestellt und gegebenenfalls histologisch gesichert. Eine Ileokoloskopie kann Schleimhautläsionen, Ulzerationen, Fisteln und möglichenfalls Stenosen darstellen (Abbildung 1).
Darüber hinaus können extraintestinale Läsionen auftreten, so zum Beispiel in Gelenken (Arthralgien) oder auf der Haut (wie Erythema nodosum, Pyoderma gangraenosa). Aber auch orale Symptome sind mit MC assoziiert, so dass der Zahnarzt gefragt ist.
Orale Symptome
Bereits seit mehr als 30 Jahren sind Fallberichte über orale Manifestationen von MC bekannt [Dudeney, 1969; Carr, 1974; Snyder et al., 1971]. Neben gelegentlichen leukoplakischen und lichenoiden Veränderungen wurden aphthoid ulzerative Läsionen an der Mundschleimhaut mit MC in Verbindung gebracht. Aber auch mukosale sowie gingivale Hyperplasien, Lippenschwellungen und ein sogenanntes Pflastersteinrelief („cobblestone pattern“) mit Hyperplasien, die durch Fissuren unterbrochen werden, wurden beschrieben [Beitman, 1981; Engel et al., 1981]. Gelegentlich wurde berichtet, dass diese Läsionen den gastrointestinalen Symptomen vorausgehen oder gleichzeitig mit ihnen auftreten können [Williams et al., 1991].
Unsere Arbeitsgruppe an der Uniklinik Aachen (Klinik für Zahnerhaltung in Kooperation mit der III. Medizinischen Klinik des Universitätsklinikums der RWTH Aachen) beschäftigt sich seit einigen Jahren mit der Beziehung chronisch entzündlicher Darmerkrankungen und oralen beziehungsweise parodontalen Manifestationen. In einer klinischen Untersuchung von insgesamt 149 Patienten mit MC konnten wir in 36,7 Prozent der Fälle orale Läsionen beobachten. Dabei traten gingivale Schwellungen (27,2 Prozent) und mukosale Hyperplasien (20,4 Prozent), seltener jedoch aphthoide Ulzerationen (4,1 Prozent), Leukoplakien (2,0 Prozent), lichenoide Veränderungen (2,7 Prozent) oder Candidiasis (3,4 Prozent) auf [Stein et al., 2010] (Abbildungen 2 bis 5). Die bislang in der Literatur vermutete Koinzidenz der oralen Symptome mit gastrointestinalen Erscheinungen konnte in unseren Untersuchungen jedoch nur in 10,2 Prozent aller Fälle festgestellt werden.
Parodontitis bei Morbus Crohn
Frühere Fallbeschreibungen deuteten auch auf das Vorliegen einer mit MC assoziierten Gingivitis [Carr, 1974; Snyder et al., 1976; Beitman, 1981] und Parodontitis hin. Die Ergebnisse neuerer Querschnittstudien zeigten eine erhöhte Prävalenz, aber moderate Schweregrade der Parodontitis bei Patienten mit MC und CU [Flemming et al., 1991; Grössner-Schreiber et al., 2006; Brito et al., 2008]. In unseren eigenen Untersuchungen konnte dies an 149 Patienten mit MC prinzipiell bestätigt werden. Bei einer durchschnittlichen Sondierungstiefe von 3,6 mm und einem durchschnittlichen klinischen Attachmentlevel von 3,8 mm betrug der CPITN in 57,8 Prozent der Fälle Code 3, während 31,3 Prozent der Patienten einen CPITN Code 4 aufwiesen [Stein et al., 2010]. Da jedoch auch in der Normal-population ähnlich erhöhte Parodontitisprävalenzen bekannt sind [Deutsche Mundgesundheitsstudie DMS IV; Holtfreter et al., 2010], konnte eine „Crohn-spezifische“ Parodontitis somit nicht festgestellt werden.
Orale mikrobiologische Befunde
Neben immunologischen und immungenetischen Faktoren scheinen infektiöse Einflüsse bei MC eine Rolle zu spielen. Hierbei werden unter anderen Mycobacterium avium paratuberculosis, Helicobacter-, Bacteroides- und auch Campylobacter-Spezies [Hansen et al., 2010; Man et al., 2011] als mögliche ätiologische Agenzien diskutiert. Auch eine spezifische orale Mikroflora könnte mit MC assoziiert sein.
Diese Vermutung wurde erstmals in den 80er-Jahren aufgestellt. Van Dyke et al. [1986] hatten an einer kleinen Gruppe von 20 Patienten in den parodontalen Taschen von Patienten mit MC und CU eine erhöhte Anzahl von Campylobacter rectus (ehemals Wolinella recta) nachgewiesen und eine mit diesem Mikroorganismus assoziierte, verringerte neutrophile Chemotaxis festgestellt. In unserer Arbeitsgruppe wurden in den subgingivalen Plaqueproben von 149 Patienten mit MC erhöhte Prävalenzen von Aggregatibacter actinomycetemcomitans (76,9 Prozent), Porphyromonas gingivalis (62,6 Prozent), Prevotella intermedia (79,6 Prozent) und Tannerella forsythia (64,6 Prozent) festgestellt. Am höchsten war jedoch das Auftreten von Campylobacter rectus (94,6 Prozent), der bei fast allen Patienten gefunden wurde [Stein et al., 2010].
Neben des von van Dyke et al. [1986] vermuteten Einflusses auf die neutrophilen Funktionen der Granulozyten könnten Sequenzhomologien zwischen Hitzeschockproteinen (HSP-60) und Oberflächenbestandteilen von Campylobacter rectus zu Kreuzreaktionen führen (molekulare Mimikry) [Bene et al., 2002]. In einer kürzlich veröffentlichten Arbeit einer internistischen Arbeitsgruppe [Man et al., 2009] wurde ein häufigeres Auftreten von Campylobacter Spezies in fäkalen Proben bei Kindern mit MC beobachtet und eine besondere ätiologische Bedeutung des Genus Campylobacter für MC angenommen.
Genetische Polymorphismen
Sowohl bei der Parodontitis als auch bei MC spielen genetische Hintergrundfaktoren eine Rolle. Für beide Erkrankungen wurde eine familiäre Häufig beobachtet. Zwillingsstudien deuten ebenfalls auf das Vorliegen erblicher Einflüsse hin. Zytokinpolymorphis men als auch Assoziationen im MHC-System konnten für die Parodontitis und für MC festgestellt werden [Cuffari, 2010; Loos et al., 2005]. Speziell für MC sind Polymorphismen der Caspase Recruitment Domain 15 (CARD15) bekannt. Diese Genabschnitte kodieren für ein intrazelluläres Protein, das über die Erkennung bestimmter bakterieller Bestandteile eine entzündliche Immunantwort induziert. Eine starke Assoziation zu bestimmten CARD15-Allelen wurde bei MC-Patienten festgestellt [Hampe et al., 2001; Hugot et al., 2001]. Diese Assoziation könnte eine hyperinflammatorische Immunantwort provozieren. Ein Einfluss von CARD15 auf klinische orale / parodontale Parameter konnte bei Patienten mit MC nicht festgestellt werden. Interessanterweise bestand jedoch eine negative Korrelation zwischen dem Auftreten eines CARD15-Polymorphismus und dem Nachweis von Prevotella intermedia, was möglicherweise auf eine CARD15-vermittelte hyperresponsive Immunantwort deuten könnte [Stein et al., 2010].
Fazit
Parodontitis und Morbus Crohn haben Gemeinsamkeiten hinsichtlich der multifaktoriellen Ätiologie und der Existenz von genetischen Hintergrundfaktoren. Unklare Schleimhautveränderungen, insbesondere Hyperplasien, können gelegentlich mit einer entzündlichen Darmerkrankung in Verbindung stehen. Dabei ist zu beachten, dass je nach Verlauf und Schweregrad Patienten mit MC häufig antiinflammatorische (5-Aminosalizylate, Prednison, und andere) und teilweise immunsuppressive (wie Azathioprin) Medikamente erhalten, die als Dauer- oder verlaufsabhängige Medikation verordnet werden. Die Medikation einerseits und die Erkrankungsphase andererseits (Schub oder Remission) haben wahrscheinlich einen Einfluss auf die Häufigkeit oraler Manifestationen. Eine „Crohn-spezifische“ Parodontitis scheint aber nicht vorzuliegen. Die sehr hohe Prävalenz parodontitis-assoziierter Anaerobier, insbesondere des Genus Campylobacter, könnte möglicherweise auf Crohn-charakteristische immunologische Mechanismen zurückgeführt werden, die die Bedingungen für die Popularisierung dieser Keime – trotz eher mildem bis moderatem Verlauf der Parodontitis – begünstigen. Ob diese Beobachtungen zukünftig von diagnostischem und gegebenenfalls auch prognostischem Wert sein könnten, müssen zukünftige Arbeiten zeigen. Folgestudien diesbezüglich laufen derzeit an.
Priv.-Doz. Dr. Jamal M. SteinUniversitätsklinikum der RWTH AachenKlinik für Zahnerhaltung, Parodontologie undPräventive ZahnheilkundePauwelsstraße 30, 52074 Aachenund Praxiszentrum für Parodontologie,Implantologie und ProthetikSchumacherstraße 14, 52062 AachenJStein@ukaachen.de