Die Arthroskopie ist visuell überragend
Schmerzen durch entzündliche beziehungsweise degenerative Prozesse der Kiefergelenke sind neben Schmerzen der Kaumuskulatur ein wichtiger Bestandteil der kraniomandibulären Dysfunktion (CMD). Allerdings erschweren die verschiedenen Ätiologien und variablen Verlaufsformen entzündlicher Erkrankungen des Kiefergelenks die Diagnostik und Behandlungsstrategie. Für Patienten kann die Gelenkdestruktion insbesondere im fortgeschrittenen Stadium problematisch sein, weil dann eine Restitutio ad integrum in der Regel nicht mehr möglich ist. Deshalb kommt einer raschen und umfassenden Diagnostik sowie einer Frühintervention besondere Bedeutung zu und erfordert in der Praxis ein interdisziplinäres Vorgehen.
Mit der Einführung der Kiefergelenksarthroskopie 1975 durch Onishi steht ein chirurgisch minimal-invasives diagnostisches und therapeutisches Verfahren zur Verfügung, das – nicht zuletzt durch das bessere Verständnis der Pathophysiologie der Kiefergelenksdestruktion unter anderem durch die Arthroskopie selbst – zunehmend wichtiger bei der frühzeitigen therapeutischen Intervention wurde [Onishi, 1975]. Die Arthrozentese ist im Vergleich zur Arthroskopie ein einfacheres Verfahren, das mit begrenzteren Möglichkeiten alternativ eingesetzt wird. Mittlerweile gibt es zahlreiche Belege, dass Schmerzen und Funktionseinschränkungen des Kiefergelenks durch diese minimal-invasiven Therapieverfahren insbesondere in der frühen Phase günstig beeinflusst werden [Murakami, 2013].
Kiefergelenksdestruktion:
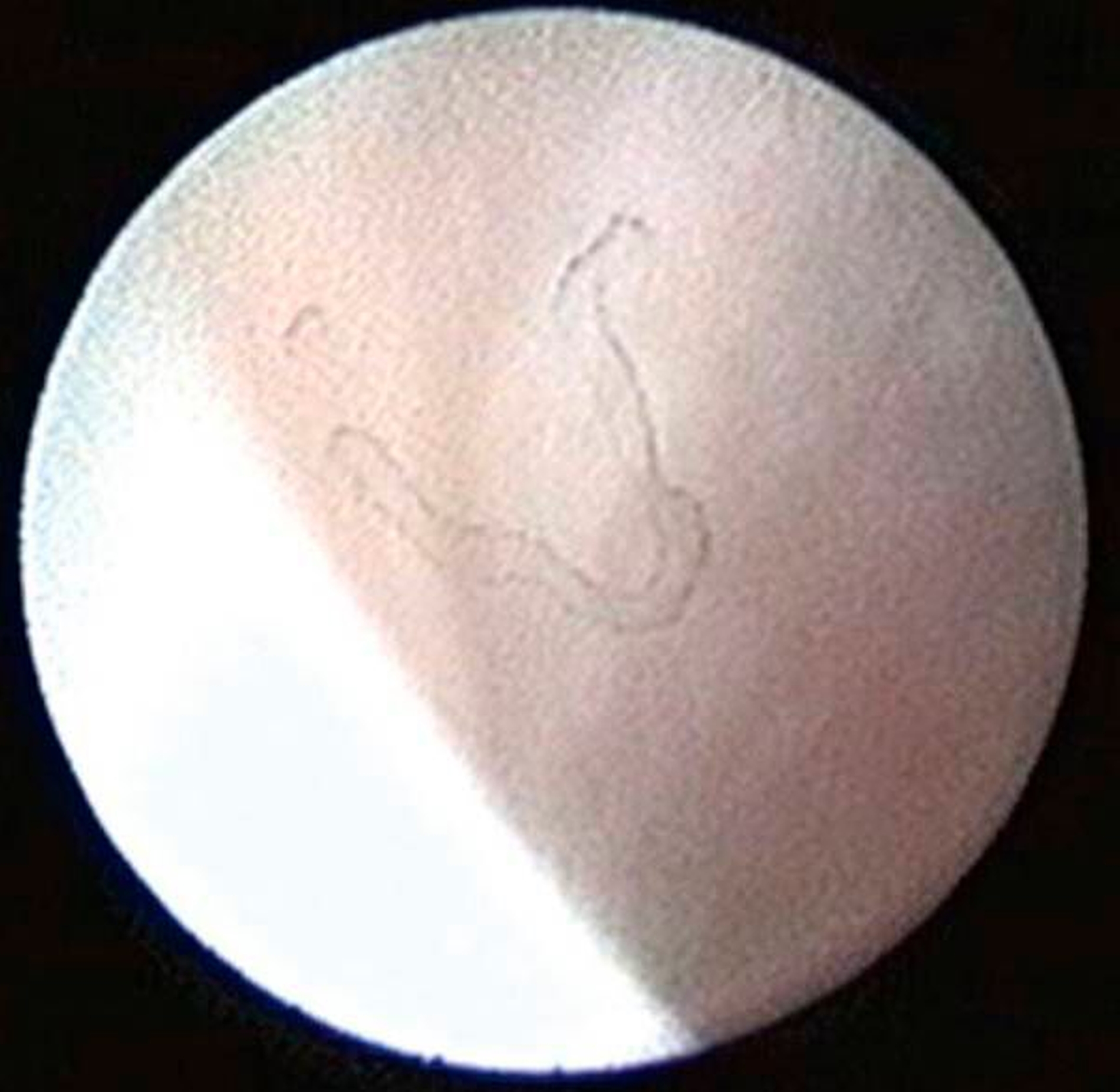
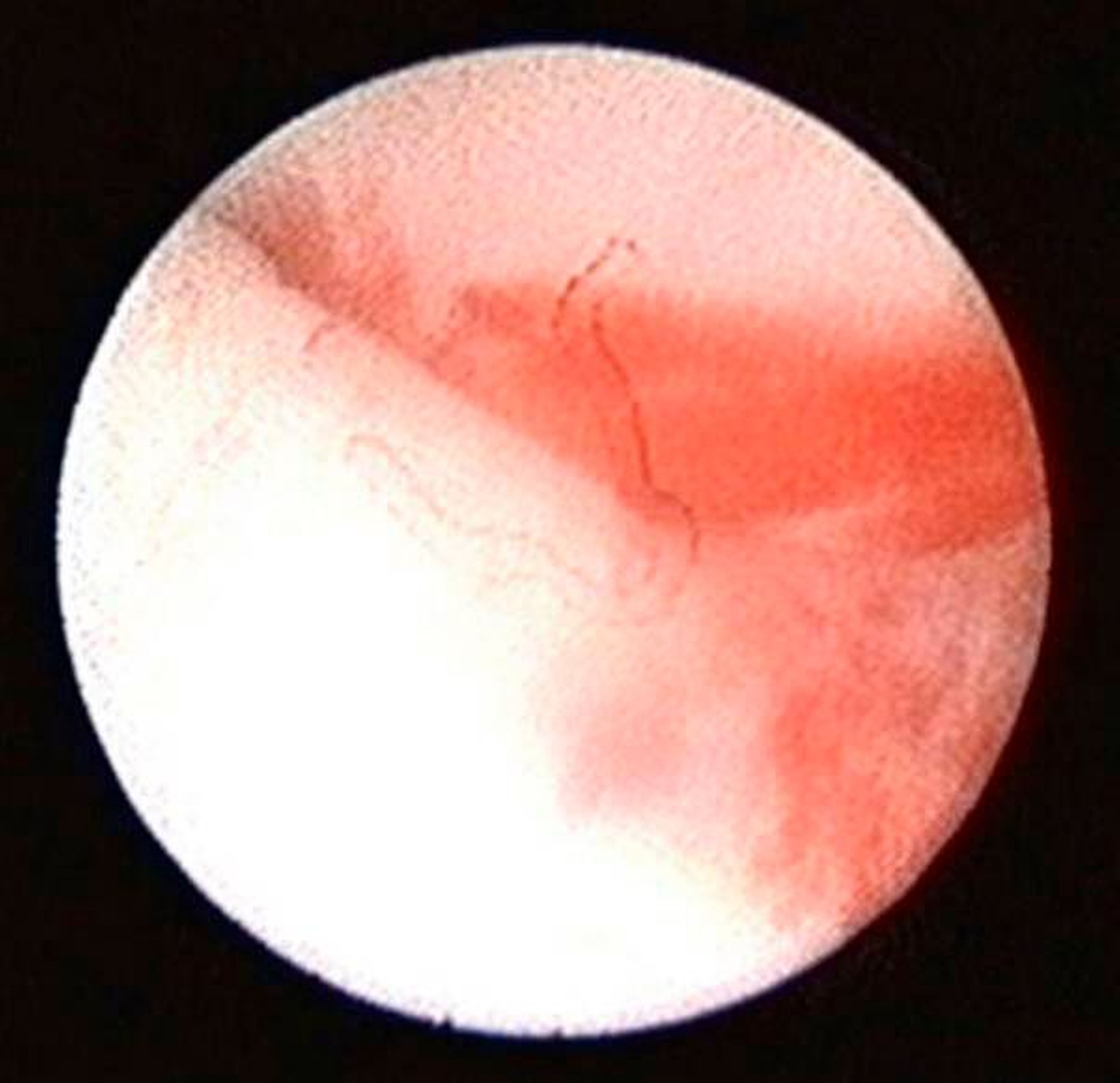
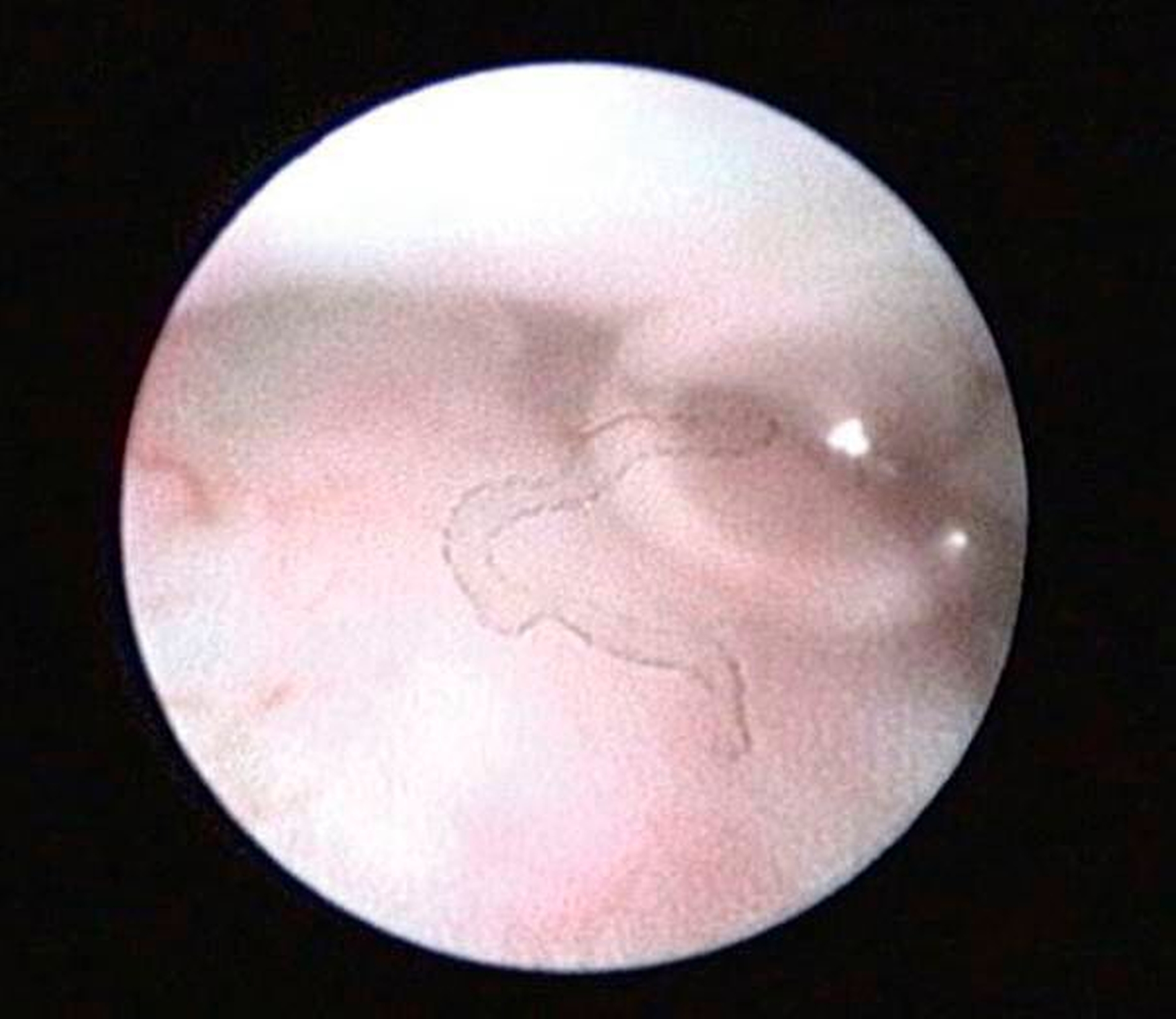
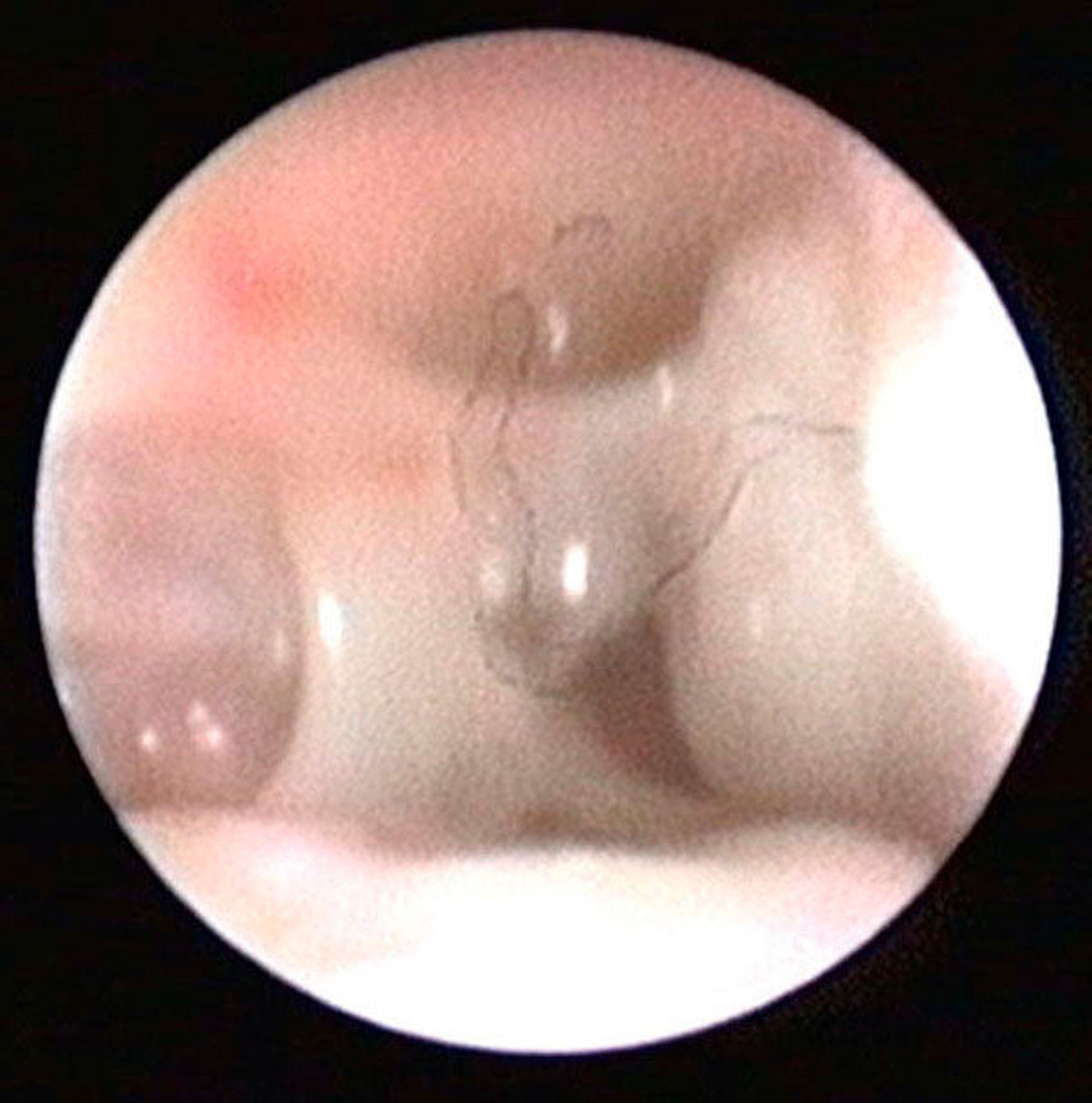
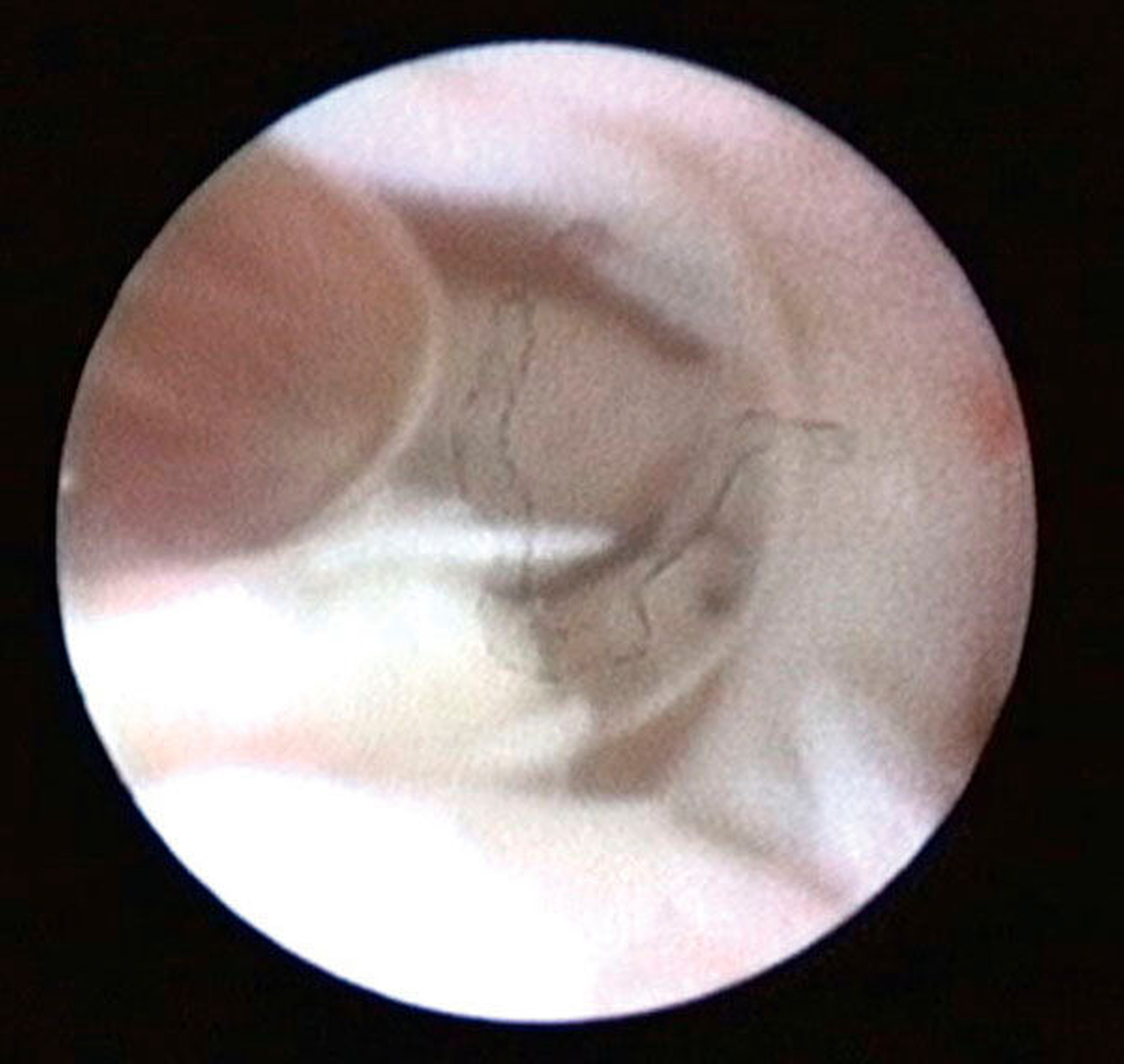
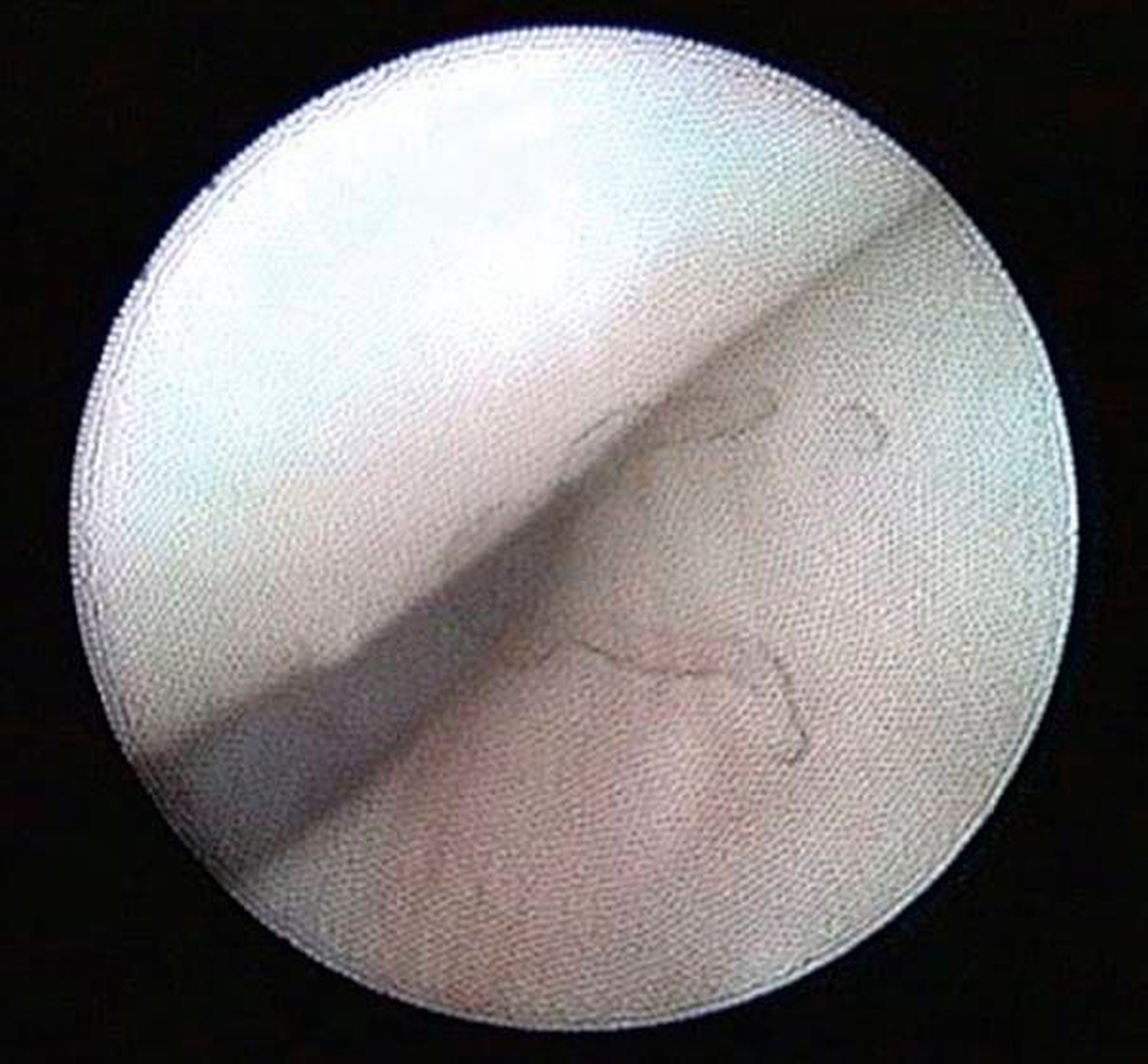
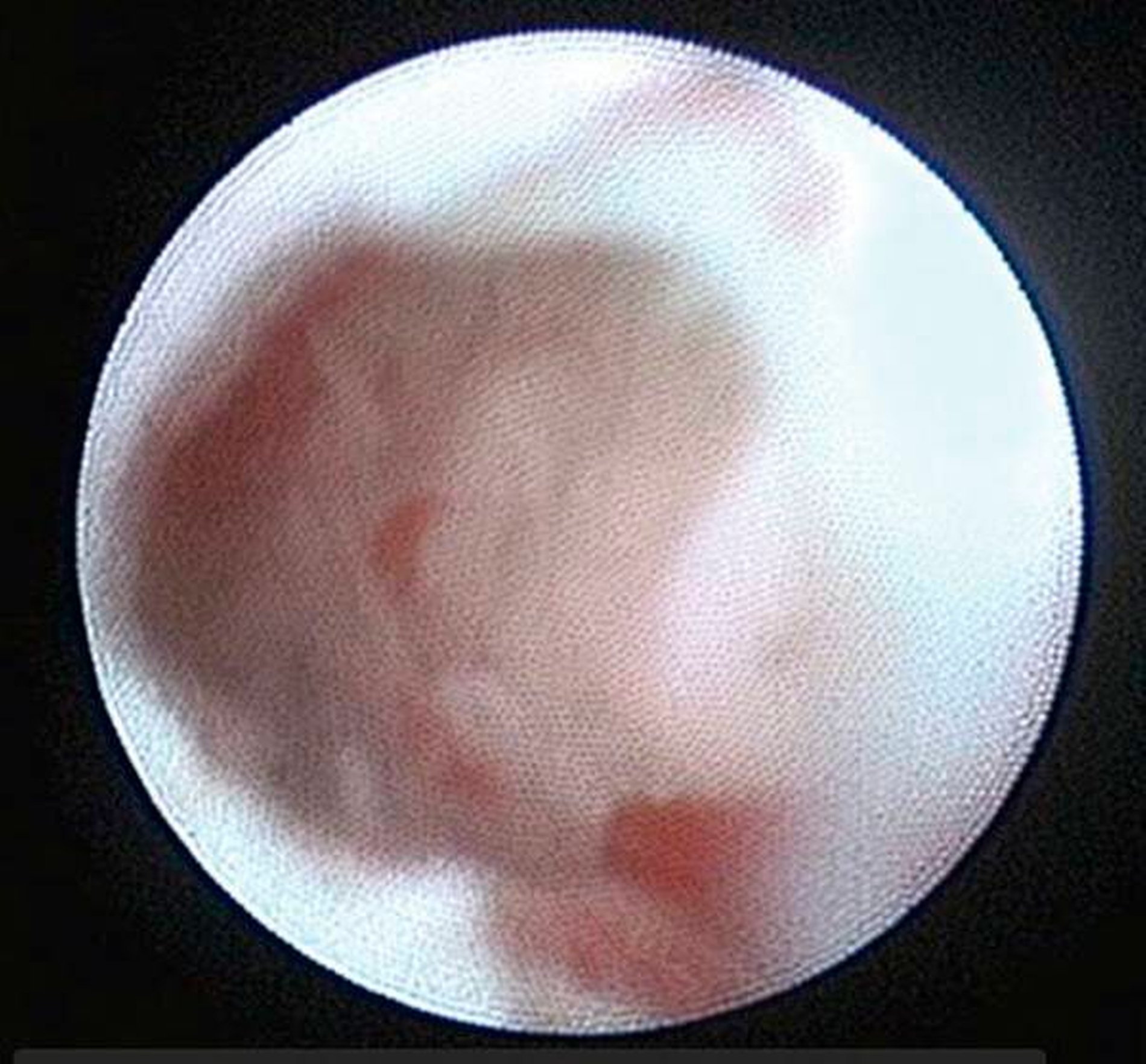
Die Kiefergelenksdestruktion wird als Ergebnis eines katabolen Prozesses verstanden, der die regenerativen Fähigkeiten des Gelenks überlagert und unter anderem durch eine kaskadenartige Aktivierung von Zytokinen vermittelt wird. Dabei kommt es neben einem Verstärkungseffekt durch die Synovial- und Gefäßproliferation zu einer Aktivierung von Osteoblasten. Zytokin-aktivierte Osteoblasten fördern die Rekrutierung und Aktivität von Osteoklasten, diese sezernieren wiederum Enzyme wie beispielsweise Matrix-Metalloproteasen (MMPs), die für den Abbau der extrazellulären Matrix (Hydroxylapatit und Kollagen) des Gelenks verantwortlich sind [Gunson et al., 2011; Zhang et al., 2016; Wang et al., 2012: Ge et al., 2011]. Die Schädigung des Gelenkknorpels wird dabei als „Chondromalazie“ bezeichnet und bei der arthroskopischen Diagnostik je nach Schweregrad im Stadium der Erweichung (Stadium 1), Furchung (Stadium 2), Fibrillation beziehungsweise Fransenbildung (Stadium 3) oder mit subchondraler Knochenexposition (Stadium 4) vorgefunden (Abbildungen 1 bis 3) [Quinn, 1989; Thomas et al., 1991].
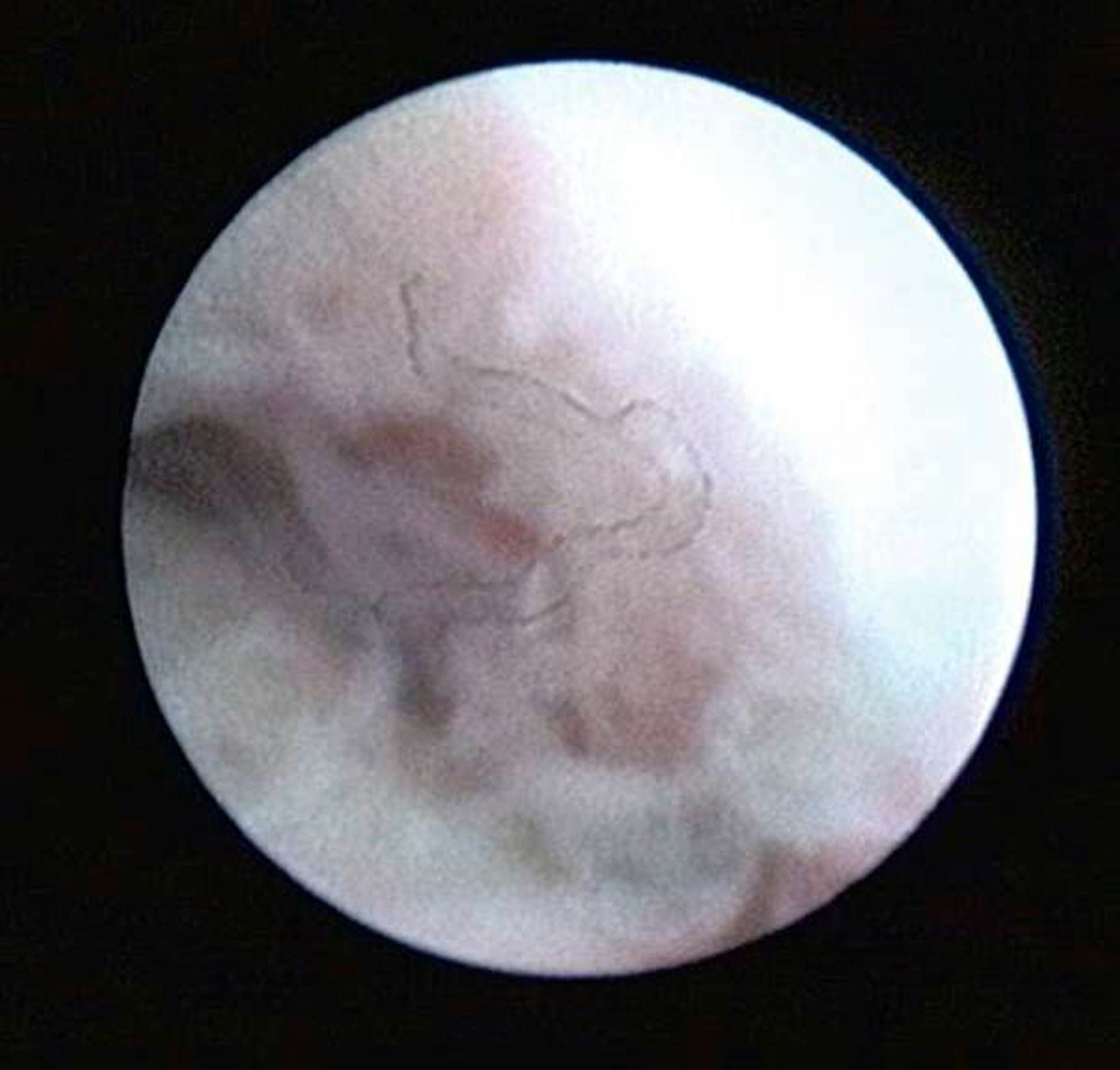
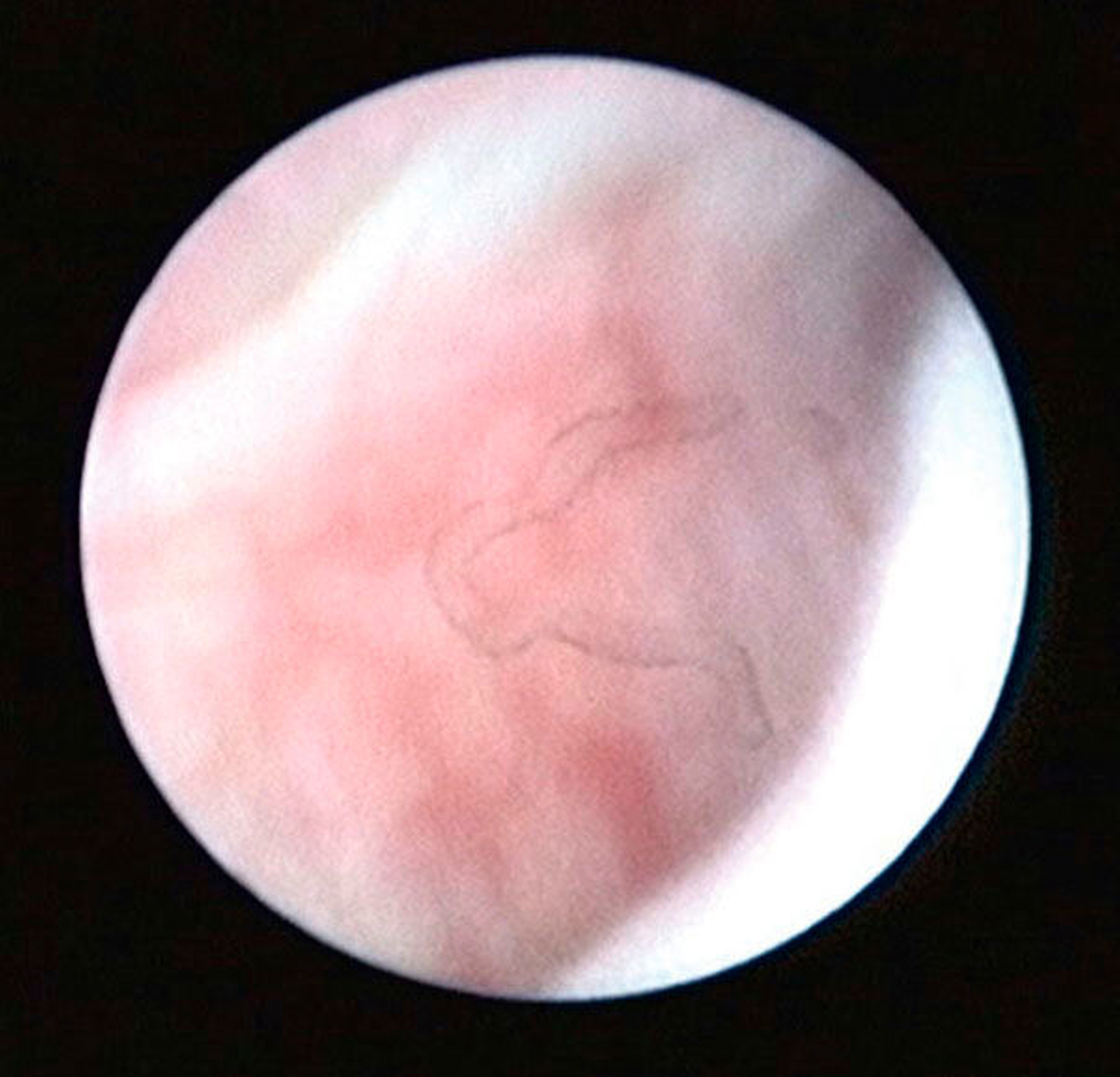
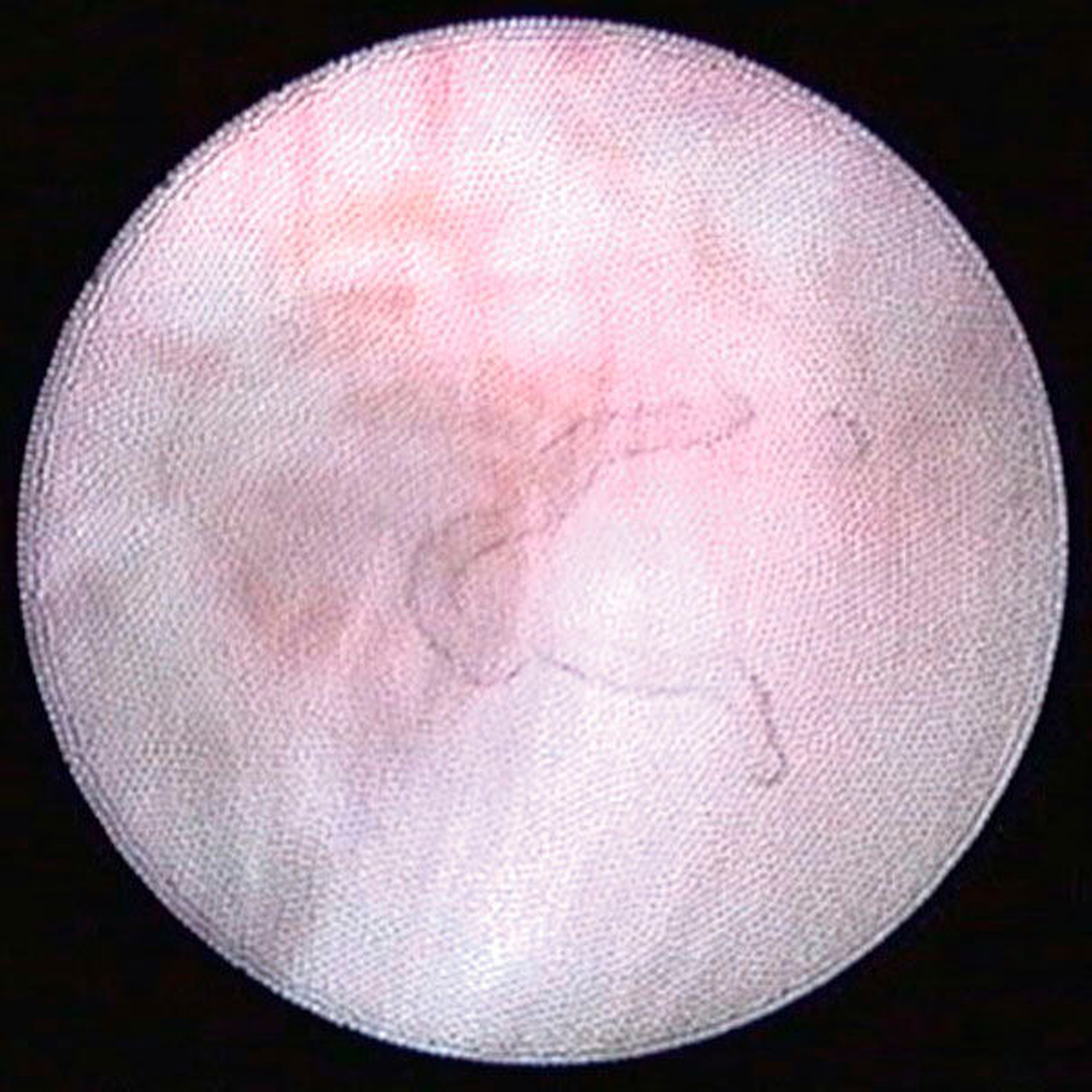
Arthroskopisch existieren verschiedene Klassifikationen der Synoviitis, die im Wesentlichen das Ausmaß der beobachteten Gefäßproliferation und Hyperämie berücksichtigt (Abbildungen 4 bis 6) [Mc Cain et al., 1989; Gynther et al.,1994].
Ätiologie und Pathophysiologie
Degenerative Kiefergelenkserkrankung:
Die degenerative Kiefergelenkserkrankung scheint ein multikausales Geschehen unterschiedlicher Ätiologie zu sein [Umstadt, 2010]. Als Risikofaktoren für eine degenerative Kiefergelenkserkrankung gelten rheumatologisch-immunologische Grunderkrankungen, weibliches Geschlecht, Okklusionsstörungen, Gelenkfehlstellungen, Zustände nach Traumata mit Beteiligung des Kiefergelenks, Hypermobilität und Gelenküberlastungen, aber auch genetische Faktoren und Zustände des „Internal Derangements“ [Hu Xinxin, 2017; Lou et al., 2016; Xi et al., 2016; Zheng et al., 2016; Jiang et al., 2013; Liu, 2010]. Letztere bezeichnen dabei die abnorme Beziehung von Discus articularis zum Kondylus. Die Position der Gelenkscheibe beeinflusst nicht nur die Absorption von Spannungen und damit die Entlastung der Kiefergelenkkomponenten, sondern auch das „Remodeling“ des Kiefergelenks selbst [Tanne et al., 2015; Hu et al., 2016; Yang Chi, 2017]. Jedoch wird die Rolle von moderaten Diskusverlagerungen und solchen mit Reposition gegenwärtig kontrovers beurteilt. So werden diese einerseits bereits zu den funktionellen Erkrankungen gerechnet und sogar als Stadium für degenerative Kiefergelenkserkrankungen klassifiziert [Wilkes, 1989; Bornstein et al., 1992].
Diskusluxationen:
Andererseits kann die anteriore Diskusluxation mit Reposition bei fehlenden Beschwerden und fehlender Funktionseinschränkung ohne Krankheitswert und progredientem Verlauf bleiben und bedarf dann auch keiner Behandlung. Obwohl die genaue Prävalenz der anterioren Diskusverlagerungen nicht bekannt ist, wird diese als relativ häufig angenommen – und wäre somit mehrheitlich ohne Gelenkentzündung beziehungsweise -destruktion anzutreffen [Zhou Wei, 2017; Li Yangfei, 2017; Tasaki et al., 1996]. Demgegenüber wurde in jüngerer Zeit ein Zusammenhang zwischen anteriorer Diskusluxation und einer knöchernen Resorption des Kondylus beschrieben, es wurde sogar eine knöcherne Regeneration des Kondylus nach operativer Diskusreposition bei jugendlichen Patienten in der Wachstumsphase beobachtet [Yang Chi, 2017; Hu et al., 2016].
Blockaden:
Zustände des „Internal derangements“ mit Blockaden gehören zu den Funktionsstörungen des Kiefergelenks und bedürfen in der Regel einer Abklärung dahingehend, wodurch die Mobilität des Diskus pathologisch reduziert ist. Infrage kommen hier beispielsweise die Diskusverlagerung ohne Reposition (Abbildung 7) oder das „Anchored Disc Phenomenon“. Bei Letzterem kommt die Gelenkblockade dadurch zustande, dass der Diskus nahezu unbeweglich in der Fossa verbleibt und die weitere Öffnungsbewegung behindert [Nitzan et al., 1997]. Neben Adhäsionen und Vernarbungen können im weiteren Verlauf auch schwerwiegendere degenerative strukturelle Schäden am Diskus auftreten, die oben genannten degenerativen Veränderungen können die Mobilität des Kiefergelenks dauerhaft einschränken (Abbildung 8). Bei Funktionseinschränkungen mit Blockaden kann die frühe Intervention durch eine therapeutische Arthroskopie einer Entstehung von Adhäsionen beziehungsweise Vernarbungen wirkungsvoll entgegenwirken (Abbildung 9), jedoch kann hier das Zeitfenster mitunter sehr klein sein [Zhang et al., 2011].
Diagnostik
Die Basis der Diagnostik stellen die Anamnese und die klinische Untersuchung dar. Befundbögen erleichtern ein strukturelles und standardisiertes Vorgehen, so dass bereits mögliche Pathologien und Funktionsstörungen des Kiefergelenks im Vorfeld erkannt werden können. Wichtig ist hierbei auch die weitere Abklärung hinsichtlich relevanter Systemerkrankungen.
Die Magnetresonanztomografie (MRT) der Kiefergelenke ist das radiologische Verfahren der Wahl zur Beurteilung pathologischer Veränderungen im Bereich der Kiefergelenke, da diese dann schon in einer früheren Phase erfasst werden können [AWMF DRG 039/093; Kainberger et al., 2011]. Demgegenüber erfassen projektionsradiografische Verfahren wie die Orthopantomografie (OPG) oder die Fernröntgenseitaufnahme (FRS), aber auch die digitale Volumentomografie (DVT) mögliche Gelenkdestruktionen erst bei knöcherner Beteiligung ohne die Möglichkeit einer Beurteilung der Gelenkbinnenstrukturen – das heißt erst in der Spätphase [Kainberger et al., 2011].
Selbst durch die MRT können bestimmte frühe Entzündungszustände der Kiefergelenke (beispielsweise die Synoviitis) bei fehlendem Gelenkerguss nicht direkt erfasst werden (radiologisch okkulte Kiefergelenksentzündungen). In der Praxis stellen symptomatische, aber radiologisch okkulte Entzündungszustände insbesondere im Fall einer Therapieresistenz auf konservative Therapiemaßnahmen (wie Schienen- und Physiotherapie) eine besondere Herausforderung dar, weil hier die Gefahr von Fehldiagnosen besonders groß ist (Abbildungen 4 bis 6).
Auch einige fortgeschrittene Gelenkveränderungen (beispielsweise die Synoviahypertrophie oder Diskusperforationen) sind durch die MRT direkt oft nicht nachweisbar [Liu et al., 2010; Zhang et al., 2009]. Diese Veränderungen lassen sich aber in der Regel durch die Arthroskopie nachweisen (siehe unten und Abbildung 6).
Invasive Gelenkdiagnostik
Das Kiefergelenk ist ein Zweikammergelenk und wird durch den Discus articularis in einen oberen und einen unteren Gelenkraum unterteilt. Sowohl bei der Arthroskopie als auch bei der Arthrozentese (Punktion des Gelenks und Untersuchung des Punktats) wird in der Regel nur der obere Gelenkraum erreicht, der untere Gelenkraum ist nur ausnahmsweise im Fall größerer Diskusperforationen einseh- beziehungsweise erreichbar (Abbildung 3).
Arthrozentese:
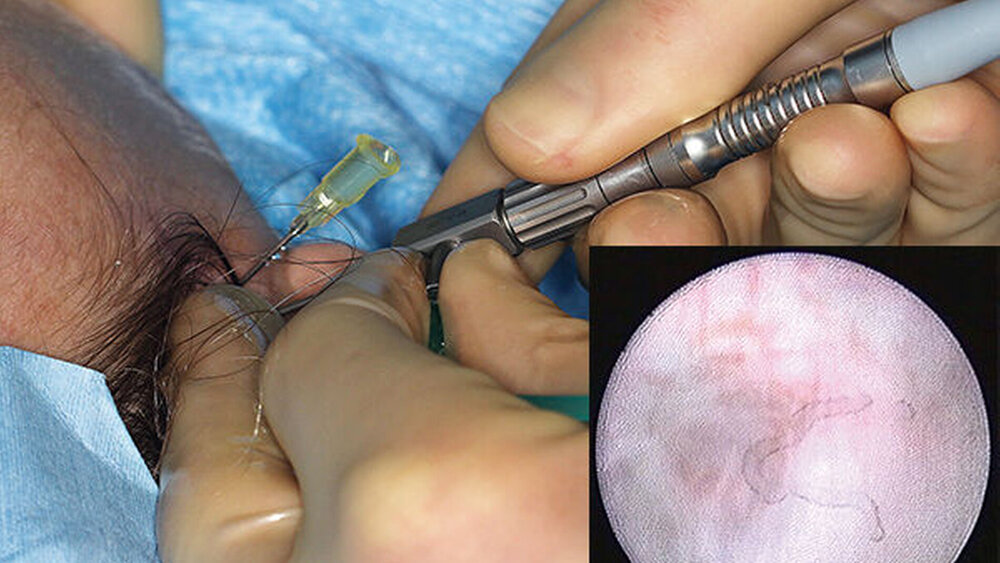
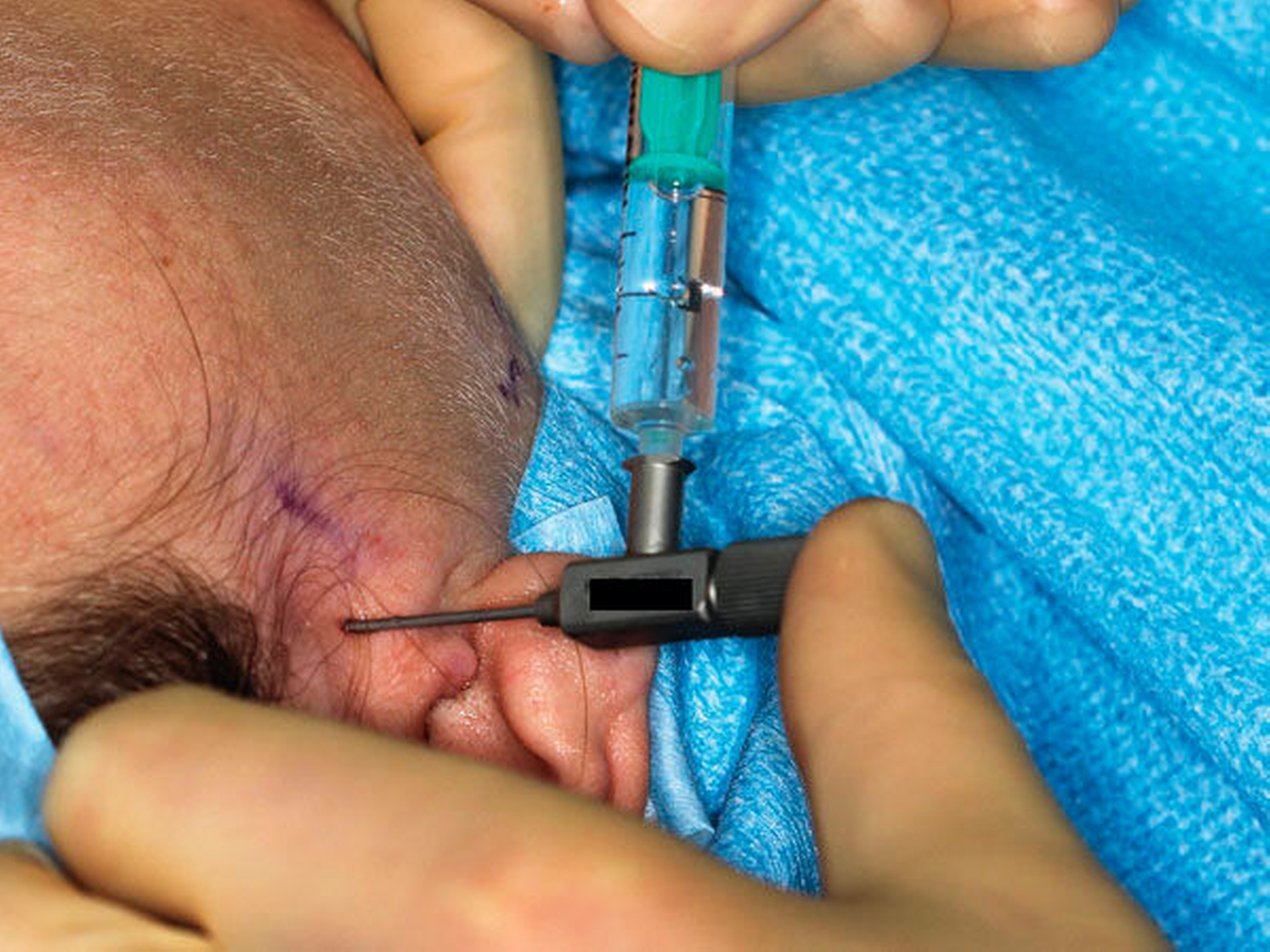
Die Punktion des oberen Gelenkraums erfolgt durch Throkare beziehungsweise durch Kanülen zumeist mit der Doppel-Punktionstechnik (Abbildungen 10 bis 12) [Mc Cain, 1996]. Darüber wird dann das Kiefergelenk gespült, bei der Arthroskopie erfolgt die Inspektion des oberen Gelenkraums nach Einbringen einer Optik.
Arthroskopie:
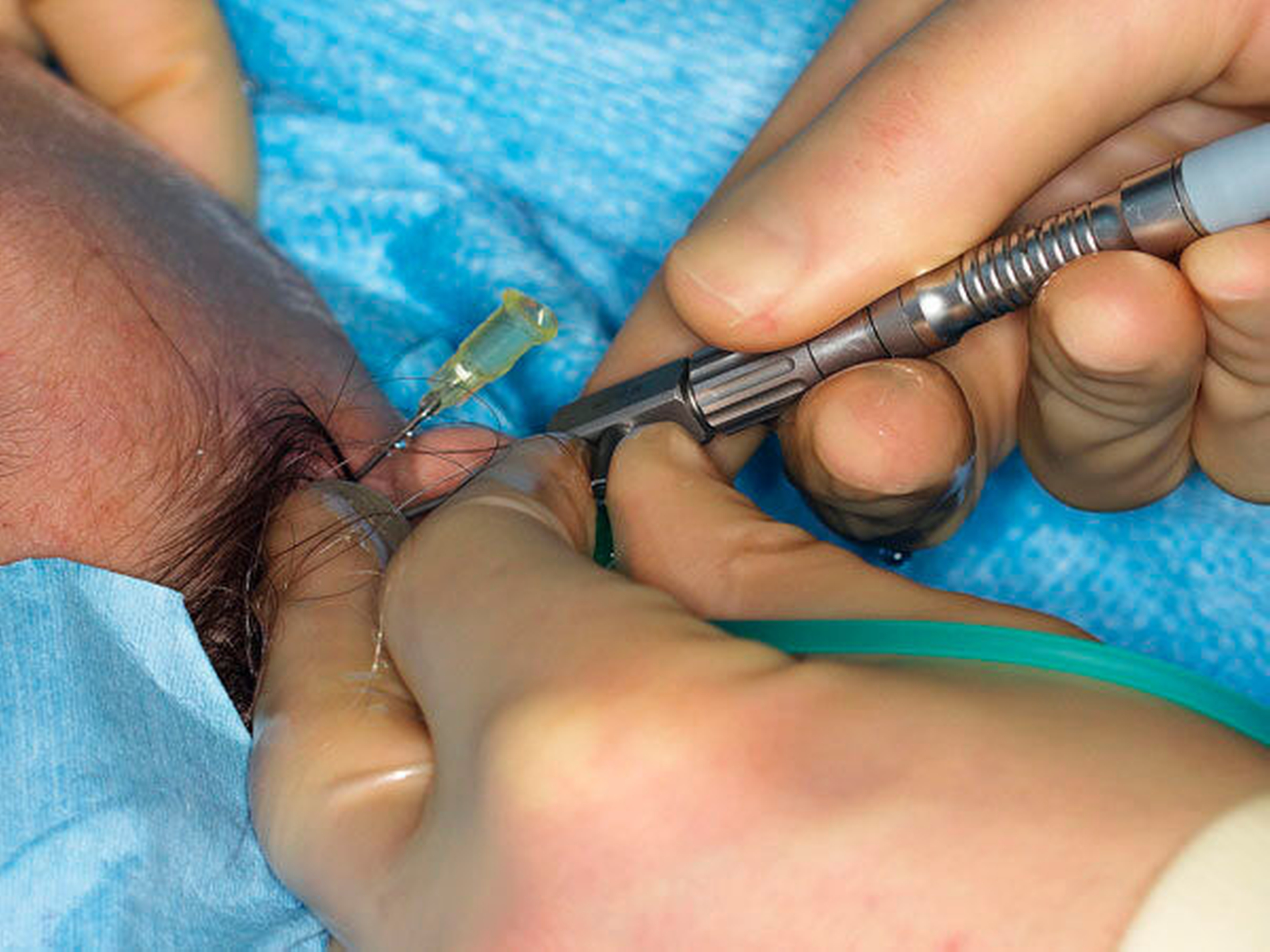
Für die interventionelle Arthroskopie muss in der Regel noch ein Zugang für den Arbeitskanal gestochen werden. Die Arthroskopie ist im Vergleich zur Arthrozentese zeitintensiver und wird in Allgemeinnarkose durchgeführt. Die Arthrozentese kann zwar auch in Lokalanästhesie oder in Sedierung durchgeführt werden, häufig ist jedoch eine kurze Allgemeinnarkose ratsam, insbesondere wenn sich die Punktion und die Spülung des Gelenks als schwierig erweisen sollten. Eine Verletzung der Gelenkkapsel durch Fehlpunktionen kann zu Leckagen führen und die Effizienz der Gelenkspülung sowie der Arthroskopie erheblich beeinträchtigen.
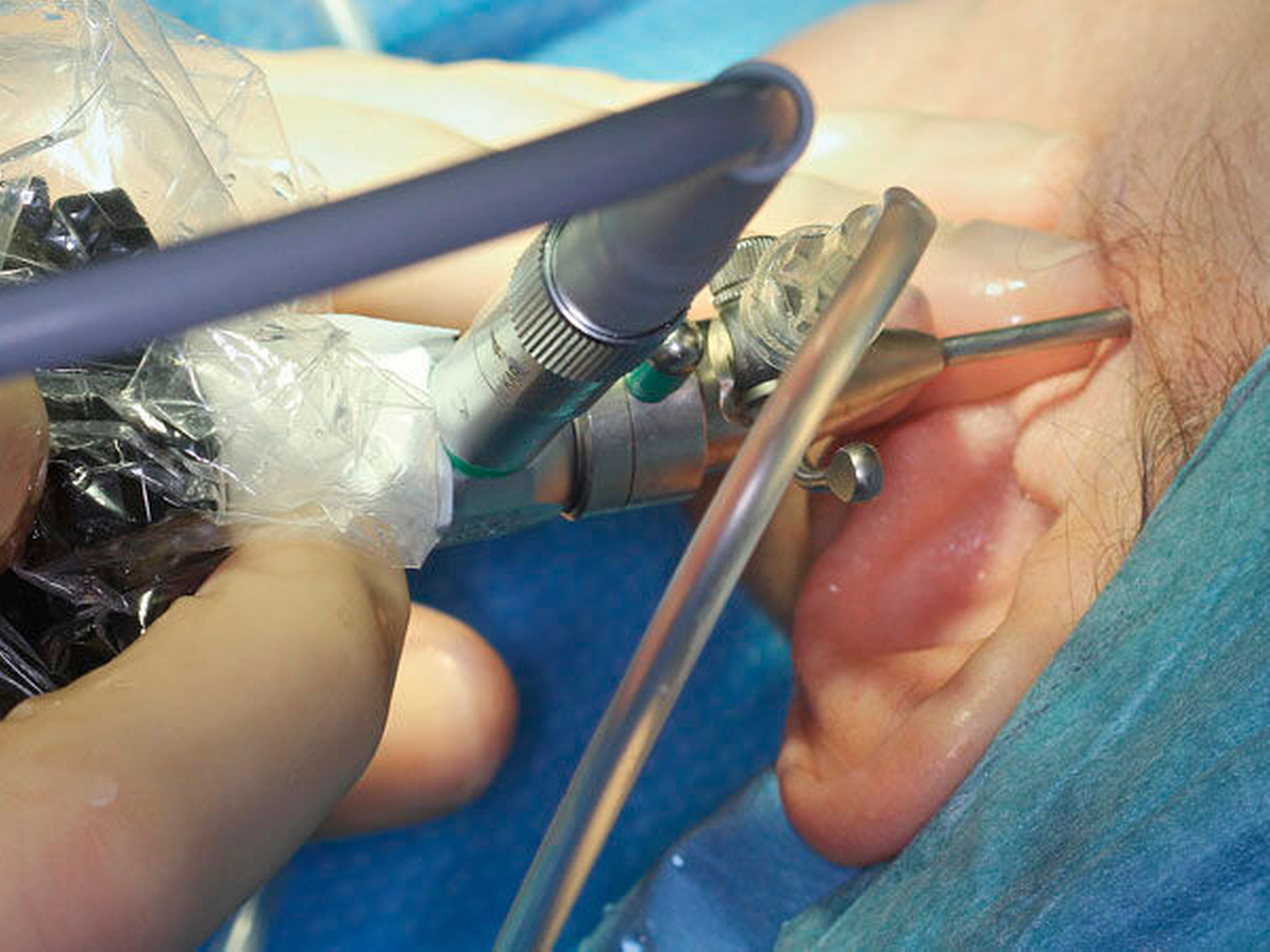
Durch die weitere Miniaturisierung sind moderne Kiefergelenksarthroskope auch im Hinblick auf den therapeutisch geforderten effizienten Druck und das Spülvolumen bei einer Kiefergelenkslavage schon zu Beginn einer minimal-invasiven Intervention einsetzbar (Abbildungen 10 bis 12) [Xu et al., 2013; Zhu et al., 2017]. Bei der Abwägung „Arthrozentese versus Arthroskopie“ gilt zumindest beim Einsatz kleinerer Arthroskope mit geringem Durchmesser (Außendurchmesser von 1,3 beziehungsweise 1,2 mm mit Glasfaseroptik) das Argument einer geringeren Invasivität nicht mehr, auch wenn hier im Vergleich zu den größeren Arthroskopen mit Linsenoptik (Außendurchmesser 2,2 beziehungsweise 2,7 mm, Abbildung 12) Abstriche bei der Übersicht und der Bildqualität gemacht werden müssen.
Die Kiefergelenksarthroskopie bietet bei gleichzeitiger Lavage eine überragende visuelle Diagnostik des oberen Gelenkraums (Abbildungen 1 bis 7, 13 und 14).
Im Fall diagnostizierter Pathologien können in der gleichen Sitzung arthroskopische therapeutische Maßnahmen durchgeführt werden (Abbildungen 8 und 9 ). Allerdings ist die Lernkurve der diagnostischen Arthroskopie im Vergleich zur Arthrozentese deutlich flacher, arthroskopisch-therapeutische Interventionen erfordern in der Regel eine zusätzliche Punktion für den Arbeitskanal und die Beherrschung der Triangulations-Technik. Weiterhin sind genaue Kenntnisse der arthroskopischen Anatomie und Pathologie des Kiefergelenks Voraussetzung.
Neben dem technischen Know-how ist ein methodisches Vorgehen (arthroskopischer Rundgang) bei der Beurteilung des oberen Gelenkraums von Vorteil. Jedoch hängt das Ausmaß der Beurteilung des oberen Gelenkraums neben der Beschaffenheit der anatomischen Gegebenheiten von der Wahl der Punktionsstellen (superiorlateral, anterior, transmeatal) und der verwendeten Systeme beziehungsweise Optiken (0-Grad- beziehungsweise 70-Grad-Optik, Linsenoptiken, Fiberglasoptiken) ab.
Indikationen für eine Kiefergelenkarthroskopie:
Zu den geeigneten Indikationstellungen für die diagnostische und therapeutische Kiefergelenksarthroskopie zählen insbesondere entzündlich bedingte Schmerzen und Funktionsstörungen der Kiefergelenke. Neben der Gelenkdestruktion können Entzündungszustände des Kiefergelenks teils mit erheblichen Schmerzen verbunden sein. Dabei können die bei der Gelenkentzündung freigesetzten Zytokine als Entzündungsmediatoren Schmerzen verursachen [Matsumoto, 2006; Ernmberg, 2017]. Weiterhin kann durch die Verstärkungsfunktion die induzierte Gefäßproliferation mit Hyperämie eine vermehrte Sezernierung von Synovialflüssigkeit (Gelenkerguss beziehungsweise „Joint effusion“) Schmerzen (durch Druck auf die Gelenkkapsel) verursachen und die Bewegung des Gelenks einschränken. Neben der Entlastung mit Senkung des Kapseldrucks wird der therapeutische Effekt der Kiefergelenksspülung unter anderem durch die Auswaschung der Entzündungsmediatoren und Debridement von Bestandteilen der extrazellulären Matrix aus dem Gelenkraum erzielt [Kaneyama et al., 2004].
Zur Planung eines arthroskopischen Eingriffs am Kiefergelenk sollte ein möglichst aktuelles MRT der Kiefergelenke vorliegen, sofern hierfür keine Kontraindikationen bestehen. Dabei ist zu beachten, dass radioogisch diagnostizierte Pathologien durch die MRT nicht zwingend voraussetzend für eine Kiefergelenksarthroskopie sind. Bei Patienten mit symptomatischen Kiefergelenkschmerzen, aber radiologisch okkulten Kiefergelenksentzündungen ist die Kiefergelenksarthroskopie bislang immer noch das einzig relevante Verfahren zur Sicherung der Diagnose (Abbildungen 4 bis 6).
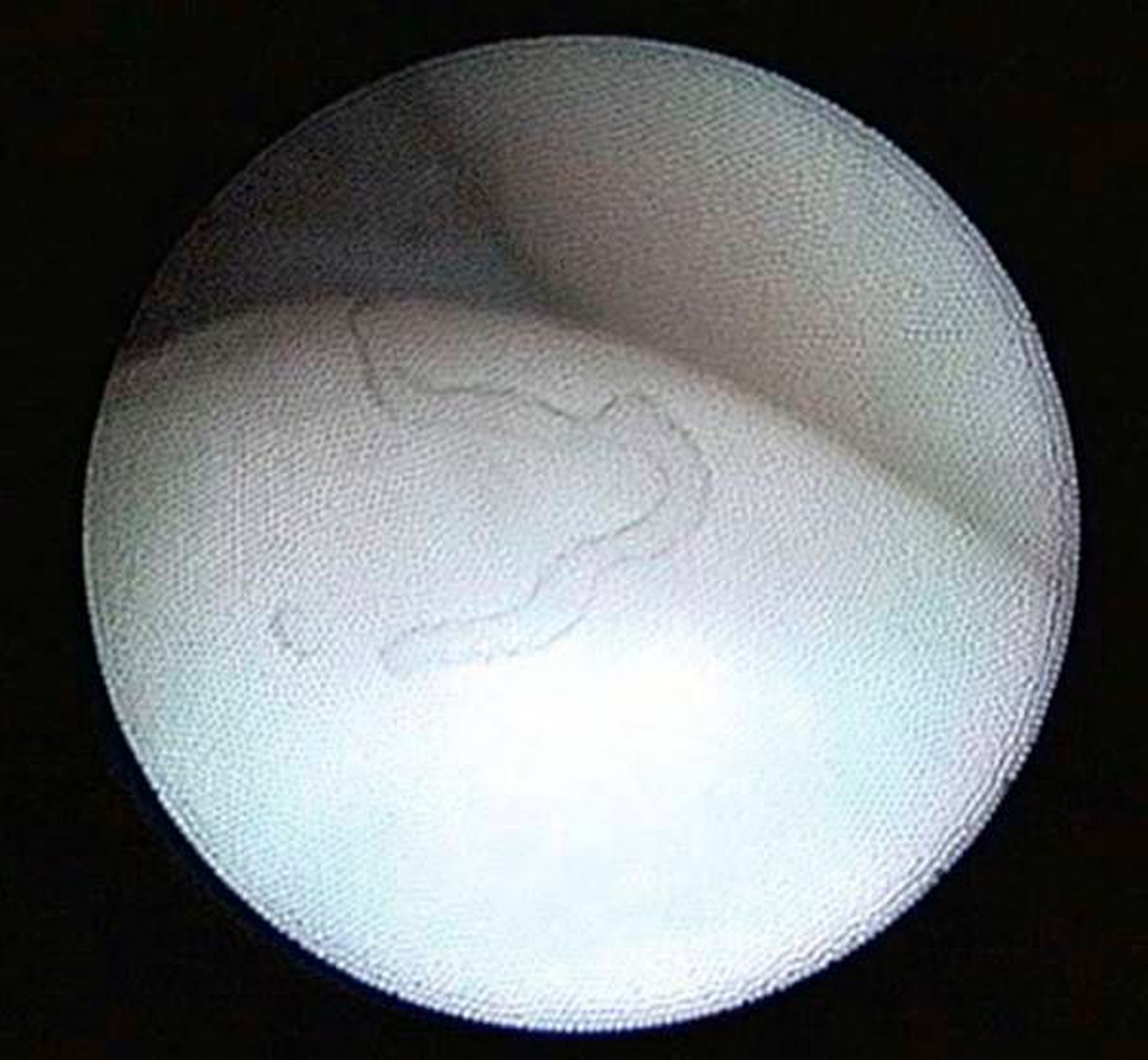
Bei fortgeschrittenen Gelenkdestruktionen können arthroskopische Befunde detailliertere Informationen über das Ausmaß der Gelenkdestruktion liefern und somit einen wichtigen Beitrag zur Indikationsstellung und Planung möglicher weiterer chirurgischer Behandlungen des Kiefergelenks leisten. Weiterhin kann eine positive Beeinflussung von Schmerzzuständen und eine Verbesserung des Bewegungsumfangs durch diese minimal-invasiven Verfahren in ausgewählten Fällen versucht werden. Eine weitere wichtige Indikation für eine therapeutische Kiefergelenksarthroskopie sind Diskusverlagerungen mit Blockaden. Hier kann eine Frühintervention durch eine therapeutische Arthroskopie der Entstehung von Adhäsionen beziehungsweise Vernarbungen vorbeugen oder diese lösen, sonst kann die Mobilität des Kiefergelenks dauerhaft eingeschränkt werden.
Zusammenfassung
Seit 1975 wird die Arthroskopie des Kiefergelenks in erster Linie als diagnostisches Verfahren mit anschließender minimal-invasiver chirurgischer Intervention in der klinischen Anwendung eingesetzt. Mittlerweile haben sich sowohl die arthroskopische Operation als auch die Arthrozentese mit Lavage als minimal-invasive Intervention bei Kiefergelenkserkrankungen etabliert. Bei fortgeschrittenen Gelenkdestruktionen stoßen die Möglichkeiten der therapeutischen Kiefergelenksarthroskopie jedoch schnell an ihre Grenzen, weshalb deren Einsatz frühzeitig in Betracht gezogen werden sollte. Bei Beherrschung der Technik und bei Anwendung durch einen erfahrenen Operateur ist die Kiefergelenksarthroskopie mit einem geringen Risiko für den Patienten verbunden [Zhang et al., 2011].
Dr. Dr. Christoph Zizelmann und
PD Dr. Dr. Thomas Fillies
Marienhospital Stuttgart
Klinik für Mund-, Kiefer- und Plastische Gesichtschirurgie
Böheimstr. 37, 70199 Stuttgart
christoph.zizelmann@gmx.de
Literaturverzeichnis
Ohnishi M: Arthroscopy of the Temporomandibular joint, J Stomatol Soc Jpn, 42: 207, 1974
Murakami K: Rationale of arthroscopic surgery of the temporomandibular joint,
J Oral Biol Craniofac Res, 3(3): 126–134, 2013
Gunson MJ, Arnett GW, Milam SB 2011: Pathophysiology and pharmacologic control of osseous mandibular condylar resorption. J Oral Maxillofac Surg.70(8):1918-34, 2012
Zhang C, Wang P, Jiang P, Lv Y, Dong C, Dai X, Tan L, Wang Z 2016: Upregulation of lncRNA HOTAIR contributes to IL-1β-induced MMP overexpression and chondrocytes apoptosis in temporomandibular joint osteoarthritis. Gene: 586(2):248-53, 2016
Wang XD, Kou XX, Mao JJ, Gan YH, Zhou YH: Sustained inflammation induces
degeneration of the temporomandibular joint. J Dent Res 91(5):499-505, 2012
Ge XP, Gan YH, Zhang CG, Zhou CY, Ma KT, Meng JH, Ma XC: Requirement of the NF-κB pathway for induction of Wnt-5A by interleukin-1β in condylar chondrocytes of the temporomandibular joint: functional crosstalk between the Wnt-5A and NF-κB signaling pathways. Osteoarthritis Cartilage. 19(1):111-7, 2011
McCain JP, de la Rua H. Arthroscopic observation and treatment of synovial chondromatosis of the temporomandibular joint. Report of a case and review of the literature. Int J Oral Maxillofac Surg, 18(4):233-6. 1989.
Gynther GW, Holmlund AB, Reinholt FP: Synovitis in internal derangement of the temporomandibular joint: correlation between arthroscopic and histologic findings. J Oral Maxillofac Surg. 52(9):913-7, 1994
Umstadt H: Minimalinvasive chirurgische Behandlung des Kiefergelenkes. In: Therapie von Kiefergelenkschmerzen. Ein Behandlungskonzept für Zahnärzte, Kieferorthopäden und Physiotherapeuten. Georg Thieme Verlag.Stuttgart. Hrsg: Stelzenmüller Wolfgang et al.), S. 4472010
Quinn JH: Pathogenesis of temporomandibular joint chondromalacia and arthralgia. Oral Maxillofac Surg Clin North Amer 1: 47, 1989
Thomas M, Bornstein S:Arthroscopy of the temporomandibular joint. WB Saunders Company, Philadelphia, 1991
胡欣欣 朱耀旻 何柳婷 顾颖 梁志刚 郑苍尚. 109例颞下颌关节紊乱病相关因素分析—上海口腔医学》2017年02期. (hú xīnxīn zhūyàomín héliǔtíng gù yǐng liángzhìgāng zhèngcāngshàng. 109 Lì niè xiàgé guānjié wěnluàn bìng xiāngguān yīnsù fēnxī—shànghǎi kǒuqiāng yīxué”2017 nián 02 qī)
Luo S, Long X, Deng M, Meng Q, Ke J, Guo H: Association of COL1A1 polymorphism with subchondral bone degeneration of the temporomandibular joint. Int J Oral Maxillofac Surg.45(12):1551-1555, 2016
Xie Q, Yang C, He D, Cai X, Ma Z, Shen Y, Abdelrehem A: Will unilateral temporomandibular joint anterior disc displacement in teenagers lead to asymmetry of condyle and mandible? A longitudinal study. J Craniomaxillofac Surg 44(5):590-6, 2016
Zheng ZW, Yang C, Wang MH, Zhu XH, Fang YM: Non-joint effusion is associated with osteoarthritis in temporomandibular joints with disk displacement. J Craniomaxillofac Surg.44(1):1-5, 2016
Jiang Q, Qiu YT, Chen MJ, Zhang ZY, Yang C.Synovial TGF-β1 and MMP-3 levels and their correlation with the progression of temporomandibular joint osteoarthritis combined with disc displacement: A preliminary study. Biomed Rep. 1(2):218-222, 2013
Liu XM, Zhang SY, Yang C, Chen MJ, Can XY, Haddad MS, Yun B, Chen ZZ:
Correlation between disc displacements and locations of disc perforation in the temporomandibular joint. Dentomaxillofac Radiol. 39(3): 149–156, 2010
Tanne K, Okamoto Y, Su SC, Mitsuyoshi T, Asakawa-Tanne Y, Tanimoto K. Current status of temporomandibular joint disorders and the therapeutic system derived from a series of biomechanical, histological, and biochemical studies. APOS Trends Orthod 5: 4-21, 2015
Hu YK, Yang C, Cai XY, Xie QY: Does condylar height decrease more in temporomandibular joint nonreducing disc displacement than reducing disc displacement?
A magnetic resonance imaging retrospective study. Medicine (Baltimore): 95(35), 2016
专访杨驰:青春期面型突变的真实原因. 澎湃新闻记者 肖蓓
2017-06-15 14:52 来源:澎湃新闻 (Zhuānfǎng yáng chí: Qīngchūnqí miàn xíng túbiàn de zhēnshí yuányīn. Péngpài xīnwén jìzhě xiào bèi
2017-06-15 14:52 Láiyuán: Péngpài xīnwén)
Wilkes C. H. Internal derangements of the temporomandibular joint, Arch. Otolaryngol. Head Neck Surg,: 115, 469–477, 1989
Bornstein SL, Merrill RG: Clinical staging for TMJ internal derangement. Application to arthroscopy. J Craniomandib Disord 6:7, 1992
周玭, 李阳飞. 无症状人群颞下颌关节盘位置的核磁共振研究.口腔疾病防治, 2017,25(4): 239-244. (Zhōu pín, lǐyángfēi. Wú zhèngzhuàng rénqún niè xiàgé guānjié pán wèizhì de hécí gòngzhèn yánjiū. Kǒuqiāng jíbìng fángzhì, 2017,25(4): 239-244.)
杨驰. 颞下颌关节盘前移位与髁突骨吸收的关系及联合诊疗模式的探索. 中华口腔医学杂志, 2017,52(3) : 157-160. (Yáng chí. Niè xiàgé guānjié pán qián yí wèi yǔ kē tū gǔ xīshōu de guānxì jí liánhé zhěnliáo móshì de tànsuǒ. Zhōnghuá kǒuqiāng yīxué zázhì, 2017,52(3) : 157-160)
Tasaki MM, Westesson PL, Isberg AM, Ren YF, Tallents RH:Classification and prevalence of temporomandibular joint disk displacement in patients and symptom-free volunteers.
Am J Orthod Dentofacial Orthop. 109(3):249-62, 1996
Nitzan DW, Marmary Y: The „anchored disc phenomenon“: a proposed etiology for sudden-onset, severe, and persistent closed lock of the temporomandibular joint. J Oral Maxillofac Surg. 55(8): 797-802, 1997
Zhang S, Huang D, Liu X, Yang C, Undt G, Haddad SM, Chen Z: Arthroscopic treatment for intra-articular adhesions of the temporomandibular joint. J Oral Maxillofac Surg. 69(8):2120-2127, 2011
AWMF (Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V.) DRG (Deutsche Röntgengesellschaft)039/093 Radiologische Diagnostik im Kopf- Halsbereich
Kainberger F, Klauser A, Peloschek P, Rettenbacher Th, Schüller-Weidekamm C. Bildgebung in der Rheumatologie. In: Praktische Rheumatologie. SpringerWienNewYork. Dunky, Graninger, Herold, Smolen, Wanivenhaus (Hrsg.). 2011; 5. Aufl.: 141
Zhang S, Liu X, Yang C, Cai X, Chen M, Haddad MS, Yun B, Chen Z: Intra-articular adhesions of the temporomandibular joint: Relation between arthroscopic findings and clinical symptoms. BMC Musculoskelet Disord. 17;10:70, 2009
McCain JP: Principles and practice of temporomandibular joint arthroscopy.St. Louis. Mosby, S. 136- 138, 1996
Xu Y, Lin H, Zhu P, Zhou W, Han Y, Zheng Y, Zhang Z: A comparative study between use of arthroscopic lavage and arthrocentesis of temporomandibular joint based on computational fluid dynamics analysis. PLoS One. 1;8(11):e78953. doi: 10.1371, 2013.
Zhu P, Lin H, Zhou Q, Lv J, Zhang Z, Xu Y: Dynamic Evaluation of Lavage Efficacy in Upper Compartment of the Temporomandibular Joint. J Oral Maxillofac Surg. 75(2):276-283, 2017
Matsumoto K, Honda K, Ohshima M, Yamaguchi Y, Nakajima I, Micke P, Otsuka K: Cytokine profile in synovial fluid from patients with internal derangement of the temporomandibular joint: a preliminary study. Dentomaxillofac Radiol. 35(6):432-41,
2006
Ernberg M: The role of molecular pain biomarkers in temporomandibular joint internal derangement. J Oral Rehabil. 44(6):481-491, 2017
Kaneyama K, Segami N, Nishimura M, Sato J, Fujimura K, Yoshimura H: The ideal lavage volume for removing bradykinin, interleukin-6, and protein from the temporomandibular joint by arthrocentesis. J Oral Maxillofac Surg. 62(6):657-61, 2004
Zhang S, Yang C, Cai X, Liu X, Huang D, Xie Q, Haddad MS, Chen Z: Prevention and treatment for the rare complications of arthroscopic surgery in the temporomandibular joint. J Oral Maxillofac Surg. 69(11):e347-53, 2011