Der „Meth mouth“: Symptomatik, Diagnostik, Therapie
Methamphetamin (MA) wurde erstmals 1893 in Japan synthetisiert [Hamamoto et al., 2009]. Politisches und militärisches Interesse fand die Substanz durch ihre enthemmende und vor allem Vigilanz steigernde Wirkung. Sie wurde 1939/40 in den „Blitzkriegen“ gegen Polen und Frankreich von den Wehrmachtssoldaten großzügig als „Hitler-Speed“ oder Zusatz in der „Panzerschokolade“ konsumiert. Nachdem die umfangreichen Nebenwirkungen der Droge zutage traten, wurde Methamphetamin 1941 in Deutschland als Betäubungsmittel eingestuft.
Nach den 80er-Jahren publizierte ein Chemiker unter dem Pseudonym „Uncle Fester“ die „Secrets of Methamphetamine Manufacture“, eine im Internet frei verfügbare Anleitung zur MA-Produktion [Fester, 2009]. In Europa führte dies aufgrund der lockeren Gesetzgebung vor allem in Tschechien zur Entstehung von MA-Labors und Hinterhof-„Drogenküchen“. In der Folge wurden insbesondere die deutschen Grenzregionen zu Tschechien mit Drogenimporten förmlich überschwemmt [FAZ, 2014].
Wo wird das meiste Crystal Meth in Europa konsumiert?
Europas Top-Ten-Städte mit der höchsten Crystal-Meth-Spur im Abwasser, angegeben in mg pro 1.000 Menschen:
10. Jyväskylä (Finnland): 46,1 mg
9. Barcelona (Spanien): 47,9 mg
8. Kaunas (Litauen): 56,5 mg
7. Piestany (Slowakei): 81,9 mg
6. Budweis (Tschechien): 111,2 mg
5. Brno (Tschechien): 114,7 mg
4. Bratislava (Slowakei): 138,2 mg
3. Dresden: 174,6 mg
2. Chemnitz: 196,2 mg
1. Erfurt: 211,3 mg
European Centre for Drugs and Drug Addiction 2018
Das Meth-mouth-Syndrom
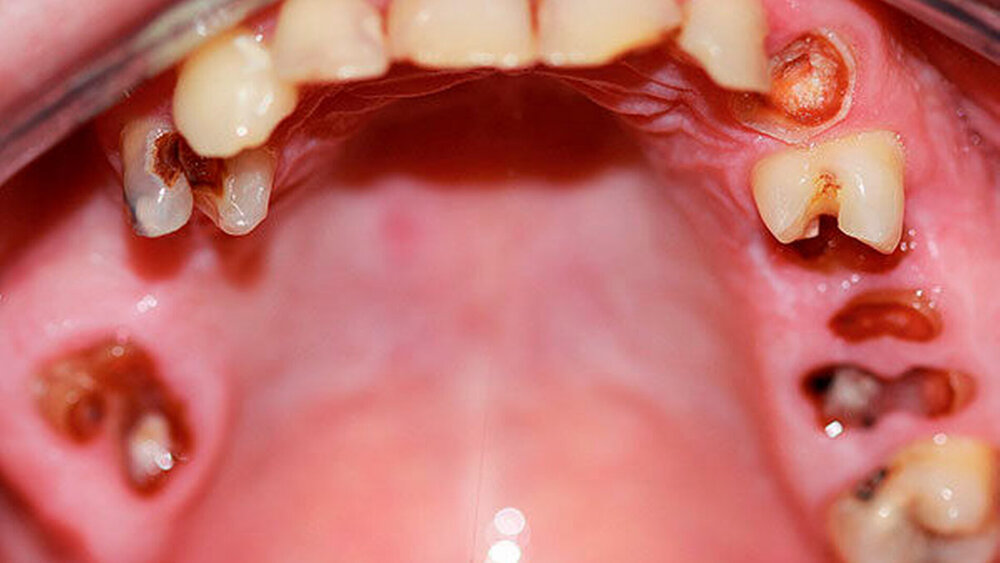
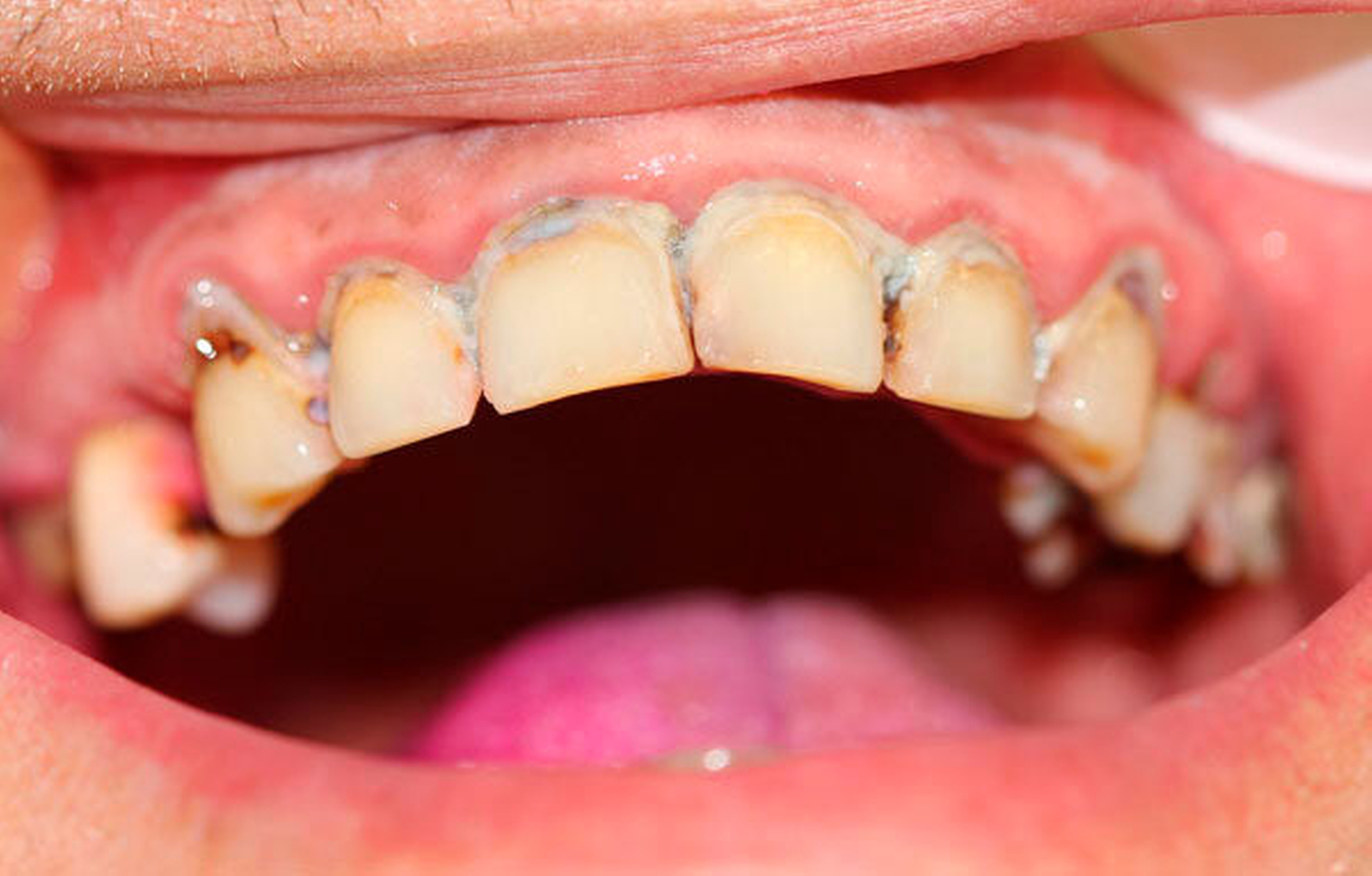
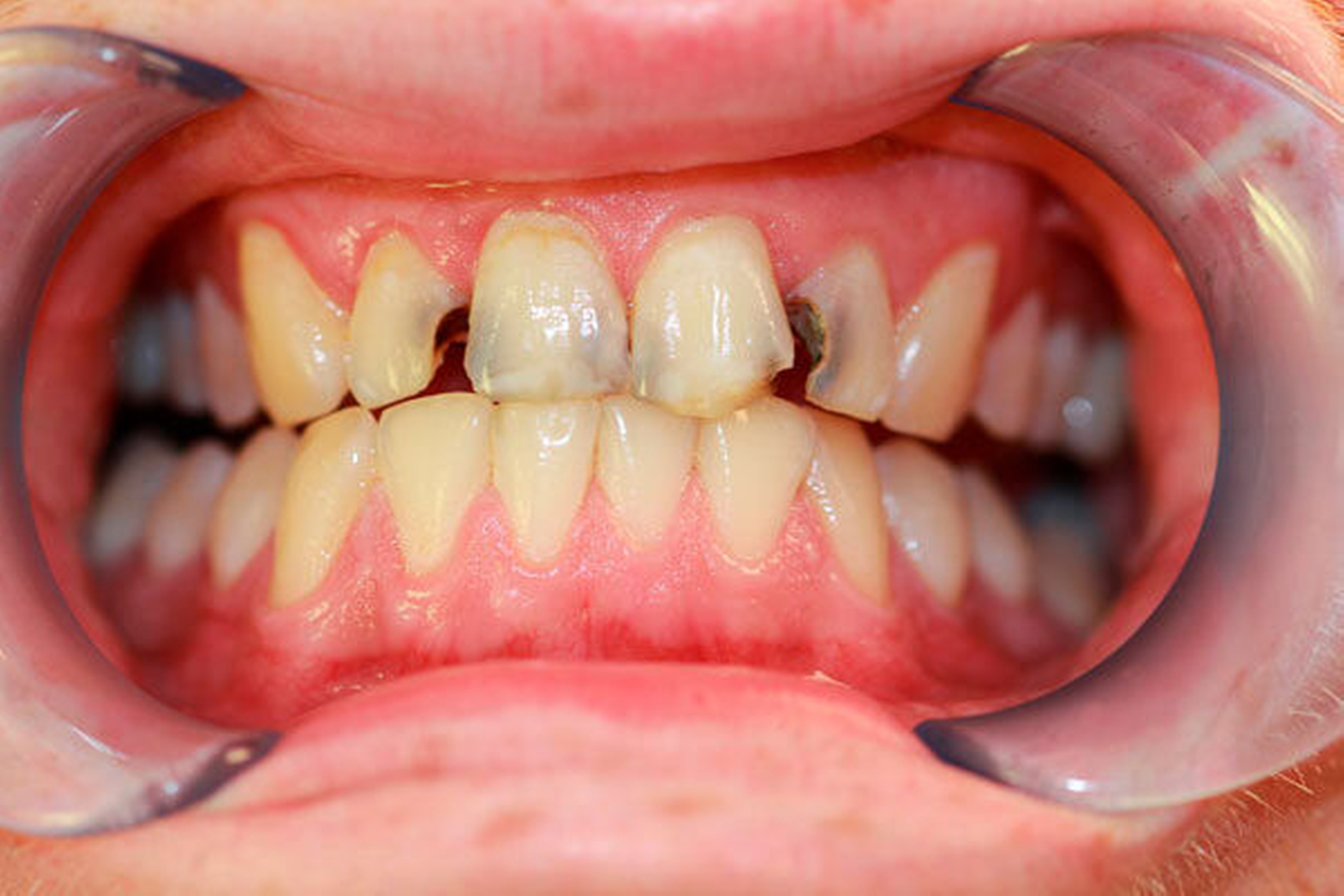
Bei chronischem Crystal-Meth(CM)-Konsum wurde eine Vielzahl körperlicher und psychischer Langzeitwirkungen, beispielsweise Herz-Kreislauf-Erkrankungen, strukturelle Hirnschädigungen und Persönlichkeitsveränderungen, beobachtet [Hamamoto et al., 2009]. In der aktuellen Literatur werden außerdem schwerwiegende Auswirkungen auf die Zahn-, Mund- und Kieferregion beschrieben [Hamamoto et al., 2009; Rhodus et al., 2008]. In den USA, wo nach Schätzungen knapp ein Drittel der weltweit über 30 Millionen CM-Abhängigen lebt, wurde 2005 erstmals der Begriff des „Meth mouth“ in der Fachliteratur genannt [Hamamoto et al., 2009; Rhodus et al., 2005] (Abbildung 1). Dabei wurden fünf Kardinalsymptome beschrieben: 1. Grassierende Karies (Abbildungen 2 und 3), 2. Gingivitis und Parodontitis, 3. Xerostomie, 4. Bruximus und 5. Trismus [Hamamoto et al., 2009; Rhodus et al., 2008].
Zielsetzung und Studiendesign
Im Rahmen eines Kooperationsprojekts zwischen der Universitätsklinik für Mund-Kiefer-Gesichtschirurgie der TU München am Klinikum rechts der Isar und den Suchtkliniken des Bezirks Oberfranken (Hochstadt, Bayreuth) wurden in einer Untersuchung erstmals in der Bundesrepublik die Folgen des CM-Konsums auf die Zahn-, Mund- und Kieferregion systematisch evaluiert. Dafür wurden insgesamt 100 Probanden mit chronischem CM-Konsum sowie 100 Kontrollprobanden entsprechend der matched-pair-Kriterien Alter und Geschlecht (+/- 1a) zur optimalen Verifizierung der Datenerhebung und -analyse akquiriert.
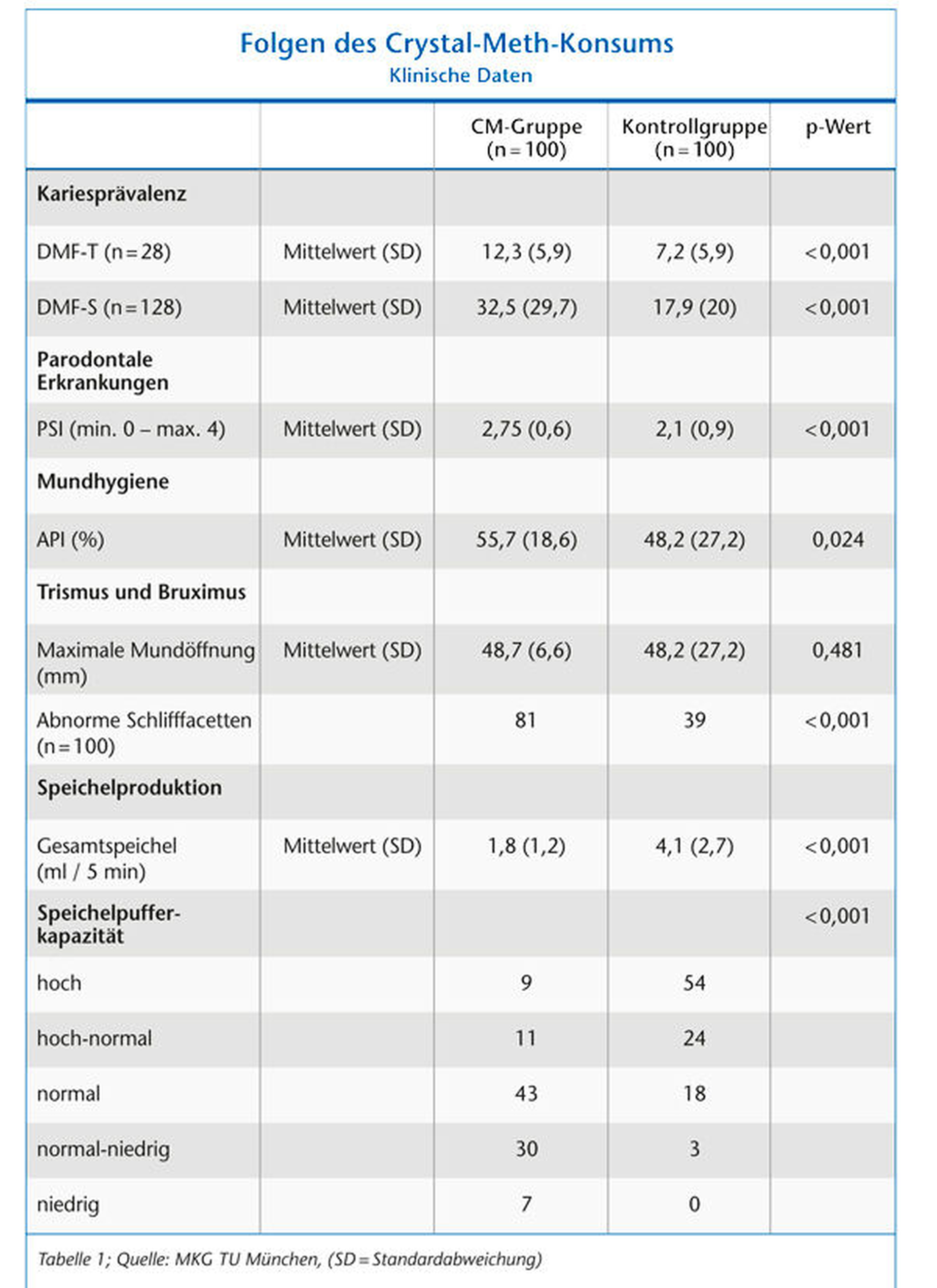
Im Zuge der Datenerhebung wurde eine ausführliche klinische Untersuchung bei allen Probanden beider Gruppen durchgeführt. Die Erfassung der Kariesprävalenz erfolgte mittels DMF-T- und DMF-S-Index. Der Gesundheitszustand des parodontalen Gewebes wurde mithilfe des Parodontalen Screening Index (PSI) erfasst. Die individuelle Mundhygiene wurde anhand spezifischer Plaque-Anfärbetabletten (Mira-2-Ton-Tabletts, Hager Werken, Duisburg) und nachfolgender Berechnung des Approximalraum-Plaque-Index (API) evaluiert. Zur Beurteilung eines möglichen Trismus wurde die Schneidekantendistanz (SKD) der mittleren Oberkiefer- und Unterkieferinzisivi bei maximaler Mundöffnung auf einem Holzspatel markiert und mit einem Lineal abgemessen. Die Prüfung auf Schlifffacetten über das physiologische Niveau hinaus diente als Hinweis auf einen möglichen Bruxismus. Im letzten Abschnitt der klinischen Untersuchung wurden die stimulierte Speichelfließrate anhand der sialometrischen Methode sowie die individuelle Speichelpufferkapazität mit einer Speichelprobe getestet. Zur Bestimmung der Pufferkapazität wurde eine Speichelprobe auf einen Indikatorstick (CRT Buffer, Vivadent, Ellwangen) aufgetragen und anhand des Verfärbungsgrades die Pufferkapazität in fünf verschiedene Kategorien von 1 (= sehr niedrig) bis 5 (= sehr hoch) eingeteilt.
Ergebnisse und Diskussion
Die Ergebnisse zeigen eine signifikant höhere Karies-, Gingivitis- und Parodontitisprävalenz innerhalb der Gruppe mit CM-Konsum als bei einer gleichaltrigen und vom Geschlecht gleich gewichteten Kontrollgruppe ohne CM-Konsum. Auffällig waren insbesondere eine signifikant verminderte Speichelflussrate und eine verminderte Speichelpufferkapazität bei der CM-Gruppe. Ein CM-induzierter Trismus durch den Nachweis einer eingeschränkten Mundöffnung war nicht ersichtlich. Signifikant erhöhte Schlifffacetten weisen auf einen durch chronischen CM-Konsum hervorgerufenen Bruxismus hin. Ebenso ist bei der CM-Gruppe eine verminderte Mundhygiene zu beobachten Tabelle 1).
Mundtrockenheit ist neben dem massiven Kariesbefall ein Hauptsymptom, das bei chronischem MA-Konsum beschrieben wird [Curtis, 2006]. Dies konnte in der Untersuchung bestätigt werden. Innerhalb der CM-Gruppe zeigte sich ein signifikant verminderter Durchschnittswert für die Gesamtspeichelmenge nach Stimulation von lediglich 0,36 ml/min. Die Gründe der MA-induzierten Mundtrockenheit sind weitgehend ungeklärt. Womöglich stellt jedoch die sympathomimetische, zentrale Wirkung von Methamphetamin auf die Speichelproduktion-hemmenden alpha-2-Rezeptoren des Gehirns die Hauptursache dar [Shaner et al., 2006]. Zudem scheint eine MA-induzierte Dehydration aufgrund des gesteigerten Stoffwechselumsatzes und der erhöhten physischen Aktivität bei MA-Konsum mitzuwirken [Goodchild et al., 2007; Shaner et al., 2006].
Dem Speichel kommt eine tragende Rolle bei der Prävention erosiver Läsionen zu [Buzalaf et al., 2012]. Liegt der Speichel-pH im sauren Bereich und sind zudem die Speichelfließrate und die Speichelpufferkapazität vermindert, werden Erosionen begünstigt [Buzalaf et al., 2012]. Speziell unter MA-Einfluss wurden ein pH-Wert-Abfall des Speichels und parallel eine Senkung der Pufferkapazität beobachtet [Navarro et al., 2001; Ravenel et al., 2012].
Ebenfalls im Zusammenhang mit chronischem MA-Konsum werden pathologische Auswirkungen auf das Parodontium [Rhodus et al., 2008; Tipton et al., 2010] mit vermehrtem Zahnfleischbluten und Entzündungen des Zahnhalteapparats sowie nachfolgendem Knochenabbau beschrieben [Tipton et al., 2010]. Auch dieser Effekt konnte bestätigt werden – es zeigte sich ein signifikant höherer PSI-Index bei der CM-Gruppe gegenüber der Kontrollgruppe. Eine Erklärung für das verstärkte Auftreten von Gingivitiden und Parodontitiden bei CM-Konsum könnte laut Tipton et al. eine gesteigerte Produktion des Entzündungsmediators Interleukin-1-Beta unter MA-Einfluss und somit ein erhöhtes Risiko für parodontale Erkrankungen sein [Tipton et al., 2010]. Darüber hinaus bewirkt MA einen signifikanten Anstieg von Leukozyten, Makrophagen und der proinflammatorischen Zytokine IFN-Gamma, TNF-Alpha, und IL-6 sowie einen signifikanten Abfall von CD3+-T-Zellen [Peerzada et al., 2013]. Auch wurden eine eingeschränkte antivirale Aktivität und eine verminderte CD14-Expression beschrieben.
Zusammenfassend kann somit von einer Abschwächung des Immunsystems mit gesteigerten Entzündungsreaktionen unter MA-Einfluss ausgegangen werden, wovon bei chronischem MA-Konsum explizit auch der Zahnhalteapparat betroffen ist.
Bruxismus wird als weiterer Einflussfaktor auf die Zahn-, Mund- und Kiefergesundheit von MA-Konsumenten diskutiert [Curtis, 2006]. Ein pharmakologischer Effekt von MA resultiert aus einer Blockierung der Wiederaufnahme von Noradrenalin in die Vesikel, wodurch eine erhöhte Sympathikusaktivität erfolgt [Lee et al., 1992]. Die übermäßige neuromuskuläre Aktivität bei MA-Konsumenten kann hierbei zu einer parafunktionalen Kieferfunktion mit verstärktem Bruxismus führen [McGrath et al., 2005]. Auch tritt ein Trismus häufig bei chronischem MA-Konsum aufgrund der übermäßigen neuromuskulären Aktivität auf [Rhodus et al., 2008]. Parodontale Erkrankungen und temporo-mandibuläre Dysfunktionen können somit bei dauerhaftem Bruxismus und Trismus die Folge sein [Curtis, 2006].
Eine signifikant reduzierte maximale Mundöffnung als Auswirkung eines möglichen Trismus war bei den CM-Konsumenten jedoch nicht ersichtlich. Eine Erklärung hierfür könnte eine verstärkte neuro-muskuläre Aktivität speziell in der akuten Konsumphase sein [Curtis, 2006], wobei in Phasen ohne Konsum eine „Erholung“ der Kaumuskulatur und somit eine Reversibilität der Kiefergelenkssymptome eintreten könnte. Hingegen konnten bei einem Großteil aller CM-Konsumenten – 81 Prozent – übermäßige und unphysiologische Schlifffacetten an den Zähnen mit signifikantem Unterschied zur Kontrollgruppe festgestellt werden. Zusammenfassend ist daher im Kontext der klinischen Beobachtungen, der pharmakologischen Effekte von MA sowie aktueller Beschreibungen in der Literatur vor allem von einem erhöhten Bruxismus-Risiko bei chronischem MA-Konsum auszugehen.
MA-Konsumenten neigen häufig zu einem Begleitkonsum von weiteren suchtfördernden Substanzen wie Cannabis, Stimulantien oder Sedativa [Turkyilmaz, 2010]. Cannabis-Konsumenten besitzen ein erhöhtes Risiko für Kariesbefall, Erkrankungen des Zahnhalteapparats und Xerostomie [Darling, 2003]. Auch die zusätzliche Einnahme von Stimulanzien (Kokain, Ecstasy) oder Sedativa (Opioide, Tranquilizer) kann eine Xerostomie hervorrufen [Brand et al., 2008; Chapman et al., 2010]. Somit ist der Begleitkonsum anderer illegaler Drogen ein relevanter Triggerfaktor bei der Entstehung des „Meth mouth“-Syndroms.
Schlussfolgerung
Chronischer CM-Konsum birgt langfristig ein hohes Schädigungspotenzial für die Zahn-, Mund- und Kieferregion. Dabei sind sowohl die direkten Auswirkungen der Substanz mit resultierenden Symptomen wie Xerostomie, Bruxismus und Senkung der Speichelpufferkapazität als auch weitere Risikofaktoren wie toxischer Begleitkonsum anderer Suchtmittel, insuffiziente Mundhygiene und mangelnde zahnärztliche Betreuung zu sehen. Diese Gesamtkonstellation lässt das Risiko für Kariesläsionen, Erkrankungen des Zahnhalteapparats und Kiefergelenksbeschwerden bei chronischem CM-Konsum massiv ansteigen.
Aufgrund der schnellen Ausbreitung des CM-Konsums innerhalb der Bundesrepublik sind weitreichende soziale und – insbesondere – gesundheitliche Folgen bei den Betroffenen zu erwarten. Diese Problematik wurde auch in der Gesundheitspolitik erkannt. Im November 2015 fand in Berlin eine Tagung der Drogenbeauftragten der Bundesregierung zu dem Thema: „Methamphetaminkonsum (‚Crystal Meth‘), seine Folgen und Antworten für die Praxis“ statt. Im Rahmen dieser Tagung wurde die Brisanz der CM-Ausbreitung deutlich und die dringende Notwendigkeit entsprechender Therapie- und Prophylaxemaßnahmen betont. Angeregt wurde unter anderem die Erstellung einer interdisziplinären S3-Leitlinie, die im Anschluss an die Tagung begonnen und im Dezember 2016 veröffentlicht wurde [DGPPN, 2016]. Da die Auswirkungen auf die Zahn-, Mund- und Kieferregion hierbei eine wichtige Rolle spielen, hat die Leitlinie ein eigenes Kapitel zum stomatognathen System mit spezifischen Therapie- und Prophylaxeempfehlungen. Diese umfassen sowohl allgemeine als auch spezielle Hinweise und Empfehlungen für das zahnärztliche Fachpersonal, um zunächst einen CM-Konsum erkennen und im Anschluss entsprechende prophylaktische und therapeutische Maßnahmen bezüglich des CM-typischen Symptomkomplexes einleiten zu können.
Vor allem bei jungen Patienten, die über Mundtrockenheit, starkes Zähneknirschen und unerklärliche Veränderungen innerhalb der Mundhöhle klagen, sollte als Ursache ein CM-Konsum in Erwägung gezogen werden. Eine ausführliche zahnärztliche und ärztliche Anamneseerhebung ist somit indiziert [Klasser et al., 2005]. Bei Bestätigung eines CM-Konsums sollten der allgemeine Gesundheitszustand und der Infektionsstatus (HIV, Hepatitis) hinterfragt werden, zudem sollte eine detaillierte Anamnese über den Begleitkonsum weiterer Suchtmittel erfolgen. Der Patient sollte über die Auswirkungen und Folgen seines CM-Konsums auf die Zahn-, Mund- und Kieferregion und die prophylaktischen und therapeutischen Möglichkeiten aufgeklärt werden. Falls er für eine medizinische Beratung empfänglich ist, ist die Konsultation eines Facharztes für Suchtmedizin oder einer suchtfachspezifischen Therapie- und Entzugsklinik wünschenswert.
Als präventive kariesprophylaktische Maßnahme wird die Anwendung von topischen Fluoriden, remineralisierenden Produkten und Chlorhexidin empfohlen [Klasser et al., 2005]. Fluoride können hierbei als Tablette, Gel, Spülung oder Lack verabreicht werden. Bei Xerostomie besitzt ein neutrales Fluorid gegenüber einem sauren Fluorid den Vorteil, den oralen pH-Wert gegenüber Säuren abzupuffern und somit die Remineralisation der Zahnhartsubstanz zu unterstützen [Donaldson et al., 2006]. Bei CM-induzierter Xerostomie wird somit insbesondere die Applikation eines neutralen Fluorids, beispielsweise Natriumfluorid, empfohlen.
Zur Vorbeugung einer Xerostomie wird bei chronischem CM-Konsum geraten, mindestens acht bis zehn Gläser Wasser pro Tag zu trinken und diuretisch wirkende Substanzen wie Koffein, Tabak und Alkohol möglichst zu meiden [Klasser et al., 2005]. Speichelersatzmittel, orale Feuchtigkeitscremes oder künstlicher Speichel können zwar kurzfristig Abhilfe schaffen, verweilen jedoch aufgrund der hohen Viskosität nur kurz in der Mundhöhle [Hamamoto et al., 2009]. Eine weitere therapeutische Empfehlung stellt die pharmakologische Stimulation der Speicheldrüsen mit dem Sialogoga Pilocarpin dar. Die parasympathomimetische Wirkung von Pilcocarpin stimuliert die großen und kleinen Speicheldrüsen [Rhodus, 1997], wodurch neben Speichel auch vermehrt IgA aus den kleinen Speicheldrüsen sezerniert wird. Allerdings sollten vor der Verabreichung von Pilocarpin mögliche Kontraindikationen wie Hypertonie, Lungen- und Nierenerkrankungen oder kardiale Arrhythmien überprüft werden. Als einfache Alternative werden zuckerfreie Kaugummis für eine Anregung der Speichelproduktion beschrieben [Rhodus et al., 2008]. Zudem werden aufgrund der verminderten Pufferkapazität des Speichels und dem damit einhergehenden erhöhten Risiko für Erosionen eine Einschränkung saurer Nahrungsmittel sowie die Nutzung einer wenig abrasiven Zahnpasta mit geringem Putzdruck empfohlen.
CM-Konsumenten neigen zu übermäßigem Bruxismus mit resultierendem Zahnhartsubstanzabrieb und -verschleiß sowie zu verstärkten Kiefergelenksbeschwerden und zu Verspannungen der Kaumuskulatur. Deshalb wird zum Schutz der Zahnhartsubstanz, zur Prävention von Kiefergelenksbeschwerden und zur Entspannung der Kaumuskulatur eine Relaxierungsschiene empfohlen. Des Weiteren können zur Relaxierung der Kaumuskulatur und zur Behandlung der kraniomandibulären Schmerzsymptomatik physiotherapeutische Interventionen angeboten werden.
Falls eine invasive zahnärztliche Maßnahme erforderlich wird, sind Paranoia, Ängste und paradoxe Schmerzsensationen bei der Therapieplanung zu berücksichtigen. Eine CM-Karenz von mehr als 24 Stunden vor einer zahnärztlichen Intervention ist dringend zu fordern, da der vasokonstriktorische Anteil im Lokalanästhetikum ein weiteres sympathikotones Triggern des Patienten hervorrufen kann. Schwerwiegende kardiovaskuläre Ereignisse könnten die Folge sein. Somit ist die Verwendung eines Lokalanästhetikums ohne Vasokonstringens zu empfehlen [Donaldson et al., 2006]. Bei deutlichen Anzeichen einer kürzlich erfolgten CM-Einnahme sollten akut indizierte Behandlungen nur unter Monitoringmaßnahmen erfolgen. Im postoperativen Status sollte die Verschreibung opioidhaltiger Analgetika aufgrund eines möglichen Abusus und von Atemdepression vermieden werden, nichtsteroidale Antiphlogistika bieten sich hier an [Donaldson et al., 2006]. Als invasiv-therapeutische Maßnahmen bei Kariesläsionen wird bei fortgeschrittenem Kariesbefall die Extraktion des Zahns empfohlen. In einem frühen Stadium einer Zahnkaries sollten Glasionomerzemente und Kompomere als Füllungsmaterialien mit dem Vorteil einer Fluoridfreisetzung verwendet werden [Heng et al., 2008]. Im Rahmen ausgedehnter Sanierungen ist jedoch ein Vorgehen in Intubationsnarkose und das Konsultieren eines Mund-Kiefer-Gesichtschirurgen beziehungsweise Oralchirurgen indiziert.
Dr. med. Dr. med. dent. Niklas Rommel
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie,
Klinikum rechts der Isar,
Technische Universität München
Ismaninger Str. 22, 81675 München
Univ.-Prof. Dr. med. dent. Herbert Deppe
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie,
Klinikum rechts der Isar,
Technische Universität München
Ismaninger Str. 22, 81675 München
Univ.-Prof. Dr. med. Dr. med. dent. Marco Kesting
Mund-, Kiefer- und Gesichtschirurgische Klinik
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
Literaturliste
1. Hamamoto DT, Rhodus NL. Methamphetamine abuse and dentistry. Oral diseases. 2009;15(1):27-37.
2. Fester U. Secrets of Methamphetamine Manufacture. 8 ed. Green Bay: FESTERING PUBN; 2009.
3. Crystal Meth wird Volksdroge [Newspaper Article]. Berlin: FAZ; 2014 [cited 2014 07.07.2014]. 07.07.2014. Available from: www.faz.net/aktuell/gesellschaft/gesundheit/kampf-gegen-die-sucht-crystal-meth-wird-volksdroge-13032468.html.
4. Rhodus NL, Little JW. Methamphetamine abuse and „meth mouth“. Pennsylvania dental journal. 2008;75(1):19-29.
5. Rhodus NL, Little JW. Methamphetamine abuse and „meth mouth“. Northwest dentistry. 2005;84(5):29, 31, 3-7.
6. Goodchild JH, Donaldson M. Methamphetamine abuse and dentistry: a review of the literature and presentation of a clinical case. Quintessence international. 2007;38(7):583-90.
7. Curtis EK. Meth mouth: a review of methamphetamine abuse and its oral manifestations. General dentistry. 2006;54(2):125-9; quiz 30.
8. Shaner JW, Kimmes N, Saini T, Edwards P. „Meth mouth“: rampant caries in methamphetamine abusers. AIDS patient care and STDs. 2006;20(3):146-50.
9. Buzalaf MA, Hannas AR, Kato MT. Saliva and dental erosion. Journal of applied oral science: revista FOB. 2012;20(5):493-502.
10. Navarro M, Pichini S, Farre M, Ortuno J, Roset PN, Segura J, et al. Usefulness of saliva for measurement of 3,4-methylenedioxymethamphetamine and its metabolites: correlation with plasma drug concentrations and effect of salivary pH. Clinical chemistry. 2001;47(10):1788-95.
11. Ravenel MC, Salinas CF, Marlow NM, Slate EH, Evans ZP, Miller PM. Methamphetamine abuse and oral health: a pilot study of „meth mouth“. Quintessence international. 2012;43(3):229-37.
12. Tipton DA, Legan ZT, Dabbous M. Methamphetamine cytotoxicity and effect on LPS-stimulated IL-1beta production by human monocytes. Toxicology in vitro: an international journal published in association with BIBRA. 2010;24(3):921-7.
13. Peerzada H, Gandhi JA, Guimaraes AJ, Nosanchuk JD, Martinez LR. Methamphetamine administration modifies leukocyte proliferation and cytokine production in murine tissues. Immunobiology. 2013.
14. Lee CY, Heffez LB, Mohammadi H. Crystal methamphetamine abuse: a concern to oral and maxillofacial surgeons. Journal of oral and maxillofacial surgery: official journal of the American Association of Oral and Maxillofacial Surgeons. 1992;50(10):1052-4.
15. McGrath C, Chan B. Oral health sensations associated with illicit drug abuse. British dental journal. 2005;198(3):159-62; dicussion 47; quiz 74.
16. Turkyilmaz I. Oral manifestations of „meth mouth“: a case report. The journal of contemporary dental practice. 2010;11(1): E073-80.
17. Darling MR. Cannabis abuse and oral health care: review and suggestions for management. SADJ: journal of the South African Dental Association = tydskrif van die Suid-Afrikaanse Tandheelkundige Vereniging. 2003;58(5):189-90.
18. Brand HS, Dun SN, Nieuw Amerongen AV. Ecstasy (MDMA) and oral health. British dental journal. 2008;204(2):77-81.
19. Chapman CR, Lipschitz DL, Angst MS, Chou R, Denisco RC, Donaldson GW, et al. Opioid pharmacotherapy for chronic non-cancer pain in the United States: a research guideline for developing an evidence-base. J Pain. 2010;11(9):807-29.
20. Klasser GD, Epstein J. Methamphetamine and its impact on dental care. J Can Dent Assoc. 2005;71(10):759-62.
21. Donaldson M, Goodchild JH. Oral health of the methamphetamine abuser. American journal of health-system pharmacy: AJHP: official journal of the American Society of Health-System Pharmacists. 2006;63(21):2078-82.
22. Rhodus NL. Oral pilocarpine HCl stimulates labial (minor) salivary gland flow in patients with Sjogren's syndrome. Oral diseases. 1997;3(2):93-8.
23. Heng CK, Badner VM, Schiop LA. Meth mouth. The New York state dental journal. 2008;74(5):50-1.
24. DGPPN, Deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde. S3-Leitlinie Methamphetamin-bezogene Störungen. Springer 2016.