Anaplastisches pleomorphes Sarkom des Kiefergelenks
Eine 49-jährige Patientin beklagte initial spontan auftretende, persistierende, CMD-artige Beschwerden im Bereich des linken Kiefergelenks. Initial nicht bestehende Schmerzen des linken Kiefergelenks und eine leicht eingeschränkte Mundöffnung bei fehlender Ursache veranlassten den zunächst aufgesuchten Zahnarzt zur Überweisung der Patientin an einen niedergelassenen MKG-Chirurgen. Die veranlasste Computertomografie (CT) ergab den hochgradigen Verdacht auf einen ausgedehnten destruierenden Prozess im Bereich des linken Kiefergelenks. Zur weiteren Abklärung wurde die Patientin an unsere Klinik überwiesen.
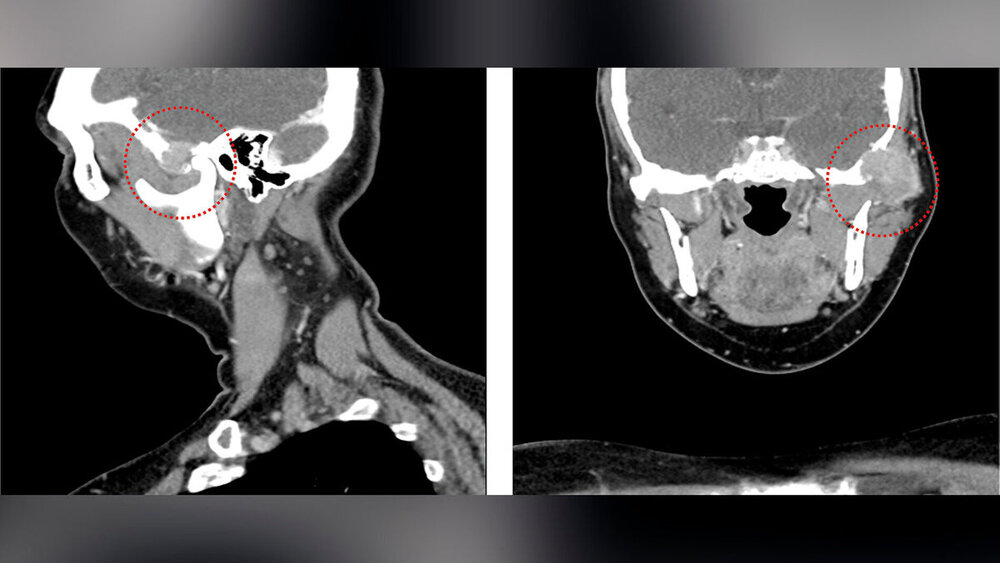
In der durchgeführten CT-Untersuchung mit Kontrastmittel (Abbildung 1) zeigte sich in der linken Gelenkpfanne des Kiefergelenks ein unscharf und destruierend wachsender Tumor mit einem maximalen Durchmesser von etwa 3 cm. Der Tumor arrodierte das Felsenbein und einzelne Mastoidzellen. Die knöcherne Begrenzung der mittleren Schädelgrube zeigte sich nach intrakraniell aufgehoben und die Dura mater zum angrenzenden Temporallappen wurde bereits nach medial verdrängt. Der linke Jochbogen zeigte sich ebenfalls knöchern destruiert, das linke Kiefergelenkköpfchen war jedoch intakt. Im MRT zeigten sich neben einer Tumorinvasion des Musculus temporalis auch ipsilateral links intra- und paraparotideale Lymphknoten, die im Seitenvergleich vermehrt imponierten (Größe < 1 cm). Im Level IIb links zeigten sich im Seitenvergleich ebenfalls vermehrt Lymphknoten, allerdings ohne einen konkreten morphologischen Malignitätsverdacht.
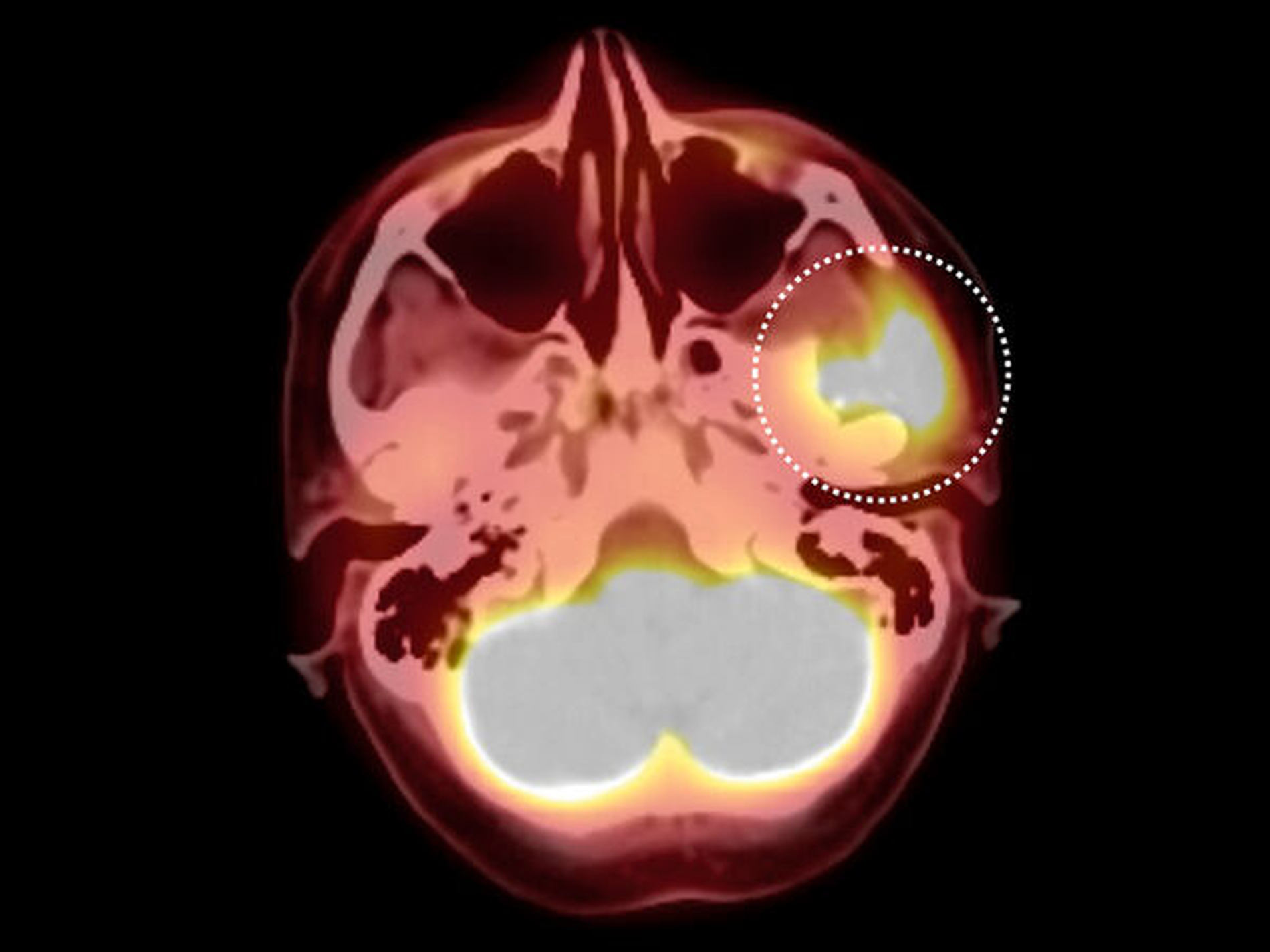
In der im Rahmen des komplettierenden Stagings durchgeführten 18-FDG- PET-/CT Untersuchung (Abbildung 2) zeigte sich eine massive Glukoseanreicherung im Bereich der linken Kiefergelenkspfanne. Anzeichen für eine Fernmetastasierung fanden sich nicht. Es erfolgte die CT-gesteuerte Punktion des Tumors an der Schädelbasis zur histologischen Einordnung. Die exakte histologische Klassifizierung des Tumors stellte sich als hochgradig diffizil heraus: Zunächst konnte nur ein wenig differenzierter, solide wachsender, maligner Tumor diagnostiziert werden. Ausgiebige Zusatzuntersuchungen und mehrere referenzpathologische Stellungnahmen konnten ebenfalls keine definitive histopathologische Einordnung des Befunds erzielen.
Nach der Vorstellung des Falles in der interdisziplinären Tumorkonferenz begann zunächst eine neoadjuvante Chemotherapie mit zwei Zyklen eines TPF-Schemas (Doxetacel 140 mg, Cisplatin 143 mg, 5-Fluoruracil 7 g). Hierunter zeigte sich im Zwischenstaging ein leicht rückläufiger Weichteilanteil mit gleichzeitig progredienter Knocheninfiltration des Tumors, was zwei ausgedehnte interdisziplinäre Tumorresektionen durch die Mund-, Kiefer- und plastische Gesichtschirurgie sowie durch die Kollegen der Neurochirurgie erforderlich machte. Auch an den großflächig resezierten Tumorpräparaten konnte keine weitere eindeutige histopathologische Einordnung des Malignoms getroffen werden. Ein mittlerweile fast vollständig entdifferenziertes Sarkom wurde von allen beteiligten Pathologen als die wahrscheinlichste Diagnose erachtet, wobei man sich am ehesten auf ein undifferenziertes pleomorphzelliges Sarkom festlegte. Nach Stabilisierung der lokalen Wundverhältnisse erfolgte eine adjuvante Strahlentherapie mittels Protonen am HIT (Heidelberger Ionenstrahl-Therapiezentrum) mit einer kumulativen Strahlendosis von 74 Gy im Tumorbett.
Regelmäßige Nachsorgen mittels Schnittbildgebung zeigten eine posttherapeutische Tumorfreiheit von acht Monaten. Danach ergaben im Rahmen der Nachsorge durchgeführte MRT- und PET/CT-Untersuchungen den Verdacht auf multiple Lymphknotenmetastasen cervical links, die im Rahmen einer Neck Dissection und einer lateralen Parotidektomie links sowie einer erneuten Tumorausräumung in der linken Fossa jugularis entfernt werden konnten. Bei weiterhin nicht eindeutig möglicher histopathologischer Subklassifizierung des Malignoms erfolgte eine Immuntherapie mittels eines Checkpoint-Inhibitors (Pembrulizumab) durch die internistische Onkologie. Die weiteren, im zeitnahen Verlauf durchgeführten schnittbildgebenden und metabolismusdetektierenden Untersuchungen zeigten ein zunehmend progredientes lokales, nach intrakraniell vordringendes Tumorwachstum und eine weitere diffuse lokale und systemische Metastasierung. Dies führte zu einer systemischen Therapie aus insgesamt sieben Zyklen Doxorubicin und Ifosfamid mit einer simultanen Hyperthermiebehandlung an der LMU München. Weitere Metastasen im Bereich der Schädelbasis und im Bereich des Mittelgesichts konnten im Verlauf erneut chirurgisch reseziert werden. Parallel dazu erfolgte eine Anbindung der Patientin ans NCT (Nationales Zentrum für Tumorerkrankungen) in Heidelberg inklusive einer Anbindung in der dortigen Sarkomsprechstunde.
Im weiteren Re-Staging zeigte sich ein erneutes ausgedehntes Tumorrezidiv im Bereich der linken Fossa temporalis mit einer Infiltration der umliegenden Hart- und Weichgewebe. Eine erneute Bestrahlung erschien nicht angezeigt. Es erfolgte eine umfassende Beratung der Patientin bezüglich einer möglichen teilweisen Tumorreduktion (aufgrund der intrakraniellen Tumorinfiltration) durch die Kollegen der Mund-, Kiefer- und Gesichtschirurgie des Universitätsklinikums Heidelberg, die letzten Endes aufgrund des Patientenwunsches nach einer heimatnahen Behandlung interdisziplinär am Bundeswehrzentralkrankenhaus durchgeführt wurde. Im Folgenden traten immer wieder weitere Metastasen auf, die die bereits hochpalliative Gesamtsituation der Patientin zunehmend verschlechterten. Die Patientin verstarb im weiteren Verlauf.
Diskussion
Zu den häufigen bösartigen Tumoren zählen Plattenepithelkarzinome der Haut und der Schleimhäute sowie Basalzellkarzinome der Haut. Als solide mesenchymale Tumoren stellen die Sarkome eine deutlich seltener auftretende Tumorentität dar [Fletcher et al., 2013]. Vom Hartgewebe – zum Beispiel Knochen oder Knorpel – gehen Osteosarkome, Chondrosarkome und Ewing-Sarkome aus, vom Weichgewebe hingegen Rhabdomyosarkome, Fibrosarkome, Synovialsarkome, Dermatofibrosarkome und Hämangiosarkome [Ferrari et al., 2011; Ferrari et al., 2016; Miettinen et al., 2019]. Diese Tumorentitäten sind in ihrem klinischen Verhalten und in den zur Verfügung stehenden Therapieoptionen sehr heterogen [Costelloe et al., 2014; Schwarz et al., 2009]. Auch unterscheidet sich häufig die Tumorbiologie zwischen pädiatrischen und adoleszenten Sarkomen, die immer häufiger mittels internationaler interdisziplinärer Studienprotokolle behandelt werden [Joshi et al., 2004; Ladenstein et al., 2010; Ottaviani et al., 2013; Schuck et al., 2003]. Viele dieser Sarkome sind hochgradig aggressive Malignome und gerade bei Sarkomen spielt der Grad der Differenzierung beziehungsweise der Entdifferenzierung (Grading) der Tumorzellen eine entscheidende prognostische Rolle [Bielack et al., 2002; Miettinen et al., 2019].
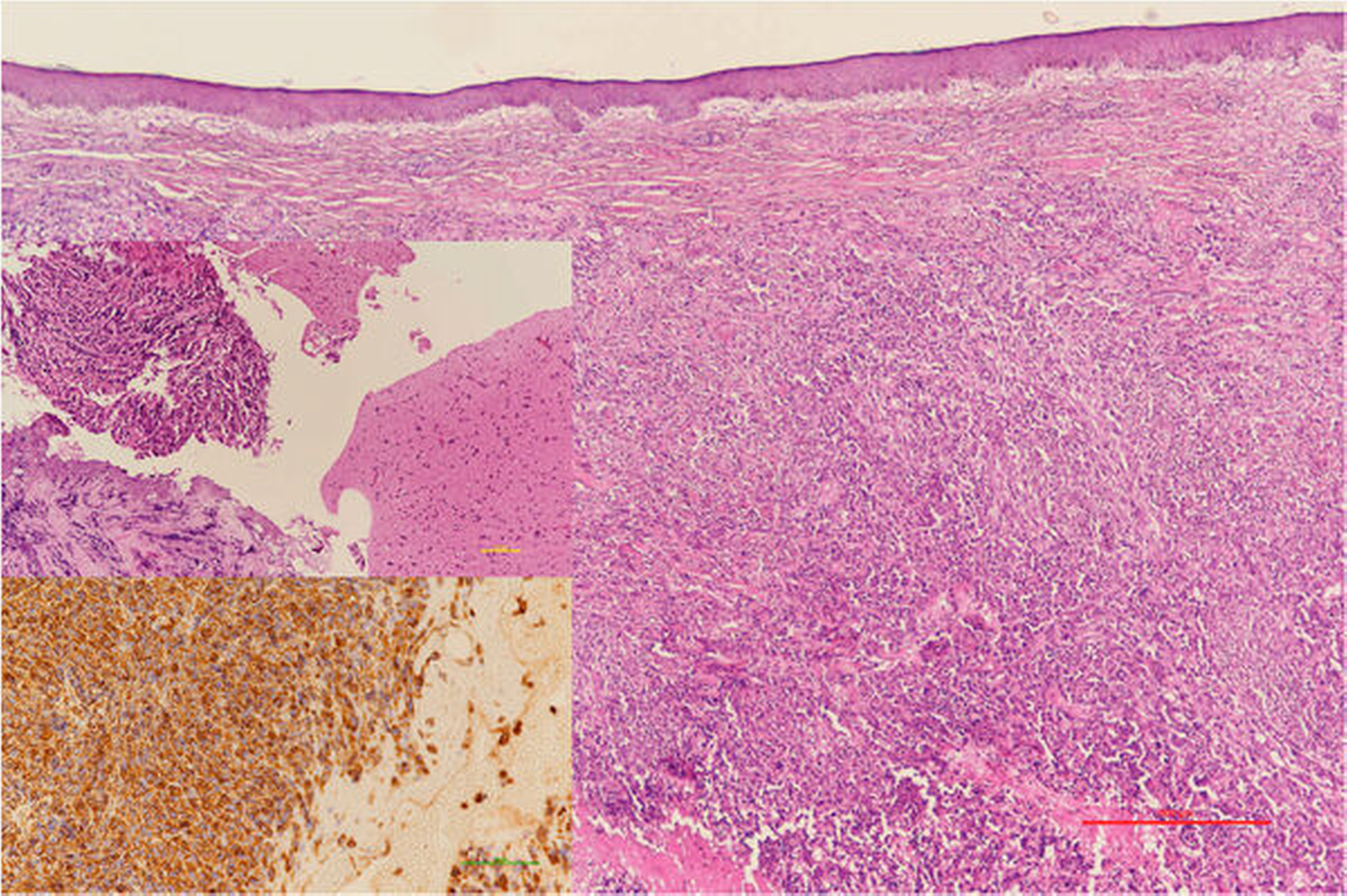
Anaplastische Sarkome im Kopf-Hals-Bereich sind selten, aber trotzdem eine immer wieder auftretende Tumorentität [Thiele, 2016]. Man muss im vorliegenden Fall davon ausgehen, dass die initial bereits entdifferenzierte Neoplasie durch die Folgen der Tumorprogression und möglicherweise auch als Reaktion auf die lokalen und systemischen Therapien eine weitere zusätzliche Entdifferenzierung erfahren hat. Dies machte im Verlauf eine weitere Liniendifferenzierung auch an den großen Tumorpräparaten weitestgehend unmöglich (Abbildung 3). Während einige Sarkomlinien (zum Beispiel Chondrosarkome, Hämangiosarkome, Fibrosarkome) weiter primär chirurgisch behandelt werden [Han et al., 2020; Thiele et al., 2009; 2010; Trofymenko et al., 2018], sind bei anderen Sarkomsubtypen (zum Beispiel Osteosarkome, Ewing-Sarkome) reine Chemotherapieprotokolle, Schwerionenbestrahlungen und interdisziplinäre komplexe chirurgisch-internistische Protokolle zum internationalen Standard geworden [Ellis et al., 2017; Frezza et al., 2017; Malouff et al., 2020]. Die Therapiefestlegung sollte bei solchen Patienten grundsätzlich durch interdisziplinäre Tumorboards in spezialisierten onkologischen Zentren erfolgen.
MKG-Chirurgie, Bundeswehrzentralkrankenhaus Koblenz
Im hier vorgestellten Fall machte die histologische Entdifferenzierung der Tumorzellen eine feingewebliche Klassifizierung besonders schwierig. Dies verzögert den zeitnahen Beginn der richtigen Therapieform. Zusätzlich zeigen entdifferenzierte Tumorzellen, speziell bei mesenchymalen Tumoren, in der Regel ein besonders aggressives Verhalten bei der lokalen Ausbreitung sowie bei Lymph- und Hämangiosis carcinomatosa, was mit einer deutlich schlechteren Prognose für die Patienten verbunden ist.
Fazit für die Praxis
Patienten mit Beschwerden der Kiefergelenke suchen häufig zunächst ihren Zahnarzt auf, von dem sie in den meisten Fällen zielführend und erfolgreich behandelt werden können. Bei einem solch ungewöhnlichen Fall wie dem hier vorgestellten besteht die hauptsächliche Problematik für den niedergelassenen Zahnarzt im zeitnahen Abklären der Differenzialdiagnose der sehr selten zugrunde liegenden Kausalität eines hochaggressiven entdifferenzierten Sarkoms und in der unverzüglichen Einleitung einer hoch spezialisierten interdisziplinären Therapie in spezialisierten onkologischen Zentren. Hier kann der niedergelassene MKG-Chirurg als Bindeglied zur Klinik wertvolle Dienste als Schnittstelle zwischen Zahnmedizin und Humanmedizin leisten. Leider muss man bei bestimmten Malignomen, wie dem hier vorgestellten anaplastischen Malignom, trotz zeitnah eingeleiteter multimodaler interdisziplinärer Therapie immer noch von einer sehr limitierten Prognose für die betroffenen Patienten ausgehen.
Literaturliste
1) Bielack SS, Kempf-Bielack B, Delling G, et al: Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1,702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols. J Clin Oncol 2002; 20: 776-790
2) Costelloe CM, Chuang HH, Madewell JE: FDG PET/CT of primary bone tumors. AJR Am J Roentgenol 2014; 202: W521-W531
3) Ellis MA, Gerry DR, Neskey DM, Lentsch EJ. Ewing sarcoma of the head and neck, Ann Otol Rhinol Laryngol. 2017 Mar; 126(3): 179-184.
4) Fletcher CDM, Bridge JA, Hogendoorn P, Mertens F: WHO Classification of Tumors of Soft Tissue and Bone, ed 4. Geneva, World Health Organization, 2013
5) Ferrari A, Sultan I, Huang TT, et al: Soft tissue sarcoma across the age spectrum: a population-based study from the surveillance epidemiology and end results database. Pediatr Blood Cancer 2011; 57: 943-949
6) Ferrari A, Dirksen U, Bielack S.: Sarcomas of soft tissue and bone. Prog Tumor Res. 2016;43:128-41. doi: 10.1159/000447083. Epub 2016 Sep 5.
7) Frezza AM, Cesari M, Baumhoer D, Biau D, Bielack S, Campanacci DA, Casanova J, Esler C, Ferrari S, Funovics PT, Gerrand C, Grimer R, Gronchi A, Haffner N, Hecker-Nolting S, Höller S, Jeys L, Jutte P, Leithner A, San-Julian M, Thorkildsen J, Vincenzi B, Windhager R, Whelan J. Mesenchymal chondrosarcoma: prognostic factors and outcome in 113 patients. A European musculoskeletal oncology society study, Eur J Cancer. 2015 Feb; 51(3): 374-81
8) Han S, Yin X, Xu W, Wang Y, Han W., The management of head and neck sarcoma, J Craniofac Surg. 2020 Mar/Apr; 31(2): e189-e192.
9) Joshi D, Anderson JR, Paidas C, et al: Age is an independent prognostic factor in rhabdomyosarcoma: a report from the soft tissue sarcoma committee of the children's oncology group. Pediatr Blood Cancer 2004; 42: 64-73
10) Ladenstein R, Pötschger U, Le Deley MC, Whelan J, Paulussen M, Oberlin O, van den Berg H, Dirksen U, Hjorth L, Michon J, Lewis I, Craft A, Jürgens H: Primary disseminated multifocal Ewing sarcoma: results of the Euro-EWING 99 trial. J Clin Oncol 2010; 28: 3284-3291
11) Malouff TD, Mahajan A, Krishnan S, Beltran C, Seneviratne DS, Trifiletti DM. Carbon ion therapy: a modern review of an emerging technology. Front Oncol. 2020 Feb 4; 10: 82.
12) Miettinen M, Felisiak-Golabek A, Luiña Contreras A, Glod J, Kaplan RN, Killian JK, Lasota J.: New fusion sarcomas: histopathology and clinical significance of selected entities. Hum Pathol. 2019 Apr; 86: 57-65.
13) Olson MD, Van Abel KM, Wehrs RN, Garcia JJ, Moore EJ. Ewing sarcoma of the head and neck: the Mayo clinic experience. Head Neck. 2018 Sep; 40(9): 1999-2006
14) Ottaviani G, Robert RS, Huh WW, Palla S, Jaffe N: Sociooccupational and physical outcomes more than 20 years after the diagnosis of osteosarcoma in children and adolescents: limb salvage versus amputation. Cancer 2013; 119: 3727-3736
15) Schuck A, Ahrens S, Paulussen M, et al: Local therapy in localized Ewing tumors: results of 1058 patients treated in the CESS 81, CESS 86, and EICESS 92 trials. Int J Radiat Oncol Biol Phys 2003; 55: 168-177
16) Schwarz R, Bruland O, Cassoni A, Schomberg P, Bielack S: The role of radiotherapy in osteosarcoma. Cancer Treat Res 2009; 152: 147-164
17) Thiele OC, Freier K, Bacon C, Egerer G, Hofele C, Interdisciplinary combined treatment of craniofacial osteosarcoma with neoadjuvant and adjuvant chemotherapy and excision of the tumour: a retrospective study. Br J Oral Maxillofac Surg 2008 Oct; 46(7): 533-6
18) Thiele OC, Seeberger R, Bacon C, Mühling J, Freier K, Hofele C, Recurrent craniofacial dermatofibrosarcoma protuberans: long-term prognosis after close surgical removal, J Craniofac Surg 2009 May;20(3): 844-6
19) Thiele OC, Freier K, Flechtenmacher C, Rohde S, Hofele C, Mühling J, Seeberger R. Haemangiopericytoma of the mandible, J Craniomaxillofac Surg. 2010 Dec; 38(8): 597-600
20) Thiele OC, Zur Therapie seltener Kopf- Hals- Tumore, Habilitationsschrift, Universität zu Köln, 2016
21) Trofymenko O, Bordeaux JS, Zeitouni NC. Survival in patients with primary dermatofibrosarcoma protuberans: National database analysis, J Am Acad Dermatol. 2018 Jun; 78(6): 1125-1134
22) Yang J, Gao J, Qiu X, Hu J, Hu W, Wu X, Zhang C, Ji T, Kong L, Lu JJ. Intensity- modulated proton and carbon ion radiation therapy in the management of head and neck sarcomas. Cancer Med. 2019 Aug; 8(10): 4574-4586