Pathologische Unterkieferfraktur als Extremkomplikation einer Periimplantitis
Eine 81-jährige Patientin stellte sich mit Verdacht auf eine Unterkieferfraktur nach Zuweisung durch einen niedergelassenen Kollegen in der Ambulanz der Mund-, Kiefer- und plastischen Gesichtschirurgie vor. Die Patientin berichtete über seit mehreren Wochen bestehende Schmerzen im Unterkiefer, die beim Kauen stark zunehmen. Ein Trauma war anamnestisch nicht erinnerlich. Die Patientin gab an, an sinusitisartigen Beschwerden mit einem Druckgefühl im Bereich der Kieferhöhlen und einem kontinuierlichen Sekretfluss aus der Nase zu leiden.
An Vorerkrankungen waren eine koronare Herzkrankheit mit einem zwei Jahre zurückliegendem Myokardinfarkt, eine arterielle Hypertonie, eine Edoxaban-Dauertherapie aufgrund eines Vorhofflimmerns und eine hochgradige, nicht dialysepflichtige chronische Niereninsuffizienz (Stadium IV) bekannt. Eine antiresorptive Therapie oder Radiatio im Kopf-Hals-Bereich hatte die Patientin in der Vergangenheit nicht erhalten.
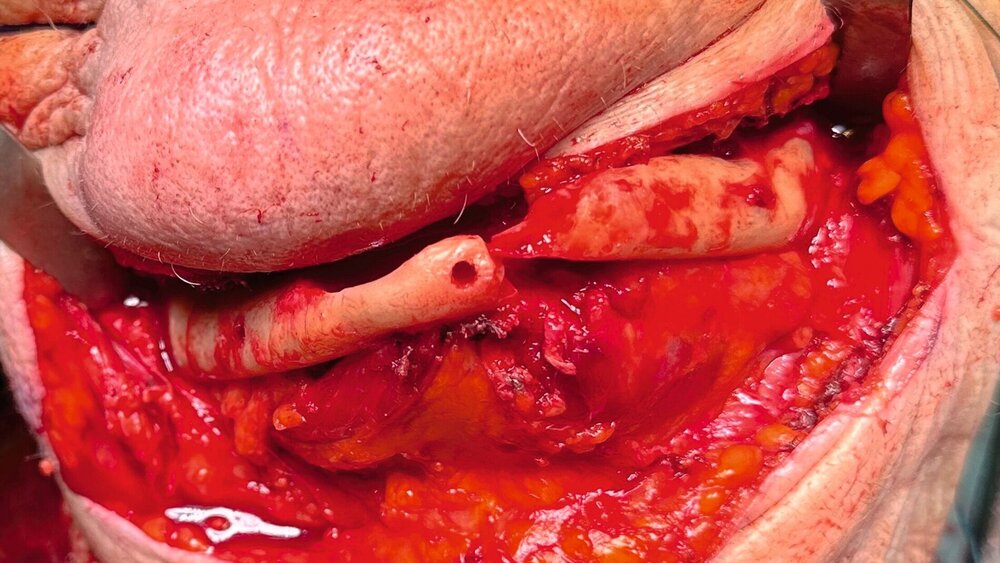
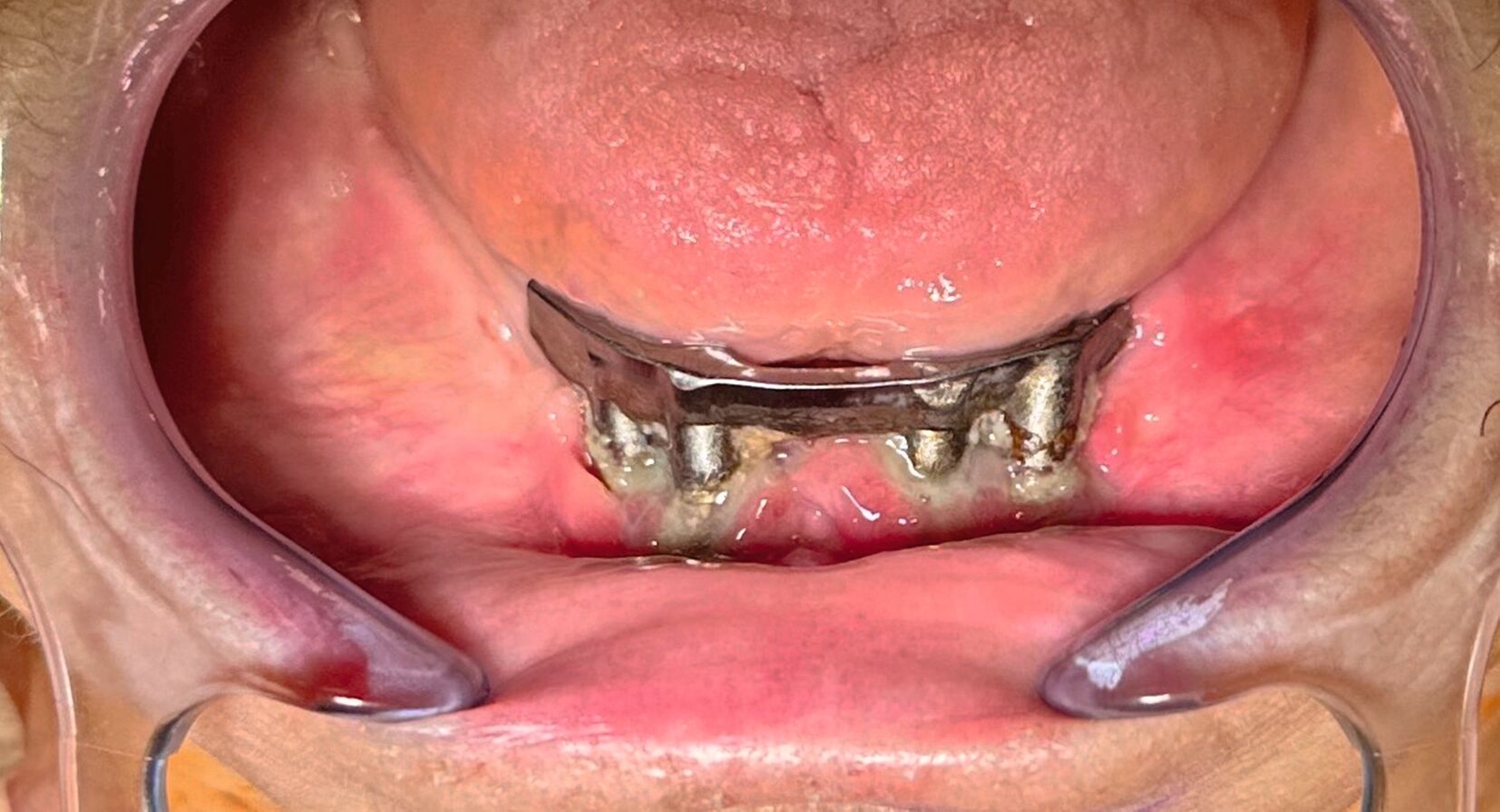
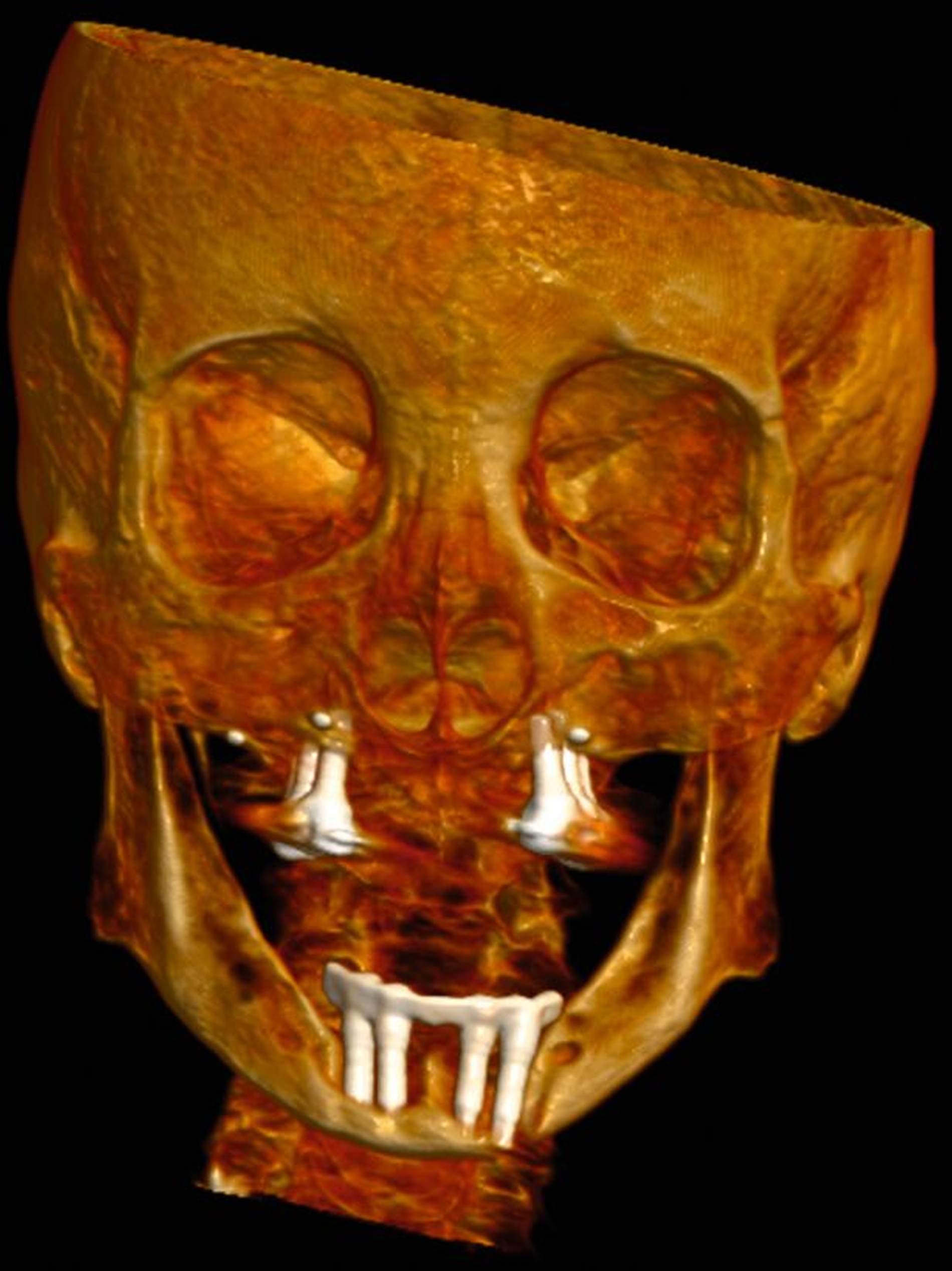
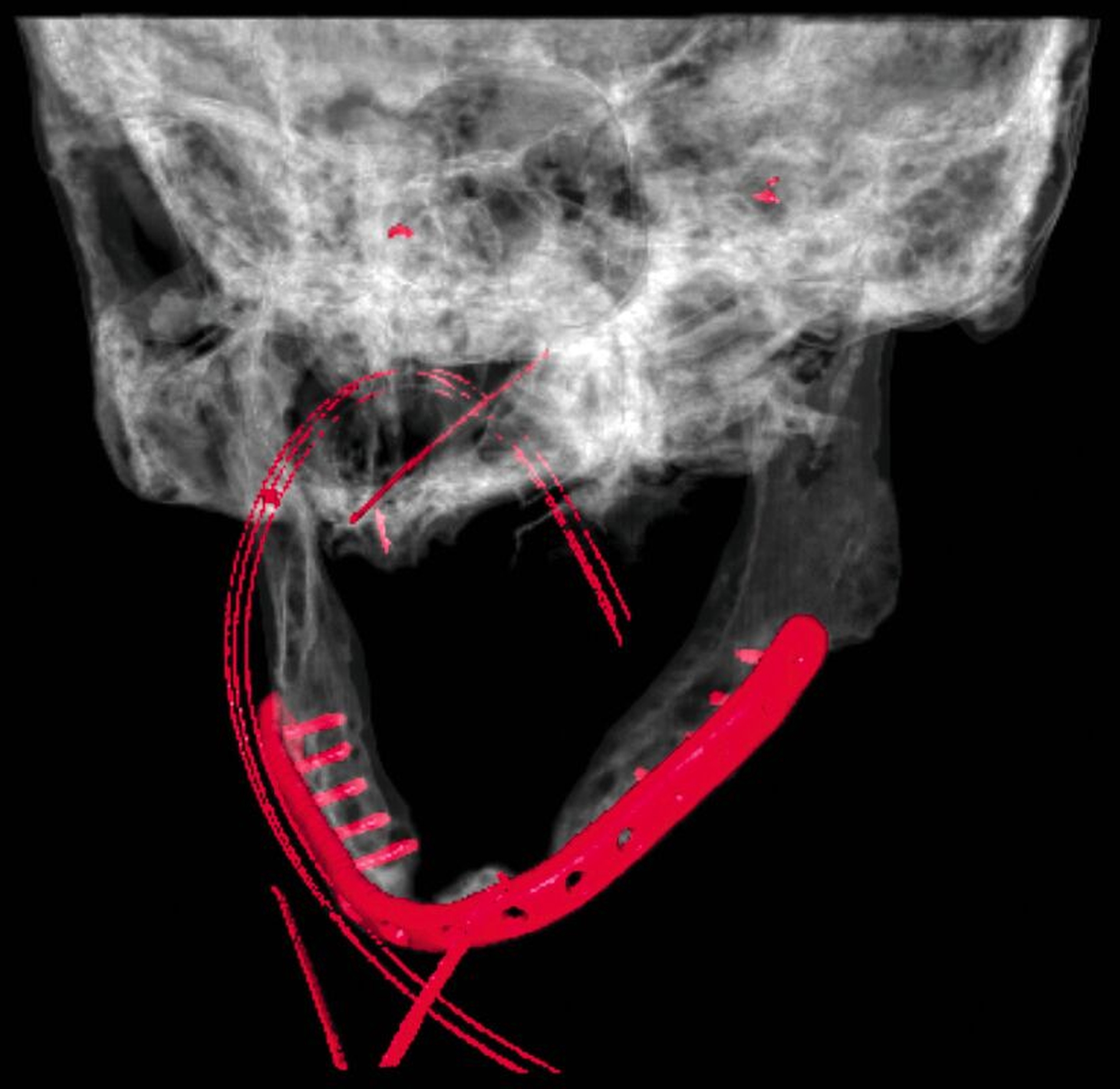
In der klinischen Untersuchung zeigte sich extraoral am linken Unterkieferkorpus eine dezente, jedoch stark druckdolente Schwellung. Aufgrund der abnormen Beweglichkeit des Unterkiefers in diesem Bereich konnte bereits klinisch eine Unterkieferfraktur diagnostiziert werden. Die Patientin war unbezahnt und im Oberkiefer mit einer auf den Implantaten 16, 15, 14, 24, 25, 26 und im Unterkiefer mit einer auf den Implantaten 33, 32, 42, 43 getragenen Prothese versorgt. Die Implantate wurden vor ungefähr 15 Jahren inseriert, wobei die Patientin nach eigenen Angaben seit mindestens zehn Jahren keinen zahnärztlichen Kontrolltermin mehr wahrgenommen hatte. Die Mundhygiene zeigte sich in einem desolaten Zustand, die Implantate wiesen ausgeprägte weiche und harte Beläge mit periimplantärem Blut- und Pusaustritt auf Sondierung auf, wobei die oberen Implantatgewinde bereits exponiert waren. Die periimplantäre Gingiva war massiv gerötet und geschwollen. An allen Implantaten waren Sondierungstiefen von über 10 mm messbar. Die Stegkonstruktion im Unterkiefer war klinisch fest, die Implantate im Oberkiefer bereits erst- beziehungsweise zweitgradig gelockert. Distal des Implantats in regio 26 war die Sondierung der Kieferhöhle mit einer MAV-Sonde möglich.
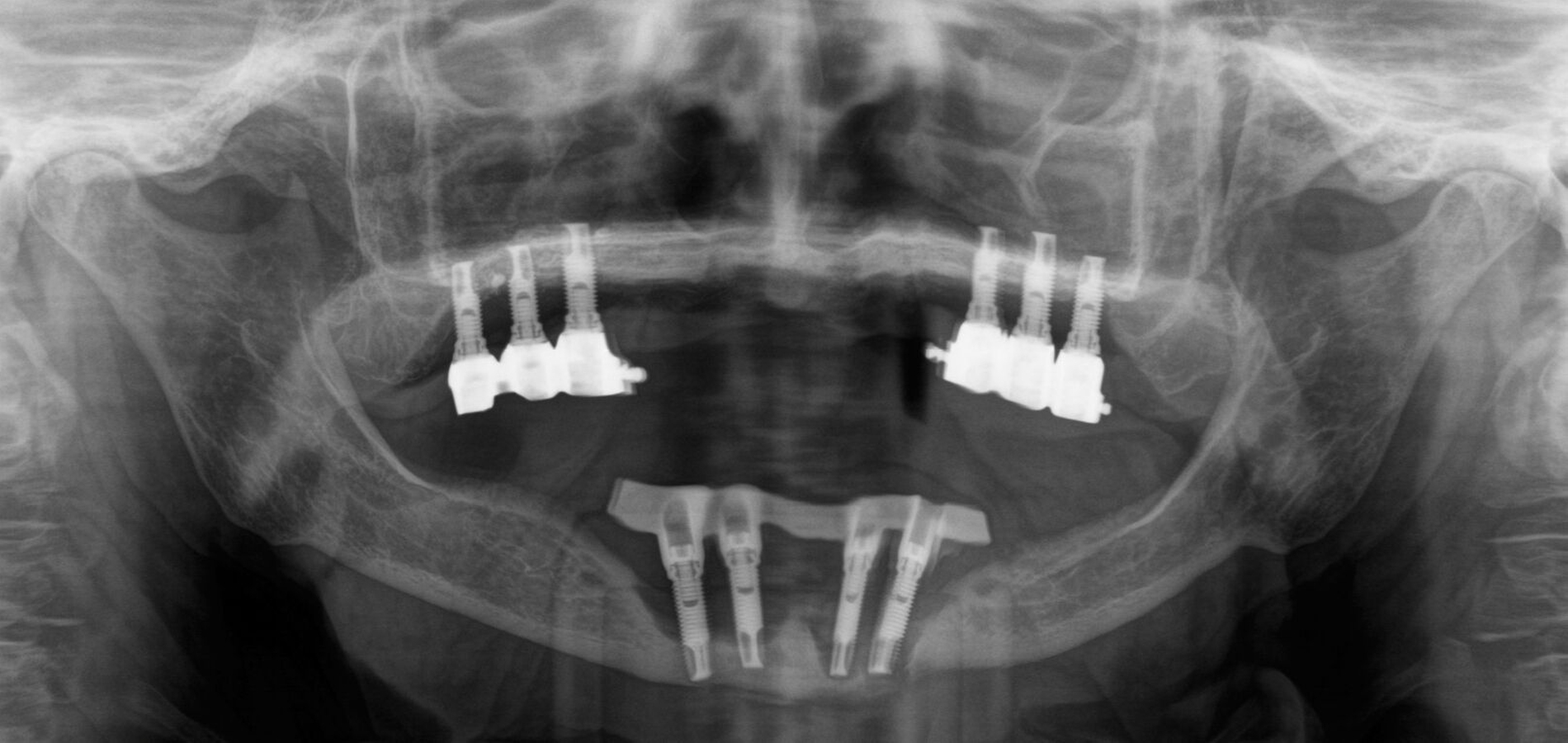
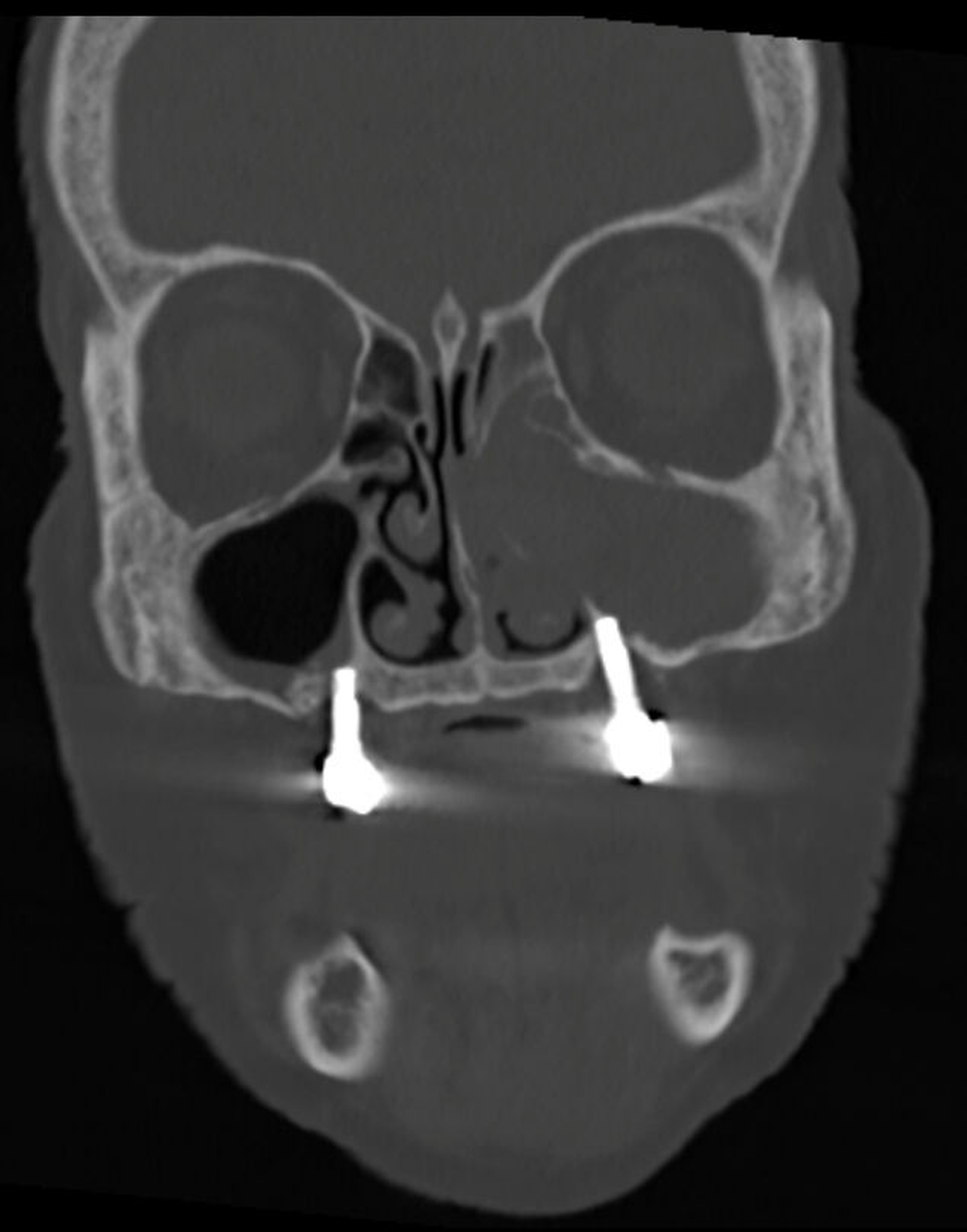
In der Panoramaschichtaufnahme zeigten sich an allen Implantaten ausgeprägte Knocheneinbrüche. Die Implantate in regio 33 und 32 waren vollständig von Osteolysesäumen umgeben, distal des Implantats in regio 33 stellte sich eine knöcherne Unterbrechung des Unterkiefers dar. Die anschließend angefertigte CT-Bildgebung des Unterkiefers und der Nasennebenhöhlen zeigte ausgeprägte osteolytische Säume um alle Implantate im Ober- und Unterkiefer mit einer knöchernen Unterbrechung des corpus mandibulae in regio 33. Weiterhin kamen weichgewebedichte Verschattungen beider Kieferhöhlen (links vollständig, rechts basal) und des sinus frontalis et ethmoidalis links, die mit einer chronischen Sinusitis vereinbar waren, zur Darstellung.
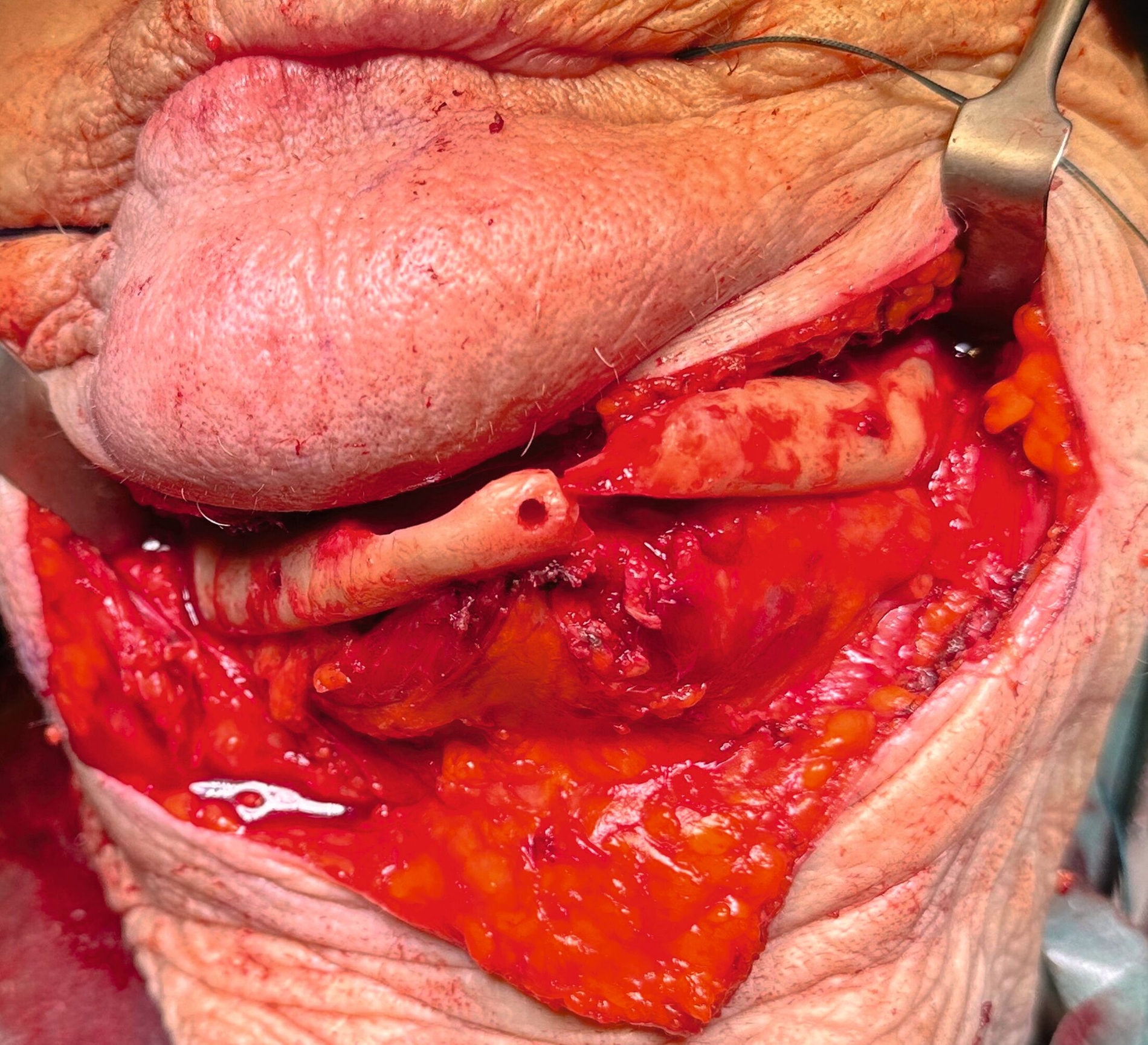
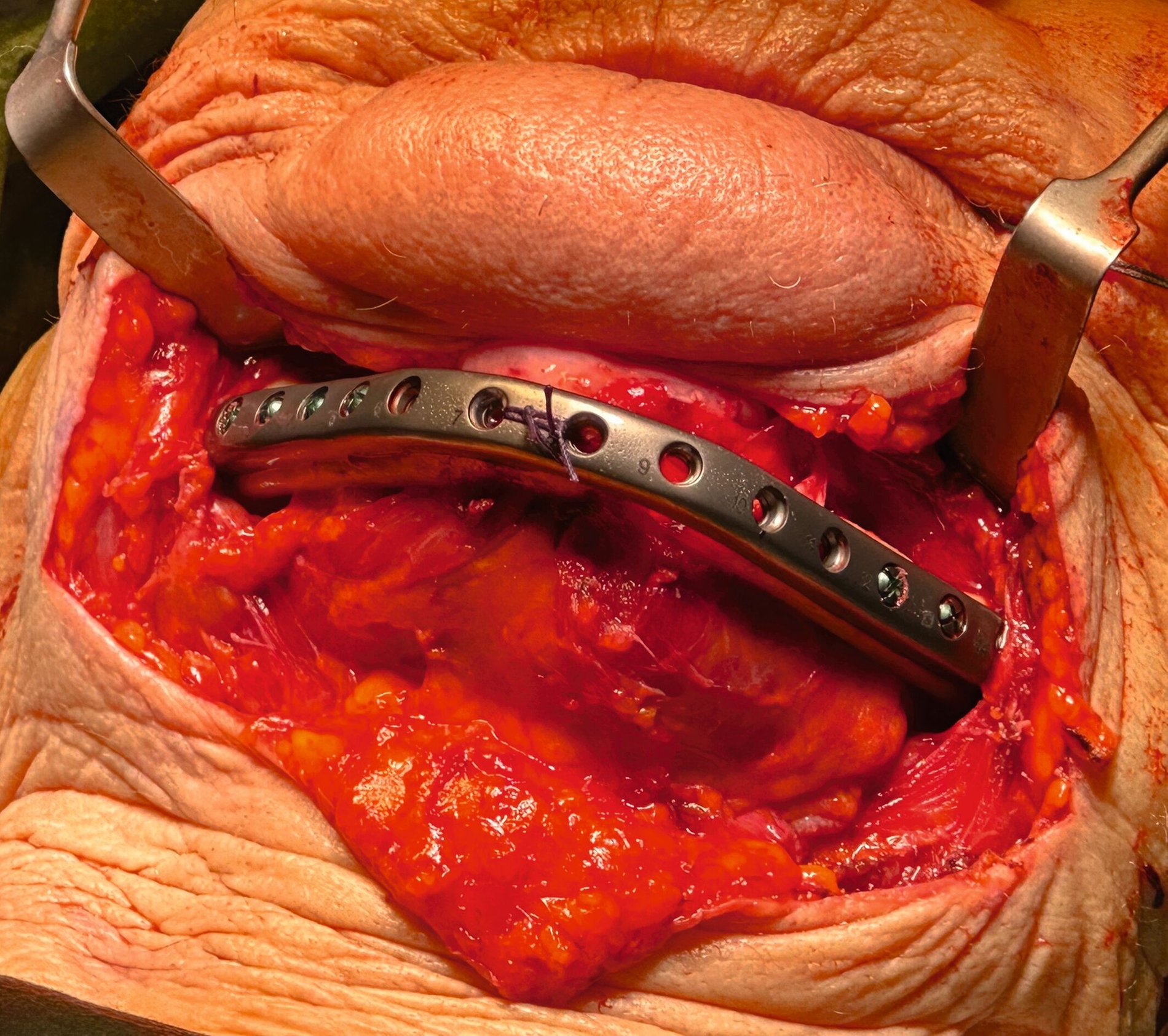
Nach anästhesiologischer Vorbereitung wurde in Allgemeinanästhesie eine Explantation aller Implantate mit Dekortikation und Entfernung des entzündlich veränderten Knochens durchgeführt. Die osteosynthetische Versorgung des Unterkiefers erfolgte mit einer patientenspezifischen Rekonstruktionsplatte. Im Oberkiefer wurde über die nach Explantation entstandenen Mund-Antrum-Verbindungen eine beidseitige Kieferhöhlenrevision in Kombination mit einer Infundibulotomie beidseits durchgeführt. Die Ethmoidalzellen und die Stirnhöhle links wurden im selben Eingriff von den Kollegen der Hals-Nasen-Ohrenheilkunde endoskopisch revidiert. Knochen- und Weichgewebeproben des Ober- und Unterkiefers und aus den Nasennebenhöhlen wurden der histopathologischen Untersuchung zugeführt. Die Wunden wurden speicheldicht verschlossen und die Patientin wurde für fünf Tage über eine nasogastrale Sonde ernährt, um die Wundheilung nicht zu gefährden. Der postoperative Verlauf war komplikationslos. Im weiteren Verlauf soll die Patientin mit einer schleimhautgetragenen Totalprothese versorgt werden. Eine erneute Implantatinsertion ist aufgrund des kompromittierten Allgemeinzustandes und der extrem schwierigen anatomischen Voraussetzungen als fraglich zu bewerten.
Diskussion
Obwohl die dentale Implantologie mit hohen Überlebens- und Erfolgsraten von über 90 Prozent einhergeht, treten dennoch regelmäßig Komplikationen auf [Schiegnitz et al., 2021; Steigenga et al., 2003]. Hierbei werden mechanische, technische und biologische Komplikationen unterschieden. Zu den mechanischen Komplikationen zählen Schraubenlockerungen, Schrauben- und Implantatfrakturen sowie die Dezementierung von Implantatkronen. Frakturen des Gerüsts, der Suprakonstruktion und der Verblendkeramik zählen zu den technischen Komplikationen. Daneben gehören bakterielle Infektionen, sensorische Störungen und die periimplantären Erkrankungen zu den biologischen Komplikationen [Hanif et al., 2017; Groß K et al., 2019].Nach der aktuellen Klassifikation parodontaler und periimplantärer Erkrankungen werden periimplantäre Gesundheit, periimplantäre Mukositis, Periimplantitis und periimplantäre Hart- und Weichgewebedefizite unterschieden. Eine Periimplantitis ist definiert als entzündlicher Zustand der periimplantären Mukosa mit fortschreitendem Verlust des Knochens. Ätiologisch sind periimplantäre Erkrankungen nahezu immer Plaque- und Biofilm-assoziiert [Berglundh, 2017]. Sowohl die periimplantäre Mukositis als auch die Periimplantitis stellen sich klinisch zunächst mit unspezifischen Entzündungszeichen wie Rötung oder Schwellung dar. Ein klinisches Diagnosekriterium für beide Erkrankungen ist die Blutung auf Sondierung (BOP+). Der periimplantäre Pusaustritt grenzt die Periimplantitis klinisch von der periimplantären Mukositis ab. Eine Zunahme der Sondierungstiefen im Vergleich zum Vorbefund oder von mehr als 2 mm ist diagnostisch wegweisend für eine Periimplantitis.
Es werden patientenabhängige und implantatbezogene Risikofaktoren unterschieden [Ramanauskaite et al., 2018; Schwarz et al., 2021]. Zu den systemischen Risikofaktoren für eine Periimplantitis zählen eine reduzierte Mundhygiene, eine chronische Parodontitis in der Vorgeschichte und unregelmäßige beziehungsweise fehlende zahnärztliche Kontroll- und Vorsorgeuntersuchungen. Auch wenn die genauen Auswirkungen von Rauchen und Diabetes mellitus auf das Krankheitsbild der Periimplantitis bislang noch nicht abschließend geklärt werden konnten, sollten dennoch ein Rauchverzicht und eine adäquate Blutzuckereinstellung angestrebt werden. Daneben gibt es Hinweise, dass Zementreste, eine reduzierte periimplantäre keratinisierte Gingiva und eine Überkonturierung der Implantatprothetik das Risiko für die Entstehung einer Periimplantitis erhöhen können [Schwarz et al., 2021; Schwarz et al., 2018]. Erhärtet sich bei der klinischen Befunderhebung der Verdacht auf eine Periimplantitis, sollte weitere röntgenologische Diagnostik mittels Panoramaschichtaufnahme, Zahnfilm- oder Bissflügelaufnahme zur Diagnosesicherung und Therapieplanung erfolgen. Zwar ist mithilfe der digitalen Volumentomographie (DVT) eine detaillierte Beurteilung der Defektmorpholgie möglich, generell zählt die DVT jedoch nicht zur Standarddiagnostik einer Periimplantitis [Berglundh et al, 2018; Schwarz et al., 2021; Golubovic et al., 2012]. Im Gegensatz dazu sollte bei Verdacht auf eine Fraktur des Gesichtsschädels in jedem Fall eine 3-D-Bildgebung (CT oder DVT) durchgeführt werden.
Therapeutisch werden gemäß der aktuellen S3-Leitlinie „Die Behandlung periimplantärer Infektionen an Zahnimplantaten“ folgende nichtchirurgische Verfahren empfohlen [DGI DGZMK, 2022]: Bei einer manifesten Periimplantitis sollten alternative Verfahren wie Er:YAG-Laser oder Glycin basiertes Air-Polishings die manuelle Instrumentierung mit Implantatküretten ergänzen - auch eine Monotherapie mittels Er:YAG-Laser oder Glycin gestützten Air-Polishings kann zum Einsatz kommen. Daneben sind Mundhygieneaufklärung und -instruktion, sowie engmaschige Nachsorgeintervalle mit einer Re-evaluation des Behandlungsergebnisses nach spätestens sechs Monaten von entscheidender prognostischer Bedeutung.
Ziel der konservativen Periimplantitistherapie ist die Elimination von Blutung und Suppuration und die Reduktion der Sondierungstiefen. Der adjuvante Einsatz von lokalen oder systemischen Antibiotika wird in der nichtchirurgischen Therapie derzeit nicht empfohlen. Kann mit einer nichtchirurgischen Behandlung das Therapieziel nicht erreicht werden, sollten chirurgische Maßnahmen eingeleitet werden. Die Grundlage der chirurgischen Therapie bildet ebenfalls die Kontrolle der Risikofaktoren mit Verbesserung der Mundhygiene, die Säuberung der Implantatoberfläche mit Entfernung des Biofilms durch Titanbürsten oder Glycinpulver basiertes Air-Polishing und die Resektion des Entzündungsgewebes [DGI DGZMK, 2022; Toma et al., 2019]. Resektive Verfahren werden von rekonstruktiven und kombinierten Maßnahmen unterschieden, wobei rekonstruktive Verfahren zu bevorzugen sind. Die rekonstruktive Therapie mit Augmentation des Defekts (zum Beispiel mit bovinem Knochenersatzmaterial) eignet sich insbesondere bei mehrwandigen Defekten und bei einem ausreichenden Angebot an periimplantärer keratinisierter Gingiva. Demgegenüber kann bei suprakrestal gelegenen Defekten die Kombination aus einer Exzision des taschenbildenden Weichgewebes, modellierender Osteotomie und Implantoplastik, definiert als vollständige Glättung des exponierten Implantatgewindes, als resektive Therapiemaßnahme zur Anwendung kommen. Ultima ratio ist die Explantation, die bei einer Lockerung des Implantats, bei gravierenden mechanischen oder technischen Komplikationen oder bei Ausbreitung einer periimplantären Infektion in umliegende anatomische Strukturen indiziert ist [DGI DGZMK, 2022].
Schwerwiegende Komplikationen, die über die Notwendigkeit der Explantation beziehungsweise des Implantatverlustes hinausgehen, treten weniger häufig auf. Dazu zählen ausgedehnte Logenabszesse, wie zum Beispiel sub- oder perimandibuläre Abzesse nach Perforation der basolingualen Unterkieferkortikalis eines fehlpositionierten Implantats. Weiterhin kann eine Fehlpositionierung des Implantats zu einer Schädigung des N. alveolaris inferior mit einem Sensibilitätsverlust im Innervationsgebiet des Nerven führen. Daneben gibt es Berichte von Osteomyelitiden nach Implantatinsertionen, die einen Verlust der Unterkieferkontinuität zur Folge hatten und eine mikrovaskuläre Rekonstruktion erforderten [Schlund et al., 2017]. Es werden sogar Abszesse nach Implantation mit einer Ausbreitung nach intrakraniell oder mediastinal beschrieben [Cariati et al., 2019; Steiner et al., 2021]. Die Ausbreitung nach intrakraniell ist durch eine fortgeleitete Infektion über die Nasennebenhöhlen möglich. Auch im vorliegenden Fall hat sich eine chronische odontogene Pansinusitis entwickelt.
Rund zehn bis 40 Prozent der Sinusitiden entstehen aufgrund eines odontogenen Fokus. Die häufigste Ursache einer odontogenen Sinusitis ist die Mund-Antrum-Verbindung, gefolgt von der apikalen Parodontitis – Implantate stellen einen Anteil von circa fünf Prozent und Sinusaugmentationen von circa zwei Prozent [Krimmel et al., 2019; Troeltzsch et al., 2015]. Bei Verdacht auf eine odontogene Sinusitis maxillaris sollte die klinische Fokussuche durch bildgebende Verfahren (zum Beispiel Panoramaschichtaufnahme, DVT) ergänzt werden, präoperativ ist eine dreidimensionale Bildgebung erforderlich. Therapeutisch reicht zumeist die zahnärztliche Fokussanierung aus [Longhini und Ferguson, 2011]. Betrifft die ursächliche Pathologie die Kieferhöhle oder sind ventilationsverbesserde Maßnahmen oder eine Drainage erforderlich, sollte eine Kieferhöhlenoperation über einen transoralen Zugang erfolgen. Bei Ausbreitungstendenz oder kompromittierten Patienten kann das chirurgische Vorgehen, gegebenenfalls auch im Rahmen eines stationären Aufenthaltes, (i.v.-) antibiotisch unterstützt werden [Krimmel et al., 2019; Zirk et al., 2017].
Die als weitere Extremkomplikation aufgetretene pathologische Unterkieferfraktur ist definiert als Unterkieferfraktur, die aufgrund einer Schwächung des Knochens durch einen pathologischen Prozess bei physiologischer Krafteinwirkung (zum Beispiel beim Kauen) entstanden ist. Ursachen dieser Knochendestabilisierung sind zumeist Tumoren, Metastasen, Zysten, eine Osteomyelitis, Osteoradionekrose oder Medikamenten-assoziierte Kiefernekrose, aber auch eine vorangegangene Weisheitszahnentfernung kann den Unterkiefer dermaßen destabilisieren, dass dieser unter normaler Kaubelastung frakturiert. Pathologische Unterkieferfrakturen stellen einen Anteil von weniger als zwei Prozent aller Unterkieferfrakturen dar, eine Unterkieferfraktur aufgrund einer Periimplantitis ist eine äußerst seltene Entität [Boffano et al., 2013]. In der Literatur werden nur wenige Fälle beschrieben, die zusätzlich häufig mit weiteren ursächlichen Nebendiagnosen, wie zum Beispiel der Einnahme von Antiresorptiva oder einer Strahlentherapie, einhergingen. Daneben können eine tiefe bikortikale Implantatinsertion, ein breiter Implantatdurchmesser und ein bereits vorbestehender atropher zahnloser Unterkiefer das Risiko für eine Periimplantitis-assoziierte Unterkieferfraktur möglicherweise erhöhen [Naval-Gías et al., 2015; O'Sullivan et al., 2006; Almasri et al., 2012].
Der hier dargestellte Fall zeigt eindrücklich, welches Ausmaß die häufige Komplikation der Periimplantitis bei unzureichender Mundhygiene und ausbleibender zahnärztlicher Kontrolle unter bestimmten Voraussetzungen annehmen kann. Die Prävention solch schwerwiegender Komplikationen beginnt bereits vor der implantologischen Versorgung mit der Reduktion von Risikofaktoren, der Schaffung adäquater Mundhygieneverhältnisse und der Therapie parodontaler Erkrankungen. Daneben haben die präoperative Implantatplanung und die chirurgischen Fähigkeiten des Behandlers einen entscheidenden Einfluss auf die Vermeidung von Komplikationen. Nach implantologischer und prothetischer Versorgung dient die lebenslange Nachsorge der Aufrechterhaltung der Mundhygiene und der frühzeitigen Diagnose sowie Therapie einer Periimplantitis, wodurch schwerwiegende Komplikationen vermieden werden können. Besonders bei älteren Patientinnen und Patienten mit einer eingeschränkten Mundhygiene und limitierten Möglichkeiten der Implantatpflege kann die implantologische Kontrolle und Nachsorge von ganz besonderer Bedeutung sein und eine spezielle Herausforderung darstellen.
Fazit für die Praxis
Die Mundhygiene ist ein entscheidender Faktor in der Prävention der Periimplantitis.
Nicht-chirurgische Therapieregime werden von chirurgischen unterschieden. Die Kontrolle der auslösenden Faktoren und die Implantatdekontamination bilden die Grundlage aller Maßnahmen.
Führt die nicht-chirurgische Therapie nicht zum gewünschten Therapieerfolg, sollte frühzeitig die chirurgische Therapie zur Anwendung kommen.
Wenn es die Defektsituation zulässt, sollte bei richtiger Indikation ein regeneratives Vorgehen angestrebt werden.
Nach einer implantologischen Versorgung ist die Etablierung einer engmaschigen Nachsorge mit zahnärztlichen Kontrollterminen in regelmäßigen Abständen zur frühzeitigen Diagnose und leitliniengerechten Therapie einer Periimplantitis lebenslang erforderlich.
Literaturliste
Almasri, M. and M. El-Hakim, Fracture of the anterior segment of the atrophic mandible related to dental implants. Int J Oral Maxillofac Surg, 2012. 41(5): p. 646-9.
Berglundh, T., et al., Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol, 2018. 45 Suppl 20: p. S286-s291.
Boffano, P., et al., Pathological mandibular fractures: a review of the literature of the last two decades. Dent Traumatol, 2013. 29(3): p. 185-96.
Cariati, P., et al., Massive Bilateral Neck Abscess and Acute Mediastinitis Following Dental Implant Surgery. J Craniofac Surg, 2019. 30(6): p. 1840-1841.
DGI, DGZMK: „Periimplantäre Infektionen an Zahnimplantaten, Behandlung“, Langfassung, Version 2.0, 2022, AWMF-Registriernummer: 083 - 023, www.awmf.org/leitlinien/detail/ll/083-023.html, (Zugriff am: 22.03.2023)
Golubovic, V., et al., Accuracy of cone-beam computed tomography to assess the configuration and extent of ligature-induced peri-implantitis defects. A pilot study. Oral Maxillofac Surg, 2012. 16(4): p. 349-54.
Groß, K., M. Mathias Schmidt, and D. Groß, „Indication first“: Die zahnärztliche Implantologie aus ethischer Sicht. Implantologie, 2019. 27/1 p. S. 7–18.
Hanif, A., et al., Complications in implant dentistry. Eur J Dent, 2017. 11(1): p. 135-140.
Krimmel, M., et al., S2k-Leitlinie Odontogene Sinusitis maxillaris. AWMF Leitlinien-Register, 2019. 007-086.
Longhini, A.B. and B.J. Ferguson, Clinical aspects of odontogenic maxillary sinusitis: a case series. Int Forum Allergy Rhinol, 2011. 1(5): p. 409-15.
Naval-Gías, L., et al., Pathological mandibular fracture: A severe complication of periimplantitis. J Clin Exp Dent, 2015. 7(2): p. e328-32.
O'Sullivan, D., P. King, and D. Jagger, Osteomyelitis and pathological mandibular fracture related to a late implant failure: a clinical report. J Prosthet Dent, 2006. 95(2): p. 106-10.
Ramanauskaite, A., K. Becker, and F. Schwarz, Clinical characteristics of peri-implant mucositis and peri-implantitis. Clin Oral Implants Res, 2018. 29(6): p. 551-556.
Schiegnitz, E., et al., Clinical long-term and patient-reported outcomes of dental implants in oral cancer patients. Int J Implant Dent, 2021. 7(1): p. 93.
Schlund, M., et al., Mandibular Osteomyelitis Following Implant Placement. J Oral Maxillofac Surg, 2017. 75(12): p. 2560.e1-2560.e7.
Schwarz, F., et al., Periimplantäre Infektionen – ein Update mit Ausblick. Zahnärztliche Mitteilungen, 2021. 3/2021.
Schwarz, F., et al., Peri-implantitis: Summary and consensus statements of group 3. The 6th EAO Consensus Conference 2021. Clin Oral Implants Res, 2021. 32 Suppl 21: p. 245-253.
Schwarz, F., et al., Peri-implantitis. J Periodontol, 2018. 89 Suppl 1: p. S267-s290.
Steigenga, J.T., et al., Dental implant design and its relationship to long-term implant success. Implant Dent, 2003. 12(4): p. 306-17.
Steiner, C., G.B. Bottini, and A. Gaggl, Brain abscess caused by dental peri-implantitis. Br J Oral Maxillofac Surg, 2021. 59(1): p. 109-110.
Toma, S., M.C. Brecx, and J.F. Lasserre, Clinical Evaluation of Three Surgical Modalities in the Treatment of Peri-Implantitis: A Randomized Controlled Clinical Trial. J Clin Med, 2019. 8(7).
Troeltzsch, M., et al., Etiology and clinical characteristics of symptomatic unilateral maxillary sinusitis: A review of 174 cases. J Craniomaxillofac Surg, 2015. 43(8): p. 1522-9.
Zirk, M., et al., Odontogenic sinusitis maxillaris: A retrospective study of 121 cases with surgical intervention. J Craniomaxillofac Surg, 2017. 45(4): p. 520-525.