50 Jahre Clindamycin
Clindamycin wurde bereits in den 1960er-Jahren als Nachfolger des Lincomycins entwickelt [Magerlein et al., 1966]. Auch 50 Jahre später erweist es sich bei ausgewählten Indikationen als wertvolles Therapeutikum, etwa zur Behandlung von Patienten mit Penicillinallergie. In der Zahnheilkunde wird es häufig verwendet, mehr als 60 Prozent aller Verordnungen in Deutschland stammen aus dem zahnärztlichen Bereich [Halling, 2016]. Dies steht im Widerspruch zu den offiziellen Empfehlungen, die als Mittel der ersten Wahl Penicilline aufführen [Lode et al., 2006; Schindler & Stahlmann, 2014]. Auch im internationalen Vergleich ist die hohe Verordnungsrate von Clindamycin im zahnmedizinischen Bereich auffällig, denn in anderen Ländern liegt der Anteil in der Regel deutlich unter 10 Prozent [Segura-Egea et al., 2017]. Dies nehmen wir zum Anlass, dieses Arzneimittel aus aktueller Sicht näher zu betrachten und seine heutige Position zu bestimmen.
Wirkspektrum und Resistenz
Clindamycin hemmt die bakterielle Proteinsynthese durch Beeinflussung der Ribosomen, woraus ein bakteriostatischer Effekt resultiert. Bei sehr empfindlichen Stämmen und hohen Wirkstoffkonzentrationen kann es auch bakterizid wirken. Mehrere Mechanismen sind bekannt, durch die Erreger resistent gegen Clindamycin werden können. Am bedeutsamsten ist die Veränderung in der ribosomalen RNA durch Methylierung von Adenin. Dieser Mechanismus ist meist Plasmid-kodiert und kann zum Beispiel bei klinisch wichtigen Erregern wie S. aureus, S. pyogenes oder B. fragilis vorkommen.
Zum Wirkungsspektrum gehören grampositive Bakterien und Anaerobier. Clindamycin besitzt eine gute Aktivität gegen Staphylokokken, auch wenn diese Penicillinase bilden. Die Methicillin-resistenten S.-aureus-Stämme (MRSA), mit denen heute auch im ambulanten Bereich gerechnet werden muss, sind allerdings ganz überwiegend auch gegen Clindamycin resistent [Walter et al., 2017]. In der Zahnmedizin spielt vor allem die Aktivität gegen Anaerobier in Mischinfektionen eine Rolle. Auch bei einigen Anaerobiern (zum Beispiel B. fragilis) bestehen jedoch häufig hohe Resistenzraten, die regional sehr unterschiedlich sein können.
Es gibt nur wenige aktuelle Publikationen aus Deutschland, die eine Beurteilung der Resistenzsituation von Erregern odontogener Infektionen ermöglichen. Eine retrospektive Auswertung der bakteriellen Erreger einer odontogenen Sinusitis maxillaris wurde in Köln durchgeführt [Zirk et al., 2017]. Vorherrschend wurden grampositive anaerobe Erreger nachgewiesen. Das Parenteralpenicillin Piperacillin/Tazobactam zeigte die beste antibakterielle Aktivität (93 Prozent empfindlich), 80 Prozent wurden durch Ampicillin/Sulbactam erfasst und 50 Prozent durch Clindamycin. Auch in einer weiteren Studie bei schwerwiegenden odontogenen Infektionen wurden durch Ampicillin/Sulbactam mehr Erreger erfasst, als durch Clindamycin (99 Prozent versus 77 Prozent) [Zirk et al., 2017].
Resorption und Elimination
Die empfohlene Dosierung beim Erwachsenen beträgt 1,2 bis 1,8 g oral täglich aufgeteilt in vier Einzeldosen. Clindamycin wird fast vollständig resorbiert. Etwa eine Stunde nach einer Einzeldosis von 300 mg liegen die Konzentrationen im Blut bei 3,6 mg/l und fallen auf einen mittleren Wert von 1,1 mg/l fünf Stunden später. Clindamycin wird überwiegend hepatisch metabolisiert und mit einer Halbwertszeit von etwa zwei bis drei Stunden primär mit den Fäzes und zu etwa einem Drittel mit dem Urin eliminiert. Mindestens fünf Tage lang ist im Stuhl die antibakterielle Aktivität nachweisbar, was mit einer Beseitigung der sensiblen Flora verbunden ist und häufig zur Diarrhö führt. Der Effekt ist mindestens 14 Tage nach einer Behandlung nachweisbar. Die mittleren Konzentrationen im Stuhl zeigten eine erhebliche interindividuelle Variabilität und nehmen mit der Behandlungsdauer deutlich zu [Kager et al., 1981].
Verteilung im Gewebe, Knochengängigkeit
Clindamycin gilt als gut gewebe- beziehungsweise knochengängig. Bei 30 Patienten, die vor einer Hüftgelenksoperation mehrere Dosen von jeweils 300 mg Clindamycin intramuskulär erhalten hatten, lagen die Konzentrationen eine Stunde nach der letzten Injektion im Serum bei 7,33 ± 3,37 mg/l, im Knochen wurde weniger als die Hälfte (2,63 ± 1,76 mg/kg) gemessen [Nicholas et al., 1975]. Dieses Ergebnis ist typisch: In den meisten Arbeiten betrugen die Gewebekonzentrationen etwa 40 bis 50 Prozent der Serumkonzentrationen. Dieses Verhältnis ist erwartungsgemäß stark abhängig vom zeitlichen Abstand nach der Einnahme, an dem die Konzentrationen ermittelt wurden.
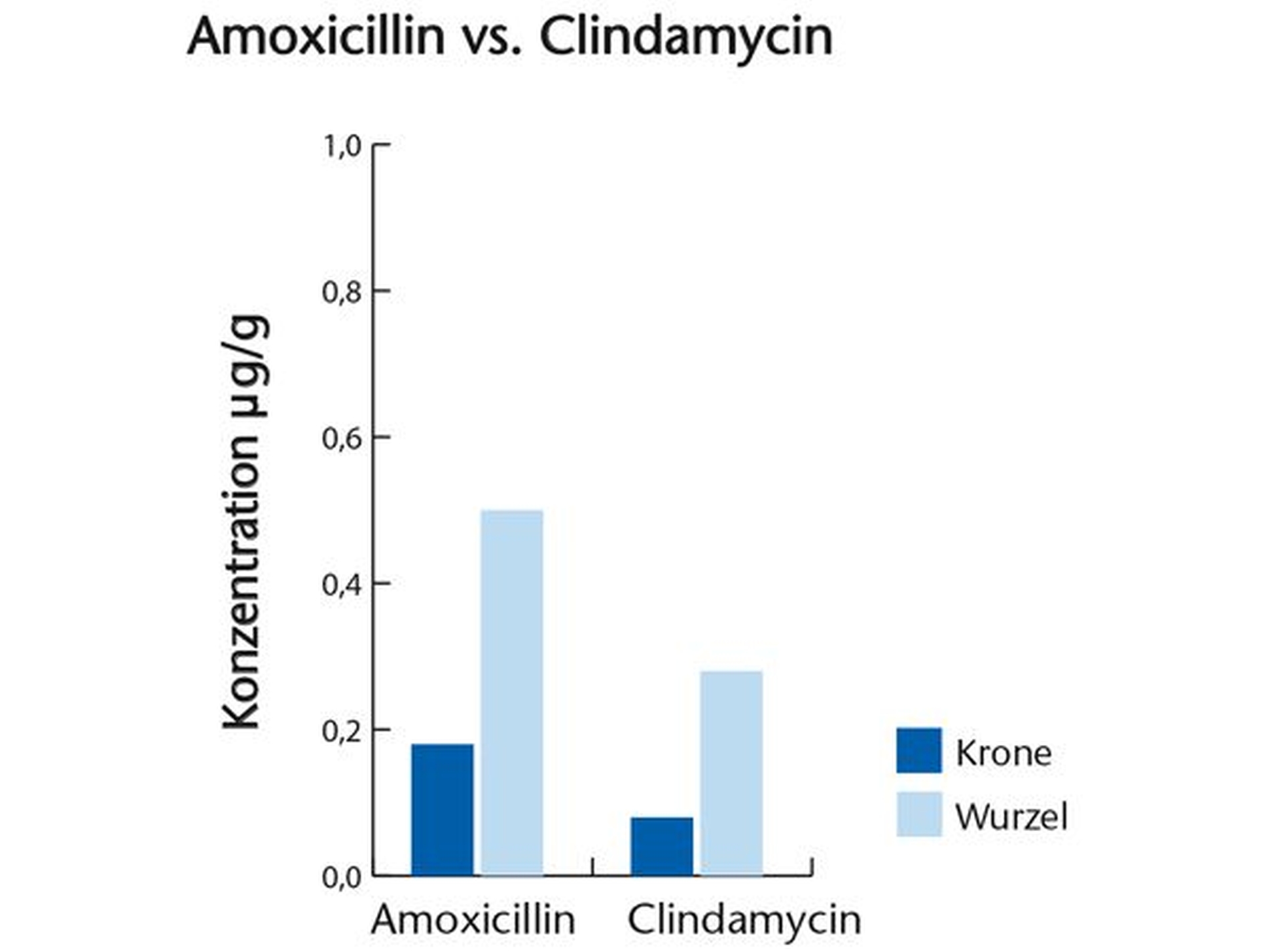
In einer ausführlichen aktuellen Literaturrecherche konnten wir etwa ein Dutzend Arbeiten identifizieren, in denen Originaldaten zur Frage der Knochengängigkeit von Clindamycin publiziert wurden. Die überwiegende Zahl der Untersuchungen stammt aus den 1970er-Jahren. Studien, in denen die Knochengängigkeit mit anderen Antibiotika bei einer ausreichenden Zahl von Patienten verglichen wird, gibt es nicht beziehungsweise sie sind wenig aussagekräftig aufgrund methodischer Mängel. Oft nahmen nur wenige Patienten an den Studien teil. Von besonderem Interesse für die Zahnheilkunde ist eine vergleichende Studie über die Konzentrationen von Clindamycin in Zähnen. Bei hoher interindividueller Variabilität lagen die Konzentrationen von Clindamycin niedriger als die von Amoxicillin. Allerdings war die verabreichte Dosis von Amoxicillin etwa dreifach höher als die von Clindamycin.
Clindamycin gehört zu einer Gruppe von klassischen Antibiotika, mit denen einerseits eine langjährige therapeutische Erfahrung besteht, andererseits aber die verfügbaren Daten aus klinischen Studien sehr limitiert sind. In den vergangenen 20 Jahren sind die Anforderungen für neue Antibiotika durch die zuständigen Behörden sehr ausführlich und präzise formuliert worden. Klinische Daten, die dem heute geforderten Standard entsprechen, sind für Clindamycin nicht vorhanden. Die schlechte Datenlage bei den klinischen Studien erschwert eine rationale Beurteilung des therapeutischen Stellenwerts des Antibiotikums. Auch der weit verbreitete Einsatz des Medikaments in der Zahnheilkunde ist nicht durch umfangreiche kontrollierte Studien belegt, obwohl laut Fachinformation SOBELIN® das Arzneimittel bei akuten und chronischen Infektionen des Zahn- und Kieferbereichs durch Clindamycin-empfindliche Erreger indiziert ist [Pfizer, 2017].
Unerwünschte Wirkungen
Eine Therapie mit Clindamycin ist relativ häufig mit unerwünschten Wirkungen verbunden. In den Statistiken der Arzneimittelkommission Zahnärzte nimmt es regelmäßig eine „führende Rolle“ ein [Schindler et al., 2016]. Durch Beeinflussung der Darmflora treten Übelkeit und Diarrhöen häufig auf bis hin zur immer wieder auch von Zahnärzten gemeldeten pseudomembranösen Enterokolitis als schwerwiegender und potenziell lebensbedrohlicher Komplikation. Gelegentlich steigen unter Clindamycin die Bilirubin- und Leberenzymwerte im Blut an. Überempfindlichkeitsreaktionen verlaufen meist mit masernähnlichem Exanthem, Juckreiz und/oder arzneimittelbedingtem Fieber; sehr selten sind schwere Allgemeinreaktionen (etwa Stevens-Johnson-Syndrom).
Fazit
Clindamycin ist ein lang bekanntes Antibiotikum, das im zahnärztlichen Bereich in Deutschland sehr häufig angewandt wird. Zum Wirkungsspektrum gehören vor allem grampositive und anaerobe Bakterien. Nach oraler Gabe ist die Resorption nahezu vollständig, die Gewebegängigkeit ist relativ gut. Die Elimination erfolgt vorwiegend durch hepatische Metabolisierung mit einer Halbwertzeit von zwei bis drei Stunden. Clindamycin ist für ein breites Spektrum von Infektionen zugelassen. Die mikrobiologischen und pharmakologischen Daten unterstützen den Einsatz des Antibiotikums bei Infektionen durch grampositive und anaerobe Bakterien. Umfangreiche klinische Vergleichsstudien, wie sie mit neueren Antibiotika üblich sind, liegen bis heute nicht vor. Die Therapie mit Clindamycin sollte – auch unter Berücksichtigung der nicht optimalen gastrointestinalen Verträglichkeit – nur nach sorgfältiger Abwägung der Vor- und Nachteile erfolgen. In der Zahnheilkunde wird es vor allem bei Patienten mit Penicillinallergie empfohlen.
Prof. Dr. med. Ralf Stahlmann
Institut für Klinische Pharmakologie und Toxikologie
Charité-Universitätsmedizin Berlin
Luisenstr. 7, 10117 Berlin
ralf.stahlmann@charite.de
Dr. Juliane Gösling, MPH
Referentin Abteilung Zahnärztliche Berufsausübung
Bundeszahnärztekammer
Chausseestr. 13, 10115 Berlin
j.goesling@bzaek.de
Prof. Dr. med. Christoph Schindler
Clinical Research Center Hannover
Medizinische Hochschule Hannover
Feodor-Lynen-Straße 15, 30625 Hannover
schindler.christoph@mh-hannover.de