Probiotika für die PAR-Therapie
Die Rolle der Biofilme in der Parodontitis-Ätiologie
Ungeachtet des klinisch sichtbaren Erfolgs einer regelmäßig wiederholten, unspezifischen Reinigung der Zähne von anhaftenden bakteriellen Belägen als Standardverfahren in der Therapie und Prävention parodontaler Erkrankungen belegen aktuelle Forschungsergebnisse mittlerweile zweifelsfrei, dass nicht das Aufwachsen einer kritischen Masse an Keimen die eigentliche Ursache parodontaler Entzündungen darstellt, sondern eine dysbiotische Zunahme des Anteils spezifischer proinflammatorisch wirksamer Keime innerhalb der von vielen unterschiedlichen Bakterienarten besiedelten Zahnbeläge. Parodontitisförderliche Keime wie Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Aggregatibacter actinomycetemcomitans und andere sind nach aktueller Evidenz keine externen Infektionskeime, sondern sogenannte Pathobionten [Hajishengallis G, 2015], das heißt, sie sind auch unter physiologischen Bedingungen natürlicher Bestandteil der oralen Mikrobiota. Nur wenn ihr relativer Anteil innerhalb der den Zähnen aufsitzenden, polymikrobiellen Biofilme ein kritisches Maß übersteigt, kommt es zum Auftreten klinisch relevanter Entzündungssymptome. Als zentrale Ursachen für ein solches proinflammatorisch wirkendes Überwachsen wurde zum einen die vermehrte Verfügbarkeit proteinreicher bakterieller Substrate, zum anderen eine verminderte kompetitive Hemmung der entzündungsförderlichen Problemkeime durch andere Bakterienarten im Biofilm identifiziert.
Konditionen, die mit einer systemischen Zunahme der Entzündungslast sowie der Entzündungsbereitschaft des Körpers verbunden sind – wie etwa Adipositas und das hiermit häufig vergesellschaftete Metabolische Syndrom, regelmäßiger Tabakkonsum, chronischer psychosozialer Stress, aber auch das Vorliegen einer Schwangerschaft – , führen in der Regel zum Ansteigen bakteriell metabolisierbarer Proteine in Sulkusfluid und Speichel [Wu et al., 2015].
Das Konzept der system-relevanten Schlüsselkeime
Die Ursachen für die verminderte kompetitive Hemmung parodontitisassoziierter Bakterien durch andere Keime im Biofilm können ebenfalls vielfältig sein. So erhöht beispielsweise eine einseitig fett- und kohlenhydratlastige Fehlernährung nicht nur die systemische Entzündungslast im Körper, sondern hat auch negative Auswirkungen auf die bakterielle Diversität der oralen und der intestinalen Mikrobiota [Fang S, Evans RM, 2013]. Dabei kann bereits das Fehlen oder Verschwinden einer einzelnen Bakterienart gravierende Folgen haben. Mazmanian et al. [2008] konnten beispielsweise in einem Modellversuch an gnothobiotischen Mäusen durch die gezielte Besiedlung des Darmes der Versuchstiere mit dem gramnegativen, proinflammatorischen Bakterium Helicobacter hepaticus vorhersagbar die Entstehung von Darmulzera provozieren. Wurde der Darm der Versuchstiere jedoch zeitgleich zusätzlich mit Bacteroides fragilis, einem weiteren gramnegativen Darmkeim, beimpft, blieb die Entstehung von Ulzera aus. Als Ursache für den durch B. fragilis vermittelten Schutzeffekt wurde ein spezifisches Kohlenhydrat, das sogenannte Polysaccharid A (PSA) in der Zellwand von B. fragilis identifiziert, das nach der Aufnahme durch immunkompetente dendritische Zellen diese dazu veranlasste, nachfolgend selektiv die Ausreifung entzündungshemmender T-Zellpopulationen sowie die Produktion des entzündungsauflösenden Botenstoffs Interleukin-10 zu fördern. Hierdurch wurde – im Sinne einer Gegenregulation – die Stärke der durch die proinflammatorisch wirkenden Antigene von H. hepaticus ausgelösten Entzündungsreaktion im Darm so weit reduziert, dass sich keine Darmulzera mehr bildeten. Neben B. fragilis konnten zwischenzeitlich weitere, mutmaßliche Schlüsselkeime identifiziert werden, denen eine zentrale Rolle bei der Erhaltung einer entzündungsfreien, friedlichen Koexistenz zwischen oralen oder intestinalen Keimen und den Zellen des mukosalen Immunsystems zugeschrieben wird.
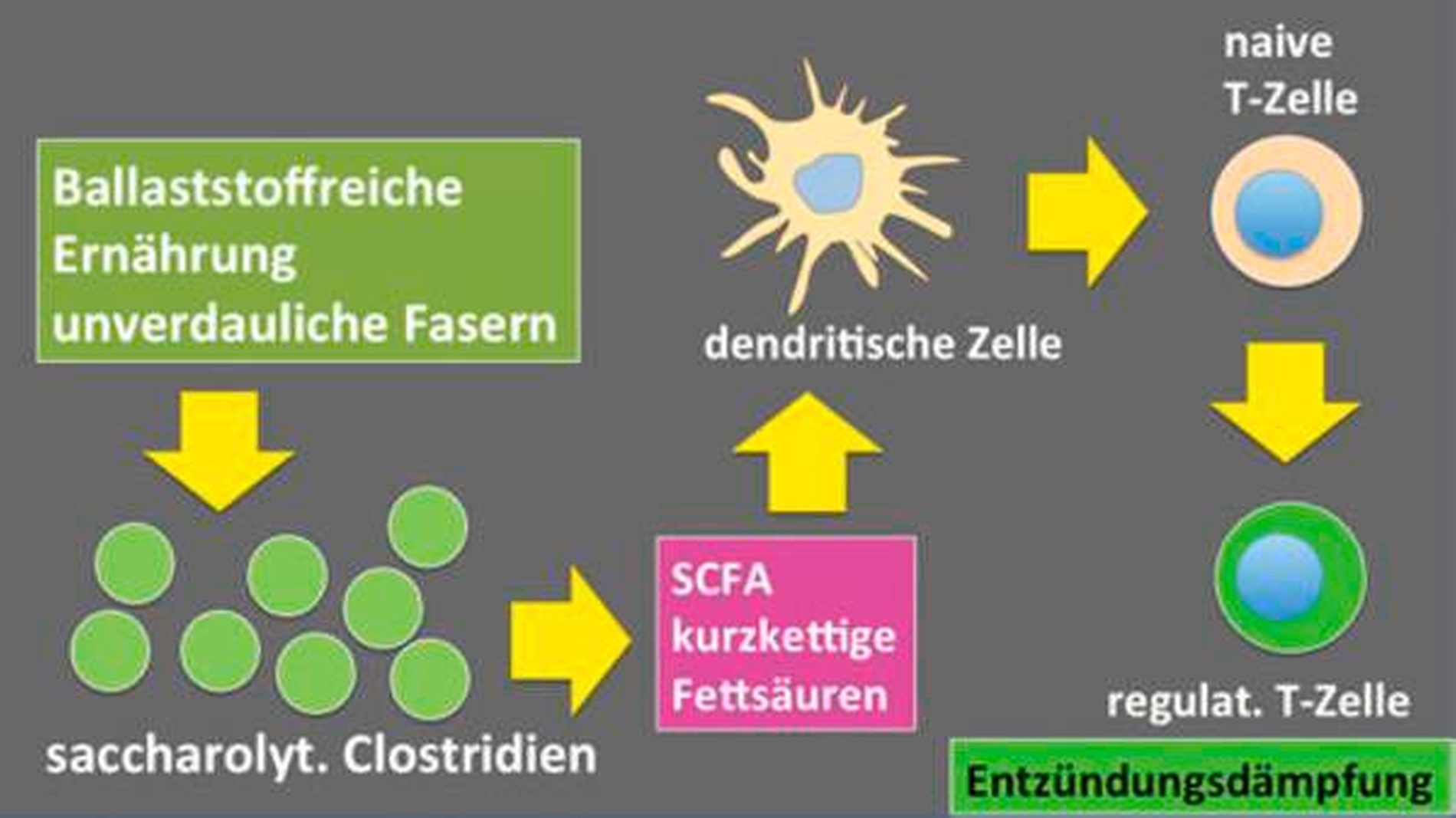
Ob Schlüsselkeime in einem gegebenen Wirt gute Lebensbedingungen finden, wird nach verfügbarem Wissen in nicht geringem Maß durch die Ernährung beeinflusst. So ist beispielsweise schon seit Längerem bekannt, dass der Konsum einer faser- und ballaststoffreichen Diät gesundheitsförderliche Auswirkungen hat. Erst neuere Untersuchungen enthüllten jedoch, dass beispielsweise faserreiche Ballaststoffe das Wachstum saccharolytischer Clostridienarten im Darm begünstigen, die die Ballaststoffe zu kurzkettigen Fettsäuren (short chain fatty acids; SCFAs) metabolisieren. Hohe SCFA-Konzentrationen im Blut wiederum stimulieren die vermehrte Ausreifung entzündungsdämpfender, regulatorischer CD4+ Foxp3+ T-Zellen und damit die Hemmung chronischer Entzündungen [Fung TC et al., 2014.] (Abbildung 1).
Nahrungsmittel, die – wie die faserreichen Ballaststoffe nach bakterieller Metabolisierung – den Gesundheitsstatus positiv beeinflussen können, werden auch als Präbiotika bezeichnet. Das Ideal eines ursachengerichteten Ansatzes zur Prävention und Kontrolle der Parodontitis wie auch anderer, mit bakteriellen Dysbiosen assoziierter chronisch-entzündlicher Erkrankungen wäre daher aus aktueller Sicht ein Ernährungs- und Lebensstil, der das Wachstum von Schlüsselkeimen optimal fördert und schädliche proinflammatorische Stimuli (wie etwa Übergewicht, chronischen Stress und Tabakkonsum) konsequent meidet. Gravierendere Umstellungen im Lebens- und Ernährungsstil sind jedoch aufgrund der Komplexizität humaner psychosozialer Strukturen häufig nur sehr schwer dauerhaft realisierbar.
Daher kann es pragmatisch sinnvoll sein, fehlende Schlüsselkeime beispielsweise in Form eines bakterienhaltigen Joghurts direkt mit der Nahrung zuzuführen. Die Nützlichkeit eines solchen Vorgehens ist als medizinisches Erfahrungswissen in vielen Völkern und Kulturen bekannt und hat beispielsweise in Japan eine Jahrhunderte alte Tradition. Mikroorganismen mit gesundheitsfördernder Wirkung, die eine Passage durch die Säure des Magens unbeschadet überstehen, werden unter dem Begriff Probiotika zusammengefasst. Zu ihnen zählen verschiedene Laktobazillenspezies, Bifidobakterien, aber auch eukaryonte Mikroorganismen (wie etwa probiotisch wirksame Stämme der Bier- oder Backhefe Saccharomyces cervisiae).
Die positive Wirkung der Probiotika kann dabei zum einen von einer direkten kompetitiven Hemmung pathogener Keime durch antibakteriell wirksame bakterielle Metabolite wie Peroxid, Nitrit oder spezifische Bakteriozine ausgehen, aber auch, wie zuvor für die Präbiotika beschrieben, auf einer gesundheitsförderlichen Modulation des Aktivierungsstatus der Zellen des mukosalen Immunsystems beruhen. Frei verkäufliche Probiotika enthalten ausschließlich apathogene Keime und sind formal keine Medikamente, sondern Nahrungsergänzungsmittel, für deren Zulassung in Europa nicht die European Medicines Agency (EMA), sondern die European Food Safety Authority (EFSA) zuständig ist. Diese verbot im Jahr 2012 für alle auf dem Markt befindlichen Probiotika mit einem konkreten Gesundheitsversprechen wie „stärkt die Abwehrkräfte“ oder „... hilft bei Erkältungen“ zu werben (Abbildung 2).
Ursache hierfür war das Urteil einer EFSA-Expertengruppe, die nach eingehenden Recherchen zum Schluss kam, dass für keines der kommerziell erhältlichen Probiotika eine ausreichende wissenschaftliche Evidenz vorliegt, um die Existenz einer signifikanten gesundheitsförderlichen Wirkung bei gesunden Individuen zweifelsfrei nachweisen zu können. Die fehlende Evidenz für eine gesundheitsförderliche Wirkung probiotischer Lebensmittel aus dem Supermarkt bei systemisch Gesunden, sollte jedoch nicht mit einem fraglichen Nutzen probiotischer Präparate bei erkrankten Personen gleichgesetzt werden. So ist beispielsweise die Gabe probiotischer Zubereitungen bei Dysbiosen des Darms eine seit vielen Jahren auch in der wissenschaftlichen Medizin etablierte Therapieoption, deren Wirksamkeit sehr gut untersucht ist [Parker et al., 2017].
Im Bereich der wissenschaftlichen Zahnheilkunde war die Anwendung von Probiotika hingegen lange Zeit wenig geläufig bis unbekannt. Es findet sich mittlerweile jedoch auch in der zahnärztlichen Literatur eine beständig steigende Zahl von Publikationen, die eine klinisch relevante Wirkung probiotische Zubereitungen auf die Ausprägung chronischer Entzündungsprozesse im Mund zweifelsfrei belegen. Insbesondere zu den Auswirkungen des Konsums spezifischer probiotischer Lactobacillus-reuteri-Stämme im Bereich parodontaler Erkrankungen ist zwischenzeitlich eine ganze Reihe in erstrangigen medizinischen und zahnmedizinischen Fachjournalen publizierter Untersuchungen verfügbar. So konnten beispielsweise Twetman et al. [2009] in einer Kohorte von Individuen mit stark ausgeprägter Gingivitis allein durch den 14-tägigen, regelmäßigen Konsum L.-reuteri-haltiger Kaugummis einen ausgeprägten Rückgang der gingivalen Sondierungsblutung beobachten, ohne dass dabei zeitgleich ein Versuch unternommen worden wäre, die defizitäre Mundhygiene der Studienteilnehmer zu verbessern. Eine von meiner Abteilung in Kollaboration mit der Frauenklinik des Universitätsklinikums Würzburg durchgeführte Interventionsstudie an Schwangeren mit manifester Schwangerschaftsgingivitis [Schlagenhauf U et al., 2016] bestätigte die Ergebnisse von Twetman et al.:
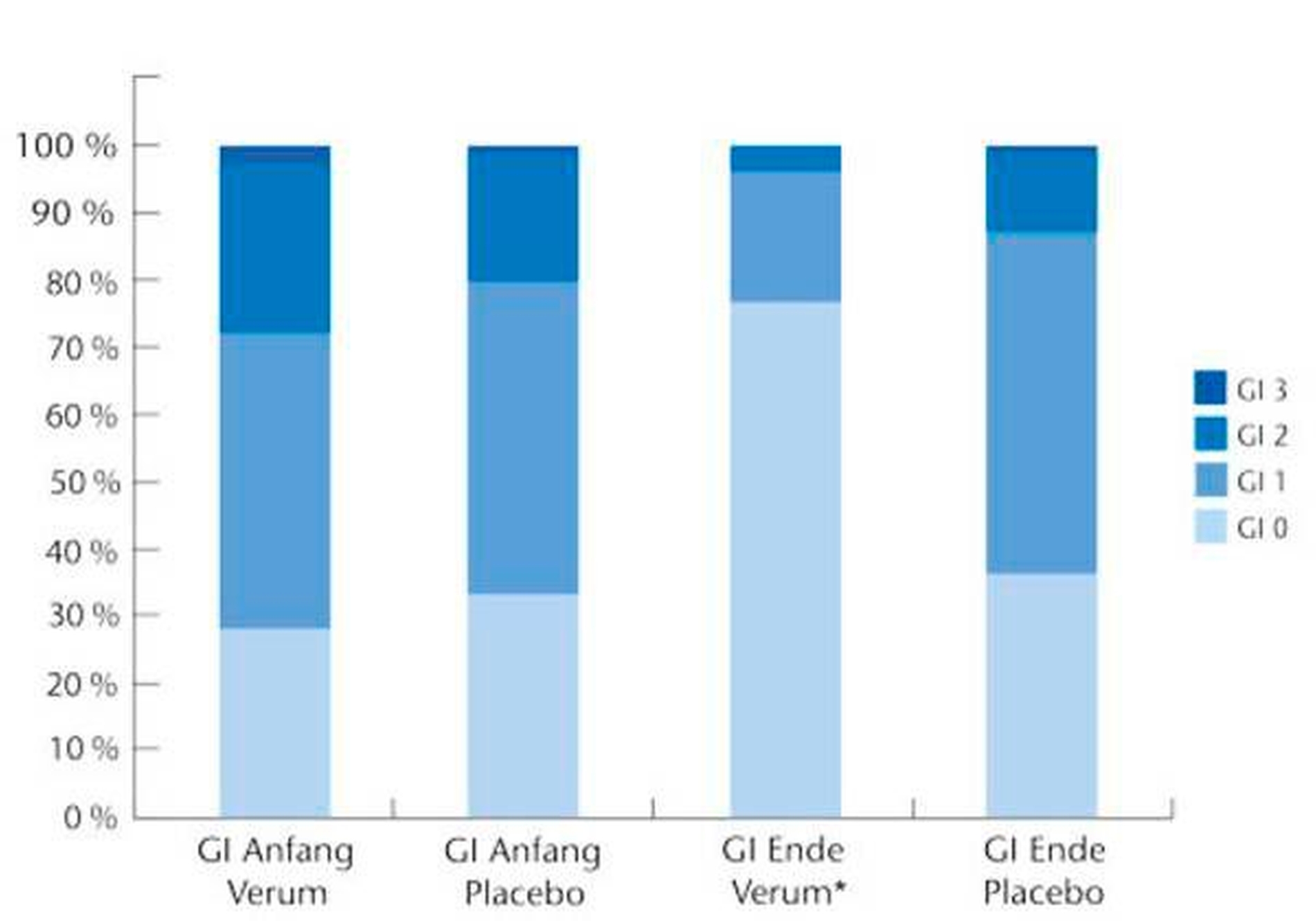
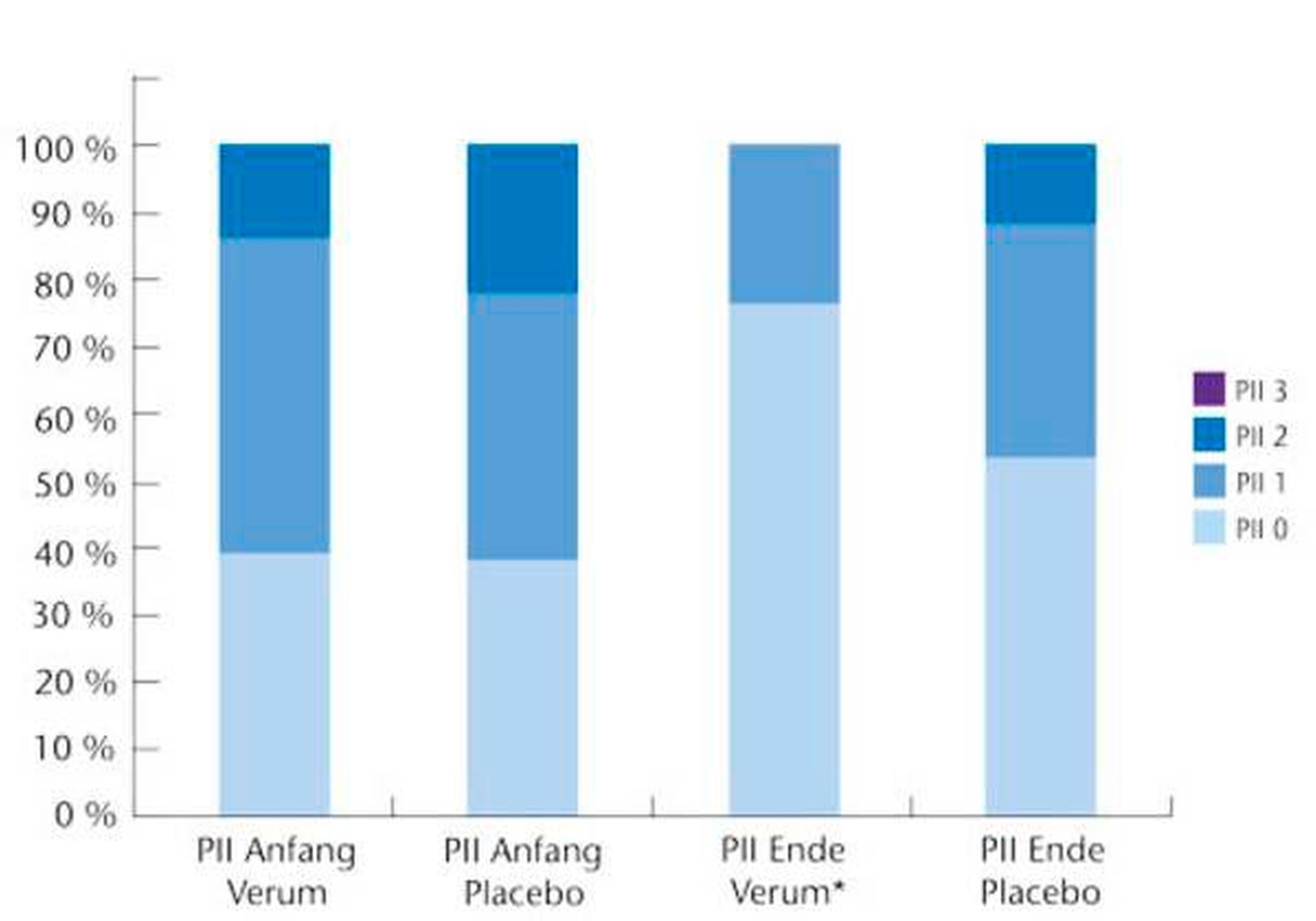
Nach sechswöchigem Konsum L.-reuteri-haltiger Lutschtabletten zeigte sich in der Testgruppe eine ganz ausgeprägte Reduktion der gingivalen Entzündung im Vergleich zur Ausgangssituation, während in der Placebogruppe nur geringe, nicht signifikante Veränderungen zu verzeichnen waren (Abbildung 3). Obwohl auch in dieser Studie den Teilnehmerinnen keinerlei Instruktionen zur Optimierung ihrer in der Regel verbesserungsbedürftigen häuslichen Zahnpflege gegeben wurde, reduzierte sich unter dem Einfluss von L. reuteri die Plaquebedeckung der Zähne in der Testgruppe auf ein Drittel des Ausgangswertes, während wiederum für die Placebogruppe nur eine geringe, nichtsignifikante Reduktion der Plaquebedeckung beobachtet werden konnte (Abbildung 4). Dies bestätigte auf eindrucksvolle Weise, dass die Stärke einer gingivalen Entzündung und die hierdurch modulierte Verfügbarkeit von Blut und Sulkusfluid als bakteriellen Substraten, die Wachstumsrate bakterieller Biofilme entscheidend beeinflusst.
Auch die Auswirkungen des Konsums L.-reuteri-haltiger Lutschtabletten auf die Abheilung parodontaler Läsionen nach systematischer Parodontaltherapie mittels Scaling und Root Planing waren bereits Gegenstand einer größeren, kontrollierten Interventionsstudie [Teughels W et al., 2013]. Sie offenbarte, dass Patienten, die in der Abheilungsphase nach Scaling und Root Planing über drei Monate hinweg regelmäßig L.-reuteri-haltige Lutschbonbons konsumiert hatten, zum Zeitpunkt der Reevaluation einen signifikant höheren mittleren Attachmentgewinn aufwiesen als die Patienten der Kontrollgruppe, die im Beobachtungszeitraum nur geschmacksidentische Placebo-Lutschtabletten regelmäßig zu sich genommen hatten.
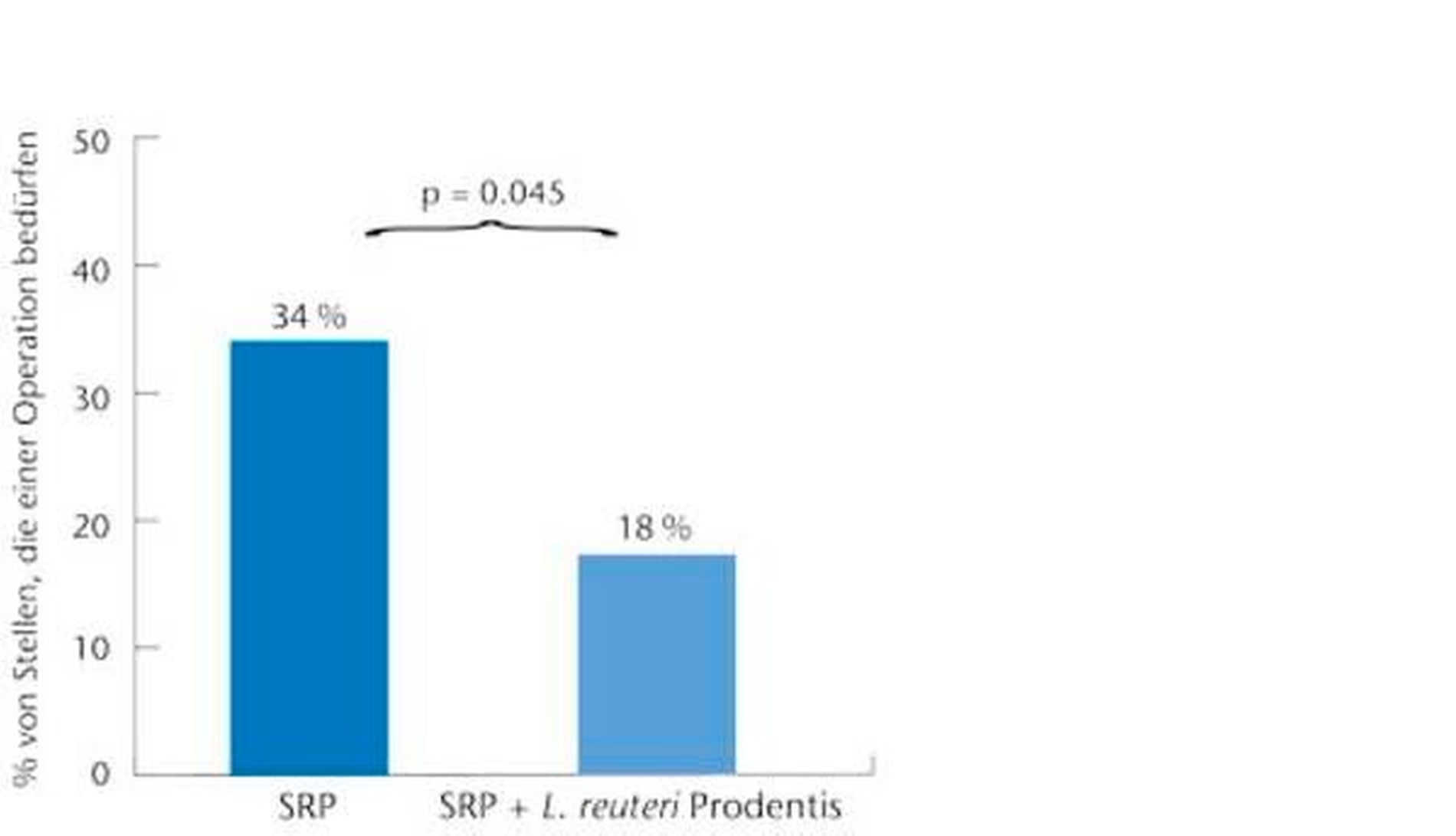
Auch der Prozentsatz an Zähnen mit weiterem Therapiebedarf aufgrund residualer Taschen > 5 mm lag zum Zeitpunkt der Reevaluation in der Testgruppe mit durchschnittlich 17 Prozent signifikant niedriger als in der Placebogruppe, in der noch 35 Prozent der Zähne dieses Kriterium aufwiesen (Abbildung 5). Eine tierexperimentelle Studie an Ratten [Poutahidis T et al., 2013] gab inzwischen einen näheren Einblick in die molekularen Mechanismen, die einer Verbesserung der Wundheilung durch den Konsum von L. reuteri zugrunde liegen. Sie konnte nachweisen, dass bereits die Zugabe von L. reuteri ins Trinkwasser der Versuchstiere eine ganz ausgeprägte Steigerung der Abheilung normiert zugefügter Hautwunden nach sich zog, ohne dass dabei L. reuteri in direkten Kontakt mit den Wunden gekommen wäre. Die Analyse der Ursachen ergab, dass der regelmäßige Konsum von L. reuteri zur vermehrten Freisetzung des Neuropeptidhormons Oxytocin führte, das nachfolgend analog zur entzündungsdämpfenden Wirkung kurzkettiger Fettsäuren die Aktivierung CD4+Foxp3+CD25+ immunregulatorischer T-Zellen induzierte.
Nebenwirkungen, Kontraindikationen
Selbst für den Langzeitkonsum probiotischer Zubereitungen sind bislang keine gravierenden Nebenwirkungen bekannt. In seltenen Einzelfällen wurde nach Probiotikakonsum ein Völlegefühl oder das vermehrte Auftreten von Flatulenzen angegeben. Obwohl es keine Berichte über aufgetretene Zwischenfälle gibt, sollten zudem schwerstkranke oder schwer immunkompromitierte Patienten probiotische Produkte nur in Absprache mit dem behandelnden Arzt konsumieren.
Empfehlungen für die Praxis
Die Reduktion oder Prävention parodontaler Entzündungen sowie die Förderung der Wundheilung im Rahmen parodontaler Therapien durch den regelmäßigen Konsum probiotischer Bakterien sind vielversprechende, innovative Ansätze, die das etablierte Standardtherapieverfahren der konsequenten mechanischen Entfernung entzündungsassoziierter bakterieller Biofilme sinnvoll ergänzen können. Da die Verwendung spezifischer probiotischer Stämme in kommerziellen probiotischen Produkten häufig durch Patente geschützt ist, fehlt es nicht an Nachahmerpräparaten, die zwar Keime derselben Art, aber nicht identische Stämme enthalten. Dies ist nicht unproblematisch, da sich zwei unterschiedliche Bakterienstämme der gleichen Art in bis zu 30 Prozent der vorhandenen Gene unterscheiden können und daher Therapieerfolge, die bei Verwendung eines spezifischen probiotisch wirksamen Bakterienstamms beobachtet wurden, sich häufig nicht einfach auf den Einsatz anderer Stämme derselben Art übertragen lassen. Es sollten daher im Zweifelsfall nur solche probiotischen Präparate für den klinischen Gebrauch in Erwägung gezogen werden, deren Wirksamkeit explizit in kontrollierten klinischen Studien mit genügend großen Fallzahlen verifiziert wurde.
Prof. Dr. med. dent. Ulrich Schlagenhauf
Abteilung für Parodontologie in der Poliklinik für Zahnerhaltung und Parodontologie,
Pleicherwall 2, 97070 Würzburg
schlagenha_u@ukw.de
Literaturverzeichnis
1. Hajishengallis G. 2015. Periodontitis: From microbial immune subversion to systemic inflammation. Nat Rev Immunol. 15(1):30-44.
2. Wu M, Chen SW, Jiang SY. 2015. Relationship between gingival inflammation and pregnancy. Mediators Inflamm. 2015:623427.
3. Fang S, Evans RM. 2013. Microbiology: Wealth management in the gut. Nature. 500(7464):538-539.
4. Mazmanian SK, Round JL, Kasper DL. 2008. A microbial symbiosis factor prevents intestinal inflammatory disease. Nature. 453(7195):620-625.
5. Fung TC, Artis D, Sonnenberg GF. 2014. Anatomical localization of commensal bacteria in immune cell homeostasis and disease. Immunol Rev. 260(1):35-49.
6. Parker EA, Roy T, D'Adamo CR, Wieland LS. 2017. Probiotics and gastrointestinal conditions: An overview of evidence from the cochrane collaboration. Nutrition. Jul 6. pii: S0899-9007(17)30135-1. doi: 10.1016/j.nut.2017.06.024. [Epub ahead of print]
7. Twetman S, Derawi B, Keller M, Ekstrand K, Yucel-Lindberg T, Stecksen-Blicks C. 2009. Short-term effect of chewing gums containing probiotic lactobacillus reuteri on the levels of inflammatory mediators in gingival crevicular fluid. Acta Odontol Scand. 67(1):19-24.
8. Schlagenhauf U, Jakob L, Eigenthaler M, Segerer S, Jockel-Schneider Y, Rehn M. 2016. Regular consumption of lactobacillus reuteri-containing lozenges reduces pregnancy gingivitis: An rct. J Clin Periodontol. 43(11):948-954.
9. Teughels W, Durukan A, Ozcelik O, Pauwels M, Quirynen M, Haytac MC. 2013. Clinical and microbiological effects of lactobacillus reuteri probiotics in the treatment of chronic periodontitis: A randomized placebo-controlled study. J Clin Periodontol. 40(11):1025-1035.
10. Poutahidis T, Kearney SM, Levkovich T, Qi P, Varian BJ, Lakritz JR, Ibrahim YM, Chatzigiagkos A, Alm EJ, Erdman SE. 2013. Microbial symbionts accelerate wound healing via the neuropeptide hormone oxytocin. PLoS One. 8(10):e78898