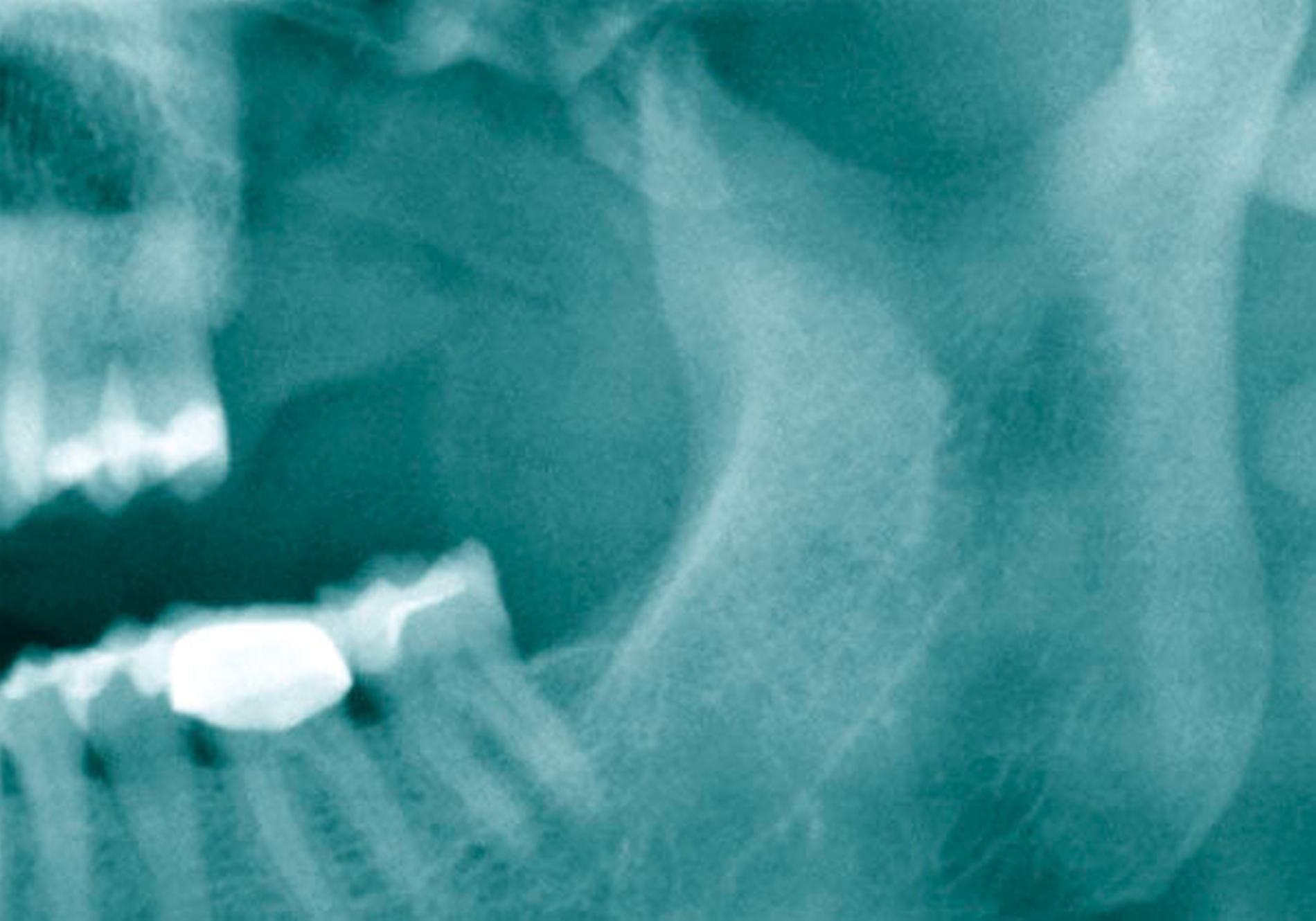
Ameloblastom füllt ganze Kieferhöhle aus
Die 54-jährige Frau wurde mit einem histologisch gesicherten Ameloblastom des linken posterioren Oberkiefers durch einen niedergelassen Oralchirurgen an die Klinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz überwiesen.
Anamnestisch war vor ungefähr sieben Monaten der nicht erhaltungswürdige Zahn 27 durch den Hauszahnarzt extrahiert worden, wobei dieser zusätzlich eine zystische Veränderung entfernt hatte. Die Patientin gab an, damals zunächst keine Schmerzen gehabt zu haben. Auch habe es zu diesem Zeitpunkt keine Komplikationen bei der Wundheilung gegeben. Fünf Monate später habe die Patientin dann bemerkt, dass sich im linken Oberkiefer immer wieder Speisereste ansammelten und sich immer wieder Sekret entleerte.
Besorgt habe sie sich bei ihrem Zahnarzt vorgestellt, der in Regio 27 eine persistierende Mund-Antrum-Verbindung entdeckte. Nach zwei- bis dreiwöchiger Spülung sei sie zur Deckung an einen niedergelassenen Oralchirurgen überwiesen worden, der aus der beschriebenen Region bei unruhigen Wundverhältnissen eine Probe zur histologischen Analyse entnahm und anschließend den plastischen Verschluss unternahm. In der histologischen Analyse stellten sich Anteile eines teils soliden basaloiden, teils plexiformen Ameloblastoms dar.
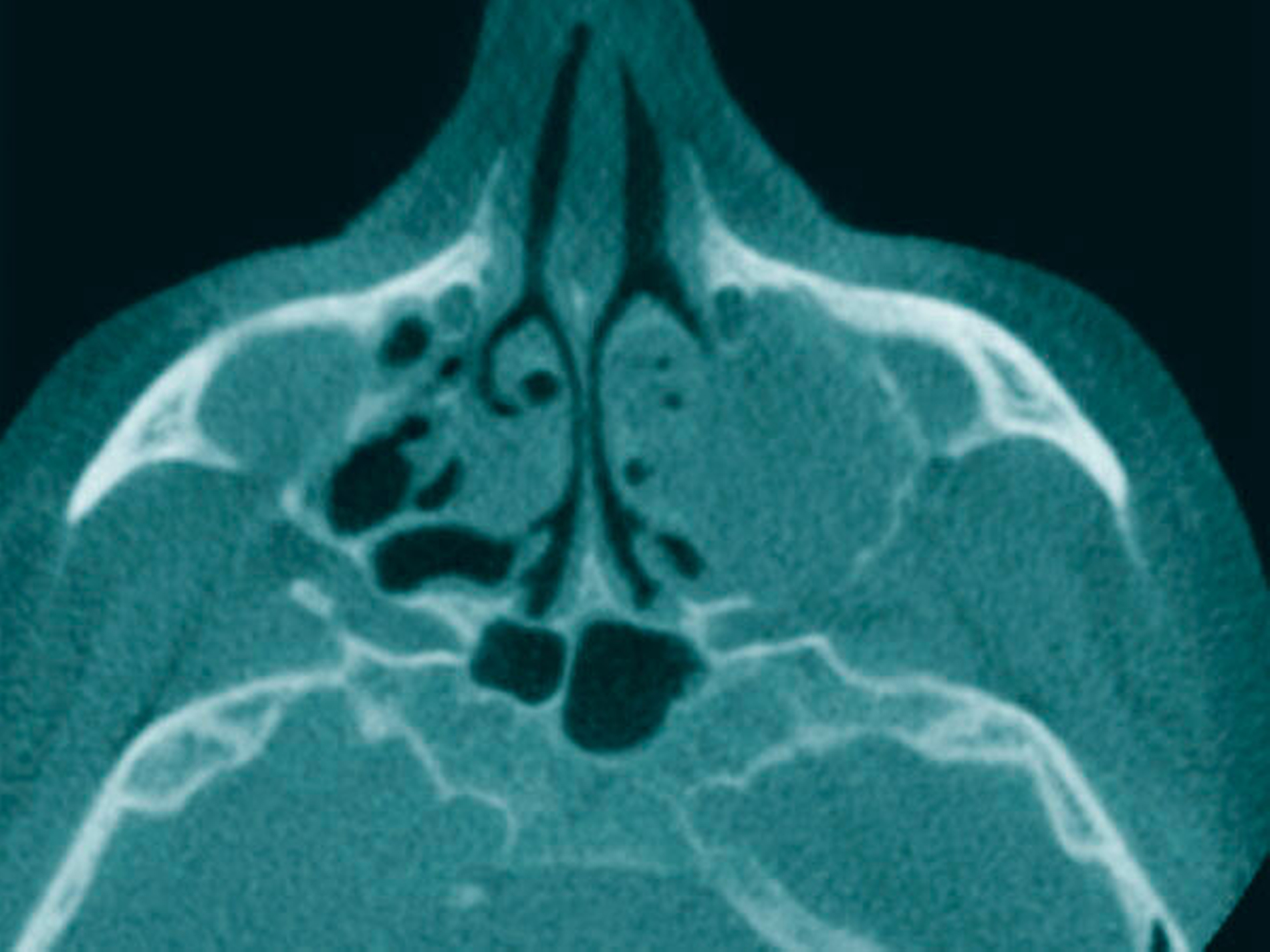
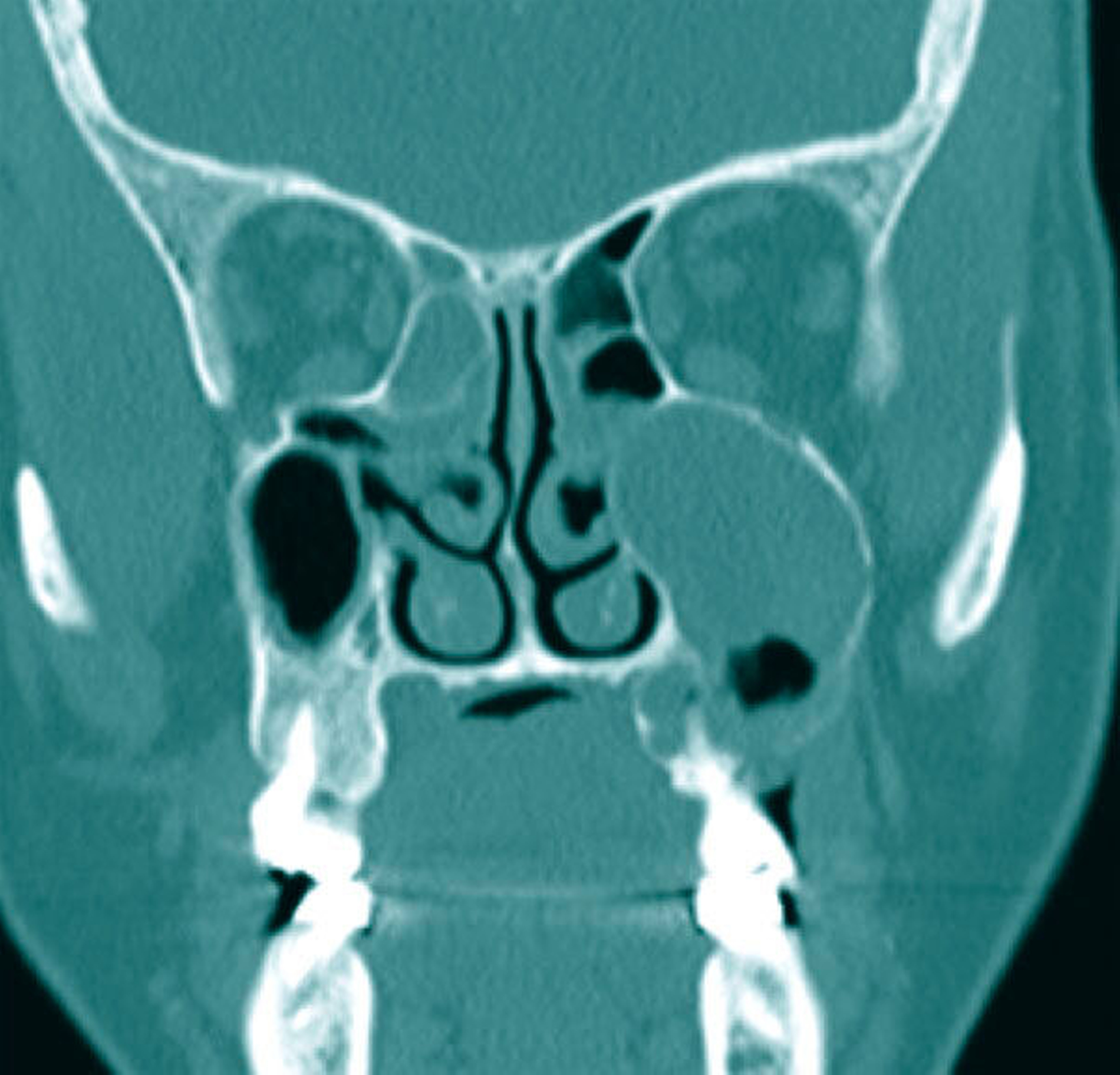
Als sich die Patientin an der Universitätsmedizin vorstellte, erfolgte primär die Anfertigung einer Computertomografie (CT) des Kopfes mit Kontrastmittel, in der sich eine vollständige Verschattung der linken Kieferhöhle sowie eine apikale Transluszenz an Zahn 26 darstellte (Abbildung 1).
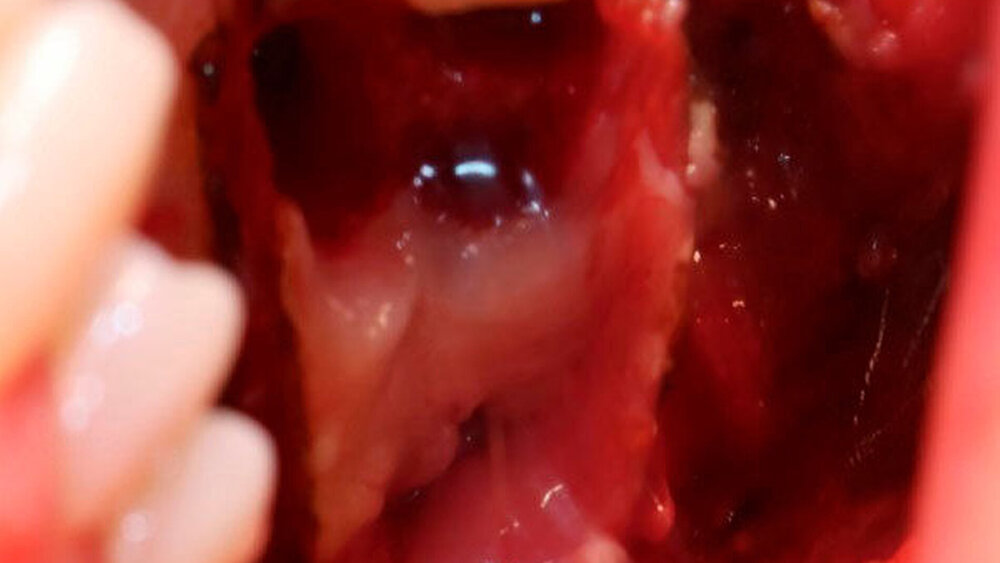
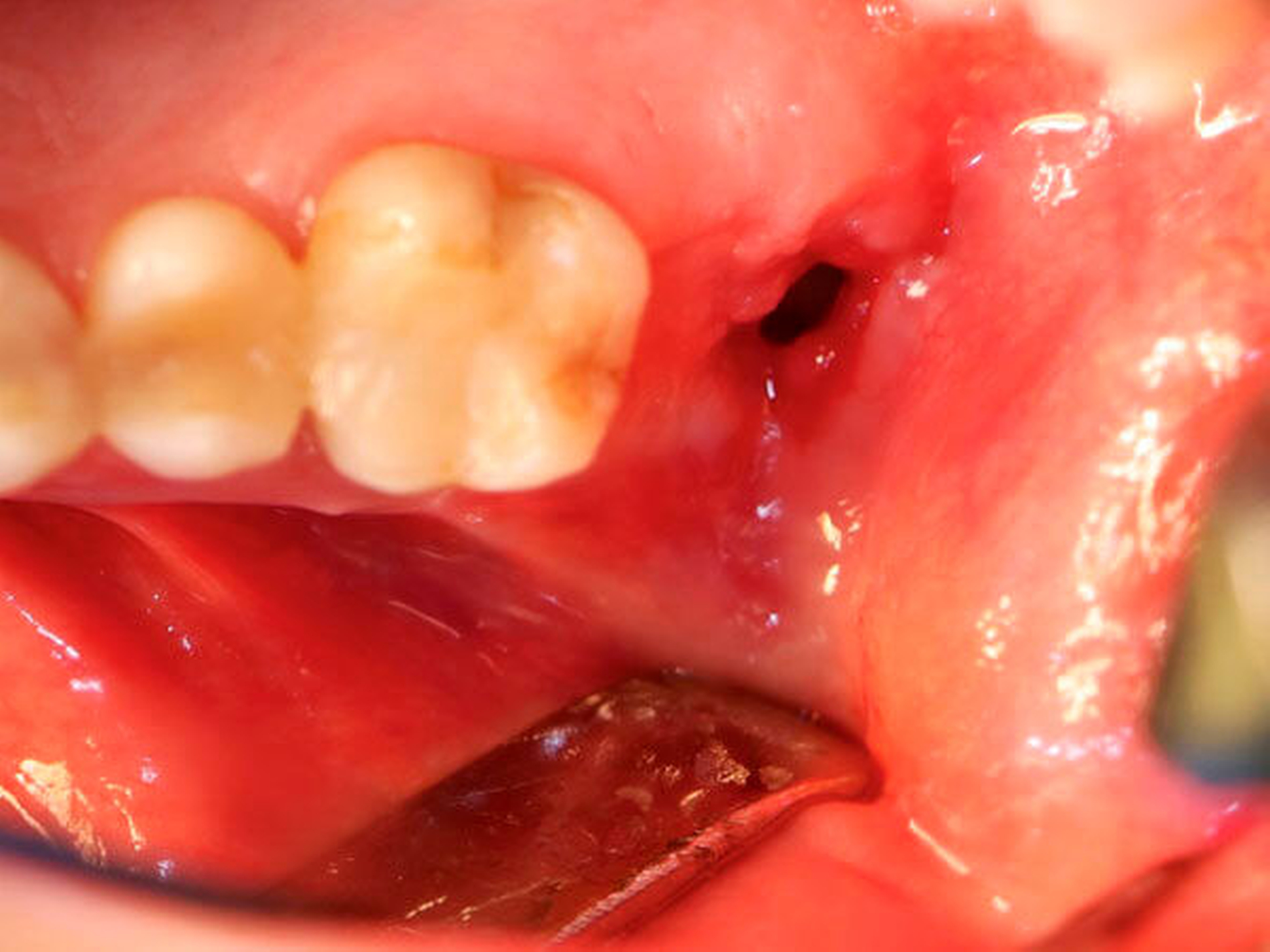
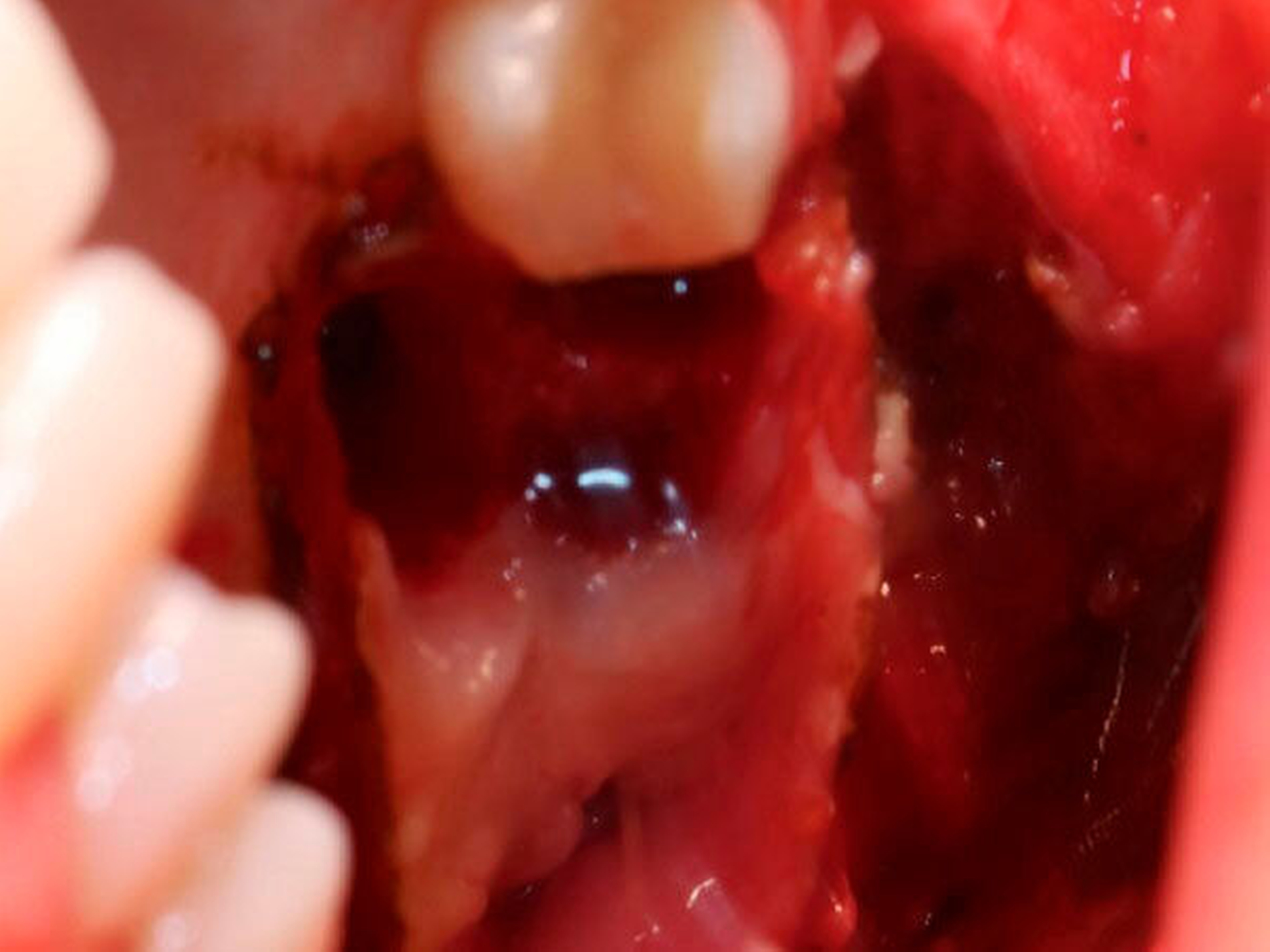
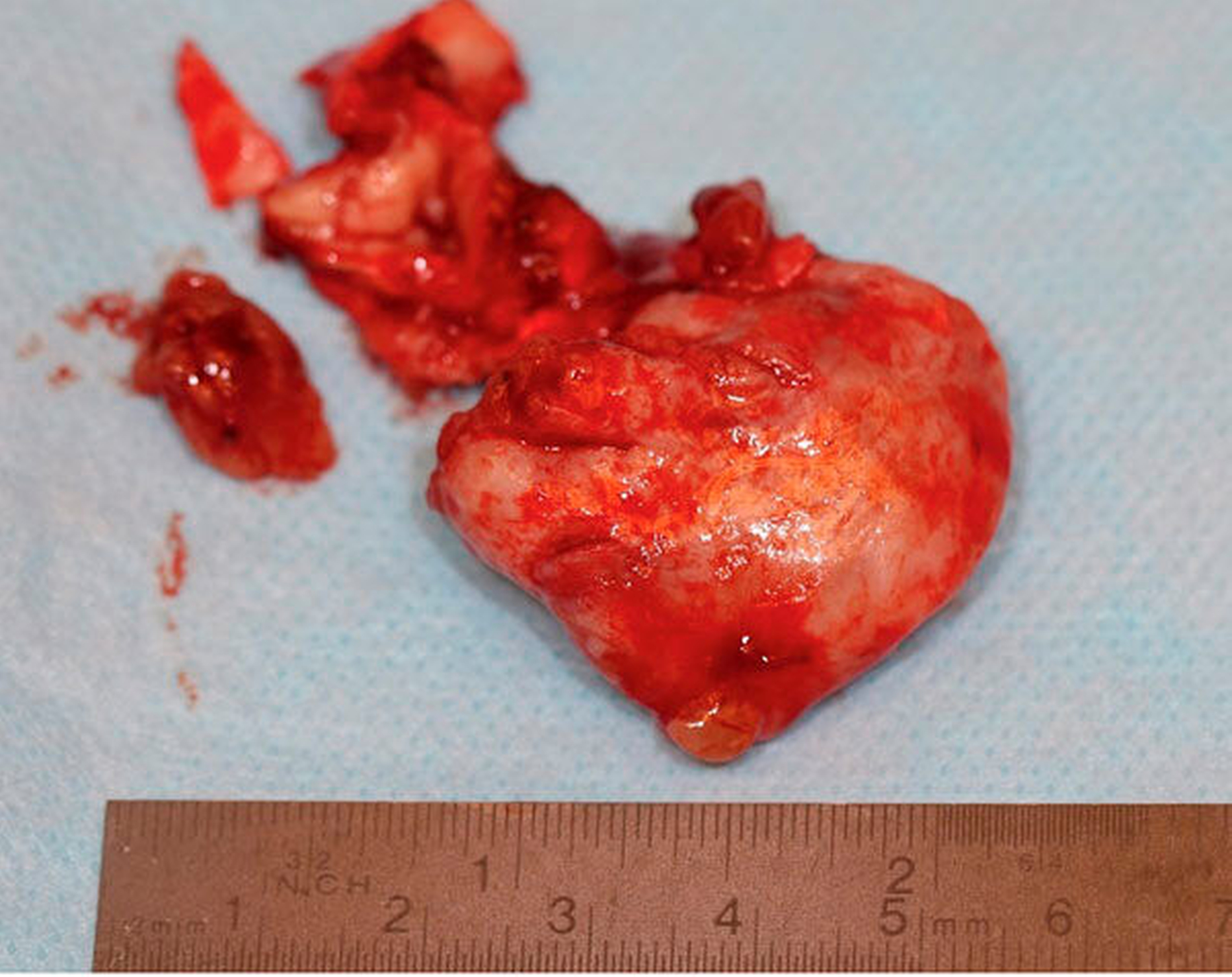
Die Allgemein- und Familienanamnese der Patientin war bis auf eine medikamentös eingestellte Hypothyreose unauffällig. Extraoral bestand kein auffälliger Befund, insbesondere keine Druckdolenz oder Nervdefizit über der Kieferhöhle links. In Regio 27 zeigte sich eine Mund-Antrum-Verbindung nach frustranem Deckungsversuch, aus der sich seröse Flüssigkeit entleerte (Abbildung 2). Der Zahn 26 reagierte negativ auf Perkussion und war avital. Nach sorgfältiger Aufklärung erfolgte die Resektion des Befunds in Intubationsnarkose. Folgend auf die Extraktion des Zahnes 26 (Abbildung 3) wurde eine Kastenresektion der linken Maxilla von distal des Zahnes 25 bis in den Tuberbereich bei makroskopischem Einhalten eines Sicherheitsabstands von 0,5 cm durchgeführt. Das narbig anmutende Gewebe in der Kieferhöhle wurde ausgeschält und en bloc mit dem Oberkieferresektat entfernt (Abbildung 4). Der Knochen wurde hier belassen, da er klinisch und radiologisch nicht infiltriert war.
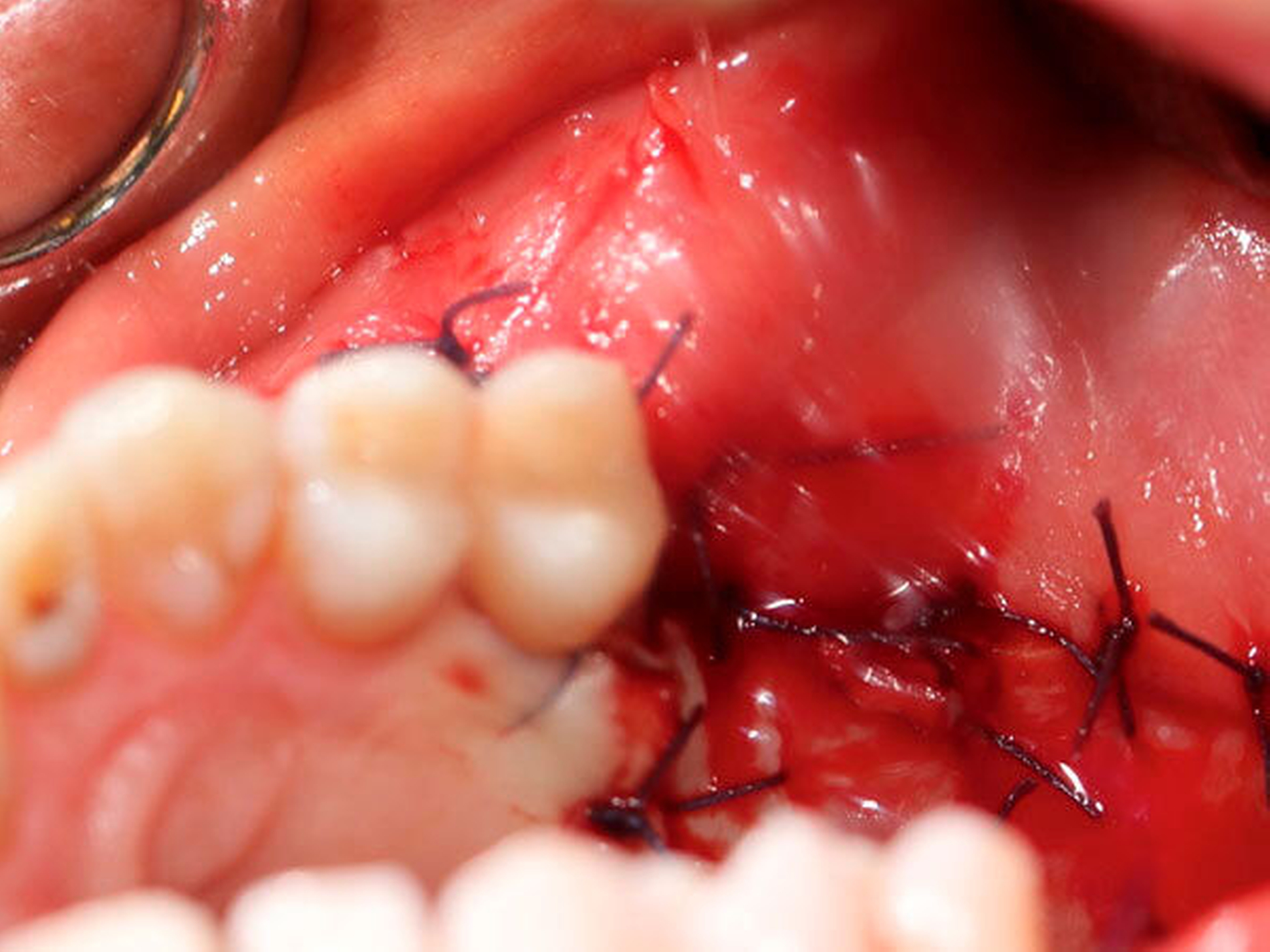
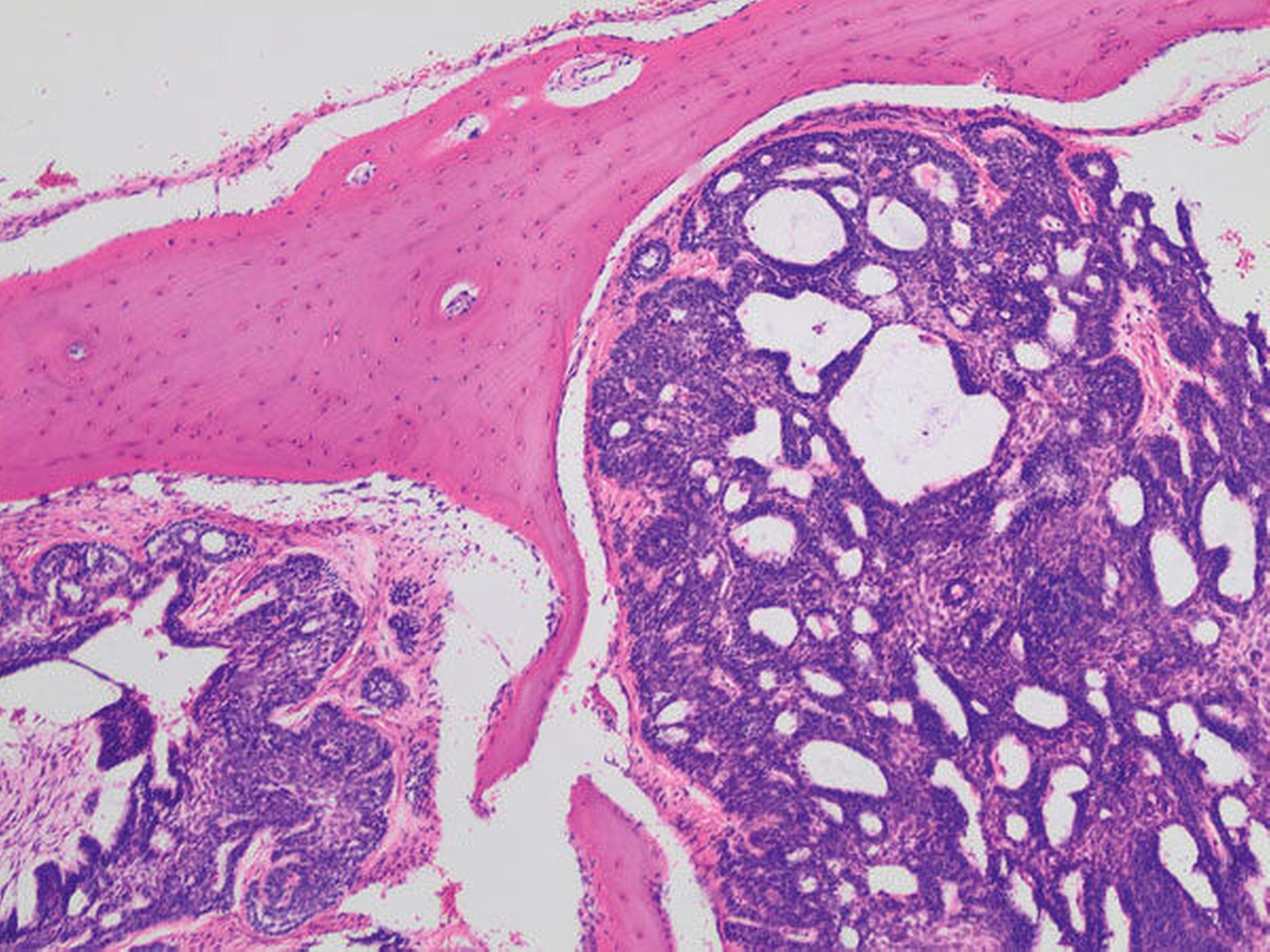
Der Defekt wurde mit einer lokalen Lappenplastik gedeckt (Abbildung 5), eine vorab angefertigte Verbandsplatte zum Wundschutz eingegliedert. Die abschließende histologische Auswertung (Abbildung 6) bestätigte, dass es sich bei dem kompletten Resektat um das bereits ex domo vor-diagnostizierte, teils plexiforme Ameloblastom handelte. Aufgrund der Größe des Tumors erfolgte ein Staging mittels CT-Thorax und Abdomen, das jedoch keinen Nachweis einer Metastasierung erbrachte. Bei mikroskopisch knappen Sicherheitsabständen nach palatinal sowie an der Nasenscheidewand und zur Orbita hin wurde die Patientin über ein differenzial-therapeutisches Vorgehen mit radikal-chirurgischem Vorgehen versus engmaschige klinische und radiologische Nachkontrollen aufgeklärt. Die Patientin entschied sich nach eingehender Aufklärung für die engmaschigen Nachkontrollen. Eine ossäre Rekonstruktion (Abbildung 7) wird derzeit von der Patientin nicht gewünscht.
Diskussion
Das Ameloblastom gehört zu den gutartigen epithelialen odontogenen Tumoren, die aus proliferierendem odontogenem Epithel (zum Beispiel aus Schmelzresten, Anteilen des sich entwickelnden Zahnschmelzes, aus der epithelialen Auskleidung einer odontogenen Zyste oder auch von den Basalzellen der oralen Mukosa) ausgehen [Hong et al., 2007]. Ein langsames, aber aggressives, lokal invasives Wachstum ist für diese Neoplasie charakteristisch [Ruslin et al., 2018; Giraddi et al., 2017]. In Europa und Amerika gehört das Ameloblastom nach dem Odontom zu den häufigsten odontogenen Tumoren (circa elf Prozent aller derartigen Fälle). Nach der WHO-Klassifikation von 2017 werden die Subtypen in unizystisch/konventionell (vorher solide/multizystisch), peripher/extraossär [Krüger et al., 2011] und metastasierend eingeteilt [Baumhoer, 2017]. Zusätzlich kann der Tumor histologisch in weitere Untergruppen wie beispielsweise follikulär und plexiform eingeteilt werden [Dandriyal et al., 2011]. Ameloblastome zeigen generell sehr selten eine Metastasierung (malignes Ameloblastom) [Haq et al., 2016].
Im Unterschied zum vorgestellten Fall sind mehr als 80 Prozent dieser Tumore im (posterioren) Unterkiefer lokalisiert, wobei die Ursache hierfür nicht bekannt ist. Beim vorliegenden Fall ist davon auszugehen, dass sich der Tumor in der posterioren Maxilla entwickelt und anschließend sekundär in die Kieferhöhle gewachsen ist, wobei in sehr seltenen Fällen auch von primär sinonasalen Ameloblastomen berichtet wurde [Hansen et al., 2013].
Ameloblastome betreffen beide Geschlechter in ähnlicher Art und Weise und treten gehäuft zwischen dem zweiten und dem vierten Lebensjahrzehnt auf, wobei regionale Unterschiede existieren [Patsa et al., 2016; Dhanuthai et al., 2012]. Das Fehlen von Symptomen führt dazu, dass diese Art von Tumor selten im Anfangsstadium und eher als radiologischer Zufallsbefund diagnostiziert wird. Aufgrund des langsamen Wachstums macht sich dieser oft lediglich als schmerzlose, langsam zunehmende Schwellung bemerkbar. Selten treten zusätzliche Symptome wie bewegliche Zähne, Malokklusion oder eine Nasenatmungsbehinderung sowie Schmerzen auf [Giraddi et al., 2017]. Radiologisch erscheint das Ameloblastom wie eine rundliche, scharf begrenzte Tranzluszenz, wobei auch eine multizystische Manifestation vorkommt.
In der Literatur werden neben der radikalen Resektion die marginale Resektion (knöcherne Grenzen belassen, wie im vorgestellten Fall) sowie die Enukleation mit oder ohne Applikation von Carnoy’scher Lösung als alternative Therapiekonzepte beschrieben. Die Therapie richtet sich nach Lokalisation, Größe, dem histopathologischen Subtyp und der Region des Kiefers. Aufgrund der hohen Rezidivrate, die bei der Resektion bis zu 5 bis 15 Prozent und bei der eher minimal-invasiven Therapie (Enukleation und Kürretage) bis zu 55 bis 90 Prozent beträgt [Celur und Babu, 2012], wird traditionellerweise eine aggressivere Resektion mit einem Sicherheitsabstand von 0,5 bis 2 cm empfohlen [Giraddi et al., 2017; Dandriyal et al., 2011]. Allerdings erwies sich bei unizystischen Ameloblastomen auch die kombinierte Anwendung einer Enukleation und Carnoy’scher Lösung mit einer Rezidivrate von zehn Prozent als vielversprechend [Lee et al., 2004]. Da in diesem Fall nach palatinal ein geringerer Sicherheitsabstand vorlag und zur Nase und zur Orbita keine knöcherne Resektion durchgeführt wurde, wurde dies entsprechend mit der Patientin diskutiert, die sich vorerst für eine abwartende Beobachtung entschied. Dies wurde auch anhand des Subtyps des Tumors befürwortet, da plexiforme Ameloblastome eine geringere Rezidivrate als beispielsweise follikuläre Formen aufweisen. Selbst bei der konservativen Behandlung zeigten dementsprechend plexiforme und unizystische Ameloblastome eine bessere Prognose als ihre anderen Konterparts [Hong et al., 2007].
Fazit für die Praxis
Ameloblastome zeigen ein invasives Wachstum mit Tendenz zu Rezidiven.
Kleine, anfänglich vorliegende Läsionen können leicht mit einem periapikalen Granulom oder einer Zyste verwechselt werden, was dazu führt, dass der potenziell schuldige Zahn endodontisch behandelt oder extrahiert wird, ohne dass die Läsion diagnostiziert und ausreichend therapiert wird.
Die Mehrheit der Fälle betrifft den Unterkiefer, aber auch der Oberkiefer kann beteiligt sein.
Eine differenzialdiagnostische Abklärung vor der definitiven Behandlung ist obligatorisch und erfordert eine Gewebebiopsie, da diese Läsion umfassender behandelt werden muss als andere gutartige odontogene Läsionen.
Die Chirurgie ist beim Ameloblastom der therapeutische Goldstandard. Die Behandlung reicht von minimal-invasiven Operationen bis hin zu radikaleren Eingriffen.
Wichtig ist, dem Patienten die Notwendigkeit eines definitiven Behandlungsprotokolls und einer periodischen, lebenslangen Nachuntersuchung zu verdeutlichen, da selbst eine fünfjährige tumorfreie Periode nicht notwendigerweise eine definitive Rezidivfreiheit bedeutet.
Literaturliste
1. Hong, J., Yun, P. Y., Chung, I. H., Myoung, H., Suh, J. D., Seo, B. M., Lee, J. H. und Choung, P. H. (2007). „Long-term follow up on recurrence of 305 ameloblastoma cases.“ Int J Oral Maxillofac Surg 36(4): 283-288.
2. Ruslin, M., Hendra, F. N., Vojdani, A., Hardjosantoso, D., Gazali, M., Tajrin, A., Wolff, J. und Forouzanfar, T. (2018). „The Epidemiology, treatment, and complication of ameloblastoma in East-Indonesia: 6 years retrospective study.“ Med Oral Patol Oral Cir Bucal 23(1): e54-e58.
3. Giraddi, G. B., Arora, K. und Saifi, A. M. (2017). „Ameloblastoma: A retrospective analysis of 31 cases.“ Journal of Oral Biology and Craniofacial Research 7(3): 206-211.
4. Krüger, M., Kämmerer, P. und Walter, C. (2011). „ifferentialdiagnose von Schwellungen des Alveolarkamms: Extraossäres Ameloblastom.“ Zahnärztliche Mitteilungen 101(22): 48-49.
5. Baumhoer, D. (2017). „Odontogene Tumoren und Knochentumoren der Kieferregion.“ Der Pathologe.
6. Dandriyal, R., Gupta, A., Pant, S. und Baweja, H. H. (2011). „Surgical management of ameloblastoma: Conservative or radical approach.“ Natl J Maxillofac Surg 2(1): 22-27.
7. Haq, J., Siddiqui, S. und McGurk, M. (2016). „Argument for the conservative management of mandibular ameloblastomas.“ Br J Oral Maxillofac Surg 54(9): 1001-1005.
8. Hansen, T., Bogumil, A. und Koutsimpelas, D. (2013). „[Primary plexiform ameloblastoma in the sinonasal tract of a 49-year-old female patient. Case report].“ HNO 61(7): 673-676.
9. Patsa, S., Jadav, R. B., Halder, G. C., Ray, J. G., Datta, S. und Deb, T. (2016). „Demographic and histopathological variation of ameloblastoma: A hospital-based study.“ J Oral Maxillofac Pathol 20(2): 230-233.
10. Dhanuthai, K., Chantarangsu, S., Rojanawatsirivej, S., Phattarataratip, E., Darling, M., Jackson-Boeters, L., Said-Al-Naief, N., Shin, H. I., An, C. H., Hong, N. T., An, P. H., Thosaporn, W., Lam-ubol, A. und Subarnbhesaj, A. (2012). „Ameloblastoma: a multicentric study.“ Oral Surg Oral Med Oral Pathol Oral Radiol 113(6): 782-788.
11. Celur, S. und Babu, K. S. (2012). „Plexiform ameloblastoma.“ Int J Clin Pediatr Dent 5(1): 78-83.
12. Lee, P. K., Samman, N. und Ng, I. O. (2004). „Unicystic ameloblastoma--use of Carnoy's solution after enucleation.“ Int J Oral Maxillofac Surg 33(3): 263-267.