So setzen Sie die Medizinprodukte-Verordnung um (Teil I)
Auf diese Frage müsste ich Ihnen schon fast eine Checkliste liefern. Also fangen wir in diesem Jahr an:
Faktencheck
Bisher gelten in Deutschland das Medizinproduktegesetz (MPG) und die Medizinprodukte-Betreiber-Verordnung (MPBetreibV) sowie weitere Gesetze und Verordnungen, wie die MPSPV zur Herstellung, zum Inverkehrbringen zum Betreiben und Anwenden von Medizinprodukten.
Das MPG regelt technische, medizinische & Informationsanforderungen für das Inverkehrbringen von Medizinprodukten (Herstellung oder Einfuhr) im Europäischen Wirtschaftsraum.
Das MPG basiert auf den europäischen Richtlinien 90/385/EWG, 93/42/EWG und 98/79/EG.
Die Verordnung EU 2017/745 (MDR) ist am 25. Mai 2017 in Kraft getreten und ab Mai 2021 umzusetzen.
Die MDR gilt in den EU-Mitgliedsstaaten unmittelbar und muss nicht in nationales Recht umgesetzt werden. Anpassungen des nationalen Medizinprodukte-Rechts sind allerdings notwendig und werden umfänglich erwartet.
Die MDR löst die RL 93/42/EWG und RL 90/385/EWG ab. RL 98/79/EG wird durch eine eigene Verordnung (EU 2017/746) ersetzt.
Die Medical Device Regulation (MDR) oder auch Medizinprodukte-Verordnung 2017/745 genannt, regelt auf europäischer Ebene den Umgang und Einsatz von Medizinprodukten. Sie hätte eigentlich schon im Mai 2020 in Kraft treten sollen. Pandemiebedingt wurde dieser Termin aber um ein Jahr auf den Mai 2021 aufgeschoben. Das sollte allen Praxen genug Zeit geben, um den Anforderungen gerecht zu werden.
Tatsächlich ist aus meiner Sicht zu dem Zeitpunkt, als die Verschiebung verkündet wurde, noch nicht viel – oder hart formuliert: quasi nichts – in den Zahnarztpraxen gemacht worden. Insofern sehen wir es einmal als zweite Chance. Ohne es vorwegzunehmen: Sie haben einige To-dos vor sich.
Ab Mai 2021 ist die MDR für die Herstellung und das Inverkehrbringen von Medizinprodukten umzusetzen. Das betrifft zunächst Medizinproduktehersteller, für die dann geänderte, – meist strengere – Vorgaben zu klinischen Prüfungen, technischen Dokumentationen, Klassifizierung, Produktkennzeichnungen und Konformitätsbewertung gelten. Während der Übergangsfrist 2017 bis 2021 sind „Zulassungen“ von Medizinprodukten vereinfacht dargestellt nach altem und neuem Recht möglich.
Was bedeutet dies für die Zahnarztpraxis?
Das Ziel der EU-Medizinprodukteverordnung ist der Schutz des Patienten vor fehlerhaften oder risikobehafteten Medizinprodukten. Mit der Verordnung zielt die EU in erster Linie aber auf die Industrie und damit auch auf die Dentalindustrie ab. Der Großteil der Umsetzungsarbeit liegt insofern bei den Herstellern, die ihre Medizinprodukte nach der MDR spezifizieren, klassifizieren und kennzeichnen müssen.

Trotzdem gab und gibt es klare Vorgaben zum Betreiben und Anwenden von Medizinprodukten, die unter anderem in der MPBetreibV geregelt sind. Das bedeutet, dass die MDR zum Anlass genommen werden sollte, um den praxisindividuellen Umgang (Dokumentation, Regelungen, Darstellung im Praxis-QM) auf den Prüfstand zu stellen und anzupassen (sofern überhaupt ansonsten: Aufbau!). So sollte unbedingt geprüft werden, ob künftig eingesetzt werden, die den gesetzlichen Vorgaben entsprechen (Aktualisierung der Medizinprodukte-Bücher, Verzeichnisse, Rücksprache mit Herstellern). Wichtig ist auch, das System zum Umgang mit Vorkommnissen mit zu überprüfen.
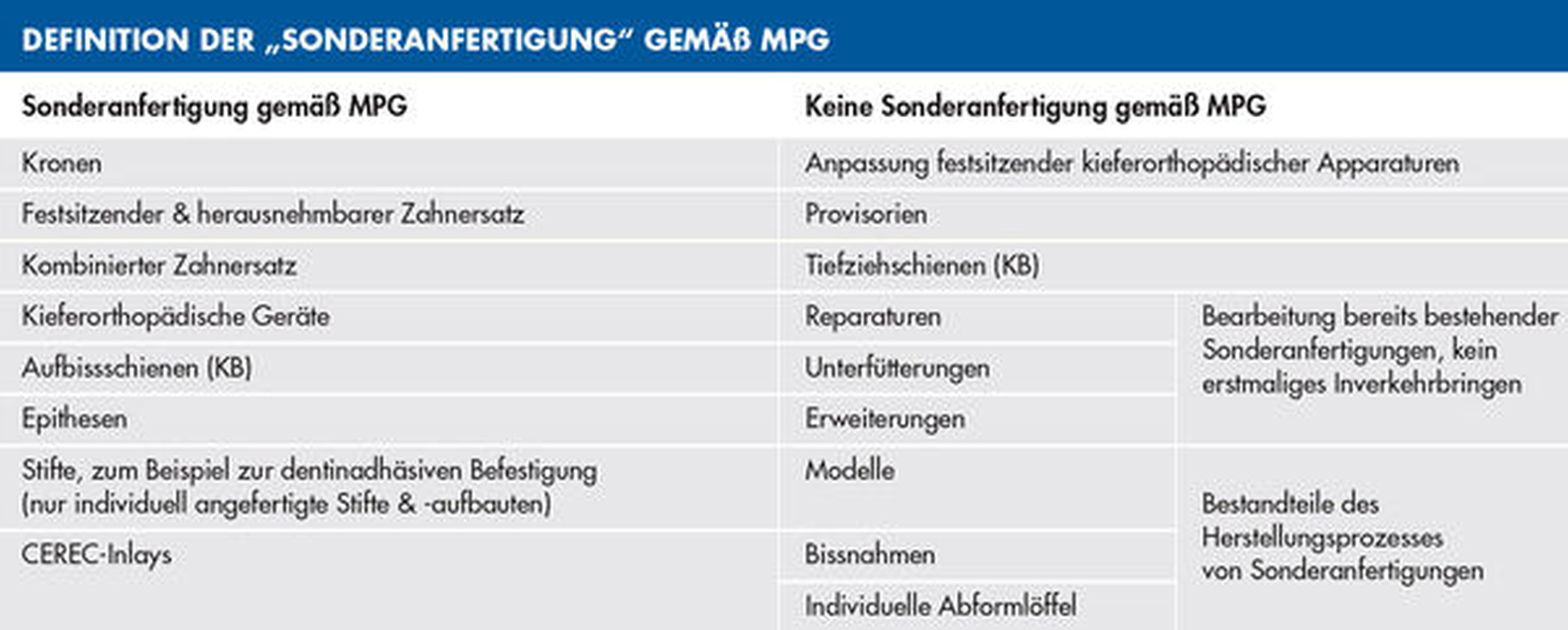
Vor einer großen Herausforderung stehen Zahnarztpraxen mit Eigenlabor. Hier ist entscheidend, ob Sonderanfertigungen oder serienmäßig hergestellte und vorkonfektionierte Produkte hergestellt werden oder nicht. Praxen, die nur ein Eigenlabor betreiben, müssen ihren Fokus im Bereich zahntechnische Werkstücke auf das Schnittstellenmanagement legen, also auf die Steuerung und Organisation der Abläufe zwischen Praxis und (Fremd-)Labor. Das Fremdlabor als Hersteller von Sonderanfertigungen muss die MDR umsetzen.
Mein Fazit
Die QM-Regulierungen greifen immer vielschichtiger um sich und bei Nicht- oder Wenigbeachtung und -entwicklung eines QM-Systems wird es mit jeder neuen Regelung potenziell schwieriger, diese umzusetzen, da schlichtweg das Fundament fehlt, auf dem es aufzusetzen gilt. Das war in der Rückschau seit der Verpflichtung zum QM in der Zahnarztpraxis 2006 – erstmalig umgesetzt 2010 – mit jedem neuen DSGVO und nun in der MDR. In der MDR sind auch Verpflichtungen aus der Vorgängerregelung übernommen worden.
Dass die Vorgängerregelung noch nicht in der Praxis umgesetzt wurde, stellt keine Entbindung von der Verpflichtung dar, diese nun korrekt, ausführlich und vollständig zu erbringen. Es ist für viele Zahnarztpraxen höchste Zeit, sich mit dem Thema intensiv zu befassen.
In diesem Sinne ...
Ihr Christian Henrici
zusammen mit Monika Köhn,
Mitglied im Praxisflüsterer-Team
Henrici@opti-hc.de, www.opti-hc.de
Ausblick: In Teil 2 gehe ich gesondert auf Zahnarztpraxen mit Eigenlabor ein und kläre, was als Sonderanfertigung gilt und damit unter die MDR fällt und was in diesem Fall zu unternehmen ist.