Fluoridfrei wirkt nicht
Positive Dosis-Wirkungs-Beziehungen zwischen Fluoridkonzentrationen in Zahnpasten und einer Kariesreduktion im Schmelz wurden in zahlreichen Studien festgestellt [Walsh et al., 2010]. Allerdings wurden nur wenige klinische Studien mit Wurzeldentin durchgeführt [Wierichs und Meyer-Lückel, 2015]. Diese belegten zwar, dass die tägliche Verwendung einer hochfluoridhaltigen Zahnpasta (5.000 ppm F-) im Vergleich zu einer normalfluoridhaltigen Zahnpasta (1.100–1.450 ppm F-) das relative Risiko für eine invasive Therapie von Wurzelkaries um circa 50 Prozent senkt, sie untersuchten aber nicht, ob eine Dosis-Wirkungs-Beziehung zwischen Fluoridkonzentrationen und der Kariesreduktion im Dentin in vivo oder in situ vorliegt.
Die kariespräventive Wirkung von fluoridfreier, Nanohydroxylapatit-haltiger Zahnpasta wurde in den vergangenen Jahren viel diskutiert. Einige Studien deuteten auf einen remineralisierenden Effekt für Zahnpasten mit Nanohydroxylapatit (nHA) oder mikrokristallinem Hydroxylapatit (mHA) hin [Najibfard et al., 2011; Schlagenhauf et al., 2019; Tschoppe et al., 2011]. In vitro verursachte eine nHA-haltige Zahnpasta eine Mineralzunahme im Schmelz, die sich aber nicht signifikant von einer aminfluoridhaltigen Zahnpasta (1.450 ppm F-) unterschied [Tschoppe et al., 2011]. Darüber hinaus wurde auch kein signifikanter Unterschied in der Mineralzunahme zwischen einer nHA- und einer NaF-haltigen Zahnpasta (1.100 ppm F-) in situ beobachtet [Najibfard et al., 2011]. Jedoch wurden beide Studien – In-vitro- und In-situ-Studie – unter netto-remineralisierenden Bedingungen durchgeführt, wobei selbst die Kontrollgruppen remineralisierten. Für die Beurteilung der kariesprophylaktischen Wirkung einer Zahnpasta ist allerdings eine Evaluation unter demineralisierenden Bedingungen notwendig.
Eine positive Wirksamkeit von mikrokristallinem Hydroxylapatit wurde ebenfalls auf Grundlage einer klinischen Studie postuliert [Schlagenhauf et al., 2019]. Hier war nach einer Beobachtungszeit von sechs Monaten eine fluoridfreie mHA-Zahnpasta einer NaF-haltigen bei der Reduzierung der Entstehung neuer initialer Läsionen (ICDAS-Code 1 oder 2) im Randbereich von kieferorthopädischen Brackets nicht unterlegen. Die Zahnpasten wurden in einer Population mit sehr hohem Kariesrisiko getestet, so dass hier das Modell möglicherweise zu kariogen war, um überhaupt Unterschiede zwischen den Interventionen aufzeigen zu können. Da weder eine Negativkontrolle – aus ethischen Gründen – noch eine Positivkontrolle (zum Beispiel hochfluoridhaltige Zahnpasta) in die Studie integriert wurden, kann dies nicht abschließend geklärt werden. Darüber hinaus wurden weitere kariesprophylaktische Maßnahmen begleitend durchgeführt, so dass der auf die Zahnpasten zurückzuführende Effekt maskiert worden sein könnte. Abgesehen von der gewählten Methodik gilt ein Untersuchungszeitraum von sechs Monaten als zu kurz, um eine verallgemeinerbare Aussage über die Wirksamkeit von Zahnpasten abzuleiten [Kerschner et al., 2020; Marinho et al., 2003; Walsh et al., 2019]. Im Unterschied dazu wurde unter ebenfalls netto-remineralisierenden Bedingungen in einer weiteren In-vitro-Studie [Körner et al., 2020] beobachtet, dass die Behandlung mit künstlichem Speichel (Negativkontrolle) zu einer signifikant höheren Mineralgehaltzunahme führte als die Behandlung mit einer mHA-haltigen Zahnpasta. Des Weiteren wies die AmF-haltige Zahnpasta die höchste Mineralgehaltszunahme auf, die auch signifikant höher war als die der mHA-haltigen Zahnpasta und der Negativkontrolle.
In zwei weiteren In-vitro-Studien, die die Kariesprogression im Schmelz unter netto-demineralisierenden Bedingungen untersuchten, schnitten Hydroxylapatit-haltige Zahnpasten schlecht ab. So konnte in der einen Studie ebenfalls kein Unterschied zwischen zwei experimentellen Pasten mit 10 beziehungsweise 20 Prozent nHA und keiner Behandlung sowie einer Placebobehandlung (Paste ohne nHA und F-) beobachtet werden [Comar et al., 2013]. In der anderen In-vitro-Studie verringerten alle fluoridhaltigen Zahnpasten den weiteren Mineralverlust signifikant im Vergleich zur Negativkontrolle und der nHA-haltigen Zahnpasta [Esteves-Oliveira et al., 2017]. In Hinblick auf die antikariogene Wirkung von nHA-haltigen Produkten fanden bisher keine Untersuchungen mit kariösem oder gesundem Dentin statt.
Das Ziel unserer In-situ-Studie war daher zum einen die Evaluation einer potenziellen Dosis-Wirkungs-Beziehung zwischen fluoridhaltigen Zahnpasten (unterschiedlicher Fluoridgehalt) hinsichtlich der Kariesinhibition im kariösen und im gesunden Dentin. Zum anderen wurde die demineralisationshemmende Wirkung einer fluoridfreien, Nanohydroxylapatit-haltigen Zahnpasta mit der von fluoridfreien, normal fluoridhaltigen und hochfluoridhaltigen Zahnpasten verglichen.
Studienaufbau
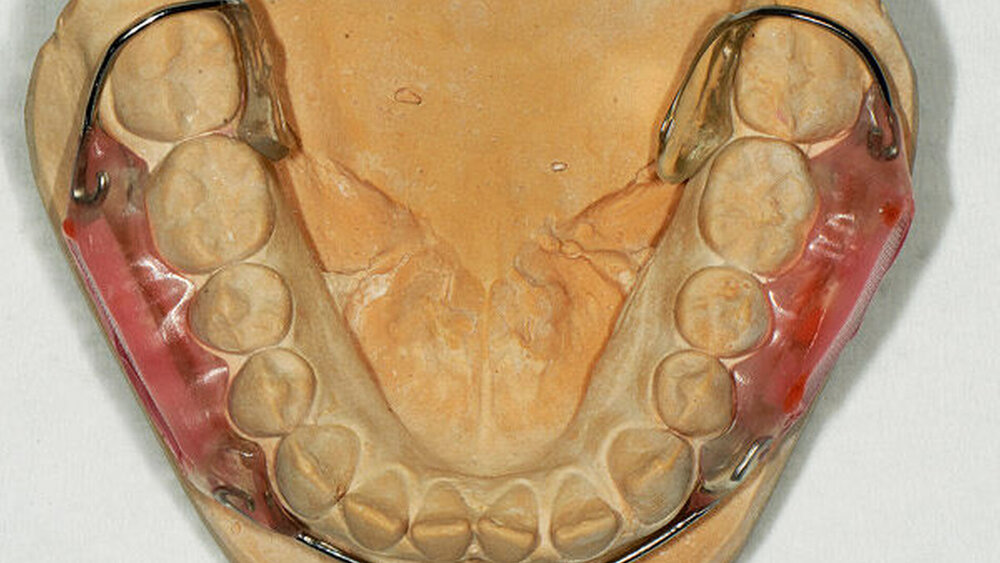
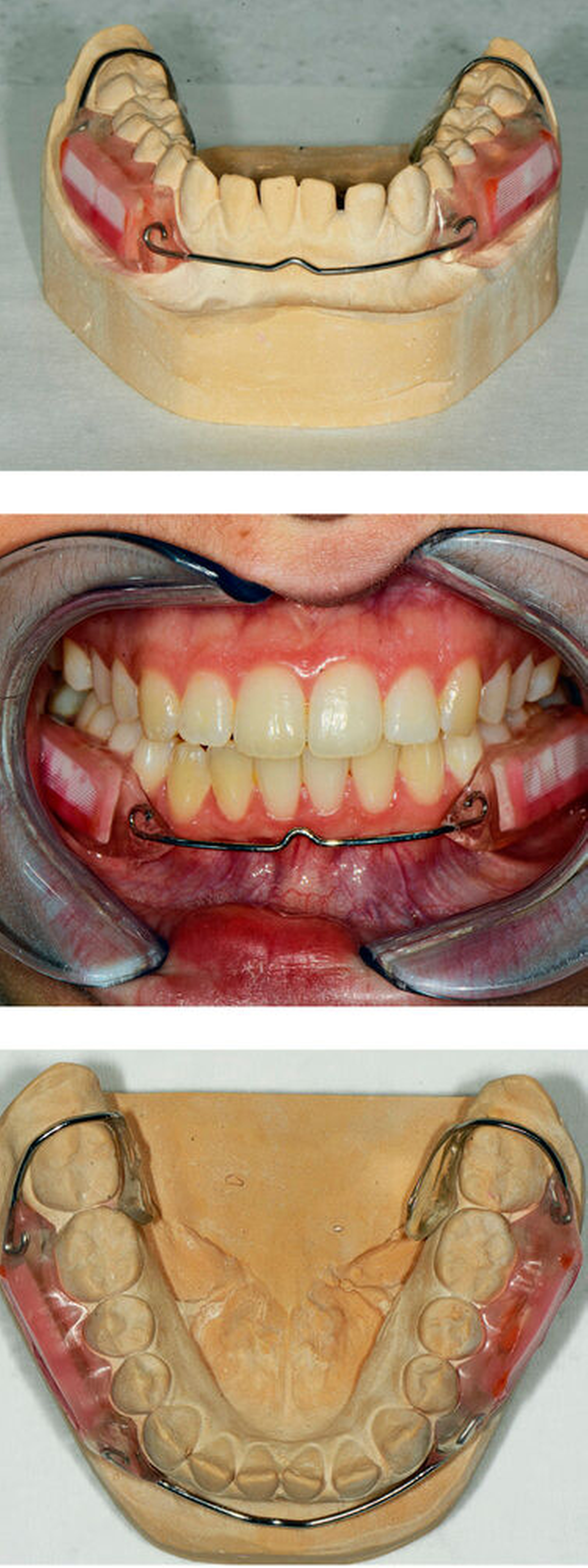
In der vorliegenden doppelblinden, randomisierten In-situ-Kreuzstudie wurden intraorale Unterkieferapparaturen für 20 Probanden, die ihr Einverständnis zur Teilnahme (Studienregister: DRKS00011653) gegeben hatten, angefertigt (Abbildung 1). In den beiden Seiten der Apparatur wurden je eine bovine Schmelz- und zwei bovine Dentinproben 1 mm vertieft in das Kunststofffenster unter einem Kunststoffnetz eingebracht, so dass plaquebedeckte Zahnflächen simuliert wurden [Schirrmeister et al., 2007]. Die Schmelz- beziehungsweise Dentinproben enthielten je eine Gesundfläche und eine (stark oder schwach) demineralisierte Läsion. Die 20 Probanden trugen die intraorale Apparatur für vier Perioden jeweils vier Wochen, wobei die Tragezeit nur während der Mahlzeiten und der Mundhygiene unterbrochen wurde.
Folgende Zahnpasten wurden von den Probanden in unterschiedlichen Reihenfolgen verwendet:
nHA0: fluoridfreie, Nanohydroxylapatit-haltige Zahnpasta, Biorepair Zahncreme (Testgruppe)
NaF0: fluoridfreie Zahnpasta (0 ppm F), Lavera Basis Sensitiv Zahncreme (Negativkontrolle)
NaF1100: NaF-Zahnpasta (1.100 ppm F), Crest Cavity Protection (Standardtherapie)
NaF5000: NaF-Zahnpasta (5.000 ppm F), Colgate Duraphat 5.000 ppm Fluoride Toothpaste (Positivkontrolle)
Zweimal täglich (morgens und abends) wurde nach 30-sekündigem Zähneputzen mit der jeweiligen Zahnpasta ein Teil der bis dahin entstandenen Speichel-Zahnpasta-Mischung für zwei Minuten extraoral auf die Proben aufgetragen. Die Teilnehmer ernährten sich fluoridarm und verwendeten fluoridfreies Salz für den Hausgebrauch. Des Weiteren wurden die Apparaturen dreimal täglich für 40 Minuten in eine 10-prozentige Zuckerlösung gelegt, um eine Demineralisierung zu ermöglichen. Vor und nach der jeweiligen Periode wurden die Proben hinsichtlich des Mineralgewinns/-verlusts densitometrisch (transversale Mikroradiografie) in vitro ausgewertet.
Ergebnisse
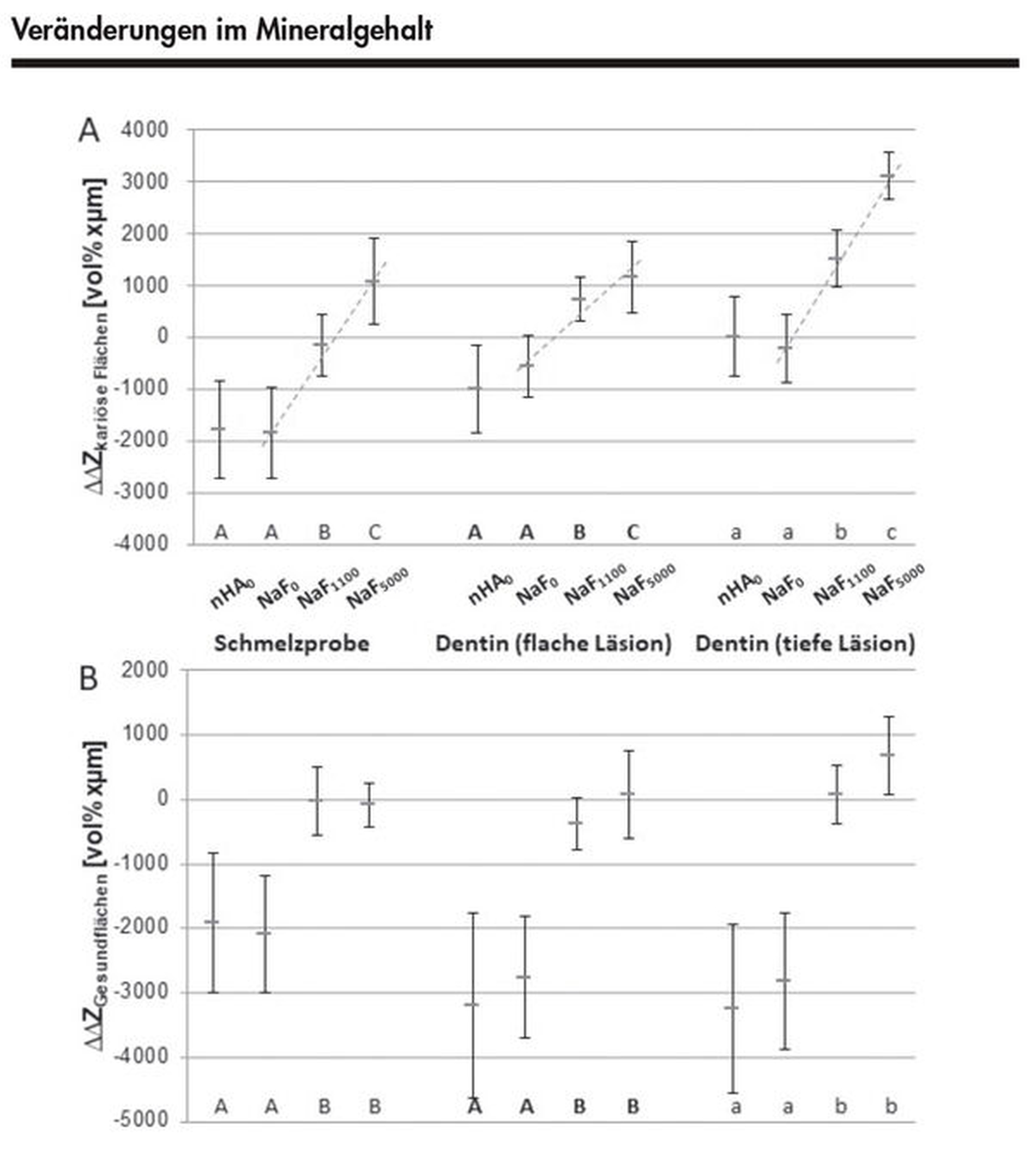
Für die fluoridhaltigen Zahnpasten (NaF0, NaF1100 und NaF5000) konnte eine Fluorid-Dosis-Wirkungs-Beziehung gezeigt werden – sowohl in Bezug auf die demineralisationshemmende Wirkung auf gesundes und unterschiedlich stark kariöses Dentin als auch auf gesunden und kariösen Schmelz (Abbildung 2). Dabei zeigte sich eine starke Korrelation für tiefe Dentinproben und eine moderate Korrelation für flache Dentin- und tiefe Schmelzproben. Darüber hinaus konnte kein Unterschied in der Veränderung des Mineralgehalts zwischen den beiden fluoridfreien Zahnpasten (NaF0 und nHA0), von denen eine Nanohydroxylapatit enthielt, beobachtet werden (Abbildung 3). Allerdings zeigten beide fluoridfreien Zahnpasten eine signifikant schlechtere demineralisationshemmende Wirkung auf als die normalfluoridhaltige Zahnpasta.

Diskussion
In der vorliegenden Studie konnte für das verwendete In-situ-Modell eine positive Fluorid-Dosis-Wirkungs-Beziehung sowohl in Bezug auf die demineralisationshemmende Wirkung auf gesundes und unterschiedlich stark kariöses Dentin als auch auf gesunden und kariösen Schmelz gezeigt werden. Zwischen den fluoridfreien Zahnpasten (NaF0 und nHA0) wurde für Schmelz und Dentin kein signifikanter Unterschied in der Veränderung des Mineralgehalts und der Läsionstiefe beobachtet – sowohl für die Kariesentstehung als auch für die Verhinderung der Kariesprogression. Außerdem induzierten beide fluoridfreien Zahnpasten während der In-situ-Perioden einen signifikant höheren Mineralverlust als die normal fluoridhaltige Zahnpasta. Obwohl der antikariogene Effekt von Nanohydroxylapatit unter Verwendung von Dentin bisher noch nicht analysiert wurde, scheinen die Ergebnisse mit den in der Einleitung erwähnten In-vitro-Studien am Schmelz übereinzustimmen. Unter demineralisierenden Bedingungen konnten keine signifikanten Unterschiede zwischen nHA und der Negativkontrolle [Comar et al., 2013; Esteves-Oliveira et al., 2017] und unter netto-remineralisierenden Bedingungen ein positiverer remineralisierender Effekt für nHA beobachtet werden [Najibfard et al., 2011; Tschoppe et al., 2011].
Man kann daher davon ausgehen, dass sich in der Präsenz von freiem Fluorid der kritische pH-Wert für die Demineralisation um etwa 0,5 bis 1,0 Einheiten zu einem saureren kritischen pH-Wert verschiebt – zumindest für Schmelz [Amaechi und van Loveren, 2013]. Darüber hinaus ist zu erwarten, dass fluoridfreie Zahnpasten zu einer schlechteren Hemmung der Demineralisation führen als fluoridhaltige [Amaechi und van Loveren, 2013]. Unter konstanten remineralisierenden Bedingungen (ohne Demineralisationsperioden) kann dieser (günstige) Effekt nicht zu jeder Zeit beobachtet werden [Tschoppe et al., 2011]. Möglich ist daher, dass die positiven remineralisierenden Wirkungen von Nanohydroxylapatit mit der Art des verwendeten (pH-Zyklus-)Modells zusammenhängen. Die Frage ist, ob der neutrale pH-Wert der nHA-Produkte ein weiterer Grund dafür sein kann, dass kein Unterschied zwischen nHA0 und NaF0 beobachtet wurde. So wurde in einer Studie ein dreifach so hoher Anstieg im Mineralgewinn für eine nHA-Lösung mit einem pH-Wert 4 im Vergleich zu einer nHA-Lösung mit einem pH-Wert 7 beobachtet [Huang et al., 2011]. Wenn also der pH-Wert von nHA0 niedriger wäre, könnte nHA0 den weiteren Mineralverlust in höherem Maße beeinflussen.
Kritisch anzumerken bei der vorliegenden Studie ist, dass sich die Zahnpasten nicht nur in pH-Werten und Fluoridverbindungen, sondern teilweise auch in den inaktiven Inhaltsstoffen unterschieden. Es kann daher nicht ausgeschlossen werden, dass die beobachteten Effekte durch andere Inhaltsstoffe (zum Beispiel antimikrobielle, abrasive oder remineralisationsinhibierende Inhaltsstoffe) beeinflusst wurden [Walther et al., 2019]. Da ein Putzen der Proben allerdings nicht erlaubt war und alle 405 Proben keine abrasiven Oberflächenverluste aufwiesen, kann der Einfluss abrasiver Inhaltsstoffe in der vorliegenden Studie ausgeschlossen werden. Nichtsdestotrotz enthielten die fluoridfreie Zahnpasta Xylitol und die normalfluoridhaltige Zahnpasta das Polymer Carbopol (Carbomer 956). Carbomer 956 wird als Verdickungsmittel verwendet. Obwohl die Bildung von Kalziumfluorid (CaF2) auf der Dentinoberfläche in der vorliegenden Studie nicht analysiert wurde, könnte folglich angenommen werden, dass Carbomer 956 auch die Bildung von ungebundenem Fluorid (CaF2) und die Ablagerung auf den Dentinoberflächen beeinträchtigt hat [Backfolk et al., 2002]. Somit war die Bioverfügbarkeit von CaF2 vermutlich während der folgenden Demineralisierungsperiode reduziert. In der Folge könnte dies zu einem verminderten Mineralgewinn bei der Verwendung der normalfluoridhaltigen Zahnpasta geführt haben.
Fazit
Das vorliegende In-situ-Modell konnte eine Fluorid-Dosis-Wirkungs-Beziehung auf Dentin zeigen. Somit wurde die in klinischen Studien aufgezeigte Wirksamkeit hochfluoridhaltiger Zahnpasten modellhaft bestätigt. Die fluoridfreien Zahnpasten, von denen eine Nanohydroxylapatit enthielt, konnten die Kariesentstehung und -progression nicht verhindern.
Die hier präsentierten Ergebnisse wurden im Journal of Dentistry veröffentlicht: Wierichs RJ, Musiol J, Erdwey D, Esteves-Oliveira M, Apel C, Meyer-Lueckel H.: Re- and demineralization characteristics of dentin depending on fluoride application and baseline characteristics in situ. 2020. J Dent. 94:103305.
PD Dr. Richard J. Wierichs, MHBA
Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin, Zahnmedizinische Kliniken der Universität Bern
Freiburgstr. 7, CH-3010 Bern
richard.wierichs@zmk.unibe.ch
Julia Musiol
Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin, Zahnmedizinische Kliniken der Universität Bern
Freiburgstr. 7, CH-3010 Bern
Prof. Dr. Hendrik Meyer-Lückel
Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin, Zahnmedizinische Kliniken der Universität Bern
Freiburgstr. 7, CH-3010 Bern