Der Einfluss des Darmmikrobioms auf neurodegenerative Erkrankungen
Die Vorstellung, dass das Mikrobiom zur Pathologie von Erkrankungen des zentralen Nervensystems (ZNS) beitragen kann, wird von aktuellen Berichten geteilt [Sharon et al., 2016]. Mehrere Studien belegen, dass eine Veränderung der Darmbakterien mit neurodegenerativen Erkrankungen, wie der Alzheimer-Krankheit („Alzheimer‘s disease“, AD) [Mezö et al., 2020; Minter et al., 2016; Vogt et al., 2017], der Parkinson-Krankheit („Parkinson’s disease“, PD) [Keshavarzian et al., 2015; Scheperjans et al., 2015] und anderen neurologischen Erkrankungen wie Multiple Sklerose [Berer et al., 2011] und Autismus-Spektrum-Störungen [Tabouy et al., 2018] in Verbindung steht.
Dabei könnten sich Mikroglia als die residenten Gewebsmakrophagen im ZNS, die zum angeborenen Immunsystem gehören, als zelluläre Mediatoren zwischen Darm und Gehirn herausstellen. Bei nahezu jeder Erkrankung, die das Gehirn betrifft, sind Mikroglia in der Pathogenese beteiligt, wobei die molekularen Mechanismen, die die Aktivität und die Funktionen der Mikroglia unter Homöostase und im pathologischen Zustand steuern, bis heute nur zum Teil verstanden sind.
Zum Fortbildungsbeitrag
Die Arbeitsgruppe um den diesjährigen Leibniz-Preisträger Prof. Dr. Marco Prinz (Neuropathologie Freiburg) beschäftigt sich seit geraumer Zeit mit der Frage, ob das Darmmikrobiom die Mikroglia des zentralen Nervensystems beeinflusst. In diesem Zusammenhang wurde klar, dass neurodegenerative Erkrankungen wie Parkinson oder Alzheimer direkt mit Störungen des Darmmikrobioms in Verbindung gebracht werden können. Dabei scheinen auch Mikroorganismen, die man in der Mundhöhle antrifft, eine Rolle zu spielen. Dieser Fortbildungsbeitrag, der sich nicht mit dem Mikrobiom der Mundhöhle beschäftigt, soll aufzeigen, wie sich künftige Forschungsprojekte in der Zahnmedizin möglicherweise mit allgemeinmedizinischen Fragestellungen verknüpfen lassen. Im Vergleich zum Darmmikrobiom sind die Mikroorganismen der Mundhöhle leicht zugänglich und möglicherweise auch einfacher zu beeinflussen.
Prof. Dr. Elmar Hellwig, Klinik für Zahnerhaltungskunde und Parodontologie, Universitätsklinikum Freiburg
Man ist bisher davon ausgegangen, dass das Gehirn durch seine anatomischen und physiologischen Eigenschaften immunologisch privilegiert und weitestgehend geschützt vor äußeren Einflüssen ist. 2015 wurde der bisher unbekannte Einfluss der Wirtsmikrobiota auf die Reifung und Funktion der Mikroglia im ZNS nachgewiesen [Erny et al., 2015]. Mikroglia von keimfrei (germ-free, GF) gehaltenen Mäusen ohne Darmbakterien zeigten im Vergleich zu Mäusen mit Darmbakterien eine veränderte Morphologie, Zellzahl, Genexpression und Immunantwort. Kurzkettige Fettsäuren (short-chain fatty acids, SCFAs), die von intestinalen Bakterien bei der Fermentation von Ballaststoffen synthetisiert werden, konnten als die bakteriellen Moleküle identifiziert werden, die für die Reifung und die Funktion der Mikroglia verantwortlich sind [Erny et al., 2015].
Weitere grundlagenwissenschaftliche und klinische Studien sind allerdings unerlässlich, um ein besseres Verständnis über den Zusammenhang von Darmbakterien mit Erkrankungen des ZNS zu erlangen und um neue geeignete therapeutische Ansätze zu entwickeln.
Alzheimer-Erkrankung
Die Alzheimer-Erkrankung (AD) wurde nach dem deutschen Psychiater und Neuropathologen Alois Alzheimer benannt, der im Jahr 1906 bei der verstorbenen Patientin Auguste Deter als Erster eine Demenzerkrankung beschrieb [Holtzman et al., 2011]. AD ist mit 40 bis 50 Millionen Betroffenen weltweit die häufigste neurodegenerative Erkrankung und Ursache einer Demenz, wobei Frauen häufiger erkranken als Männer [Nichols et al., 2019].
Ein wichtiger Risikofaktor für die Entwicklung von AD ist das Alter, aber auch genetische Faktoren spielen eine Rolle. Die erblich bedingte familiäre Form macht jedoch nur weniger als fünf Prozent aller Fälle aus, dabei tritt die Erkrankung in der Regel deutlich vor dem 60. Lebensjahr auf [Bertram und Tanzi, 2012]. Trotz intensiver Forschung gibt es auch heute noch keine vielversprechenden Behandlungsmöglichkeiten.
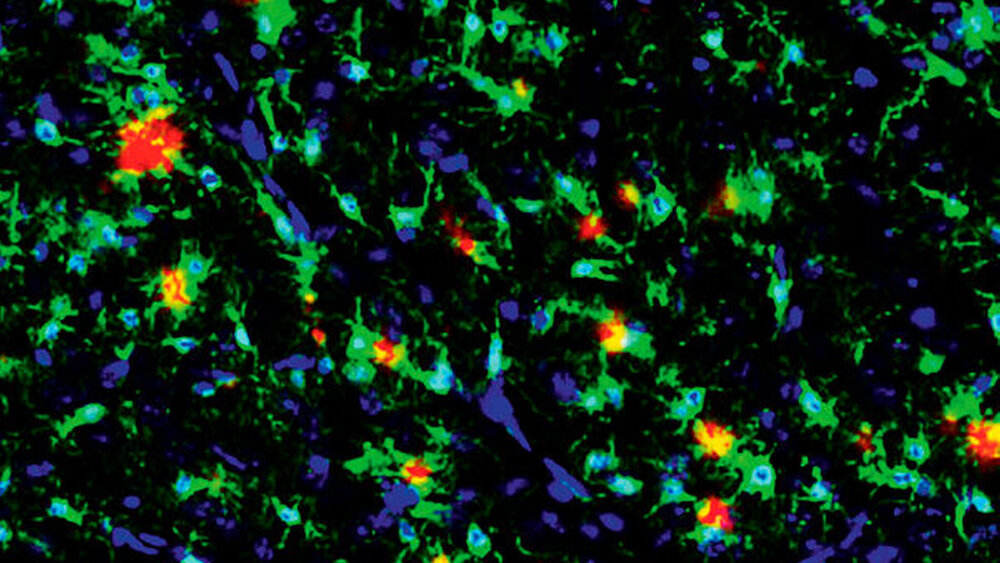
Histomorphologisch charakteristisch sind die Anhäufung des hyperphosphorylierten Tau-Proteins und die extrazelluläre Ablagerung von Beta-Amyloid(Aβ)-Peptiden, die durch die pathologische enzymatische Spaltung des Amyloid-Vorläuferproteins (amyloid precursor protein, APP) gebildet werden und als sogenannte Aβ-Plaques im Gehirn akkumulieren (Abbildung 1) [Iqbal et al., 2005; Selkoe und Hardy, 2016]. Die frühe zerebrale Aβ-Ablagerung beginnt bereits Jahrzehnte vor dem Auftreten erster klinischer Symptome [Sperling et al., 2014] und treibt die weitere Entwicklung und das Fortschreiten der AD an [Thériault et al., 2015].
Durch die Aβ-Ablagerungen kommt es zu einer Aktivierung von Mikroglia, die versuchen, die Aβ-Ablagerungen abzubauen (Abbildung 1). Dabei wird eine Immunreaktion ausgelöst, bei der proinflammatorische und neurotoxische Moleküle gebildet werden, die im weiteren Krankheitsverlauf zum Verlust von Synapsen und zur Degeneration von Neuronen führt. Folglich ist diese neurodegenerative Erkrankung symptomatisch gekennzeichnet durch fortschreitenden Gedächtnisverlust und den Rückgang kognitiver Funktionen [Selkoe und Hardy, 2016]. Neben genetischen Risikofaktoren gibt es Hinweise darauf, dass auch die Darmbakterien eine entscheidende Rolle beim Fortschreiten der AD spielen könnten [Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016].
Neuere Untersuchungen bei AD-Patienten haben eine Korrelation von Aβ-Ablagerungen, proinflammatorischen Zytokinen im Blut und bestimmten Darmbakterien bei kognitiv beeinträchtigten Patienten hervorgehoben [Cattaneo et al., 2017]. Eine weitere Analyse der Stuhlproben von AD-Patienten im Vergleich zu denen von gesunden Kontrollpatienten ergab eine reduzierte mikrobielle Diversität [Vogt et al., 2017]. Im Rahmen von Untersuchungen in transgenen AD-Mausmodellen deutete die mikrobielle Zusammensetzung der entnommenen Stuhlproben im Vergleich zu gesunden Kontrollmäusen auf eine geringere Diversität hin, was möglicherweise Auswirkungen auf die Aβ-Ablagerungen im Gehirn hat [Harach et al., 2017; Minter et al., 2016]. Im Gegensatz dazu konnten zwei aktuelle Studien keine robusten Veränderungen der mikrobiellen Diversität bestätigen [Mezö et al., 2020; Parikh et al., 2020].
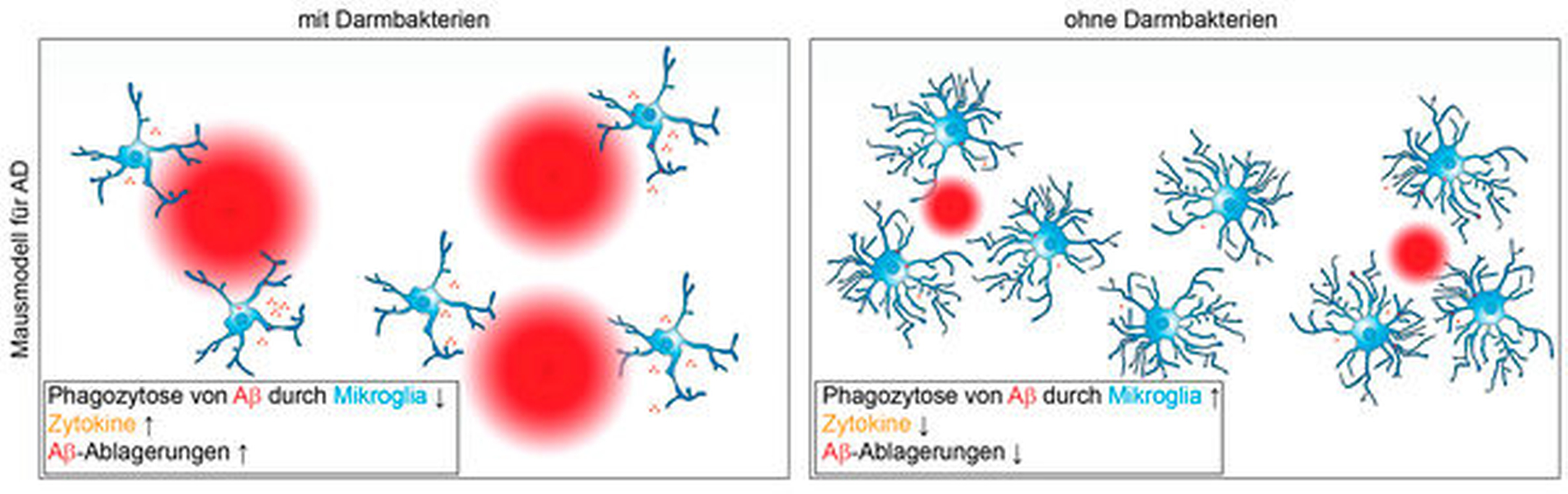
Um genauer untersuchen zu können, welchen Einfluss die Darmflora auf die Aβ-Ablagerungen und das Fortschreiten der AD hat, wurden Studien in transgenen Alzheimer-Mäusen durchgeführt, die unter GF-Bedingungen (keimfrei) aufgezogen wurden oder deren Darmbakterien durch die Gabe von Antibiotika (ABX) reduziert wurden [Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016]. Sowohl keimfrei aufgezogene als auch ABX-behandelte AD-Mäuse wiesen weniger Aβ-Ablagerungen auf als transgene Kontrolltiere mit Darmmikrobiom, sowohl im frühen Erkrankungsstadium als auch im bereits fortgeschrittenen Stadium [Colombo et al., 2020; Harach et al., 2017; Mezö et al., 2020; Minter et al., 2016].
Damit einhergehend zeigten GF- und ABX-behandelte AD-Tiere ein verbessertes Lernverhalten und verbesserte Gedächtnisfunktionen [Mezö et al., 2020]. Darüber hinaus wurde eine reduzierte Konzentration von SCFA im Blutplasma von AD-Mäusen entdeckt [Colombo et al., 2020]. Durch die Gabe von SCFA wiesen GF-AD-Mäuse eine verstärkte Ablagerung von Aβ auf, was darauf hindeutet, dass SCFA den Krankheitsverlauf im Tiermodell verschlechtert [Colombo et al., 2020]. Doch was genau ist verantwortlich für das schnellere Fortschreiten der AD-Erkrankung durch die Darmbakterien?
Mikroglia können lösliche Aβ-Oligomere über Zelloberflächenrezeptoren wie zum Beispiel TLRs („Toll-like receptor“) erkennen, was zu einer Aktivierung von Mikroglia führt. Mikroglia versuchen, Aβ-Ablagerungen durch Phagozytose abzubauen und einzudämmen (Abbildung 1). Eine anhaltende Aktivierung der Mikroglia und die Exposition gegenüber neurotoxischen proinflammatorischen Zytokinen und Chemokinen führt jedoch über die Zeit zur Degeneration von Neuronen, was entscheidend zum Fortschreiten der Krankheit beiträgt [Heneka et al., 2015].
In GF-AD-Mäusen wurde gezeigt, dass Mikroglia eine erhöhte Phagozytose-Aktivität von Aβ aufweisen und damit eine entscheidende Rolle bei der Reduktion der Aβ-Ablagerungen haben [Mezö et al., 2020]. Damit einhergehend zeigten Mikroglia von GF-AD-Mäusen eine erhöhte Expression von Genen, die mit Phagozytose in Verbindung stehen, wie Trem2 (Triggering receptor expressed on myeloid cells 2), Tyrobp (TYRO protein tyrosine kinase-binding protein), C1qb (complement component 1q) und Apoe (Apolipoprotein E) [Mezö et al., 2020].
Diese Ergebnisse deuten insgesamt darauf hin, dass sich die Darmbakterien negativ auf die AD-Pathologie auswirken, wobei die Beseitigung von Aβ-Ablagerungen durch Mikroglia beeinträchtigt wird (Abbildung 2). Jedoch sind weitere grundlagenwissenschaftliche und klinische Untersuchungen unerlässlich, um den Zusammenhang zwischen Mikrobiota und AD besser zu verstehen und zukünftig etwaige Therapieoptionen zu ermöglichen.
Parkinson-Erkrankung
Die Parkinson-Krankheit (PD) ist eine progressive Bewegungsstörung, gekennzeichnet durch Rigidität, Tremor, Bradykinese, aber auch durch nicht-motorische Symptome wie Darmbeschwerden und chronische Obstipation [O’Sullivan et al., 2008]. Auf histopathologischer Ebene geht die PD mit der Akkumulation von α-Synuclein(α-Syn)-Aggregaten, sogenannten Lewy-Körperchen, einher. Im Verlauf kommt es dadurch zur langsam fortschreitenden Degeneration dopaminerger Neuronen in der Substantia nigra des Mittelhirns [Dickson, 2018; Shulman et al., 2011].
Bei fast 80 Prozent der PD-Patienten liegen gastrointestinale Anomalien, einschließlich beeinträchtigter Magenmotilität, bakterieller Überbesiedelung des Dünndarms und Heliobacter-pylori-Infektionen vor [Fasano et al., 2015; Scheperjans et al., 2015]. Spekuliert wird, dass sich α-Syn-Aggregate zunächst im Bereich des Zäkums anhäufen, dann über das enterische Nervensystem über den Vagusnerv ins Gehirn gelangen und sich dadurch in sporadischen Fällen „prionenartig“ ausbreiten [Braak et al., 2004]. Diese Vermutung wird gestützt durch den Umstand, dass α-Syn-Aggregate bereits früh im Darm, in den enterischen Neuronen und im Vagusnerv vorhanden sind, bevor sie überhaupt im zentralen Nervensystem nachweisbar sind [Bencsik et al., 2014; Braak et al., 2004].
Weiterhin wurde eine abnormale intestinale Permeabilität beobachtet, die die Ausbreitung von α-Syn ins ZNS fördern könnte [Forsythe et al., 2014]. In einem Tiermodell demonstrierten Holmqvist und Kollegen, dass die Injektion von fibrillärem α-Syn ins Darmgewebe von gesunden Ratten ausreichend ist, um im Vagusnerv und Hirnstamm eine Pathologie auszulösen [Holmqvist et al., 2014].
Des Weiteren zeigte eine vollständige Vagotomie eine gedämpfte Progression der Erkrankung, was die Beteiligung des Vagusnervs als Kanal für die Ausbreitung von α-Syn vom enterischen System ins ZNS nahelegt [Svensson et al., 2015]. Andererseits wurde die elektrische Stimulation des Vagusnervs und dessen potenzielle antiinflammatorische Wirkung im Gehirn von Mäusen untersucht, denen bakterielle Lipopolysaccharide (LPS) verabreicht wurden, um eine Entzündungsreaktion zu induzieren [Meneses et al., 2016]. Folglich zeigte sich nach der elektrischen Stimulation eine reduzierte Produktion von proinflammatorischen Zytokinen, wie Interleukin-6 (IL-6) und Tumornekrosefaktor alpha (TNFα), durch Mikroglia im Gehirn. Diese Reaktion blieb bei Mäusen, die einer Vagotomie unterzogen wurden, aus.
Diese Studien unterstützen die Annahme, dass α-Syn über den Vagusnerv ins Gehirn gelangt und Mikroglia aktiviert. Allerdings ist die Vorstellung, dass die Aggregation im enterischen Nervensystem beginnt und sich auf das ZNS ausbreitet weiterhin umstritten [Burke et al., 2008], daher sind weitere Studien notwendig, um ein besseres Verständnis über den Einfluss der Darmbakterien auf die PD zu erlangen.
Was die mikrobielle Zusammensetzung betrifft, so zeigten Analysen von Stuhlproben von PD-Patienten im Vergleich zu gesunden Probanden eine veränderte mikrobielle Zusammensetzung, die mit dem klinischen Phänotyp der Erkrankung korrelierte [Keshavarzian et al., 2015; Scheperjans et al., 2015]. Eine Untergruppe von PD-Patienten zeigte ein vermehrtes Vorkommen von Enterobacteriaceae und eine Reduktion von Bacteroidetes und Prevotellaceae, was mit dem Schweregrad der motorischen Symptome assoziiert war.
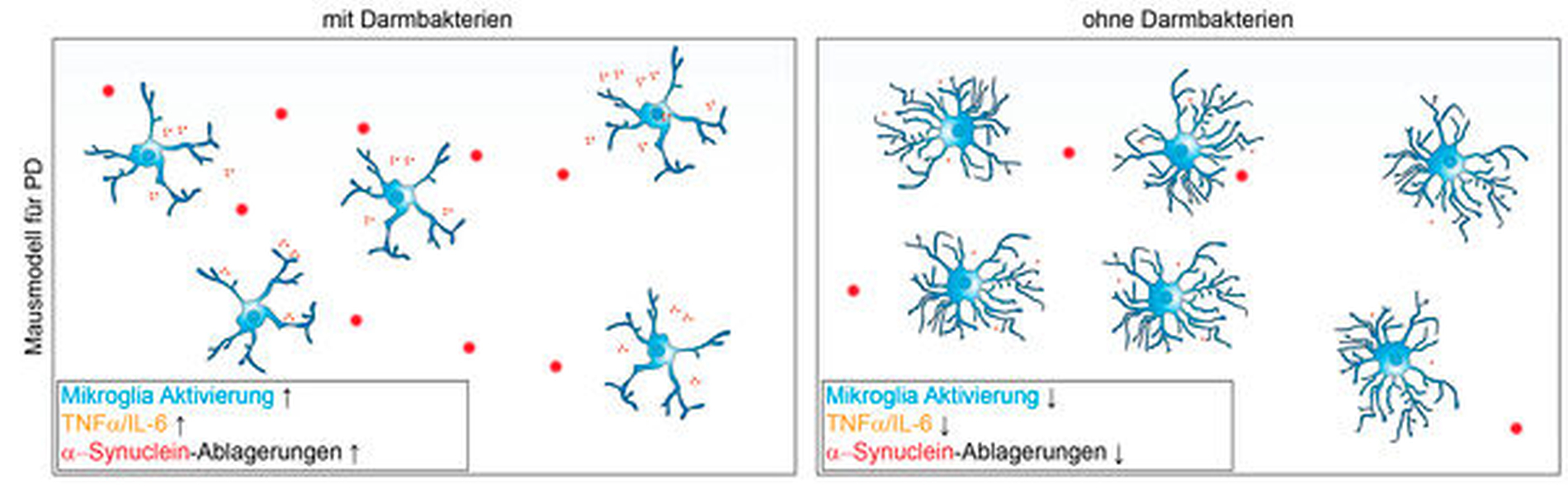
Unger und Kollegen entdeckten veränderte SCFA-Konzentrationen im Stuhl von Parkinson-Patienten, was darauf hindeutet, dass mikrobielle Metabolite eine Rolle bei der Erhaltung der Gesundheit spielen könnten [Unger et al., 2016]. Dieser Befund wurde auch im transgenen Parkinson-Mausmodell bestätigt [Sampson et al., 2016]. Konventionell gehaltene Tiere wiesen zusammen mit motorischen Funktionsstörungen ein hohes Maß an α-Syn-Aggregation im Gehirn auf, wohingegen bei GF-Tieren deutlich weniger α-Syn-Aggregationen und motorische Defizite beobachtet wurden. Durch die Gabe von SCFA wurden die Symptome wieder drastisch verstärkt.
Wie zuvor im Kontext von AD beschrieben, führt auch die Akkumulation von α-Syn bei PD zur Aktivierung von Mikroglia [Kim et al., 2013; Sanchez-Guajardo et al., 2013], was zu einer erhöhten Expression von TNFα und IL-6 in Mikroglia führt [Sampson et al., 2016]. Die Aktivierung der Mikroglia in GF transgenen PD-Mäusen war deutlich abgeschwächt und konnte durch die Gabe von SCFA wieder verstärkt werden (Abbildung 3). Die Aktivierung der Mikroglia korrelierte mit dem Ausmaß der α-Syn-Ablagerungen und der entsprechenden motorischen Beeinträchtigung.
Mezö, Prinz, Erny
Gegenwärtig kann man davon ausgehen, dass Darmbakterien die α-Syn-abhängige Immunaktivierung der Mikroglia beeinflussen, aber inwieweit die Darmbakterien die PD-Pathologie auslösen oder sogar antreiben, ist noch weitestgehend ungeklärt und wird in aktuellen Studien untersucht.
Charlotte Mezö, M.Sc.

seit 2017: Promotion in Biologie am Institut für Neuropathologie, Universitätsklinikum Freiburg
2014–2017: Masterstudiengang Neurobiologie, Eberhard-Karls Universität Tübingen
2011–2014: Studium der Biologie (Bachelor of Arts), Eberhard-Karls Universität Tübingen
Prof. Dr. med. Marco Prinz

1990–1996: Medizinstudium an der Humboldt-Universität zu Berlin (Charitè)
1997: Dissertation in Humanmedizin, Humboldt-Universität zu Berlin (Charitè)
1997–1998: Postdoc, Zelluläre Neurowissenschaft, Max Delbrück Center (MDC), Berlin
1999–2000: Postdoc, Institut für Neuropathologie, Universitätsspital Zürich
2001–2002: Senior-Postdoc, Institut für Neuropathologie, Universitätsspital Zürich
2002–2008: Gruppenleiter und seit 2004 Oberarzt, Institut für Neuropathologie, Georg- August-Universität, Göttingen
2004: Habilitation in Neuropathologie, Georg-August-Universität, Göttingen
seit 2008: Ärztlicher Direktor (W3), Institut für Neuropathologie, Uniklinikum Freiburg
Prinz war Koordinator wissenschaftlicher Großprojekte und Konferenzen, etwa bei DFG-SFB/TR1667 „NeuroMac“ (Sprecher), DFG-Forschergruppe FOR 1336 „Brain macrophages“ (Co-Sprecher), Keystone Konferenz „Microglia”, Keystone, USA (Organisator). Er ist als Reviewer für Fachjournale tätig, so für Cell, Immunity, Nature, Nat Neurosci, Science.
Literaturliste
Bencsik A, Muselli L, Leboidre M, Lakhdar L & Baron T (2014) Early and persistent expression of phosphorylated α-synuclein in the enteric nervous system of A53T mutant human α-synuclein transgenic mice. J. Neuropathol. Exp. Neurol. 73, 1144–51.
Berer K, Mues M, Koutrolos M, Rasbi Z Al, Boziki M, Johner C, Wekerle H & Krishnamoorthy G (2011) Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature 479, 538–41.
Bertram L & Tanzi RE (2012) The genetics of Alzheimer’s disease. In Progress in Molecular Biology and Translational Science. Elsevier B.V., pp.79–100.
Braak H, Ghebremedhin E, Rüb U, Bratzke H & Del Tredici K (2004) Stages in the development of Parkinson’s disease-related pathology. Cell Tissue Res. 318, 121–134.
Burke RE, Dauer WT & Vonsattel JPG (2008) A critical evaluation of the Braak staging scheme for Parkinson’s disease. Ann. Neurol. 64, 485–91.
Cattaneo A, Cattane N, Galluzzi S, Provasi S, Lopizzo N, Festari C, Ferrari C, Guerra UP, Paghera B, Muscio C, Bianchetti A, Volta GD, Turla M, Cotelli MS, Gennuso M, Prelle A, Zanetti O, Lussignoli G, Mirabile D, Bellandi D, Gentile S, Belotti G, Villani D, Harach T, Bolmont T, Padovani A, Boccardi M, Frisoni GB & INDIA-FBP Group (2017) Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly. Neurobiol. Aging 49, 60–68.
Dickson DW (2018) Neuropathology of Parkinson disease. Parkinsonism Relat. Disord. 46, S30–S33.
Erny D, Hrabě de Angelis AL, Mahlakoiv T, Buch T, Chun E, Schwierzeck V, Amit I, Jakobshagen K, David E, Diefenbach A, Staeheli P, Staszewski O, Wieghofer P, Garrett WS, Utermöhlen O, Stecher B, Keren-Shaul H, Prinz M, Jaitin D & McCoy KD (2015) Host microbiota constantly control maturation and function of microglia in the CNS. Nat. Neurosci. 18, 965–977.
Fasano A, Visanji NP, Liu LWC, Lang AE & Pfeiffer RF (2015) Gastrointestinal dysfunction in Parkinson’s disease. Lancet Neurol. 14, 625–639.
Forsythe P, Bienenstock J & Kunze WA (2014) Vagal pathways for microbiome-brain-gut axis communication. Adv. Exp. Med. Biol. 817, 115–133.
Harach T, Marungruang N, Duthilleul N, Cheatham V, Mc Coy KD, Frisoni G, Neher JJ, Fåk F, Jucker M, Lasser T & Bolmont T (2017b) Reduction of Abeta amyloid pathology in APPPS1 transgenic mice in the absence of gut microbiota. Sci. Rep. 7.
Heneka MT, Carson MJ, Khoury J El, Landreth GE, Brosseron F, Feinstein DL, Jacobs AH, Wyss-Coray T, Vitorica J, Ransohoff RM, Herrup K, Frautschy SA, Finsen B, Brown GC, Verkhratsky A, Yamanaka K, Koistinaho J, Latz E, Halle A, Petzold GC, Town T, Morgan D, Shinohara ML, Perry VH, Holmes C, Bazan NG, Brooks DJ, Hunot S, Joseph B, Deigendesch N, Garaschuk O, Boddeke E, Dinarello CA, Breitner JC, Cole GM, Golenbock DT & Kummer MP (2015) Neuroinflammation in Alzheimer’s disease. Lancet Neurol. 14, 388–405.
Holmqvist S, Chutna O, Bousset L, Aldrin-Kirk P, Li W, Björklund T, Wang Z-Y, Roybon L, Melki R & Li J-Y (2014) Direct evidence of Parkinson pathology spread from the gastrointestinal tract to the brain in rats. Acta Neuropathol. 128, 805–20.
Holtzman DM, Morris JC & Goate AM (2011) Alzheimer’s disease: The challenge of the second century. Sci. Transl. Med. 3.
Iqbal K, Del C. Alonso A, Chen S, Chohan MO, El-Akkad E, Gong CX, Khatoon S, Li B, Liu F, Rahman A, Tanimukai H & Grundke-Iqbal I (2005) Tau pathology in Alzheimer disease and other tauopathies. Biochim. Biophys. Acta - Mol. Basis Dis. 1739, 198–210.
Keshavarzian A, Green SJ, Engen PA, Voigt RM, Naqib A, Forsyth CB, Mutlu E & Shannon KM (2015) Colonic bacterial composition in Parkinson’s disease. Mov. Disord. 30, 1351–1360.
Kim C, Ho D-H, Suk J-E, You S, Michael S, Kang J, Joong Lee S, Masliah E, Hwang D, Lee H-J & Lee S-J (2013) Neuron-released oligomeric α-synuclein is an endogenous agonist of TLR2 for paracrine activation of microglia. Nat. Commun. 4, 1562.
Meneses G, Bautista M, Florentino A, Díaz G, Acero G, Besedovsky H, Meneses D, Fleury A, Del Rey A, Gevorkian G, Fragoso G & Sciutto E (2016) Electric stimulation of the vagus nerve reduced mouse neuroinflammation induced by lipopolysaccharide. J. Inflamm. (Lond). 13, 33.
Mezö C, Dokalis N, Mossad O, Staszewski O, Neuber J, Yilmaz B, Schnepf D, De Agüero MG, Ganal-Vonarburg SC, MacPherson AJ, Meyer-Luehmann M, Staeheli P, Blank T, Prinz M & Erny D (2020) Different effects of constitutive and induced microbiota modulation on microglia in a mouse model of Alzheimer’s disease. Acta Neuropathol. Commun. 8.
Minter MR, Zhang C, Leone V, Ringus DL, Zhang X, Oyler-Castrillo P, Musch MW, Liao F, Ward JF, Holtzman DM, Chang EB, Tanzi RE & Sisodia SS (2016a) Antibiotic-induced perturbations in gut microbial diversity influences neuro-inflammation and amyloidosis in a murine model of Alzheimer’s disease. Sci. Rep. 6, 30028.
Nichols E, Szoeke CEI, Vollset SE, Abbasi N, Abd-Allah F, Abdela J, Aichour MTE, Akinyemi RO, Alahdab F, Asgedom SW, Awasthi A, Barker-Collo SL, Baune BT, Béjot Y, Belachew AB, Bennett DA, Biadgo B, Bijani A, Bin Sayeed MS, Brayne C, Carpenter DO, Carvalho F, Catalá-López F, Cerin E, Choi JYJ, Dang AK, Degefa MG, Djalalinia S, Dubey M, Duken EE, Edvardsson D, Endres M, Eskandarieh S, Faro A, Farzadfar F, Fereshtehnejad SM, Fernandes E, Filip I, Fischer F, Gebre AK, Geremew D, Ghasemi-Kasman M, Gnedovskaya E V., Gupta R, Hachinski V, Hagos TB, Hamidi S, Hankey GJ, Haro JM, Hay SI, Irvani SSN, Jha RP, Jonas JB, Kalani R, Karch A, Kasaeian A, Khader YS, Khalil IA, Khan EA, Khanna T, Khoja TAM, Khubchandani J, Kisa A, Kissimova-Skarbek K, Kivimäki M, Koyanagi A, Krohn KJ, Logroscino G, Lorkowski S, Majdan M, Malekzadeh R, März W, Massano J, Mengistu G, Meretoja A, Mohammadi M, Mohammadi-Khanaposhtani M, Mokdad AH, Mondello S, Moradi G, Nagel G, Naghavi M, Naik G, Nguyen LH, Nguyen TH, Nirayo YL, Nixon MR, Ofori-Asenso R, Ogbo FA, Olagunju AT, Owolabi MO, Panda-Jonas S, Passos VM d. A, Pereira DM, Pinilla-Monsalve GD, Piradov MA, Pond CD, Poustchi H, Qorbani M, Radfar A, Reiner RC, Robinson SR, Roshandel G, Rostami A, Russ TC, Sachdev PS, Safari H, Safiri S, Sahathevan R, Salimi Y, Satpathy M, Sawhney M, Saylan M, Sepanlou SG, Shafieesabet A, Shaikh MA, Sahraian MA, Shigematsu M, Shiri R, Shiue I, Silva JP, Smith M, Sobhani S, Stein DJ, Tabarés-Seisdedos R, Tovani-Palone MR, Tran BX, Tran TT, Tsegay AT, Ullah I, Venketasubramanian N, Vlassov V, Wang YP, Weiss J, Westerman R, Wijeratne T, Wyper GMA, Yano Y, Yimer EM, Yonemoto N, Yousefifard M, Zaidi Z, Zare Z, Vos T, Feigin VL & Murray CJL (2019) Global, regional, and national burden of Alzheimer’s disease and other dementias, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 18, 88–106.
O’Sullivan SS, Williams DR, Gallagher DA, Massey LA, Silveira-Moriyama L & Lees AJ (2008) Nonmotor symptoms as presenting complaints in Parkinson’s disease: a clinicopathological study. Mov. Disord. 23, 101–6.
Parikh IJ, Estus JL, Zajac DJ, Malik M, Maldonado Weng J, Tai LM, Chlipala GE, LaDu MJ, Green SJ & Estus S (2020) Murine Gut Microbiome Association With APOE Alleles. Front. Immunol. 11, 200.
Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, Challis C, Schretter CE, Rocha S, Gradinaru V, Chesselet M-F, Keshavarzian A, Shannon KM, Krajmalnik-Brown R, Wittung-Stafshede P, Knight R & Mazmanian SK (2016) Gut Microbiota Regulate Motor Deficits and Neuroinflammation in a Model of Parkinson’s Disease. Cell 167, 1469-1480.e12.
Sanchez-Guajardo V, Barnum CJ, Tansey MG & Romero-Ramos M (2013) Neuroimmunological Processes in Parkinson’s Disease and their Relation to α-Synuclein: Microglia as the Referee between Neuronal Processes and Peripheral Immunity. ASN Neuro 5, AN20120066.
Scheperjans F, Aho V, Pereira PAB, Koskinen K, Paulin L, Pekkonen E, Haapaniemi E, Kaakkola S, Eerola-Rautio J, Pohja M, Kinnunen E, Murros K & Auvinen P (2015) Gut microbiota are related to Parkinson’s disease and clinical phenotype. Mov. Disord. 30, 350–358.
Selkoe DJ & Hardy J (2016) The amyloid hypothesis of Alzheimer’s disease at 25 years. EMBO Mol. Med. 8, 595–608.
Sharon G, Sampson TR, Geschwind DH & Mazmanian SK (2016) The Central Nervous System and the Gut Microbiome. Cell 167, 915–932.
Shulman JM, De Jager PL & Feany MB (2011) Parkinson’s disease: genetics and pathogenesis. Annu. Rev. Pathol. 6, 193–222.
Sperling R, Mormino E & Johnson K (2014) The evolution of preclinical Alzheimer’s disease: Implications for prevention trials. Neuron 84, 608–622.
Svensson E, Horváth-Puhó E, Thomsen RW, Djurhuus JC, Pedersen L, Borghammer P & Sørensen HT (2015) Vagotomy and subsequent risk of Parkinson’s disease. Ann. Neurol. 78, 522–529.
Tabouy L, Getselter D, Ziv O, Karpuj M, Tabouy T, Lukic I, Maayouf R, Werbner N, Ben-Amram H, Nuriel-Ohayon M, Koren O & Elliott E (2018) Dysbiosis of microbiome and probiotic treatment in a genetic model of autism spectrum disorders. Brain. Behav. Immun. 73, 310–319.
Thériault P, Elali A & Rivest S (2015) The dynamics of monocytes and microglia in Alzheimer’s disease. Alzheimer’s Res. Ther. 7.
Unger MM, Spiegel J, Dillmann K-U, Grundmann D, Philippeit H, Bürmann J, Faßbender K, Schwiertz A & Schäfer K-H (2016) Short chain fatty acids and gut microbiota differ between patients with Parkinson’s disease and age-matched controls. Parkinsonism Relat. Disord. 32, 66–72.
Colombo VA, Sadler RK, Llovera G, Singh V, Roth S, Heindl S, Sebastian Monasor L, Verhoeven A, Peters F, Parhizkar S, Kamp F, Gomez de Agüero M, Macpherson AJ, Winkler E, Herms J, Benakis C, Dichgans M, Steiner H, Giera M, Haass C, Tahirovic S & Liesz A (2020) Microbiota-derived short chain fatty acids promote Ab plaque deposition. bioRxiv, 2020.06.09.141879.
Vogt NM, Kerby RL, Dill-McFarland KA, Harding SJ, Merluzzi AP, Johnson SC, Carlsson CM, Asthana S, Zetterberg H, Blennow K, Bendlin BB & Rey FE (2017) Gut microbiome alterations in Alzheimer’s disease. Sci. Rep. 7, 13537.