Zufallsbefund HIV-Infektion: Was Zahnärzte wissen sollten
Die Infektion mit dem Humanen Immundefizienz-Virus (HIV) gehört auch heutzutage mit einer Neuinfektionsrate von 6,5 auf 100.000 Einwohner pro Jahr in Europa und einer vermutlich nicht zu unterschätzenden Dunkelziffer zu den führenden Gesundheitsproblemen der Gesellschaft.
Die Erkrankung tritt insbesondere in Hochprävalenzregionen wie in Teilen Afrikas, der Karibik und Südostasien auf, in denen definitionsgemäß über ein Prozent der erwachsenen Bevölkerung durch die Infektion betroffen sind.
In Deutschland zählen Großstädte wie Berlin, Frankfurt am Main, München, Köln, Düsseldorf und Hamburg zu den Hotspots des Infektionsgeschehens. Die Übertragung erfolgt in Europa in 40 Prozent der Fälle durch homosexuelle Kontakte zwischen Männern, wobei in über der Hälfte der Fälle der Transmissionsweg unbekannt ist. 33 Prozent der Infektionen erfolgen durch heterosexuelle Kontakte, vier Prozent über die intravenöse Applikation mit infiziertem Spritzenmaterial und nur etwa ein Prozent vertikal [RKI, 2018; WHO, 2019]. Das durchschnittliche Alter der Patienten liegt bei Erstdiagnose bei 37 Jahren mit einer tendenziell zunehmenden Zahl älterer Patienten (20 Prozent > 50 Jahre). 53 Prozent der Neudiagnosen erfolgen erst in späten Stadien der Erkrankung mit einer durchschnittlichen CD4-Zellzahl von < 350 Zellen/mm3 [WHO, 2019].
Übertragungswege
Das Virus wird über infektiöse Körperflüssigkeiten wie Blut, Sperma und Vaginalsekret, jedoch nicht über Speichel, Tränenflüssigkeit, per Tröpfcheninfektion, Nahrung, Trinkwasser oder Insektenstiche übertragen. Eine hohe Viruslast des Patienten bedingt auch eine höhere Infektiosität, wobei eine Läsion der perzeptiven Schleimhaut keine Voraussetzung für eine Übertragung des Virus, sondern lediglich einen begünstigenden Faktor darstellt. Eine Ansteckung im Alltag beispielsweise über die gemeinsame Nutzung sanitärer Anlagen ist überaus unwahrscheinlich [RKI, 2018].
HI-Viren sind lymphotrope Lentiviren aus der Familie der Retroviren. Sie befallen lymphozytäre Zellen und bilden während der gesamten Zeit durch Integration der Virus-DNA in die humane DNA neue Viren [RKI, 2018].
Erkrankungsstadien
Die durch HIV ausgelösten Erkrankungen werden in drei Stadien aufgeteilt. In Stadium A kommt es aufgrund der nur kurz zurückliegenden Infektion in 30 Prozent der Fälle zu akuten Krankheitssymptomen wie Fieber, Lymphknotenschwellung und Angina. Auf diese Phase der akuten grippalen Symptomatik folgt eine asymptomatische Latenzphase, in der sich die Viren im Wirtskörper vermehren. In 40 Prozent der Fälle kann eine generalisierte Lymphadenopathie über drei Monate lang persistieren [Herold, 2016].
In Stadium B kommt es zu einem Progress der Erkrankung mit einem starken Anstieg der Viruslast und einem Abfall der T-Helferzellzahl. Zu den nicht AIDS-definierenden opportunistischen Infektionen gehören die orale Candidose ebenso wie Herpes Zoster in mehreren Dermatomen, die orale Haarleukoplakie und Malignome (Hodgkin-Lymphom, invasives Analkarzinom), aber auch persistierende Symptome wie subfebrile Temperaturen und chronische Diarrhö.
Der Patientenfall
Ein 52-jähriger Patient stellte sich mit einer fortgeschrittenen Parodontitis und einer schweren Gingivitis in der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz vor. Die Überweisung durch den Hauszahnarzt war aufgrund einer sich in regio 38 befindlichen ulzerierten Raumforderung mit Verdacht auf das Vorliegen eines Plattenepithelkarzinoms erfolgt.
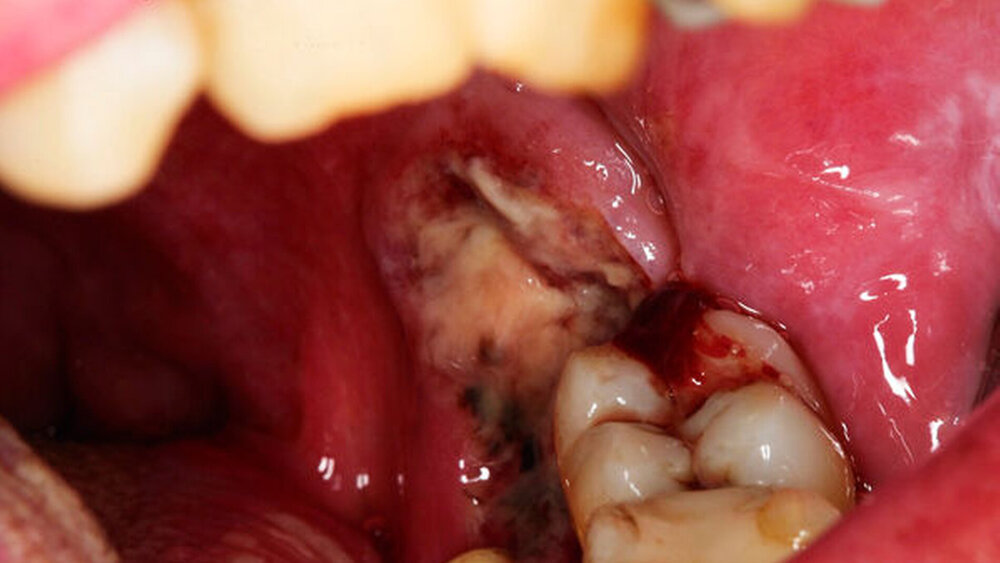
In der klinischen Untersuchung zeigte sich eine starke generalisierte Parodontitis mit ubiquitär zweit- bis drittgradig gelockerten Zähnen. Der Patient litt weiterhin unter einer starken Gingivitis mit geröteter und geschwollener Schleimhaut. Er berichtete über zahlreiche Versuche der Parodontaltherapie, die jedoch lediglich zu Blutungen, Schmerzen und einem weiteren Rückgang der Schleimhaut geführt hätten. In regio 38 zeigte sich ein etwa 3 cm x 3 cm großer, ulzerierender Befund, der sich über den aufsteigenden Ast des Unterkiefers bis nach lingual erstreckte und zu Teilen den noch vorhandenen Zahn 37 umschloss (Abbildung 1). Der Patient gab in diesem Bereich starke Schmerzen an, die Mundöffnung war deutlich eingeschränkt. Auch zeigte sich ein Foetor ex ore. Neben der akuten klinischen Symptomatik berichtete der Patient über keine bekannten Vorerkrankungen außer einem Nikotinabusus von 35 Packungsjahren.
In Anbetracht der massiv parodontal geschädigten Zähne wurde eine Panoramaschichtaufnahme mit dem Ziel der Erstellung eines aktuellen Zahnstatus durchgeführt. In der radiologischen Aufnahme bestätigte sich der klinische Befund mit einem ubiquitär sichtbaren, starken horizontalen Knochenabbau und verbreiteten Parodontalspalten (Abbildung 2). Im Rahmen des präoperativen Stagings zeigte sich eine vorliegende HIV-Infektion, die dem Patienten noch nicht bekannt war.
Abb. 2: Panoramaschichtaufnahme des Patienten: Zur Darstellung kommt ein konservierend und prothetisch versorgtes Gebiss. Auffällig ist der ubiquitäre, für das Alter des Patienten untypisch starke Knochenabbau mit Furkationsbefall zahlreicher Zähne. | MKG, Universitätsklinikum Mainz
Bei Verdacht auf das Vorliegen eines Malignoms in regio 38 wurde eine Computertomografie des Kopf-Hals-Bereichs durchgeführt. Diese zeigte eine vorwiegend hypodense Gewebeinhomogenität, die von regio 38 nach cranial bis zu regio 28 auszulaufen schien. Eine eindeutig tumorsuspekte, Kontrastmittel aufnehmende Läsion konnte nicht dargestellt werden, jedoch stellten sich beidseits multiple vergrößerte Lymphknoten von bis zu 1,7 cm Durchmesser dar (Abbildung 3). Um histopathologisch ein Malignom auszuschließen, wurde unter Lokalanästhesie eine Probe aus der entsprechenden Region entnommen. Der Befund zeigte jedoch lediglich eine ulzerierende, florid-granulierende und abszendierende Entzündung ohne Anhalt für Malignität.
Abb. 3: Computertomografie des Patienten: A zeigt die vorwiegend hypodense Gewebeinhomogenität, die von Regio 38 nach cranial bis zu Regio 28 auszulaufen scheint (Umrandung und Pfeil). Um den Befund befinden sich außerdem zahlreiche Lufteinschlüsse. B und C zeigen beidseits multiple vergrößerte Lymphknoten mit bis zu 23,6 mm Durchmesser. | MKG, Universitätsklinikum Mainz
Aufgrund der Inkonsistenz zwischen klinischem Befund und histologischem Bild wurde die Entscheidung zu einer Exzisionsbiopsie getroffen. In Anbetracht der Lokalisation des Befunds und der erhöhten Blutungsgefahr wurde der Eingriff in Intubationsnarkose durchgeführt. Die nun über sechs Wochen persistierende Raumforderung konnte komplikationslos exzidiert und die Wunde mittels hämostyptischer Maßnahmen therapiert werden, so dass der Patient noch am selben Tag in die ambulante Weiterbetreuung entlassen werden konnte. Der histopathologische Befundbericht zeigte Infiltrationen einer hochproliferativen Neoplasie, die aufgrund der vorliegenden HIV-Erkrankung, der Entnahmelokalisation und des Immunphänotyps (MUM1+, CD10+, CD79a+, Cyclin D1+) mit beinahe 100 Prozent Proliferationsaktivität als Plasmoblastisches Lymphom diagnostiziert wurde.
In Anbetracht der Diagnose eines hochmalignen Lymphoms wurde die Überweisung des Patienten in die Hämatologie eingeleitet. Hier erfolgte die Ausweitung der bisherigen Diagnostik mittels Knochenmarkspunktion. In Zusammenarbeit mit den Kollegen aus der konservierenden und der prothetischen Abteilung konnte ein interdisziplinäres Behandlungskonzept zur Therapie der stark gelockerten und nicht erhaltungswürdigen Zähne erstellt werden.
Im Anschluss an die notwendige Zahnsanierung wurde zeitnah das hämato-onkologische Therapiekonzept der Kombination einer antiretroviralen Medikation mit Bictegravir, Emtricitabin, Tenofovir und einer Chemotherapie nach dem CHOP-Schema (Cyclophosphamid, Hydroxydaunomycin, Vincristin, Prednisolon) begonnen.
Stadium C wird durch Erkrankungen und opportunistische Infektionen definiert, die typischerweise nur im Endstadium der Erkrankung vorkommen. Zu den AIDS-definierenden Erkrankungen zählen das Wasting-Syndrom (ungewollter Gewichtsverlust von mehr als zehn Prozent des Körpergewichts, chronische Diarrhö, Fieber und Abgeschlagenheit) und – wie in 80 Prozent der Fälle bei Erstmanifestation vorliegend – opportunistische Infektionen, wie die zerebrale Toxoplasmose, die Pneumocystis-jiroveci-Pneumonie und die Candidose des Ösophagus und der Lunge. Typische, unter AIDS auftretende Malignome sind das Kaposi-Sarkom und einige Non-Hodgkin-Lymphome [Herold, 2016]. In 15 Prozent der Fälle führt das Vorliegen einer solchen Neoplasie zur Erstdiagnose einer HIV-Infektion [RKI, 2018].
Orale Manifestationen
Während der frühen Phase der Erkrankung kann sich die HIV-Infektion durch orale Läsionen manifestieren. Die häufigsten Manifestationsformen sind die orale Candidose und die orale Haarleukoplakie. Es gibt jedoch insgesamt sieben orale Kardinalläsionen. Hierzu zählen das Kaposi-Sarkom, das Lineare Gingivaerythem, die nekrotisierende, ulzerierende Gingivitis und Parodontitis sowie – wie im vorliegenden Fall – B-Zell-Lymphome [Lorosa et al., 2019].
Gingivitis
Die nekrotisierende, ulzerierende Gingivitis (NUG) manifestiert sich rasch mit interdentalen gingivalen Nekrosen, lokalen Schmerzen, Blutungen, bis hin zu systemischen Symptomen wie einer Lymphadenopathie [Malek et al., 2017]. Zu den prädisponierenden Faktoren zählen Stress, Malnutrition, Tabakrauchen, Alkoholkonsum, Diabetes mellitus und insbesondere eine Dysfunktion des Immunsystems [Malek et al., 2017]. Es gibt Hinweise darauf, dass die NUG eines der ersten Anzeichen für eine HIV-Infektion sein könnte, jedoch sind die oralen Kardinalläsionen schwer zu diagnostizieren und führen aufgrund der niedrigen Prävalenz HIV-Kranker gegenüber der nicht infizierten Bevölkerung zu zahlreichen falsch-positiven Befunden [Reichart, 2003].
Parodontitis
Gegenüber der NUG, die sich streng auf die marginale Gingiva begrenzt, ist die nekrotisierende, ulzerierende Parodontitis abzugrenzen, die sich über die Papille und die marginale Gingiva hinaus erstreckt und zu einem Verlust des gingivalen Attachments und zu freiliegendem Knochen führt. Nicht selten werden diese Erkrankungsformen auch als ineinander übergehende Stadien der Krankheit aufgefasst, deren Endstadium die nekrotisierende Stomatitis darstellt. Diese erstreckt sich über das Parodont hinaus auf die Mukosa und den Knochen und führt typischerweise zu starken Schmerzen [Reichart, 2003].
Lineares Gingivaerythem
Ein weiteres orales Symptom ist das Lineare Gingivaerythem (LGE). Dieses zeigt diffuse und punktuelle Erytheme der marginalen Gingiva mit spontanen Blutungen [Reichart, 2003]. Vermutungen legen nahe, dass es sich bei den genannten Entitäten um prinzipiell die gleichen Erkrankungen handelt, wie sie auch bei nicht-infizierten Personen auftreten, wobei der Infektion mit dem HI-Virus eine initialisierende und progressionsfördernde Wirkung zugesprochen wird [Reichart, 2003].
Kaposi-Sarkom
Zu den typischen oralen Neoplasien unter HIV-Infektion zählt das Kaposi-Sarkom. Es entsteht durch die maligne Transformation lymphatischer endothelialer Zellen nach Infektion mit dem Humanen Herpes Virus 8 – insbesondere unter Immunsuppression. Diese Entität wird entsprechend der Ursache und des Symptombildes in vier Gruppen eingeteilt. Das epidemische oder auch AIDS-assoziierte Kaposi-Sarkom ist das häufigste AIDS-assoziierte Malignom in Deutschland und den USA. Die Erstmanifestation geschieht meist in Form zahlreicher Makulae in den Hautspaltlinien der betroffenen Personen. An den distalen Extremitäten entstehen indurierte, rötlich-braune bis violette Makulae, die später flächig konfluieren und schmerzhafte Knoten bilden. Durch die Ummauerung von Lymphbahnen kann es zu Ödemen kommen; befallene Organe sind die Lymphknoten, der Gastrointestinaltrakt, die Leber und die Lunge ebenso wie Niere und Milz [DGHO, 2018]. In 80 Prozent der Fälle kommt es zu einem oralen Befall – meist im Bereich des Gaumens, der befestigten Gingiva oder des Zungenrückens. Das Vorkommen mukosaler Läsionen wird signifikant mit einer geringeren Anzahl CD4+-Lymphozyten assoziiert [Reichart, 2003]. Bei einem vorher nicht therapierten Patienten kann durch eine gezielte antiretrovirale Therapie ein Progressionsstillstand oder sogar das Verschwinden der Erkrankung erreicht werden [Reichart, 2003; DGHO, 2018].
Non-Hodgkin-Lymphom
Neben dem Kaposi-Sarkom sind aggressive B-Zell-Non-Hodgkin-Lymphome (NHL) die zweithäufigste HIV-assoziierte Neoplasie und führen die Liste der AIDS-assoziierten Todesursachen an. Das Risiko zur Entwicklung eines HIV-NHL nimmt mit fallender CD4-Zellzahl zu und lag vor Einführung der antiretroviralen Therapie (ART) bei einer gegenüber der Normalbevölkerung 60- bis 200-fachen Inzidenzrate [Onkopedia, 2019]. Als hierfür ursächlich erachtet werden eine chronische Antigenstimulation und die Zytokin-Dysregulation unter HIV-Erkrankung ebenso wie die Koinfektion mit onkogenen Viren. Zu den häufigsten HIV-NHL zählen das diffuse großzellige B-Zell-Lymphom, Burkitt-Lymphome und Hodgkin-Lymphome. Das grundsätzliche Therapieziel ist kurativ, wobei im Fall HIV-NHL simultan zur Chemotherapie eine ART verabreicht wird. Hierbei ist zu beachten, dass dies zu einer deutlichen Steigerung der Chemotherapie-assoziierten Toxizität führt [Onkopedia, 2019].
Plasmoblastische Lymphome sind eine seltene Lymphomentität, weisen weder B- noch T-Zellmarker auf und entwickeln sich häufig im Bereich der Mundhöhle. Sie machen etwa 2,6 Prozent aller AIDS-assoziierten Lymphome aus und treten gehäuft um das 39. Lebensjahr auf [Castillo und Reagan, 2011]. Der Tumor besteht aus plasmazystischen Zellen mit runder oder ovaler Form, die von kleinen, reifen Lymphozyten umgeben sind.
Typische Prädilektionsstellen sind die Mundhöhle, gefolgt von dem Gastrointestinaltrakt, den Lymphknoten und der Haut. 60 Prozent der Patienten werden erst in fortgeschrittenen Krankheitsstadien erstdiagnostiziert. Die Responserate auf eine Chemotherapie wird mit 77 Prozent angegeben, wobei 46 Prozent der Patienten eine komplette und drei Prozent eine partielle Remission erreichen. Ohne Gabe einer Chemotherapie liegt die mittlere Überlebenszeit bei drei Monaten. Eine simultane ART wird mit einer besseren Überlebensrate assoziiert. Bisherige Studien konnten eine mittlere Überlebenszeit von lediglich 14 Monaten und eine Fünf-Jahres-Überlebensrate von 31 Prozent nachweisen [Castillo und Reagan, 2011]. Durch eine primäre konsolidierende Hochdosischemotherapie mit anschließender autologer Stammzelltransplantation konnte in einer kleinen Fallserie mit vier Patienten eine anhaltende Remission erreicht werden [Onkopedia, 2019].
Diagnostik
Spezifische Antikörper gegen das HI-Virus entwickeln sich typischerweise zwei bis zehn Wochen nach der Infektion. Innerhalb der ersten Wochen ist die Ansteckungsfähigkeit aufgrund der hohen Viruslast besonders hoch, stagniert im Latenzstadium und steigt mit zunehmender Immundefizienz wieder an. Innerhalb der ersten zwei Erkrankungsjahre ist die Rate der AIDS-Erkrankungen gering und steigt in den darauffolgenden Jahren pro Jahr um sechs Prozent an [RKI, 2018].
Die HIV-Diagnostik erfolgt in einem zweistufigen Testverfahren mit einem Such- und einem Bestätigungstest. Bei dem Suchtest werden Antikörper gegen das Virus gemessen. Dieser ist durchschnittlich 22 Tage nach Exposition positiv – jedoch sollte aufgrund der oben genannten variablen Zeit bis zur Antikörperbildung ein Sicherheitsfenster von zwölf Wochen eingehalten werden. Bei dem Bestätigungstest handelt es sich meist um einen Immunoblot, der die Bindungsspezifität der Antikörper an bestimmte virale Proteine mit einer hohen Spezifität untersucht. Neben der HIV-Diagnostik sollte nach Stellung einer Erstdiagnose der Erkrankung außerdem der Serostatus weiterer übertragbarer Erkrankungen wie Tuberkulose, Hepatitis A, B und C und Syphilis getestet werden. Insbesondere im Rahmen einer Immunschwäche ist das Risiko erhöht, an einer offenen Tuberkulose zu erkranken. Handelt es sich beim Übertragungsweg um eine Weitergabe durch Sexualkontakte, sollte auch auf andere sexuell übertragbare Erkrankungen wie Infektionen mit dem Humanen Papillomavirus, Chlamydien und Gonokokken getestet werden [RKI, 2018].
Therapie
Die Indikation einer antiretroviralen Therapie wird anhand des Krankheitsstadiums, der CD4-Zellzahl und der Viruslast gestellt [Deutsche AIDS-Gesellschaft, 2014]. Bei den gängigen Medikamenten zur Therapie des HI-Virus handelt es sich um Inhibitoren viraler Enzyme. Sie werden entsprechend ihres Angriffspunkts an der Zielzelle in fünf Gruppen unterteilt [RKI, 2018]. Ziel der Therapie ist es, die durch das Virus induzierte Entstehung des Immundefekts und die damit einhergehenden Komplikationen zu verhindern [RKI, 2018]. Seit Einführung der ART konnten die Viruslast, die Morbidität und die Mortalität der Patienten mit HIV-Erkrankung deutlich gesenkt werden. Der Mortalitätsindex sank von ursprünglich 97,4 Prozent im Jahr 1993 auf 19,8 Prozent im Jahr 2001 [Goncalves et al., 2013]. Zum aktuellen Zeitpunkt wissen etwa 78 bis 85 Prozent der Patienten um ihren Status, etwa 61 bis 73 Prozent erhalten eine ART und 54 bis 65 Prozent der Patienten mit HIV-Erkrankung haben eine virale Suppression unterhalb der Nachweisgrenze. Trotz der Fortschritte in der antiretroviralen Therapie konnte bisher keine Lösung für die Heilung der Erkrankung gefunden werden [Lorosa et al., 2019]. Dass etwa zehn bis zwölf Prozent der Patienten in Deutschland gegen ein oder mehrere antiretrovirale Medikamente resistente Erreger aufweisen, erschwert die effektive Therapie betroffener Personen [Deutsche AIDS-Gesellschaft, 2014].
Es konnte gezeigt werden, dass das LGE als Gingivaerkrankung fungaler Ursache einen signifikant prädiktiven Wert von 70 Prozent für eine Immunsuppression und unter HIV-Erkrankung einer CD4-Zellzahl von unter 200 Zellen/mm3 besitzt. Entsprechend nimmt die frühe Diagnose eines LGE einen hohen Stellenwert in der Frühdiagnose einer HIV-Erkrankung ein. Trotz der Assoziation der unterschiedlichen Formen mit einer Immundefizienz ist bisher unklar, ob eine antiretrovirale Therapie einen Einfluss auf die klinischen Faktoren der gingivalen und parodontalen Erkrankungen bei HIV-infizierten Patienten besitzt [Goncalves et al., 2013]. Gezeigt werden konnte, dass orale Manifestationen unter einer adäquaten ART seltener vorkommen [Tappuni und Fleming, 2001].
In der Zahnarztpraxis
Studien haben ergeben, dass – trotz der hohen Relevanz der oralen Gesundheit bei HIV-Infizierten – viele Patienten heutzutage noch keine adäquate zahnärztliche Therapie erhalten [Lorosa et al., 2019]. Anhand einer Studie konnte zwar festgestellt werden, dass die Studierenden die grundlegenden Kenntnisse über die wichtigsten oralen Manifestationen einer HIV-Erkrankung kannten und wussten, dass Schutzmaßnahmen getroffen werden sollten, jedoch auch zahlreiche Unklarheiten bestanden. Zu diesen zählen einerseits die Form und Auswertung der HIV-Testung ebenso wie die Beziehung zu anderen infektiösen Erkrankungen wie Hepatitis, zahlreiche andere Formen der oralen Manifestation und das Wissen darum, welche Körperflüssigkeiten infektiöses Material darstellen [Lorosa et al., 2019].
Grundsätzlich gilt, dass nach Behandlung eines HIV-Infizierten die routinemäßigen Hygienemaßnahmen wie die Desinfektion der Oberflächen und die sachgerechte Aufarbeitung der verwendeten Instrumentarien getroffen werden müssen. Weder ist eine eigene Räumlichkeit noch die Separation von anderen Patienten notwendig. Da der Infektionsstatus des zu behandelnden Patienten in den meisten Fällen unbekannt ist, sollten grundsätzlich bei allen Patienten adäquate Basishygienemaßnahmen getroffen werden. Diese beinhalten das Tragen von Handschuhen bei Kontakt zu erregerhaltigem Material und das Anlegen eines Schutzkittels, eines Mund-Nase-Schutzes und gegebenenfalls einer Schutzbrille bei Bildung erregerhaltiger Tröpfchen [RKI, 2018]. Die notwendigen Basishygienemaßnahmen sind übersichtlich in den Empfehlungen der KRINKO zusammengefasst [Ruscher, 2015].
Im Fall eines Unfalls mit kontaminiertem Material HIV-infizierter Patienten, wie Nadelstich- oder Schnittverletzungen, sollte eine Postexpositionsprophylaxe erwogen und typischerweise über vier Wochen eingenommen werden. Der Unfall ist umgehend als Arbeitsunfall an den zuständigen Dienstarzt zu melden. Die Nachuntersuchungen finden aufgrund der potenziell verzögerten Nachweisbarkeit einer Infektion nach sechs Wochen und sechs Monaten statt. Das Übertragungsrisiko einer perkutanen Verletzung liegt bei etwa 1:300. Weitere Informationen hierzu findet man in der Deutsch-Österreichischen Leitlinie zur postexpositionellen Prophylaxe der HIV-Infektion [RKI, 2018].
Im Fall eines direkten oder indirekten HIV-Nachweises sollte dieser spätestens zwei Wochen nach Diagnosestellung nichtnamentlich gemeldet werden [RKI, 2018].
Zusammenfassung
Das HI-Virus stellt mit einer Neuinfektionsrate von 6,5 auf 100.000 Einwohner pro Jahr in Europa auch heute noch eines der führenden Gesundheitsprobleme dar. Etwa 70 Prozent der Patienten werden erst in fortgeschrittenen Krankheitsstadien diagnostiziert. Zu den Frühsymptomen der Erkrankung zählen auch insbesondere enoral auftretende Krankheitsbilder, wie das Lineare Gingivaerythem, die nekrotisierende, ulzerierende Parodontitis und Gingivitis. Die häufigsten Manifestationsformen sind die orale Candidose und die orale Haarleukoplakie. Gerade in Anbetracht dieser Umstände wird die Bedeutung des Zahnarztes bei der Erstdiagnose einer HIV-Erkrankung deutlich.
Neben dem Kaposi-Sarkom sind aggressive B-Zell-Non-Hodgkin-Lymphome die zweithäufigste HIV-assoziierte Neoplasie und führen die Liste der AIDS-assoziierten Todesursachen an. Wie im vorliegenden Fall dargestellt, ist die Differenzialdiagnostik in einem solchen Fall nicht leicht und weist auf die Relevanz der – insbesondere repräsentativen – Biopsie hin. Bei inkonklusiven Ergebnissen ist unbedingt eine Wiederholung der Probenentnahme durchzuführen, um eine Verzögerung der Therapie zu verhindern.
Diana Heimes
Klinik und Poliklinik für Mund-, Kiefer und Gesichtschirurgie – plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
PD Dr. Dr. Peer W. Kämmerer, Ma, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer und Gesichtschirurgie – plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Literaturliste
Castillo, J. J. and J. L. Reagan (2011). „Plasmablastic lymphoma: a systematic review.“ ScientificWorldJournal 11: 687-696.
Deutsche AIDS-Gesellschaft (2014). Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion.
DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V. (2018). Leitlinie: Kaposi-Sarkom.
Goncalves, L. S., B. M. Goncalves and T. V. Fontes (2013). „Periodontal disease in HIV-infected adults in the HAART era: Clinical, immunological, and microbiological aspects.“ Arch Oral Biol 58(10): 1385-1396.
Herold, G. (2016). Innere Medizin. Köln.
Lorosa, A. H., C. M. Pereira, R. P. Hussne and C. M. Silva-Boghossian (2019). „Evaluation of dental students' knowledge and patient care towards HIV/AIDS individuals.“ Eur J Dent Educ 23(2): 212-219.
Malek, R., A. Gharibi, N. Khlil and J. Kissa (2017). „Necrotizing Ulcerative Gingivitis.“ Contemp Clin Dent 8(3): 496-500.
Onkopedia (2019). HIV-assoziierte Lymphome – Leitlinie. DGHO Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e.V.
Reichart, P. A. (2003). „Oral manifestations in HIV infection: fungal and bacterial infections, Kaposi's sarcoma.“ Med Microbiol Immunol 192(3): 165-169.
RKI. (2018, 22.11.2018). „RKI Ratgeber: HIV-Infektion/AIDS.“ 2020, from www.rki.de/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber_HIV_AIDS.html.
Ruscher, C. (2015). „Infektionspravention im Rahmen der Pflege und Behandlung von Patienten mit ubertragbaren Krankheiten. Empfehlung der Kommission fur Krankenhaushygiene und Infektionspravention (KRINKO) beim Robert Koch-Institut.“ Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 58(10): 1151-1170.
Tappuni, A. R. and G. J. Fleming (2001). „The effect of antiretroviral therapy on the prevalence of oral manifestations in HIV-infected patients: a UK study.“ Oral Surg Oral Med Oral Pathol Oral Radiol Endod 92(6): 623-628.
UAIDS (2020). Global AIDS Update – Executive Summary.
WHO (2019). HIV/AIDS surveillance in Europe 2019 – 2018 data. European Centre for Disease Prevention and Control.