Toxikologie zahnärztlicher Restaurationsmaterialien
Moderne Füllungswerkstoffe
Aufgrund der Indikationseinschränkungen für Amalgam seit 1992 durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) sowie der gestiegenen ästhetischen Ansprüche in der Bevölkerung werden von den Patienten in der letzten Zeit zunehmend mehr zahnfarbene Werkstoffe für Zahnrestaurationen gewünscht. Amalgam ist zwar bis heute das meist verwendete Zahnfüllungsmaterial, wegen der Toxizität von Quecksilber hat es aber seit der ersten Anwendung Diskussionen über Gefahren für Patient und Behandlungspersonal gegeben [Geurtsen 1990].
In den letzten Jahren sind zahlreiche Füllungsmaterialien beziehungsweise Materialtypen als Amalgamalternativen auf den Markt gekommen. Bei den zahnfarbenen Füllungsmaterialien unterscheidet man heute direkte und indirekte Materialien. Direkte Materialien müssen plastisch verarbeitbar sein und können deshalb direkt als Füllung appliziert werden. Indirekte Materialien müssen erst außerhalb des Mundraumes gestaltet werden (wie Inlays, Kronen). Bei den zahnfarbenen, direkten Materialien unterscheidet man nach der stattfindenden Abbindereaktion, das heißt nach dem Aushärtevorgang. Man unterscheidet zwischen Glasionomerzementen und Kompositen. Glasionomerzemente härten über eine Säure-Base-Reaktion unter Wasserfreisetzung. Komposite härten durch lichtinduzierte Polymerisation ohne Wasserabspaltung. Füllungsglasionomerzemente weisen im Vergleich zu Kompositen eine schlechtere Biegefestigkeit auf, weshalb heute den Kompositen der Vorzug gegeben wird. Komposite sind Kunststoffe, die aus einer organischen Matrix mit eingebetteten anorganischen Füllmaterialien (wie Quarze) bestehen. Als Monomere werden meist (Di-)Methacrylate verwendet, die in schwere Basismonomere (wie Bisphenol A(di)glycidylmethacrylat, BisGMA; Urethandimethacrylat, UDMA) und leichte Komonomere (beispielsweise Triethylenglycoldimethacrylat, TEGDMA; Hydroxyethylmethacrylat, HEMA) unterteilt werden. Weitere Bestandteile von Kompositen sind Photoinitiatoren oder thermische Initiatoren, die die radikalische Polymerisation der Methacrylate starten.
(Ko)Monomere werden heute in der Zahnmedizin nicht nur in Füllungswerkstoffen verwendet, sondern auch in Dentinadhäsiven, kunststoffhaltigen Zementen, Klebstoffen für Inlays, Kronen, Veneers, orthodontische Brücken, Keramiken sowie in Unterfüllungen für Amalgam- und Goldfüllungen und als Fissurenversiegler.
Biokompatibilität von Kompositen
Der Wissensstand über Toxizität und Nebenwirkungen von Amalgam und Quecksilber ist weitaus größer als von allen anderen Zahnwerkstoffen. Mögliche Nebenwirkungen und Schädigungen durch Inhaltsstoffe in Kompositen sind bekannt. Die Nebenwirkungen reichen von auftretenden Hautirritationen [Lonnroth und Shahnavaz 1997] bis hin zur Entstehung einer generalisierten motorischen und sensorischen Neuropathie [Sadoh et al. 1999]. Die genauen Ursachen von Schädigungen sind bis heute weitestgehend unbekannt. Diskutiert wird eine Devitalisierung der Pulpa durch herausgelöste Restmonomere, Additive oder Reaktionsprodukte beziehungsweise eine Pulpaschädigung durch Sekundärkaries von in den Randspalt, das heißt zwischen Füllung und Zahn eingewanderten Bakterien [Buchmann et al. 1992; Berkiten et al. 2000], die sogar Komposite als Kohlenstoffquelle nutzen können [Friedl et al. 1992]. Einige (Ko)Monomere besitzen außerdem eine hohe allergische Potenz. Allergien gegen Kunststoffe treten häufiger auf als gegen Amalgam. Bei Zahnärzten ist mit einer Zunahme der Allergien gegen bestimmte Kunststoffe zu rechnen [Munksgaard et al. 1996; Lindstrom et al. 2002].
Schädigungen können aber erst dann auftreten, wenn Komposit-Inhaltsstoffe in die Zellen und/oder in die Organsysteme gelangen. Neben Abrasion und Verschleiß können (Ko)Monomere und mehr durch Speichelzutritt, aber auch zum Beispiel durch Nahrung beziehungsweise Getränke (wie hochprozentige Alkohole), aus der Füllung ausgelaugt werden. Abradierte Partikel mit einer Größe bis zu 100 μm können sogar inhaliert werden und über die Lunge in die Blutbahn gelangen. Wie die verschluckten oder inhalierten (Ko)Monomere oder Partikel resorbiert werden, war bis dato weitestgehend unbekannt. Erste Ergebnisse sollen in diesem Artikel präsentiert werden. Amalgam wird seit Jahren kontrovers diskutiert, in letzter Zeit sind nun auch die Komposit-Kunststoffe in die Kritik geraten. In einer Untersuchung wurde sogar auf die östrogene beziehungsweise cancerogene Wirkung von Inhaltsstoffen in Kunststoffen hingewiesen [Olea et al. 1996]. Seit 1996 fordert die Internationale Gesellschaft für Ganzheitliche Zahnmedizin e.V. wegen der Gefährlichkeit die Einstellung aller Komposit- Anwendungen, einschließlich der Fissurenversiegelung. Es muss aber allgemein festgehalten werden, dass zahlreiche Behauptungen über Toxizität und Nebenwirkungen von Kompositen ohne Existenz von wissenschaftlichen fundierten Untersuchungen abgegeben wurden. Die Kriterien für die Auswahl wie die Entscheidung für die Indikation von Füllungsmaterialien dürfen aber nur auf der Grundlage wissenschaftlicher Erkenntnisse erfolgen.
Freisetzung von Restmonomeren
Die Polymerisation der Monomere und vor allem der Komonomere verläuft nicht vollständig. Mit Hilfe der Infrarot(IR)-Spektroskopie lässt sich der Prozentsatz an nicht umgesetzten Doppelbindungen im Komposit bestimmen. Er beträgt je nach Schichttiefe 20 bis 70 Prozent, wobei sowohl die Bestrahlungszeit als auch die Beschaffenheit der Oberflächenschicht eine Rolle spielen [Hellwig et al. 1995]. Durch quantitative Bestimmung wurde für einige Komposite nach zwei Wochen Extraktion in Wasser eine gesamte Restmonomerabgabe in vitro von 0,2 bis zwei Gew. Prozent festgestellt [Ferracane und Condon 1990; Ortengren et al. 2001].
Eluate aus Kompositen können mit verschiedenen Methoden, wie der HPLC (High- Performance-Liquid-Chromatography), getrennt werden. Diese haben aber den Nachteil, dass die Identifizierung unbekannter Substanzen nur durch den direkten Vergleich mit Referenzsubstanzen möglich ist. Die Identifizierung von (Ko)Monomeren beziehungsweise (Ko)Monomer- Metaboliten aus Proben, die aus In-vivo- Experimenten gewonnen wurden, zum Beispiel von Urin, Fäzes, Galle, Blut oder Geweben, ist mit diesen Methoden nicht möglich .
Einsatz von radioaktiv markierten Materialien
In Zusammenarbeit mit dem Prins-Maurits- Laboratorium (TNO, Rijswijk, Niederlande) war es möglich, das radioaktiv markierte Komonomer 14C-TEGDMA in genügender Menge zu synthetisieren. Dieses wurde dann im Tierexperiment eingesetzt. Die Bestimmungen der 14C-Gehalte in den erwähnten Körperflüssigkeiten beziehungsweise Geweben konnten so durchgeführt und toxikokinetische Daten (beispielsweise Resorption, Elimination) von 14CTEGDMA erhalten werden.
Toxikokinetik von Restaurationsmaterialien
Dem Gastrointestinaltrakt kommt bei der (Ko)Monomeraufnahme eine wichtige Rolle zu. Aus den Zahnfüllungen freigesetzte (Ko)Monomere können mit dem Speichel in den Magen-Darm-Trakt und nach der Resorption mit dem Blut in die Organe gelangen. Mit der Methode der Darmperfusion in situ (Pendelperfusion) [Reichl et al. 1994] ist es möglich, sowohl die Menge an radioaktiv markierten (Ko)Monomeren zu bestimmen, die über das Dünn- und Dickdarmepithel resorbiert wird und in die Blutbahn gelangt, als auch die Menge, die mit der Galle ins Darmlumen ausgeschieden wird. Des Weiteren lassen sich für (Ko)Monomere eventuell existierende Transportmechanismen für die Ausscheidung mit der Galle, die Plasmahalbwertzeiten, sowie die Zielorgane bei einer Exposition ermitteln.
Dabei zeigte sich, dass 14C innerhalb von einer Stunde zu etwa vier Prozent der eingesetzten 14C-TEGDMA-Dosis mit der Galle über einen aktiven Transportmechanismus ausgeschieden wird. In der Niere wurden die höchsten 14C-Gehalte gemessen (siehe Abb. 1), sie gilt deshalb als das Zielorgan bei einer akuten Exposition mit TEGDMA. Die Gesamtwiederfindung der 14C-Aktivität lag unter 25 Prozent der eingesetzten 14CTEGDMA- Dosis, so dass eine Anreicherung von 14C-TEGDMA in anderen Organen und/oder eine Ausscheidung mit dem Urin postuliert wurde [Reichl et al. 2001a, b].
In den folgenden Experimenten wurde die urinäre und die fäkale 14C-Ausscheidung sowie die Verteilung von 14C in allen Organen nach per oraler und subcutaner 14CTEGDMA Verabreichung beim Meerschweinchen untersucht. Die Tiere schieden innerhalb von 24 Stunden 14C mit dem Urin zu etwa 15 Prozent und mit den Fäzes zu weniger als einem Prozent der eingesetzten 14C-TEGDMA-Dosis aus. 14C wurde nahezu vollständig im Darm resorbiert. Einschließlich des Gehaltes an 14C in allen Organen ergab sich wieder nur eine Wiederfindung von zirka 20 Prozent der eingesetzten 14C-TEGDMA-Dosis, so dass die Ausscheidung von gasfömigen 14C-Anteilen postuliert wurde [Reichl et al. 2001a, b]. Anschließend wurde eine Methode zum Nachweis gasfömiger Metabolite in vivo entwickelt. Dabei wird die Exhalationsluft durch gekühlte, in Serie geschaltete, mit Natronlauge gefüllte Glasflaschen zur Absorption von 14C-Kohlendioxid geleitet und als 14C-Natriumbicarbonat gemessen (siehe Abb. 2). Dabei konnte tatsächlich die Bildung von 14C-Kohlendioxid nachgewiesen werden (65 Prozent innerhalb von 24 Stunden). Die 14C-Wiederfindung lag jetzt bei über 90 Prozent (siehe Abb. 3). Aus diesen Ergebnissen wird der Metabolismus von TEGDMA abgeleitet und dabei die Bildung von toxischen Metaboliten postuliert [Reichl et al. 2001a, b]. Ähnliche Ergebnisse wurden auch nach Applikation von 14C-HEMA erhalten [Reichl et al. 2002a]. Die Exhalation stellt somit den Hauptweg der Elimination des Kohlenstoff-Labels beider Komonomere beziehungsweise deren Metabolite dar.
Metaboliten beim Abbau von TEGDMA und HEMA
TEGDMA wurde an der Carboxylgruppe mit 14C markiert (siehe Abb. 4). Aus dem Nachweis der Bildung von 14C-Kohlendioxid aus 14C-TEGDMA wird die Existenz von zwei Stoffwechselwegen postuliert. Der erste Stoffwechselweg könnte mit der enzymatischen Hydrolyse von 14C-TEGDMA zu Methacrylsäure und Triethylenglycol durch unspezifische Esterasen beginnen (siehe Abb. 4). Methacrylsäure könnte dann ähnlich der Aminosäure Valin im Organismus abgebaut werden. Der Abbau von Valin beginnt mit der Transaminierung zu alpha-Ketoisovalerat. Die oxidative Decarboxylierung führt dann zu Isobutyryl-CoA, das eine C-C-Doppelbindung enthält. 14C-Methacrylyl- CoA ist äquivalent mit dem Thioester von 14C-Methacrylsäure und Coenzym A, das aus 14C-TEGDMA gebildet werden könnte. Die Decarboxylierung von 14C-LMalat könnte zur Bildung von 14C-Kohlendioxid und unmarkiertem Pyruvat führen [Reichl et al. 2002b].
Der zweite Stoffwechselweg, der ebenfalls zur Bildung von 14CO2 aus 14C-TEGDMA führen würde, wäre ebenfalls gekennzeichnet durch die hydrolytische Spaltung von 14C-TEGDMA zu 14C-Methacrylsäure und Triethylenglycol. Hier würde aber dann die C-C-Doppelbindung von 14C-Methacrylsäure zu Formaldehyd und markiertem 14CPyruvat oxidiert werden. Bei diesem Stoffwechselweg wird die Bildung des Epoxid-Intermediats 14C-2,3-Epoxymethacrylsäure und/oder das cyclische Peroxid-Intermediate 14C-2,3-Epidioxymethacrylsäure postuliert (siehe Abb. 4). 14C-Pyruvat könnte dann weiter decarboxyliert werden zu Acetat und 14CO2.
Epoxide (und Peroxide) gelten als sehr toxische (vorwiegend cancerogene und mutagene) Substanzen. Es sind keine toxikologischen Daten der Intermediate 14C-2,3- Epoxymethacrylsäure und/oder des cyclischen Peroxid 14C-2,3-Epidioxymethacrylsäure in der Literatur verfügbar. Die tatsächliche Bildung dieser toxischen Intermediate beim Abbau von TEGDMA in vivo wird unterstützt durch die Daten aus der Analyse von Galleproben, die in den oben erwähnten Tierexperimenten gewonnen wurden. In diesen Experimenten konnte gezeigt werden, dass bis zu 40mal mehr 14C-Pyruvat, im Vergleich zu 14C-L-Malat, gebildet wird. Diese Ergebnisse belegen die Bildung von 14C-Pyruvat und sprechen deshalb für die Existenz der Bildung von toxischen (wahrscheinlich cancerogenen und mutagenen) Metaboliten beim Abbau von TEGDMA im Organismus [Reichl et al. 2002b]. Ähnliche Resultate wurden auch beim Abbau von 14C-HEMA erhalten, das offensichtlich nach dem gleichen Schema wie TEGDMA im Körper verstoffwechselt wird [Reichl et al. 2003a].
Aufgrund der Ergebnisse aus den toxikokinetischen In-vivo-Untersuchungen, das heißt der möglichen Bildung von mutagenen und cancerogenen Metaboliten beim Abbau von TEGDMA beziehungsweise HEMA, wurden eine Reihe von Untersuchungen zur Cytotoxizität und Mutagenität dieser zahnärztlichen Restaurationsmaterialien angeschlossen. Einige bereits erhaltene Ergebnisse sollen hier vorgestellt werden:
Einfluss von TEGDMA auf die Gluconeogenese
Eine geeignete Methode für Untersuchungen von Einflüssen von Fremdstoffen (Xenobiotika) auf den Metabolismus im Körper (Toxikodynamik) ist die Bestimmung der Neubildung der Glucose (Gluconeogenese) in Zellen. Die Gluconeogenese stellt einen phylogenetisch sehr alten Stoffwechselweg dar. Sie ist für diese Untersuchungen gut geeignet, da sie sehr eng mit vielen Bereichen des zellulären Energiestoffwechsels verbunden ist. Beeinflussungen durch Fremdstoffe können hier weitreichende Folgen haben, weil viele gebildete Intermediate dann nicht mehr in andere Stoffwechselwege einfließen können und somit weitere Schäden folgen. Zielorgan der akuten Exposition mit TEGDMA und HEMA ist die Niere (siehe oben). Deshalb wurden diese Untersuchungen mit Nierenzellen durchgeführt. Gegenstand dieser Versuchsreihe war die vergleichende toxikologische Bewertung verschiedener Kunststoff-(Ko)Monomere und anderer Zahnwerkstoffe (wie Quecksilberverbindungen) am Modell der isolierten Ratten-Nierentubulizellen. Die Vitalität der Zellen wurde durch einen Farbausschlusstest ermittelt.
Zusammenfassend zeigte sich, dass TEGDMA etwa zehnmal, Methyl-Quecksilberchlorid zirka 1000-mal und Quecksilberdichlorid (aus Amalgam) etwa 10 000-mal toxischer ist als das Komonomer HEMA [Reichl et al. 1999]. Die höhere Toxizität der Hg-Verbindungen im Vergleich zu den (Ko)Monomeren kann mit der spezifischen Bindung dieser Hg-Spezies an die Schwefelwasserstoffgruppen bestimmter Proteine erklärt werden. Die höhere Toxizität von TEGDMA gegenüber HEMA wird mit der höheren Lipophilie und einer dementsprechend schnelleren Zellgängigkeit von TEGDMA gegenüber HEMA begründet [Reichl et al. 1999].
Synergistischer Effekt von Wasserstoffperoxid mit TEGDMA auf die Gluconeogenese
Zellen reagieren oft sehr empfindlich auf exogene und endogene oxidative Veränderungen. In weiteren Versuchen zur Gluconeogenese wurde entdeckt, dass es zu einer synergistischen Wirkung der Toxizität von H2O2 nur mit TEGDMA kam. Bei allen anderen untersuchten zahnärztlichen Materialien (wie HEMA, Quecksilberverbindungen) wurden keine synergistischen toxischen Wirkung mit H2O2 beobachtet.
Der Wunsch nach weißen Zähnen steigt in der Bevölkerung stark an. Zunehmend werden in der zahnärztlichen Praxis Peroxide zum Bleichen der Zähne verwendet. Meist wird Carbamidperoxid (zehn bis 35 Prozent) eingesetzt, das äquivalent zu drei bis zwölf Prozent H2O2 ist.
Genetisch bedingt und/oder durch iatrogene Einflüsse auf das (anti)oxidative System und/oder erhöhter oxidativer Stress in Zellen können zu einem drastischen endogenen Anstieg von H2O2 im Körper führen, was wiederum Krankheiten auslösen kann [Salahudeen et al. 2000; Lee et al. 2001; Cuttle et al. 2001]. In den vorherigen Experimenten konnte gezeigt werden, dass zahnärztliche Restaurationsmaterialien die Glukoseneubildung in Nierenzellen beeinflussen können (siehe oben).
In den weiteren Untersuchungen wurde deshalb der Einfluss von H2O2 in Kombination mit zahnärztlichen Restaurationsmaterialien auf die Gluconeogenese in Nierenzellen untersucht.
Um die Toxizitäten der untersuchten Materialien vergleichen zu können, werden meist „Effective-Concentrations“ (EC) angegeben. Der EC50-Wert ist die Konzentration eines Stoffes, bei der die Wirkung (hier die Glukosebildung) um die Hälfte reduziert wird. Dabei zeigte sich, dass die Gabe von HEMA, HgCl2 oder Methylquecksilberchlorid in Kombination mit H2O2 (bis 100μmol H2O2) zu keiner Erniedrigung des EC50- Wertes führte. Die Gabe von TEGDMA in Kombination mit H2O2 führte allerdings zu einer starken Erniedrigung des EC50-Wertes von 1,9 mmol/L (ohne Zugabe von H2O2) auf 0,04 mmol/L (bei Zugabe von 100μmol/L H2O2) (siehe Abb. 5). Es wurde also eine starke Zunahme der Toxizität von TEGDMA in Kombination mit H2O2 beobachtet (synergistischer Effekt) [Reichl et al. 2003b].
Beim (gesunden) Menschen halten die körpereigenen Enzyme Katalase und Glutathionperoxidase die H2O2-Konzentration unter Normalbedingungen bei zirka 10-7 mol/L H2O2. Die hier entdeckten synergistischen Wirkungen von H2O2 mit TEGDMA in Nierenzellen in vitro treten also erst bei 1000fach höherer H2O2-Konzentration auf, im Vergleich zu den physiologischen H2O2- Konzentrationen beim Menschen. Aus vorangegangenen toxikokinetischen Studien ist ferner bekannt, dass eine Konzentration im Spontanurin beim Meerschweinchen von maximal 0,2 mmol/L TEGDMA erreicht wird, wenn dem Tier TEGDMA in einer Dosis verabreicht wird, die auch für den Menschen relevant ist. Das heißt eine Dosis eingesetzt wird, die sich aus der Freisetzung von TEGDMA aus Komposit ergibt, wenn der Mensch alle Zähne mit TEGDMA enthaltendem Komposit ersetzt hätte (worst case). Die gemessene maximale TEGDMAKonzentration im Tierurin entspricht einem Zehntel des EC50-Wertes für TEGDMA für die Hemmung der Glukoneogenese in Nierenzellen. Die Ergebnisse sprechen zwar nicht für die Entstehung einer systemischen (Schad-)Wirkung bei Personen, selbst wenn sie viele Kompositfüllungen tragen und sich öfters die Zähne bleichen lassen würden. Allerdings muss festgehalten werden, dass vor allem zahnärztliches Personal beim (täglichen) Umgang mit diesen Werkstoffen auch höheren, mitunter auch länger andauernden Konzentrationen, ausgesetzt sein kann.
Es wird empfohlen, den Einsatz von TEGDMA enthaltenden Restaurationsmaterialien bei Personen mit bekannten Krankheiten, verursacht durch ein geschädigtes (anti)oxidatives System und/oder erhöhtem oxidativen Stress, sorgfältig abzuwägen [Reichl et al. 2003b].
XTT-Test
In weiteren In-vitro-Experimenten zur Cytotoxizität von (Ko)Monomeren wurde deren Einfluss auf die intramitochondriale Dehydrogenase-Aktivität (XTT-Test) in permanenten menschlichen (A549-Zellen) und tierischen (L2-Zellen, Ratte) Lungenzelllinien untersucht. Die Messung dieses Parameters wird für die metabolische Aktivität lebender Zellen herangezogen. In diesem Testsystem werden die Zellen in einem speziellen Puffer 24 Stunden inkubiert und danach mit XTT (sodium 3’-(1-phenylaminocarbonyl)- 3,4-tetrazolium)- (4-methoxy-6-nitro)benzenesulphonic acid) behandelt. In lebenden Zellen wird durch die aktiven intramitochondrialen Dehydrogenasen das Tetrazolium-Salz XTT in ein oranges lösliches Formazan umgewandelt. Vollständig inhibierte mitochondriale Dehydrogenasen können kein Formazan aus XTT bilden. Die Formazanbildung wird photometrisch über ein Microtiterplattenlesegerät quantifiziert und der Grad beziehungsweise die Bewertung der Cytotoxizität der Testsubstanzen kann angegeben werden. Während in den Untersuchungen mit Nierenzellen (siehe Gluconeogenese oben) nur akute Effekte von Substanzen bis maximal 60 Minuten erfasst werden können, können mit dem XTT-Test auch Effekte bis zu 24 Stunden bestimmt werden. Lungenzelllinien wurden ausgewählt, weil für sie bereits Vergleichsdaten mit anderen Fremdstoffen vorliegen.
Alle untersuchten Substanzen induzierten einen dosisabhängigen Verlust der Vitalität der Lungenzellen. TEGDMA war in menschlichen A549-Lungenzellen etwa fünfmal, HgCl2 etwa 200-mal und MeHgCl zirka 300-mal toxischer als HEMA. In L2-Zellen war TEGDMA etwa zweimal, HgCl2 etwa achtmal und MeHgCl etwa 20-mal toxischer als HEMA. L2-Zellen reagieren auf Komonomere empfindlicher als A549-Zellen (siehe Tabelle 1). Die höhere Toxizität der Hg-Verbindungen im Vergleich zu den (Ko)Monomeren kann wieder mit der spezifischen Bindung dieser Hg-Spezies an die Schwefelwasserstoffgruppen bestimmter Proteine erklärt werden (siehe auch Gluconeogenese- Versuche). Für die höhere Empfindlichkeit der L2-Zellen auf Komonomere, im Vergleich zu den A549-Zellen, wird das Fehlen bestimmter Detoxifizierungsmechanismen in L2-Zellen verantwortlich gemacht [Kehe et al. 2001].
COMET-Assay
Aus den Ergebnissen der toxikokinetischen Untersuchungen (siehe oben) wird die Bildung mutagener und cancerogener Substanzen beim Abbau von TEGDMA und HEMA im Körper postuliert. In weiteren Experimenten wurden deshalb Mutagenitätsstudien durchgeführt. Ein hierfür geeigneter Test ist der so genannte Einzelzell- Mikrogelelektrophorese-Test, kurz auch COMET-Assay genannt.
Durch den COMET-Assay können die durch mutagene Noxen induzierten Schädigungen der DNA an einzelnen Zellen mit hoher Genauigkeit bestimmt werden. Zunächst werden die Zell- und Kernmembran der untersuchten Zellen durch alkalische Lyse entfernt. Im Anschluss an die nachfolgende Entspiralisierungsphase der DNA können mit dem COMET-Assay die DNA-Veränderungen detektiert werden. Neben Einzelstrangbrüchen des DNA-Moleküls werden auch überkreuzte Vernetzungen zwischen zwei DNA-Molekülen beziehungsweise DNAMolekülen und Proteinen sowie Einzelstrangbrüche, die im Zusammenhang mit einer unvollständigen Exzisionsreparatur auftreten, entdeckt [Tice et al. 2000]. Der COMET-Assay hat sich in der Vergangenheit im Vergleich mit vielen anderen labortechnischen Nachweisverfahren für mutagene DNA-Veränderungen als überlegen erwiesen. Der wichtigste Vorteil ist neben der sehr hohen Sensitivität dieses Testverfahrens die außerordentlich niedrige Nachweisbarkeitsgrenze von DNA-Schäden sowie die vergleichsweise einfache praktische Anwendbarkeit.
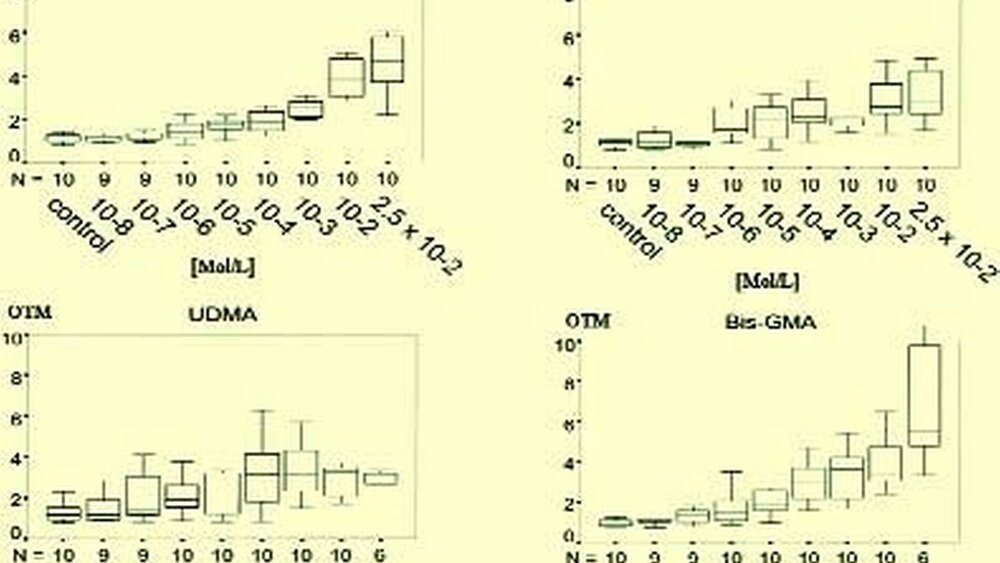
Sehr stark mutagen wirkende Substanzen, wie N-methyl-N-nitro-N-nitrosoguanidin (3,5x10-2 mM), dienen bei dieser Methode als Positivkontrolle und weisen ein so genanntes „Olive Tail Moment“ (OTM) von 35 bis 50 bei hoher Zellvitalität (75 bis 85 Prozent) auf. Das OTM ist das Maß für die Intensität der stattgefundenen DNA-Brüche. Als negative Kontrolle wird meistens DMSOLösung verwendet, mit einem OTM von 1,0 bis 1,2. Wird bei einer Substanz ein OTM von größer als 2,0 gemessen, kann auf das Vorhandensein mutagener DNA-Effekte geschlossen werden.
Tatsächlich konnten mit diesem Test mutagene Wirkungen von zahnärztlichen Restaurationsmaterialien in menschlichen Lymphozyten entdeckt werden (siehe Abb. 6). Die Exposition der Lymphozyten mit HEMA bei Konzentrationen von 10-8 bis 10-7 M führte zu einem OTM kleiner als 2. Bei einer Konzentration von 10-6 M war das OTM 2, bei 2,5x10-2 M war es 3,3 (bei 84 Prozent vitaler Zellen). TEGDMA induzierte signifikante DNA-Veränderungen ab 10-3 M mit einem Maximum bei 2,5x10-2 M mit einem OTM von 3,3. Der größte Effekt war bei BisGMA zu beobachten bei einer Konzentration von 2,5x10-2 M mit einem OTM von 7,4.
(Ko)Monomere erreichen im Speichel des Menschen nach der Elution aus Komposit- Füllungen maximal nur micromolare Konzentrationen, selbst beim Vorhandensein höchster Füllungszahlen und unter Berücksichtigung ungünstigster Umstände (zum Beispiel Alkoholkonsum fördert die Elutionsrate von (Ko)Monomeren). Die hier beschriebenen signifikanten mutagenen Effekte in Zellen treten aber erst bei (Ko)Monomer- Konzentrationen in vitro auf, die um den Faktor 5000 höher liegen.
Es gibt zwar die Anschauung, dass ein einziges mutagenes DNA-Ereignis einen Tumor induzieren kann. Dies ist aber mehr oder weniger nur von theoretischer Natur. Vielmehr muss berücksichtigt werden, dass durch die körpereigenen DNA-Reparaturbeziehungsweise Kompensationssysteme im intakten Organismus sehr wohl Reversibilität und Heilung eintreten können. Dennoch sollte in Zukunft bei der Entwicklung von neuen Zahnrestaurationsmaterialien auch daran gedacht werden, dass Stoffe nach der Freisetzung und Resorption im Körper umgewandelt (gegiftet) werden können. Es sollte deshalb frühzeitig über (Alternativ)- Lösungen zur Reduktion (oder zum Ersatz) von Stoffen, die möglicherweise im Körper zu potenziellen toxischen Substanzen metabolisiert werden können, nachgedacht werden.
Schlussfolgerung
Während für Amalgam beziehungsweise für Quecksilber umfangreiche wissenschaftliche Untersuchungen und Erkenntnisse zu Wirkmechanismen vorliegen, sind diese bei der Vielzahl der Substanzen in Kompositen und Dentinadhäsiven größtenteils noch unbekannt.
Der Nachweis von Eigenschaften in In-vitro- Systemen kann nur ein Hinweis auf eine mögliche Gefahr sein, da die vielfältigen Reparatur- und Kompensationsmöglichkeiten komplexer Organsysteme im gesamten Tier (Mensch) in diesen Modellen nicht erfasst werden können. Umgekehrt schließt ein negatives Resultat in einem In-vitro-Test nicht sicher aus, dass ein Stoff beim Menschen doch eine Wirkung zeigt. Einige Substanzen wirken nämlich nicht direkt, sondern werden erst zu aktiven Metaboliten umgewandelt.
Ziel sollte es sein, neue, weniger (Ko)Monomer freisetzende Komposite zu entwickeln, die damit zur geringeren Belastung im menschlichen Körper führen und deshalb das Risiko einer möglichen gesundheitlichen Beeinträchtigung minimieren helfen.
Prof. Dr. Dr. Franz-Xaver ReichlWalther-Straub-InstitutNussbaumstr. 2680336 MünchenE-Mail: reichl@lmu.de
\n
EC50-Werte (μmol/L) ± SEM
Relative Toxizität
\n
Substanz
A549 Zellen
L2 Zellen
A549 Zellen
L2 Zellen
\n
HEMA
8854 ± 1882
191 ± 28
1
1
\n
TEGDMA
1821 ± 529
111 ± 16
5
2
\n
HgCl2
41 ± 6
25 ± 5
216
8
\n
MeHgCl
27 ± 2
8 ± 5
327
24
\n