Wechselwirkungen zwischen Parodontitiden und Diabetes
Die Interaktionen zwischen parodontalen und systemischen Erkrankungen stehen seit einigen Jahren im Fokus der parodontologischen Forschung. Das besondere Interesse an dieser Thematik ist unter anderem der hohen Prävalenz von Parodontitiden, Diabetes mellitus und kardiovaskulären Erkrankungen geschuldet. Laut der 4. Mundgesundheitsstudie kommen parodontale Erkrankungen nicht nur häufig in Deutschland vor, sondern ihre Prävalenz nimmt auch bei den Senioren zu. Hier eine aktuelle Übersicht zur Assoziation beider „Volkserkrankungen“.
Entsprechend neuesten Untersuchungen kann davon ausgegangen werden, dass in Deutschland zwischen vier bis acht Prozent der Erwachsenen und zwischen 14 bis 22 Prozent der Senioren eine schwere Parodontitiserkrankung aufweisen. Eine moderate Ausprägung der Parodontitis liegt dagegen bei rund 40 Prozent der Durchschnittsbevölkerung vor. Aufgrund des zunehmenden Zahnerhalts in Deutschland ist anzunehmen, dass Parodontalerkrankungen weiter zunehmen werden [1,2].
Ähnlich verhält es sich mit der Prävalenz des Diabetes mellitus: In Deutschland lebten im Jahre 2000 rund sechs Millionen Diabetiker [3]. Im Jahre 2000 waren weltweit 171 Millionen Menschen an Diabetes erkrankt, wobei sich die Anzahl der Diabetiker bis zum Jahre 2030 voraussichtlich auf 366 Millionen erhöhen wird [4]. Parodontitiden und Diabetes mellitus sind chronische multifaktorielle Erkrankungen, die oft lange Zeit unerkannt fortschreiten und die Lebensqualität beachtlich einschränken können. Der folgende Beitrag widmet sich den Wechselwirkungen zwischen Parodontitis und Diabetes mellitus. Pathomechanismen, die den möglichen Interaktionen zwischen beiden Erkrankungen zugrunde liegen könnten, werden diskutiert.
Parodontale Erkrankungen
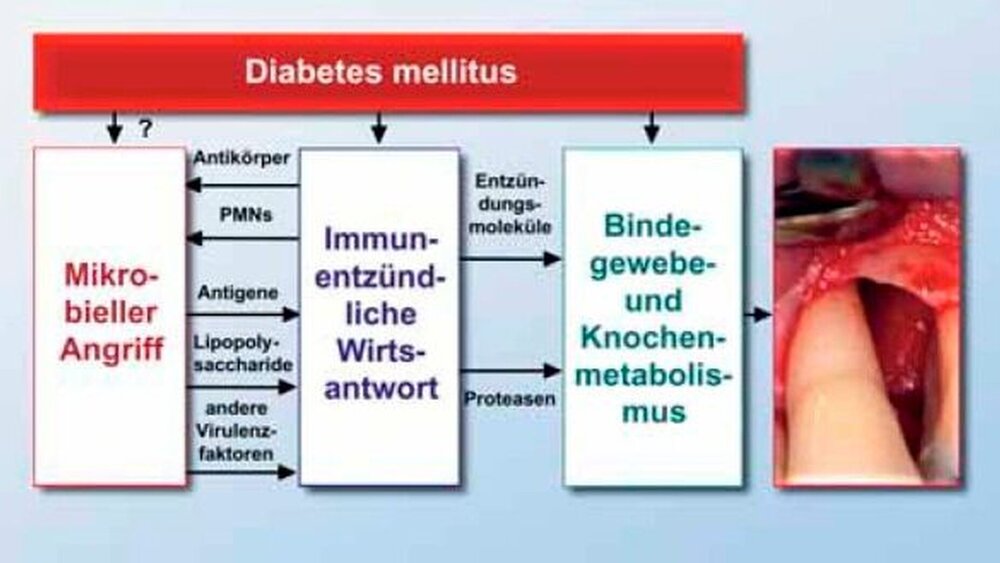
Parodontitis ist eine inflammatorische Erkrankung des Parodonts, die durch Knochen-, Kollagen- und Attachmentverlust gekennzeichnet ist (Abbildung 1). Parodontalpathogene Mikroorganismen im subgingivalen Biofilm stellen für die Entstehung einer Parodontitis eine notwendige Bedingung dar. Diese Mikroorganismen sind jedoch nicht ausreichend, um die Entstehung und Progression von parodontalen Erkrankungen erklären zu können. Bei der Parodontitis handelt es sich vielmehr um eine komplexe multifaktorielle Erkrankung, zu deren Entstehung und Fortschreiten weitere ätiologische Faktoren, zum Beispiel Rauchen, genetische Disposition, systemische Erkrankungen und psychischer Stress, beitragen. Diese Kofaktoren regulieren die immuninflammatorische Reaktion des Wirts auf die pathogenen Bakterien und dadurch auch die Destruktion des Parodonts (Abbildung 2) [5,6]. Auf pathogene Bakterien im subgingivalen Biofilm reagiert der Wirt zunächst mit der Etablierung eines Abwehrwalls aus polymorphkernigen Granulozyten (PMNs) im gingivalen Sulkus. Eine wichtige Funktion der PMNs besteht vor allem in der Phagozytose, das heißt, der Vertilgung von pathogenen Mikroorganismen, so dass ein weiteres Vordringen der Bakterien gehemmt wird. Versagt dieser Abwehrwall, gelangen Mikroorganismen, ihre Bestandteile oder Stoffwechselprodukte zunehmend ins parodontale Gewebe, wo sich subepithelial ein Abwehrwall befindet, der anfänglich vor allem aus Makrophagen besteht. Wie PMNs können Makrophagen pathogene Mikroorganismen phagozytieren. Zusätzlich besitzen Makrophagen die Fähigkeit, Antigene der phagozytierten Mikroorganismen gegenüber Lymphozyten zu präsentieren, wodurch spezifische Immunmechanismen in Gang gesetzt werden. Bei einem Fortbestehen des mikrobiellen Angriffs wird das gingivale Gewebe nun zunehmend von Lymphozyten und später auch von antikörperproduzierenden Plasmazellen infiltriert. Schließlich kann es zu einer apikalen Verschiebung des Saumepithels, Attachmentverlust und Knochenresorption kommen, so dass eine echte parodontale Tasche, das heißt Parodontitis entsteht (Abbildung 3) [7].
Diabetes mellitus
Diabetes mellitus ist eine Regulationsstörung des Stoffwechsels, deren Leitbefund die chronische Hyperglykämie darstellt. Die Ursache für die Hyperglykämie ist eine gestörte Insulinsekretion und/oder Insulinresistenz [8]. Unter einer Insulinresistenz versteht man die verminderte Insulinwirkung bei normaler Insulinmenge (relativer Insulinmangel). Insulin wird in den Beta-Zellen der Langerhansschen Inseln des Pankreas produziert. Insulin senkt die Glukosekonzentration im Blut unter anderem durch Verringerung der Glukosebereitstellung aus der Leber, durch erhöhte Glukoseaufnahme in die Skelettmuskulatur und ins Fettgewebe sowie verbesserte Glukoseverwertung in der Leber. Ob eine Hyperglykämie vorliegt, kann durch Bestimmung der Gelegenheitsglukose, der Nüchternglukose und/oder den Glukosetoleranztest festgestellt werden (Abbildung 4). Wurde ein Diabetes diagnostiziert, kann zur weiteren Kontrolle der glykämischen Einstellung der HbA1c-Wert (Anteil des glykierten Hämoglobins am Gesamthämoglobin) benutzt werden (Abbildung 5).
Bei einer Hyperglykämie kommt es zu einer verstärkten Glykierung von Proteinen, so zum Beispiel auch des Hämoglobins. Der Anteil des glykierten Hämoglobins erlaubt daher eine Aussage über die glykämische Stoffwechseleinstellung des Patienten während der letzten zwei bis drei Monate [9].
Diabetes ist eine multifaktorielle Erkrankung. Verschiedene Diabetes-Typen können unterschieden werden, wobei Typ 1– und Typ 2-Diabetes die häufigsten Formen darstellen (Abbildung 6) [8]. Charakteristisch für den Typ 1-Diabetes, der zumeist bei normgewichtigen Kindern, Jugendlichen und jungen Erwachsenen auftritt, ist die reduzierte bis fehlende Insulinsekretion. Eine Insulinresistenz liegt nicht vor. Bei Patienten mit Typ 1-Diabetes können fast immer Autoantikörper nachgewiesen werden. Früher wurde dieser Diabetestyp auch als insulinpflichtiger beziehungsweise -abhängiger Diabetes mellitus bezeichnet, da diese Patienten eine Insulintherapie benötigen. Typ 1-Diabetes kommt bei etwa fünf bis zehn Prozent aller Diabetiker vor.
Typ 2-Diabetes, der bei etwa 85 bis 90 Prozent aller Diabetiker vorliegt, beruht vor allem auf einer Insulinresistenz. Anfänglich versucht der Organismus, auf die verminderte Insulinwirkung mit einer erhöhten Insulinsekretion zu reagieren, später kann es jedoch auch beim Typ 2-Diabetes zu einer Abnahme der Insulinsekretion kommen.
Typ 2-Diabetiker befinden sich meist im mittleren oder höheren Erwachsenenalter und sind oft übergewichtig. Aufgrund der zunehmenden Prävalenz von Übergewichtigkeit und Adipositas bei Kindern und Jugendlichen tritt der Typ 2-Diabetes immer häufiger auch in diesen Altersgruppen auf.
Autoantikörper spielen bei diesem Diabetestyp keine Rolle. Eine Insulintherapie ist bei Typ 2-Diabetes zumeist erst nach jahrelangem Verlauf der Erkrankung erforderlich. Daher wurde dieser Diabetestyp früher auch als insulinunabhängiger Diabetes mellitus bezeichnet [10].
Die chronische Hyperglykämie führt an kleinen und großen Gefäßen zu pathologischen Veränderungen, das heißt zu Mikround Makroangiopathien, und dadurch zu diabetesassoziierten Folgeerkrankungen (wie Retino- und Makulopathie, Neuro- und Nephropathie, koronarer Herzkrankheit, zerebrovaskulären Erkrankungen, peripherer arterieller Verschlusskrankheit und gestörter Wundheilung). Aufgrund solcher diabetesassoziierter Komplikationen ist die Lebenserwartung bei Diabetikern im Vergleich mit Nichtdiabetikern vermindert.
Parodontopathien und Diabetes mellitus
Zahlreiche Querschnittsstudien haben gezeigt, dass Diabetes mit Parodontitis assoziiert ist [11–14]. Diese Studien wurden sowohl an Pima-Indianern, bei denen Typ 2-Diabetes besonders häufig vorkommt, als auch in anderen ethnischen Bevölkerungsgruppen durchgeführt. Entsprechend dieser Untersuchungen ist das Risiko für die Entstehung einer Parodontitis bei Diabetikern, unabhängig vom Typ, um das rund Dreifache erhöht. Neben der gesteigerten Prävalenz ist auch die Inzidenz von parodontalen Erkrankungen bei Diabetikern im Vergleich mit Nichtdiabetikern gesteigert [15].
In einer Meta-Analyse, die 23 Studien aus den Jahren 1970 bis 2003 und damit insgesamt 19 245 Personen einschloss, wurden der Plaque- und Gingivaindex sowie das Ausmaß und der Schweregrad der parodontalen Erkrankungen von Diabetikern und Nichtdiabetikern verglichen (Abbildung 7) [16]. Die Analyse offenbarte, dass Diabetiker einen höheren Plaque- und Gingivaindex aufweisen. Obwohl der Schweregrad der gingivalen und parodontalen Erkrankungen bei Diabetikern gegenüber Nichtdiabetikern höher war, wurde kein signifikanter Unterschied bezüglich des Ausmaßes (Prozentsatz der von einer Gingivitis beziehungsweise Parodontitis betroffenen Stellen oder Flächen) gefunden [17]. Eine Querschnittsstudie aus dem Jahre 2006 ergab ebenfalls einen höheren Plaque- und Gingivaindex sowie einen stärkeren Attachmentverlust bei Diabetikern. Außerdem wiesen Diabetiker bei gleichem Plaqueindex einen höheren Gingivaindex als Nichtdiabetiker auf [18]. Longitudinale Studien zeigen zudem, dass die Progression von entzündlichen Parodontopathien bei Diabetes beschleunigt ist [19,20]. Wenn nun Diabetes tatsächlich mit Parodontitis assoziiert ist, dann sollte die Diabetesprävalenz bei Parodontitispatienten im Vergleich mit parodontal gesunden Individuen erhöht sein. Dies konnte auch tatsächlich gezeigt werden: Patienten mit Parodontitis waren doppelt so häufig an einem Diabetes erkrankt wie parodontal gesunde Individuen [21]. Insgesamt kann festgehalten werden, dass Prävalenz, Inzidenz und Schweregrad von parodontalen Erkrankungen bei Diabetikern, unabhängig vom Diabetestyp, erhöht sind und dass parodontale Erkrankungen bei Diabetikern im Vergleich mit Nichtdiabetikern stärker progredient sind.
Parodontitisrisiko und Diabetesdauer
Zahlreiche Studien an Diabetikern deuten daraufhin, dass das erhöhte Risiko für parodontale Erkrankungen von der glykämischen Einstellung des Diabetes abhängt. So hatten zum Beispiel in einer großen Querschnittsstudie schlecht eingestellte Typ 2-Diabetiker (HbA1c > 9 Prozent) signifikant häufiger eine schwere Parodontitis als Nichtdiabetiker. Zwischen besser eingestellten Diabetikern und Nichtdiabetikern war dagegen kein signifikanter Unterschied bezüglich des Auftretens von schwerer Parodontitis nachweisbar [12]. Weitere Studien bestätigen, dass der Parodontalzustand von Diabetikern mit guter glykämischer Einstellung dem von Nichtdiabetikern ähnelt, wohingegen mit schwindender glykämischer Kontrolle Prävalenz und Schweregrad der Parodontitis zunehmen [22–26]. Auch das erhöhte Risiko eines Diabetikers für die Ausbildung einer Gingivitis wird maßgeblich von der Blutzuckereinstellung bestimmt [27].
”Parodontal erkrankte Diabetiker mit guter Blutzuckereinstellung können wie Nichtdiabetiker erfolgreich parodontal behandelt werden. Auch parodontal-chirurgische Eingriffe können problemlos vorgenommen werden."
Je länger ein Diabetes bei einem Patienten besteht, desto größer und nachhaltiger könnte der Effekt einer Hyperglykämie auf die parodontalen Gewebe ausfallen. Somit ist auch der Zusammenhang zwischen Parodontitis und Diabetesdauer untersucht worden. In einigen Studien wurde eine Korrelation zwischen Diabetesdauer und parodontaler Destruktion gefunden [28–30], wohingegen in anderen Untersuchungen kein Zusammenhang zwischen der Dauer des Diabetes und dem Parodontalzustand nachweisbar war [22].
Parodontitis und Diabetes-Folgeerkrankungen
Zahlreiche Querschnittsstudien haben zudem gezeigt, dass gingivale und parodontale Erkrankungen nicht nur mit Diabetes, sondern auch mit diabetesbedingten Begleiterkrankungen, wie Retinopathie, Neuropathie und Nephropathie, assoziiert sind [31–35].
Erwähnenswert sind insbesondere die wenigen Longitudinalstudien, die sich dem Zusammenhang zwischen glykämischer Kontrolle, diabetesassoziierten Komplikationen und parodontalen Erkrankungen gewidmet haben [36–39]. In einer 2005 veröffentlichten Langzeitstudie wurde der Einfluss von Parodontitis auf die allgemeine und kardiovaskuläre Mortalitätsrate bei Pima-Indianern mit Typ 2-Diabetes untersucht. Diabetiker mit schwerer Parodontitis hatten ein erhöhtes Risiko für kardiorenale Mortalität im Vergleich mit Diabetikern, die keine oder nur eine milde und moderate Parodontitis besaßen. Bei Diabetikern mit schwerer Parodontitis war die Todesrate für ischämische Herzerkrankung 2,3-fach und für diabetische Nephropathie 8,5-fach höher als bei parodontal gesunden oder parodontal weniger schwer erkrankten Diabetikern [37]. Eine weitere Longitudinalstudie an Pima-Indianern fand eine 2,1-fach erhöhte Inzidenz von Makroalbuminurie und eine 3,5-fach erhöhte Inzidenz von terminaler Niereninsuffizienz bei parodontal schwer erkrankten Typ 2-Diabetikern im Vergleich mit parodontal gesunden oder nur parodontal leicht erkrankten Diabetikern [36].
Insgesamt wird aus diesen Untersuchungen deutlich, dass parodontale Erkrankungen auch ein erhöhtes Risiko für diabetesassoziierte Komplikationen darstellen.
Parodontitistherapie bei Diabetikern
Die Beantwortung der Frage, ob Diabetiker auf eine gewöhnliche Parodontitistherapie erfolgreich ansprechen, ist klinisch von besonderer Bedeutung. Aus den verfügbaren Studien kann geschlussfolgert werden, dass der Parodontalzustand von Diabetikern durch eine parodontale Behandlung verbessert werden kann [40–51]. Mehrere Kurzund Langzeituntersuchungen legen nahe, dass metabolisch gut eingestellte Diabetiker genauso gut auf eine Parodontitistherapie ansprechen wie Nichtdiabetiker und dass die Ergebnisse nach parodontaler Therapie gleichermaßen erfolgreich aufrechterhalten werden können [41,50,52,53]. Bei schlechter glykämischer Einstellung kann dagegen die Therapieantwort reduziert sein. So weisen hyperglykämische Diabetiker im Vergleich mit gut eingestellten Diabetikern und Nichtdiabetikern schlechtere Langzeitergebnisse nach parodontaler Therapie auf [54].
In einigen Studien wurde der Effekt einer lokalen oder systemischen Gabe eines Antibiotikums bei der nichtchirurgischen Parodontitistherapie von Diabetikern untersucht. Häufig, wenn auch nicht immer, konnte ein zusätzlicher positiver Effekt auf den Parodontalzustand durch die adjuvante Antibiotikumgabe erzielt werden [43, 45, 46, 55].
Im Fokus der parodontologischen Forschung steht vor allem auch die Frage, wie die Assoziation zwischen Parodontitis und Diabetes mellitus zustande kommt, denn die Aufdeckung der zugrunde liegenden Pathomechanismen könnte Perspektiven für eine Optimierung der parodontalen Therapie bei Diabetikern eröffnen.
Es wurde gemutmaßt, dass Unterschiede hinsichtlich der mikrobiellen Zusammensetzung des subgingivalen Biofilms zwischen Diabetikern und Nichtdiabetikern existieren. Die subgingivale Mikroflora wird jedoch kaum von der glykämischen Einstellung beeinflusst [56,57]. Es scheinen eher Besonderheiten in der Wirtsabwehr oder im Metabolismus der parodontalen Gewebe zu sein, die zu einer vermehrten parodontalen Destruktion bei Diabetes führen können [58]. Im Folgenden werden kurz einige Pathomechanismen erläutert, die das erhöhte Risiko für Parodontitis bei Diabetes erklären könnten.
Einen wichtigen Pathomechanismus stellt die bei einer Hyperglykämie vermehrte Bildung von Endprodukten der fortgeschrittenen Glykierung (Advanced Glycation End Products, AGE) dar (Abbildung 8). AGE können sich in Geweben, so zum Beispiel auch in der Gingiva, ablagern [59]. Die pathogenetische Bedeutung der AGE besteht vor allem darin, dass sie Einfluss auf die immuninflammatorischen Prozesse im Parodont sowie die Homöostase der parodontalen Gewebe nehmen. AGE können beispielsweise die funktionellen Eigenschaften von Matrixmolekülen wie Kollagen verändern. Kollagen wird über AGE zusätzlich vernetzt, so dass Abbau, Umbau und Erneuerung des parodontalen Bindegewebes bei Diabetes reduziert sind (Abbildung 9) [60,61]. AGE führen auch zu einer Verdickung und Änderung der funktionellen Eigenschaften der Basalmembran, die unter anderem aus Kollagen Typ IV besteht, und können dadurch den Austausch von Zellen, Sauerstoff sowie Stoffwechselprodukten in den Geweben beeinflussen [62,63].
Zusätzliche pathogenetische Effekte werden ausgelöst, wenn AGE mit ihrem Zelloberflächenrezeptor (Receptor of AGE, RAGE) interagieren. Binden zum Beispiel AGE an ihren Rezeptor auf immuninflammatorischen Zellen, kann die Freisetzung von Entzündungsmolekülen aus diesen Zellen verstärkt werden (Abbildung 10) [64,65]. Kommt es beispielsweise zur Interaktion zwischen AGE und ihrem Rezeptor auf Gefäßendothelzellen, werden verstärkt Adhäsionsmoleküle auf den Endothelzellen ausgebildet, so dass die Anheftung von Entzündungszellen an die Gefäßinnenwände und die Rekrutierung dieser Zellen ins parodontale Gewebe gefördert werden [66,67]. Zusätzlich zu diesen entzündungsfördernden Prozessen werden auch direkt gewebedestruktive Effekte durch AGE hervorgerufen. So induzieren AGE zum Beispiel die Freisetzung von Enzymen (wie Kollagenase), die die extrazelluläre Matrix abbauen [68]. AGE können aber auch die Apoptose, das heißt den programmierten Zelltod, von Fibroblasten und Osteoblasten fördern und dadurch die Synthese von Kollagen und Knochen hemmen [69]. Tierexperimentelle Studien haben die Bedeutung von AGE für parodontale Erkrankungen eindrucksvoll belegen können [70,71]. So führte beispielsweise die Neutralisierung von AGE zur Hemmung der Synthese von Entzündungsmolekülen und Enzymen sowie zur Reduktion des Alveolarknochenverlusts [70]. Ebenso konnten durch Blockierung der AGE-induzierten Effekte die Kollagenproduktion und Wundheilung bei diabetischen Tieren verbessert werden [72].
Ein weiterer Mechanismus, der für eine kausale Assoziation zwischen Parodontitis und Diabetes verantwortlich sein könnte, umfasst die Adipokine. Es handelt sich um Moleküle, die von Adipozyten, oft jedoch auch von anderen Zellen, freigesetzt werden. Das Fettgewebe wurde lange Zeit lediglich als Energiespeicher betrachtet, obwohl es sich um ein hoch aktives metabolisches und endokrines Organ handelt. Zu den Adipokinen gehören neben bekannten Entzündungsmediatoren, wie Interleukin-6, Tumornekrosefaktoralpha und C-reaktives Protein, auch Leptin, Visfatin, Resistin und Adiponektin. Adipokine regulieren nicht nur die Insulinresistenz, sondern auch Entzündungsprozesse [73]. Veränderte Adipokinspiegel, insbesondere bei adipösen Diabetikern, könnten daher entzündungsfördernd wirken [74–76].
Eine Hyperglykämie kann auch direkt zur Freisetzung von Entzündungsmediatoren führen. Werden beispielsweise Monozyten mit Glukose stimuliert, steigt die Produktion von proinflammatorischen Molekülen in diesen Zellen an [77,78].
Es ist also denkbar, dass AGE, Adipokine, Glukose und andere Faktoren zu einem erhöhten subklinischen Entzündungszustand bei Diabetes führen, so dass die lokalen parodontitisinduzierten Entzündungsprozesse verstärkt werden. Die Serumkonzentration von Entzündungsmarkern ist bei Diabetes tatsächlich erhöht [79,80]. Der diabetesinduzierte subklinische Entzündungszustand könnte zu einer „Vor“-aktivierung von Entzündungszellen führen, die dann bei einer nachfolgenden Konfrontation mit parodontalpathogenen Mikroorganismen stärker als bei Nichtdiabetikern mit der Freisetzung von Entzündungsmolekülen und Enzymen reagieren. Unterstützung findet diese Annahme zum Beispiel durch eine Untersuchung, bei der eine Gingivitis experimentell induziert wurde. In dieser klinischen Studie reagierten Typ 1-Diabetiker und Nichtdiabetiker auf die experimentelle Plaqueakkumulation mit einer gingivalen Entzündung, wobei Diabetiker eine raschere und stärkere Entzündungsantwort auf vergleichbare bakterielle Beläge entwickelten [19]. Ausdruck dieser hyperinflammatorischen Wirtsantwort sind auch die höheren Spiegel von Entzündungsmediatoren in der Sulkusflüssigkeit und in gingivalen Biopsien von Diabetikern im Vergleich mit Nichtdiabetikern bei ähnlichem Parodontalzustand [81,82].
Ein weiterer Pathomechanismus könnte darin liegen, dass das lokale Milieu in der parodontalen Tasche durch die Hyperglykämie verändert ist. Bei Diabetes ist die Glukosekonzentration in der Sulkusflüssigkeit erhöht [83]. Veränderungen in der Sulkusflüssigkeit könnten wiederum die Plaqueakkumulation und -zusammensetzung beeinflussen. Bei Tieren mit Diabetes wurden erhöhte Plaquemengen im Vergleich mit jenen ohne Diabetes gefunden [84,85]. Klinische Studien haben dagegen zu widersprüchlichen Ergebnissen geführt. Einige Studien fanden keinen Unterschied in der parodontalen Mikroflora von Diabetikern und Nichtdiabetikern, wohingegen andere Studien eine höhere Anzahl von parodontalpathogenen Bakterien bei Diabetikern nachwiesen [56,57,86–88]. Obgleich wenig Evidenz für diese Annahme bisher vorliegt, kann daher nicht ausgeschlossen werden, dass auch diabetesinduzierte Veränderungen der Biofilmmenge und/oder -zusammensetzung eine gewisse Rolle spielen.
”Bei schlechter Blutzuckereinstellung ist ein nichtchirurgisches subgingivales Debridement, gegebenenfalls mit einer systemischen Antibiotikatherapie kombiniert, ratsam. Solange keine Informationen bezüglich der Blutzuckereinstellung vorliegen, sollte lediglich eine Notfallbehandlung durchgeführt werden. Bei chirurgischen Notfallmaßnahmen ist die prophylaktische Einnahme eines Antibiotikums zur Vermeidung von postoperativen Infektionen und Wundheilungsstörungen zu empfehlen."
Die Assoziation zwischen Parodontitis und Diabetes könnte möglicherweise aber auch auf einer gemeinsamen genetischen Disposition für beide Erkrankungen beruhen [89]. In diesem Falle wäre ein spezieller Genotyp, der das Risiko sowohl für Diabetes als auch für Parodontitis erhöht, die Ursache.
Glykämische Einstellung durch parodontale Therapie
Klinisch ist von besonderem Interesse, ob parodontale Erkrankungen die glykämische Einstellung beeinflussen. Unterstützung findet diese Annahme durch klinische Studien, die gezeigt haben, dass Diabetiker mit einer Parodontitis höhere HbA1c-Werte als parodontalgesunde Diabetiker aufweisen [90] und dass der Schweregrad der parodontalen Erkrankung mit der glykämischer Einstellung assoziiert ist [23]. Sollte der Parodontalzustand tatsächlich die glykämische Einstellung beeinflussen, so müsste durch eine effektive Parodontitistherapie der HbA1c-Wert gesenkt werden können.
Obwohl dieser Nachweis aus verschiedenen Gründen in mehreren Studien nicht gelungen ist [50, 91], deuten doch zahlreiche Untersuchungen daraufhin, dass durch eine effektive Parodontitistherapie der HbA1c-Wert reduziert werden kann [47, 51, 92, 93]. In einer Meta-Analyse wurde versucht, den Effekt einer Parodontitistherapie auf die metabolische Einstellung bei Typ 1– und 2-Diabetikern zu quantifizieren (Abbildung 11) [94]. Die Analyse schloss 456 Patienten aus zehn Interventionsstudien, die zwischen 1980 und Januar 2005 publiziert worden waren, ein. Der HbA1c-Spiegel sank durch die parodontale Therapie im Durchschnitt um 0,38 Prozentpunkte, wenn alle Studien einbezogen wurden, und sogar um 0,71 Prozentpunkte, wenn nur Typ 2-Diabetiker, bei denen zusätzlich ein Antibiotikum verabreicht wurde, Berücksichtigung fanden. Diese Verbesserungen waren jedoch statistisch nicht signifikant. In einer randomisierten, kontrollierten Drei-Monatsstudie aus dem Jahre 2005 an 44 Diabetikern vom Typ 2 führte die nichtchirurgische Therapie zu einer signifikanten HbA1c–Senkung von 7,3 auf 6,5 Prozent. In der Kontrollgruppe war dagegen keine signifikante Veränderung des HbA1c-Spiegels nachweisbar [42]. Weitere erst kürzlich erschienene Interventionsstudien offenbarten ebenfalls eine (zum Teil auch signifikante) Senkung der HbA1c-Werte durch parodontale Therapie [41,44,55,95]. Auch wenn weitere multizentrische, randomisierte, kontrollierte Interventionsstudien mit höheren Patientenzahlen notwendig sind, legen die bisherigen Studien nahe, dass durch eine effektive parodontale Therapie die glykämische Einstellung bei parodontal erkrankten Diabetikern beeinflusst werden kann [96].
Parodontitisinduzierte Pathomechanismen bei D.m.
Über welche Pathomechanismen parodontale Erkrankungen die glykämische Einstellung und damit auch diabetesbedingte Begleiterkrankungen beeinflussen, ist bisher wenig erforscht. Pathogene Mikroorganismen oder ihre Bestandteile stimulieren parodontale Zellen zur Freisetzung von Entzündungsmediatoren oder gelangen über das ulzerierte Taschenepithel in die systemische Zirkulation, wo sie wiederum die Synthese von Entzündungsmolekülen induzieren. Schon durch sanfte Mastikation gelangen mikrobielle Bestandteile aus der Mundhöhle ins Blut, und dies umso stärker, je schwerer die Parodontitis ausgeprägt ist [97]. Mehrere Studien belegen, dass bei einer Parodontitis die Spiegel von Entzündungsmediatoren in der Sulkusflüssigkeit, in der Gingiva und in der systemischen Zirkulation erhöht sind [98–105]. Andererseits scheinen die bei einer Parodontitis erhöhten systemischen Entzündungsspiegel nach einer parodontalen Behandlung wieder abzufallen [92,98,106–108]. Parodontitis trägt demnach zur systemischen Entzündungsbelastung eines Individuums bei und könnte dadurch die glykämische Einstellung bei Diabetes verschlechtern. So ist zum Beispiel bekannt, dass Entzündungsmoleküle die Wirkung des Insulins verringern, das heißt die Insulinresistenz erhöhen, indem sie die Aktivierung/Phosphorylierung des Insulinrezeptors und weiterer Moleküle der intrazellulären Insulin-Signalkaskade hemmen (Abbildung 12) [109–115]. Entzündungsmoleküle können auch zu einer verminderten Produktion von Molekülen der Insulin-Signalkaskade und des Glukosetransports sowie von positiven Regulatoren der Insulinsensitivität führen. Weiterhin steigern Entzündungsmoleküle die Synthese von Hemmern der Insulin-Signalkaskade [116]. Die durch eine Parodontitis erhöhten systemischen Spiegel von Entzündungsmediatoren könnten somit ein erhöhtes Risiko für die metabolische Einstellung des Diabetes bedeuten. Andererseits könnte die durch eine Parodontitistherapie induzierte Senkung von systemischen Entzündungsmediatoren zu einer Verminderung der Insulinresistenz und dadurch zu einer Verbesserung der Blutglukosespiegel beitragen.
”Generell sollten parodontale Eingriffe möglichst kurz und atraumatisch sein sowie nur geringfügig mit der normalen Nahrungsaufnahme, Insulinapplikation und Medikamenteneinnahme interferieren. Bei großen Eingriffen oder einer Beeinträchtigung der postoperativen Nahrungs- und Medikamenteneinnahme ist eine Abstimmung mit dem Hausarzt beziehungsweise Diabetologen erforderlich."
Ein weiterer, jedoch bisher kaum untersuchter Pathomechanismus, über den eine Parodontitis die glykämische Einstellung beeinflussen könnte, stellt die Ernährung dar. Parodontal schwer erkrankte Patienten könnten sich aufgrund einer möglichen Einschränkung der Kaufunktion anders als parodontal gesunde Patienten ernähren, so dass daraus unterschiedliche Blutglukosespiegel resultieren [117,118].
Klinische Aspekte
Eine sehr gute Mundhygiene, regelmäßige zahnärztliche Kontrolluntersuchungen, professionelle Zahnreinigungen und ein effektives subgingivales Debridement sind für parodontal erkrankte Diabetiker und Nichtdiabetiker gleichermaßen essenziell. Bei parodontal erkrankten Diabetikern sind jedoch einige Besonderheiten zu beachten. Ergibt die Anamnese, dass ein Diabetes vorliegt, sollte zusätzlich erfragt werden, um welchen Diabetestyp es sich handelt, seit wann der Diabetes besteht, wie die augenblickliche glykämische Einstellung (HbA1c-Wert, Blutglukosewert) ist, ob diabetesassoziierte Komplikationen vorliegen und welche Medikamente vom Patienten derzeitig eingenommen werden. Name und Kontaktadresse des behandelnden Arztes beziehungsweise Diabetologen sollten für die weitere gemeinsame Behandlung des Patienten dokumentiert werden. Über den kausalen Zusammenhang zwischen Parodontitis und Diabetes muss der Patient aufgeklärt werden. Für die erfolgreiche Behandlung sowohl der Parodontitis als auch des Diabetes ist eine sehr gute Patientencompliance unabdingbar.
Parodontal erkrankte Diabetiker mit guter Blutzuckereinstellung können wie Nichtdiabetiker erfolgreich parodontal behandelt werden. Zusätzlich zu nichtchirurgischen Verfahren können auch parodontalchirurgische Eingriffe in Abhängigkeit von der parodontalen Situation problemlos vorgenommen werden. Bei schlechter Blutzuckereinstellung ist dagegen ein nichtchirurgisches subgingivales Debridement, gegebenenfalls mit einer systemischen Antibiotikatherapie kombiniert, ratsam. Solange keine Informationen bezüglich der Blutzuckereinstellung vorliegen, sollte lediglich eine Notfallbehandlung durchgeführt werden.
Bei chirurgischen Notfallmaßnahmen ist die prophylaktische Einnahme eines Antibiotikums zur Vermeidung von postoperativen Infektionen und Wundheilungsstörungen zu empfehlen. Der eigentliche Wahleingriff kann dann später durchgeführt werden. Generell sollten parodontale Eingriffe möglichst kurz und atraumatisch sein sowie nur geringfügig mit der normalen Nahrungsaufnahme, Insulinapplikation und Medikamenteneinnahme interferieren. Bei großen Eingriffen oder einer Beeinträchtigung der postoperativen Nahrungs- und Medikamenteneinnahme ist eine Abstimmung mit dem Hausarzt beziehungsweise Diabetologen erforderlich. Die Intervalle im Rahmen der unterstützenden Parodontitistherapie (Recall, Erhaltungstherapie) sollten relativ kurz gewählt werden. Neben den üblichen Maßnahmen zur Kontrolle der parodontalen Infektion ist die Sicherstellung einer adäquaten Blutzuckereinstellung für den Langzeiterfolg der parodontalen Therapie entscheidend.
Daher ist eine enge und vertrauensvolle Zusammenarbeit zwischen Patienten, Zahnarzt und Arzt unabdingbar [119,120]. Veranstaltungen wie der sechste „Monat der Zahngesundheit“, durchgeführt von der Bundeszahnärztekammer im Juni 2006, sowie die diesjährige Jahrestagung der Deutschen Gesellschaft für Parodontologie mit dem Thema „Orale Medizin – die Mundhöhle ein Spiegel der Allgemeingesundheit“, organisiert in Zusammenarbeit mit der Deutschen Gesellschaft für Innere Medizin, tragen diesem Ziel Rechnung.
Zusammenfassung
Prävalenz und Schweregrad von parodontalen Erkrankungen sind bei Diabetikern erhöht. Außerdem schreiten parodontale Erkrankungen bei Diabetikern im Vergleich mit Nichtdiabetikern schneller voran (Abbildung 13). Die Parodontitis muss als eine weitere Komplikation des Diabetes angesehen werden [121]. Das erhöhte Risiko für parodontale Erkrankungen hängt vor allem von der glykämischen Einstellung des Diabetes ab. Metabolisch gut kontrollierte Diabetiker besitzen kein erhöhtes Risiko für Parodontitis und sprechen genauso erfolgreich wie Nichtdiabetiker auf eine Parodontitistherapie an. Die Ergebnisse nach der parodontalen Therapie können bei gut eingestellten Diabetikern erfolgreich aufrechterhalten werden. Zahlreiche Studien legen nahe, dass durch eine effektive parodontale Therapie die glykämische Einstellung von parodontal erkrankten Diabetikern verbessert werden kann. Die Behandlung von Parodontopathien muss integraler Bestandteil des Diabetesmanagements werden, wohingegen die Sicherstellung einer adäquaten glykämischen Einstellung wesentlicher Bestandteil einer erfolgreichen Parodontitistherapie ist.
Priv.-Doz. Dr. James DeschnerProf. Dr. Dr. Søren JepsenDFG-Klinische Forschergruppe 208„Ursachen und Folgen von Parodontopathien“Poliklinik für Parodontologie, Zahnerhaltungund Präventive ZahnheilkundeRheinische Friedrich-Wilhelms-UniversitätWelschnonnenstraße 1753111 Bonnjames.deschner@uni-bonn.de
Danksagung:
Die Autoren danken Priv.-Doz. Dr. UdoSchmitz, Medizinische Poliklinik, Endokrinologie/Diabetologie, Rheinische Friedrich-Wilhelms-Universität Bonn, sehr herzlich für dieDurchsicht des Manuskripts.