Diagnostische Hilfsmittel
Nach dem Auffinden einer Schleimhautläsion, der „Früherkennung“ im engeren Sinne, besteht die Notwendigkeit, das Gefährdungspotential einer Schleimhautveränderung korrekt einzuschätzen. Für beide dieser zentralen Schritte der Früherkennung stehen heute unterstützende Verfahren zur Verfügung, für die allerdings die wissenschaftliche Absicherung und die klinische Akzeptanz erhebliche Unterschiede aufweisen.
Bei den heute überwiegend propagierten Verfahren handelt es sich insbesondere um die Toluidinblaufärbung, die photodynamische Diagnose, die Autofluoreszenzdiagnostik und die verschiedenen Varianten der oralen Zytologie (Bürstenbiopsie) [Remmerbach et al., 2001; Hullmann et al., 2007].
Toluidinblau
Toluidinblau (OraTest®, OraScan®, Ora-Screen®) zählt wie die Lugolsche Lösung und Methylenblau zu den absorptiven Farbstoffsubstanzen. Für die Intravitalfärbung wird eine einprozentige Toluidinblau-Lösung auf die Mundschleimhaut aufgetragen und nach einer ein- bis zweiminütigen Einwirkzeit mit zweiprozentiger Essigsäure wieder entfernt [Johnson, 1999]. Toluidinblau diffundiert in die Zellen und färbt im Wesentlichen die Kernstukturen an. Die Unterscheidung zwischen benignen und malignen Schleimhautarealen basiert auf der Annahme, dass maligne Läsionen aufgrund der größeren Kern-Plasma-Relation eine intensivere Blaufärbung aufweisen sollen [Niebel and Chomet, 1964; Johnson, 1999]. Die Methode soll insbesondere bei Patienten mit starker Exposition zu Risikofaktoren [Mashberg and Samit, 1995] helfen, sichtbare Läsionen hinsichtlich ihrer Dignität besser einordnen zu können [Mashberg, 1980] und auch eine optisch gezielte Biopsie ermöglichen [Epstein et al., 1992] (Abbildung 28).
Die entscheidenden Nachteile der Methode liegen in der geringen Spezifität, da auch nicht maligne proliferationsaktive Bezirke ein vergrößertes Kern-Plasma-Verhältnis zeigen können und außerdem in der geringen bis fehlenden Sensitivität für Vorläuferläsionen. (Tabelle 4) [Onofre et al., 2001]. Insgesamt beschränkt sich der Nutzen daher auf die Erkennung bereits invasiver, aber noch symptomarmer Karzinome, die bei einer klinischen Untersuchung eventuell übersehen werden könnten [Ephros and Mashberg, 1999; Missmann et al., 2006]. Tatsächlich hat sich die Toluidinblaufärbung daher, trotz langjähriger Verfügbarkeit, nicht als tragfähige Säule eines flächendeckenden Früherkennungskonzeptes etablieren können.
5-Aminolävulinsäure (5-ALA)
Die sogenannte „photodynamische Diagnostik“ basiert auf der gezielten Anregung von fluoreszierenden Vitalfarbstoffen, die vermehrt in dysplastischen oder atypischen Zellen aufgenommen, metabolisch aktiviert und in ihrer aktiven Form retiniert werden.
In der photodynamischen Diagnostik des Mundhöhlenkarzinoms und seiner Vorläuferläsionen wird als photosensibilisierender Farbstoff insbesondere 5-Aminolävulinsäure (5-ALA), die körpereigene Ausgangssubstanz der Häm-Synthese, verwendet. Im Überschuss topisch verabreicht, stimuliert 5-ALA in dysplastischem – und in karzinomatösem Gewebe eine verstärkte Bildung und intrazelluläre Akkumulation von stark fluoreszierendem Protoporphyrin IX, das durch kurzfristige Einwirkung von Licht einer Wellenlänge von 405 nm angeregt wird [Leunig et al., 1996; Chang and Wilder-Smith, 2005]. Die Fluoreszenzbefunde gelten als suspekt und können biopsiert werden (Abbildung 29).
Bei der Detektion oraler Plattenepithelkarzinome wird für die Methode zwar eine hohe Sensitivität, aber eine recht geringe Spezifität angegeben.
Problematisch sind die falsch positiven Befunde bei Prothesenträgern und insbesondere bei vorbestrahlten Patienten [Zenk et al., 1999; Betz et al., 2002; Schleier et al., 2002], so dass sich die photodynamische Diagnose nicht für die Rezidivbeziehungsweise Zweittumordiagnostik bei zuvor bestrahlten Patienten eignet [Zenk et al., 1999] (Abbildung 30).
Autofluoreszenz
Autofluoreszenz bezeichnet die biologische Eigenschaft von Gewebe, aufgrund endogener Fluorophore, wie Flavin, Tryptophan, Elastin und Kollagen, bei Bestrahlung mit Licht einer bestimmten Wellenlänge zu fluoreszieren [Policard, 1924; Betz et al., 1994]. Als charakteristisch für die maligne Transformation gilt eine Reduktion der Fluoreszenz im Grünbereich sichtbaren Lichtes [Poh et al., 2006] (Abbildung 31).
Im Gegensatz zur photodynamischen Diagnose erfordert die Autofluoreszenz keine medikamentöse Gabe von Photosensibilisatoren. Ihr Stellenwert in der Diagnostik epithelialer Tumoren findet sich in den unterschiedlichen medizinischen Teilbereichen in der Erprobung [Baletic et al., 2004; Ohkawa et al., 2004; DaCosta et al., 2005]. Da neben der malignen Transformation auch andere pathologische Prozesse, zum Beispiel Entzündungen und Ischämie, den metabolischen Zustand einer Zelle und somit den oxidativen Zustand des Gewebes beeinflussen, ist die Treffsicherheit bislang nicht abschließend untersucht. Erste Ergebnisse für Vorläuferläsionen der Mundschleimhaut weisen aber auf mögliche Vorteile für die Früherkennung auch subklinischer Läsionen hin [Poh et al., 2006, 2007].
Bürstenbiopsie
Die moderne orale Zytologie verwendet speziell hierfür entwickelte Bürsten oder die in der gynäkologischen Vorsorgeuntersuchung des Zervixkarzinoms erprobte Bürste als Entnahmeträger. Die programmatisch verwendete Bezeichnung „transepitheliale Bürstenbiopsie“ soll die Methode von der klassischen Exfoliativzytologie abgrenzen und unterstreichen, dass mittels der rigiden Borsten Zellen aller für die Diagnosestellung relevanten Zelllagen geerntet werden können [Sciubba, 1999; Mehrotra et al., 2006] (Abbildung 32).
Im Gegensatz zur klassischen Skalpellbiopsie bietet die Bürstenbiopsie eine schmerzarme Probeentnahme ohne größere Blutungen [Zunt, 2001] und erfordert im Regelfall keine Infiltrationsanästhesie und keinen Wundverschluss [Drinnan, 2000]. Hierdurch nimmt sie dem Patienten die Angst vor Spritze und Skalpell und soll dem Arzt zu einer schnellen und kostengünstigen Methode der Probengewinnung verhelfen [Hullmann et al., 2007]. Durch die einfache, nicht invasive Wiederholbarkeit soll sie engmaschige Kontrollen oraler Vorläuferläsionen erlauben und eine frühzeitige Erkennung maligne transformierter Zellen ermöglichen [Christian, 2002].
Hierbei wird die Bürste mit leichtem Druck und gleichzeitiger Rotation um 360° über die Läsion geführt. Kleine punktförmige Blutungen kennzeichnen eine ausreichende Eindringtiefe. Anschließend werden die Zellen durch mehrfaches Drehen und Ausstreichen der Bürste auf einen Objektträger übertragen und nach Färbung mit Hämatoxylin-Eosin (HE) oder Papanicolaou der zytologischen Auswertung zugeführt (Abbildung 33). Die große Fläche der Mundhöhle verhindert die Anwendung der Bürstenbiopsie im Sinne eines Screeningverfahrens und beschränkt ihren Nutzen auf die Kontrolle sichtbarer Läsionen. Außerdem ist die Technik für die Untersuchung von Läsionen an der Lippe durch die ausgeprägte Keratinisierung ungeeignet.
Nachdem eine allein zytomorphologische Betrachtung einen relevanten Anteil maligner Läsionen (Studienabhängige Sensitivität: 79 bis 94,5 Prozent) nicht eindeutig zu identifizieren vermag [Remmerbach et al., 2001; Driemel et al., 2007a, 2007b], wurden in den letzten Jahren vermehrt unterstützende Verfahren evaluiert. Die von Kujan und Mitarbeitern für orale Bürstenbiopsate vorgeschlagene Dünnschichtzytologie [Kujan et al., 2006] ist aufgrund der geringen Datenlage noch nicht beurteilbar. Neben computerunterstützenden Methoden zur Bildanalyse (OralCDx®) [Sciubba, 1999], verwenden andere Auswertungsstrategien den DNA-Gehalt [Remmerbach et al., 2001; Maraki et al., 2006], spezifische Protein-Expressionsmuster zur Detektion maligner Zellen [Driemel et al., 2007c] oder eine zusätzliche Zellblock-Technologie, das heißt die ergänzende Aufbereitung eventuell mit der Bürste gewonnener Gewebefragmente.
Dabei ist die strategische Positionierung der ergänzenden fortgeschrittenen diagnostischen Methoden bei den einzelnen Verfahren unterschiedlich. Während die Computerassistierte Diagnostik (OralCDx®) als primäre Screeninghilfe eingesetzt wird, werden DNA-Bildzytometrie sowie spezielle ergänzende immunhistologische Untersuchungen in der Regel in einem zweiten Schritt bei denjenigen Fällen durchgeführt, die beim primären konventionellen Screening auffällig waren.
Computer-unterstützte Bildanalyse (OralCDx®)
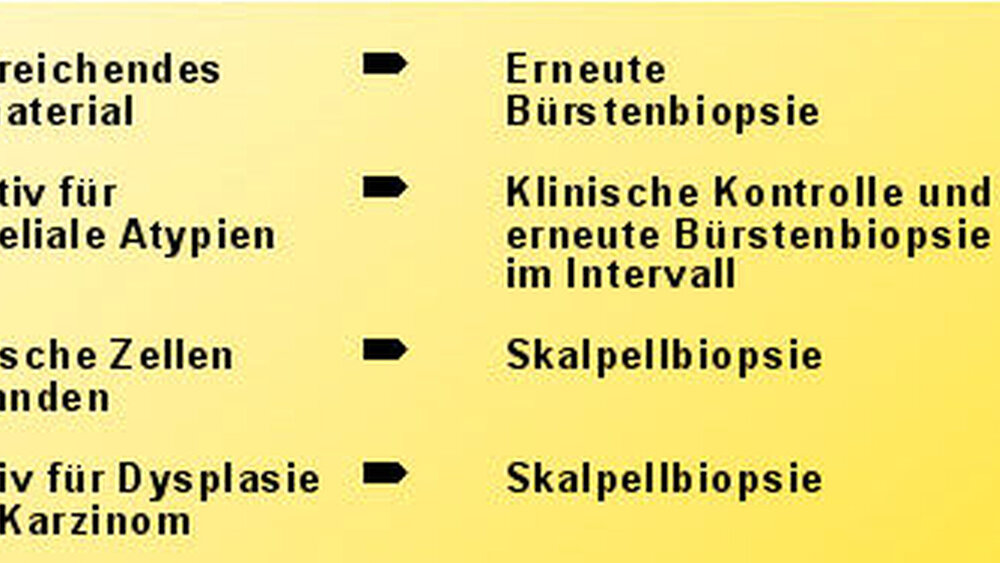
Bei der automatischen Bildanalyse erfolgt die morphologisch-zytologische Auswertung des Bürstenbiopsates zunächst mithilfe eines Computerprogrammes. 192 Zellen, welche vom Computer als am ehesten atypisch klassifiziert worden sind, werden dem Pathologen zur gezielten, mikroskopischen Kontrolle präsentiert. Anschließend werden dem behandelnden Arzt vier Befundkategorien mitgeteilt, welche das weitere Prozedere empfehlen (Abbildung 34).
Die mit diesem Verfahren erreichbare Sensitivität wird mit Werten zwischen 71,4 Prozent und 100 Prozent angegeben [Sciubba, 1999; Poate et al., 2004; Scheifele et al., 2004]. Aufgrund quantitativ oder qualitativ unzureichenden Materials müssen 2 bis 7 Prozent der Bürstenbiopsate wiederholt werden [Poate et al., 2004; Scheifele et al., 2004]. Das Verfahren ist lizenzgebunden und steht in Deutschland bisher nur durch einen Anbieter zur Verfügung. Kritisch wurde die Spezifität der Methode bewertet, die in Studien bis hinunter zu 32 Prozent reicht [Poate et al., 2004] und in Übersichten pathologischer Institute bisweilen unter 25 Prozent angegeben wird [Slater, 2004].
DNA-Bildzytometrie (Imagezytometrie)
Die DNA-Bildzytometrie wählt die DNAPloidie als Kriterium zur Beurteilung der malignen Potenz. Die auf einen Objektträger aufgebrachten Einzelzellen des Bürstenbiopsates werden mit dem DNA-spezifischen Feulgenfarbstoff markiert und die Kern-DNA mittels spezieller Software-Programme unter dem Mikroskop mit einer Digitalkamera quantifiziert. Typischerweise werden 300 suspekte Zellen mit nicht pathologischen, als Referenz dienenden Plattenepithelzellen verglichen, um Abweichungen des DNA-Gehalts vom normalen diploiden Wert zu bestimmen.
Bei den im Rahmen von Studien gewonnenen Zellen wiesen 0,5 Prozent der Proben quantitativ oder qualitativ unzureichendes Material auf [Remmerbach et al., 2004]. Sensitivität und Spezifität der konventionellen Analyse der Bürstenbiopsate sollen durch die statische DNA-Bild-Zytometrie bis auf 100 Prozent gesteigert werden können [Maraki et al., 2004; Remmerbach et al., 2004]. Allerdings liegen für orale intraepitheliale Neoplasien mit hohem Risiko nur sehr begrenzte Daten zur Treffsicherheit vor. Da nicht alle Tumoren aneuploide Stammlinien aufweisen, hängt die diagnostische Einordnung einer Läsion mitunter an der Bewertung einzelner Zellen als aneuploid (zum Beispiel > 9c) [Burkhard, 2006]. In der bisherigen Form der Anwendung setzt die statische DNA-Bildzytometrie daher eine hohe Qualifikation des Untersuchers voraus. Zudem können balancierte Chromosomengewinne oder -verluste sowie strukturelle Chromosomenaberrationen von weniger als 10 Prozent des Gesamt-DNA-Gehaltes mit dieser Technik nicht identifiziert werden.
Immunzytologie
In der immunzytologischen Analyse oraler Bürstenbiopsate werden tumortypische Varianten der Proteinexpression zur Erkennung atypischer Zellen verwendet. Eine interessante Gruppe von Proteinen betrifft hierbei Kontaktstrukturen zur extrazellulären Matrix, die sich im Rahmen der malignen Transformation verändern und beispielsweise vermehrt zytoplasmatisch exprimiert werden. Hierzu wurden beispielsweise Antikörper gegen die extrazellulären Matrixproteine hochmolekulares Tenascin-C und die g-2-Kette von Laminin-5 eingesetzt. [Driemel et al., 2007a, 2007b]. Hierbei konnten transformierte Zellen mit einer Sensitivität um 93 bis 95 Prozent und einer Spezifität bis 100 Prozent detektiert werden.
Priv.-Doz. Dr. Dr. Oliver DriemelProf. Dr. Dr. Torsten E. ReichertKlinik und Poliklinik für Mund-,Kiefer- und GesichtschirurgieUniversität RegensburgFranz-Josef-Strauß-Alle 1193053 Regensburgoliver.driemel@klinik.uni-regensburg.de
Prof. Dr. Dr. Martin KunkelKlinik und Poliklinik für Mund-,Kiefer- und GesichtschirurgieJohannes Gutenberg-Universität Mainz
Prof. Dr. Arne BurkhardtPathologie Praxis und Institut Reutlingen
Prof. Dr. Dr. Alexander HemprichProf. Dr. Torsten RemmerbachKlinik und Poliklinik für Mund-,Kiefer- und Plastische GesichtschirurgieUniversitätsklinikum Leipzig AöR
Prof. Dr. Dr. Hans Peter HowaldtKlinik und Poliklinik für Mund-,Kiefer- und GesichtschirurgieUniverstität Giessen
Prof. Dr. Hartwig KosmehlInstitut für PathologieHELIOS Klinikum Erfurt
Prof. Dr. Dr. Christopher MohrUniversitätsklinik für MKG-Chirurgiean den Kliniken Essen Mitte
Prof. Dr. Peter A. ReichartZentrum für ZahnmedizinAbteilung Oralchirurgie und ZahnärztlicheRöntgenologieCharité Campus Virchow-Klinikum
Prof. Dr. Dr. Klaus-Dietrich WolffKlinik und Poliklinik für Mund-Kiefer-GesichtschirurgieTechnische Universität München