Knochenersatzmaterialien
Indikation von Augmentationsverfahren
Der klinisch langfristige Erfolg enossaler Implantate sowie ein anspruchsvolles ästhetisches Ergebnis sind an ein ausreichendes periimplantäres Knochenangebot geknüpft [Nkenke et al., 2006; Schlegel et al., 2002]. Jedoch bedingen vorbestehender Zahnverlust (Inaktivitätsatrophie) und ein ersatzschwaches Implantatlager nach multimodaler Therapie von Karzinomen im Kieferbereich insbesondere bei den Patientengruppen, die von einer Implantatversorgung profitieren, ein vermindertes periimplantäres Knochenangebot. International referiert ist die klinisch belegte Forderung nach einem Mindestknochenangebot von sechs bis acht Millimetern in der Vertikalen und fünf Millimetern in der Horizontalen in Ober- und Unterkiefer zur erfolgreichen Insertion enossaler Implantate [Neukam et al., 1989; Schliephake et al., 1997; Schlegel et al., 2003].
Modalitäten des Knochenersatzes
In Fällen eines ungenügenden Knochenangebotes lässt sich durch augmentative Verfahren ein lokoregionäres Knochendefizit kompensieren. Autologer Knochen stellt zur Augmentation wegen seiner ihm charakteristischen Eigenschaften den Standard dar [Rissolo et al., 1998; Moore et al., 2001; Wiltfang et al., 2005; Schlegel et al., 2007]. Die Nachteile bei der Verwendung autologen Knochens als Augmentat stellen die limitierte, quantitative Verfügbarkeit sowie die mit der Transplantathebung verbundene Donormorbidität in der Entnahmeregion dar [Cricchio et al., 2003; Joshi, 2004; Joshi et al., 2004] sowie seine Resorptionsneigung dar [Wiltfang et al., 2005].
Die Nachteile der Verwendung autologen Knochens zur Augmentation motivierten die Entwicklung einer Reihe von Knochenersatzmaterialien, die sich in Struktur und biologischer Herkunft unterscheiden.
Neben den autologen Transplantaten (autografts) werden genetisch differente, humane Transplantate (allografts), bezüglich der Spezies differente Transplantate (xenografts) und artifizielle, biokompatible Transplantate (alloplasts) unterschieden.
Autografts
Humane autologe Bone-Transplantate
Autologe Transplantate können zur Knochenauf- und Einlagerung gleichermaßen klinisch erfolgreich eingesetzt werden [Nkenke et al., 2001; Nkenke et al., 2002; Nkenke et al., 2004]. Zur Gewinnung autologen Knochens stehen extra- und intraorale Donorregionen zur Verfügung. Die intraorale Knochengewinnung bietet den Vorteil eines Vorgehens in Lokalanästhesie (Kinn, Retromolarregion, lokal). Funktionell und ästhetisch beeinträchtigende Narben werden vermieden. Jedoch ist die verfügbare Knochenmenge bei intraoraler Entnahme limitiert, die extraoralen Donorregionen ermöglichen ein größeres Knochenangebot (Tibia, Beckenkamm anterior und posterior) [Nkenke et al., 2001; Nkenke et al., 2002]. Von einigen Autoren wird die Beckenknochentnahme vom anterioren Aspekt wegen ihrer einfachen Zugänglichkeit bevorzugt, bezüglich der zu gewinnenden Quantität und der postoperativ zu erwartenden Morbidität ist dem posterioren Aspekt jedoch der Vorzug zu geben [Hall et al., 1991]. Es bestehen Unterschiede bezüglich der Mineralisation von autologen, ossären Augmentaten in Abhängigkeit von der Donorregion, aus der sie gewonnen wurden [Schlegel et al., 2006]. Allerdings sind Ergebnisse, einen möglichen, unterschiedlichen, langfristigen Implantaterfolg betreffend, nicht verfügbar.
Allografts
Humane, heterologe Bone-Transplantate
Allotransplantate bieten gegenüber autogenen Transplantaten den Vorteil der höheren quantitativen Verfügbarkeit und der Vermeidung von Donormorbiditäten. Allotransplantate werden als Substitut für autogenen Knochen und in Kombination mit autogenem Knochen verwendet. Aktuell wird das Material überwiegend in partikulierter Form eingesetzt, allerdings ist es auch als Gel-Formulation oder Matrix verfügbar. Bei -70 °C eingefrorener, lyophylisierter Kadaverknochen (FDBA – freeze dried bone allograft) weist nach klinischer Applikation biologisch aktive Wachstumsund Differenzierungsfaktoren auf [Urist et al., 1984; Shigeyama et al., 1995]. Alternativ werden entkalkter, lyophilisierter Knochen (DFDBA-decalcified freeze dried bone allograft) und bestrahlter Knochen kommerziell angeboten [Misch et al., 1993]. Bei der Gefriertrocknung (FDBA) kann eine Inaktivierung von HIV nicht sichergestellt werden, hingegen zeigten die Entkalzifizierung und zusätzliche viruzide Behandlung eine sichere Inaktivierung von HIV [Buck et al., 1990; Mellonig, 1992; Mellonig et al., 1992]. Hierbei wird das kumulative Risiko einer HIV-Infektion über ein Allograft-Transplantat mit aktuell 1:1 600 000 angegeben [Buck et al., 1990]. Die Antigenität von ossären Allotransplantaten wird durch Lyophylisierung signifikant vermindert (FDBA), bei zusätzlicher Demineralisierung (DFDBA) wurde in einigen Studien der Funktionsverlust von Morphogenen, wie BMP-2/4 beschrieben [Meffert, 1998; Becker et al., 1995; Li et al., 2000]. Auf Grund seiner größeren Formstabilität wird FDBA gegenüber entkalktem Transplantatknochen (DFDBA) bei der Augmentation frischer Extraktionsalveolen, beim Sinus-Lift und zur Defektfüllung nach Implantatverlust präferiert [Meffert, 1998]. Bezüglich der osteoinduktiven Potenz von FDBA und DFDBA sind die Literaturangaben uneinheitlich.
Während eine klinische Studie zur Sinusbodenaugmentation eine knorpelähnliche Formation nach sechs Monaten bei der Verwendung von DFDBA gegenüber Knochenbildung bei Einsatz von FDBA zeigte, wurden in einer vergleichenden Studie zur Alveolarkamm- und Sinusbodenaugmentation nach sechs Monaten 42 Prozent neu formierter Knochen ohne statistisch signifikanten Unterschied beider Materialien gesehen [Meffert, 1998; Cammack et al., 2005]. Die Osteoinduktivität von DFDBA zeigt sich bezüglich des Materials verschiedener Donatoren interindividuell unterschiedlich und nicht vorhersagbar [Schwartz et al., 1996].
Ein klinisches Problem bei der Verwendung von DFDBA stellt seine in Studien beschriebene teilweise fibröse Einheilung der DFDBA-Partikel ohne Kalzifizierung und Knochenbildung dar [Brugnami et al., 1996]. Im Vergleich dazu wurde die Inkorporation von FDBA-Partikeln in neu gebildetem Knochen nachgewiesen [Brugnami et al., 1996].
Die Vorteile der Verwendung von Allograft-Materialien liegen in der gegenüber autologem Knochen erweiterten Verfügbarkeit, der Reduktion von Entnahmemorbidität und Ausmaß des Eingriffes. Die Nachteile bestehen in der nicht exakt prognostizierbaren Osteoinduktivität von FDBA, der nicht zu eliminierenden Infektionsgefahr für HIV (insbesondere FDBA) und der nicht kontrollierbaren Übertragungsmöglichkeit für Prionen (BSE).
Alloplasts
Alloplastische Materialien
Limitationen im Bereich der autologen Transplantate, die Problematiken der Allo-Transplantate sowie Fortschritte im Bereich der Biomaterialien forcierten Entwicklung und klinischen Einsatz synthetischer und kombiniert synthetisch-biomimetischer Materialien zum Knochenersatz [Schlegel et al., 1998; Schlegel et al., 1998; Wiltfang et al., 2003]. Synthetische Materialien sind osteokonduktiv ohne intrinsisches Potenzial für Osteogenese oder Osteoinduktion. Alle osteokonduktiven Materialien bieten eine Leitschiene für Endothelien, Kapillaren und nachfolgende Osteoprogenitor-Zellen zur De-novo-Knochenbildung unter Degradation/Persistenz des eingebrachten alloplastischen Transplantates, abhängig von der Materialart. Es besteht keine Begrenzung der quantitativen Verfügbarkeit. Alloplastische Materialien werden als poröse, synthetische Kalziumphosphat-Keramiken, Kalziumkarbonat, Polymere, bioaktive Glaskeramiken sowie in Kombination mit BMPs und Wachstumsfaktoren klinisch eingesetzt [Burchardt, 1983; Greenspan et al., 1995] .
Kalziumphosphat- und Kalziumsulfat-Keramiken stellen die derzeit am häufigsten eingesetzten Knochenersatzmaterialien dar [Misch et al., 1993; Frame, 1987; Frame et al., 1987; Frame et al., 1987; Frame et al., 1987]. Gewonnen aus denaturiertem Knochen und natürlicher, organischer Substanz (Korallen) stellen die Substanzen Hydroxylapatit (HA) und Trikalziumphosphat (TCP) etablierte, klinisch langfristig erfolgreiche alloplastische Transplantate dar [Hansen, 1984; Roy et al., 1974; Precheur, 2007]. Diese Materialien zeichnen sich durch hohe Druck- und geringe Zugfestigkeit, ähnlich natürlichem Knochen, aus [Misch et al., 1993]. Die Knochenneubildung entlang der Oberfläche dieser osteokonduktiven Materialien wurde gezeigt [Schepers et al., 1993].
Bei der Verwendung von HA bestimmen steuerbare physikalische und physiko-chemische Parameter (ph-Wert, Porosität, Oberfläche, Dotierung mit Fremdionen) des synthetisch, hydrothermal hergestellten kristallinen Materials die Resorption und Degradationskinetik [Misch et al., 1993] (Abbildung1). Poröses Material wird schneller von Knochenmatrix erschlossen als kompakter HA (Abbildung 1). Neben den bereits längerfristig etablierten HA-basierten KEM unter hauptsächlicher Verwendung von gesintertem HA, sind aktuell Materialien, basierend auf ungesintertem HA, in Pasten-Formulation verfügbar (Abbildung 2). Bei diesen nanopartikulären Materialien wird eine höhere Löslichkeit, eine vollständige Resorbierbarkeit und eine initiale, vergrößerte aktive Oberfläche postuliert. Die vergrößerte Bindungskapazität für freies Wasser in der Inflammationsphase der Einheilung, bedingt durch die verkleinerte Partikelgröße der ungesinterten HAs, begünstigt den Influx zellulärer Elemente und die frühzeitige Kapillarisierung [Huber et al., 2007]. Die ossäre Integration des Materials erfolgt über primäre Kollagensynthese nach Osteoblastenadhärenz an der Oberfläche sowie konsekutiver Matrixsynthese und Kalzifizierung vom bindegewebig erschlossenen HA-Partikel ausgehend [Springer et al., 2006].
Ein Nachteil der porösen Keramiken ist die exponentielle Abnahme der mechanischen Belastbarkeit mit der Porosität [Frame, 1987]. Die Sinusbodenaugmentation mit HA zeigte in mehreren klinischen Studien eine anderen KEM überlegene Dimensionstreue [Jensen et al., 1998; Hurzeler et al., 1998; Small et al., 1993; Schlegel et al., 2003; Schlegel et al., 2007].
Trikalziumphosphat, ein synthetisches Knochenersatzmaterial, liegt in zwei Gitterformen (a-TCP und b-TCP) vor, die sich hinsichtlich ihrer Degradationskinetik unterscheiden. A-TCP wird innerhalb von sieben Monaten zu 70 Prozent degradiert, b-TCP zu 80 Prozent [Wiltfang et al., 2002]. Nach vier Monaten sind sequestrierende TCPPartikel mit umgebenden Makrophagen und mehrkernigen Riesenzellen nachweisbar (Abbildung 3) [Merten et al., 2000; Kondo et al., 2006]. Bei synthetischen Kalziumphosphatkeramiken findet keine echte Resorption, sondern eine Fragmentierung und Degradation in Abhängigkeit von den Materialeigenschaften statt [Wiltfang et al., 2002]. Bedingt durch seine Degradation im zeitlichen Verlauf, eignet sich der Einsatz des osteokonduktiven TCP im ersatzstarken Knochenlager, da die entstehenden Resorptionsdefekte durch neu gebildeten Knochen ersetzt werden [Misch et al., 1993; Jensen et al., 2006].
Sowohl HA als auch TCP zeichnen sich durch Biokompatibilität aus. Jedoch wird keine mechanisch belastbare Verbindung zum Knochen erreicht, so dass eine Augmentation großer, intraossärer Defekte mit HA und TCP problematisch ist [Fetner et al., 1994]. Klinische Langzeitbeobachtungen zeigten eine persistierende, unterschiedlich kristalline Struktur natürlichen Knochens im Vergleich zu integrierten HA-Augmentaten [Spector, 1994]. Es bestehen Hinweise auf eine schnellere Knochenneubildung in HAaugmentierten Defekten als in TCP-gefüllten Bereichen. Die Aktivität der alkalischen Phosphatase, sezerniert von mononukleären Zellen während des Knochenremodellings, zeigte sich HA-assoziiert eher und erhöht als nach vergleichbarer Zeitspanne in TCP-Augmentaten [Nagahara et al., 1992].
Neben synthetisch hergestelltem HA und TCP ist die klinische Anwendung von anorganischer Substanz tierischen Knochens und von Kalziumkarbonat pflanzlicher Herkunft (Korallen) etabliert. Der anorganische Anteil bovinen Knochens zeigte nach chemischer Vorbehandlung und Sterilisation als nicht immunogene, anorganische Matrix eine hohe Osteokonduktivität [Pinholt et al., 1991; Pinholt et al., 1991; Schlegel et al., 2003] (Abbildung 4). Im Gegensatz zu TCP wurde für anorganischen, bovinen Knochen eine Integration im zeitlichen Verlauf der Einheilung gezeigt. Die damit verbundene größere mechanische Stabilität im Vergleich zu keramischen KEM qualifiziert anorganische, bovine Knochenmatrix zum Einsatz allein oder in Kombination mit autologem Knochen zur Augmentation großer, periodontaler und raumschaffender, knochenbegrenzter Defekte, sowie zur periimplantären Knochenregeneration [Hislop et al., 1993]. Als KEM verwendete Derivate des Korallins bestehen aus von Korallen abgeschiedenem Kalziumkarbonat unterschiedlicher dreidimensionaler Struktur und Porosität [Lane, 1995]. Für osteokonduktive Materialien wurden eine im Vergleich zu anderen KEM intraoperativ gute, mechanische Bearbeitbarkeit sowie der erfolgreiche klinische Einsatz bei der periimplantären Augmentation gezeigt [Wiltfang et al., 2003].
Glaskeramiken
Die als KEM eingesetzten Biogläser sind amorphe, nicht poröse Materialien. Hauptbestandteile sind Kalziumsalze, Phosphate und Siliziumoxid [Valimaki et al., 2006]. Eine Biodegradation findet nach klinischer Applikation nicht statt. Biogläser weisen im Vergleich zu anderen KEM zwei wesentliche Unterschiede auf:
1. eine schnelle Interaktion der Oberfläche mit ortsständigen Zellen im Knochen,
2. eine Adhärenzpromotion von Kollagen in Knochen und Bindegewebe an die Materialoberfläche.
Die Stimulation der Knochenregeneration durch frühzeitige Kolonisierung der Bioglas-Oberfläche durch Osteoblasten mit beschleunigter Osteogenese wurde beschrieben [Fetner et al., 1994; Schlegel et al., 2003]. Neben Osteoblasten wird auf der Bioglas-Oberfläche die Adhärenz von Fibroblasten im Bereich bindegewebiger Einheilung induziert. Eine Ausbildung einer 0,3 Millimeter starken, fibrösen Zone auf der Bioglasoberfläche wurde gezeigt. [Fetner et al., 1994], [Greenspan et al., 1995]. Experimentell wurde in unserer Gruppe ein signifikant verminderter Knochen-Implantat-Kontakt bei der Verwendung von Biogläsern gegenüber autologem Knochen und HA nachgewiesen [Klongnoi et al., 2006].
Für den Implantaterfolg nach Sinusbodenaugmentation unter Verwendung von Knochenersatzmaterialien liegt eine Vielzahl von klinischen Studien vor. Da diese jedoch sehr heterogen bezüglich der erhobenen Parameter und verwendeten Materialien sind, kann eine differentielle Implantaterfolgsrate für HA und TCP nicht gegeben werden. Kumulativ ergibt sich in einer aktuellen Meta-Analyse an 2 046 Patienten aus 39 Studien bei 6 913 Implantaten eine Gesamterfolgsrate von 91,49 Prozent an. Bei Augmentation mit autologem Knochen wird der Implantaterfolg mit 93 Prozent, bei Augmentation mit autologem Knochen/alloplastischen Material mit 93,3 Prozent und mit 81 Prozent bei der Verwendung von ausschließlich alloplastischem Knochenersatzmaterial angegeben [Aghaloo et al., 2007]
Zur Auf- und Anlagerungsosteoplastik des atrophen Alveolarkamms durch HA oder TCP liegen sehr wenige klinische Studien vor, so dass zum gegenwärtigen Zeitpunkt keine Erfolgsrate angegeben werden kann [Aghaloo et al., 2007].
Biologische Aktivierung von Knochenersatzmaterialien
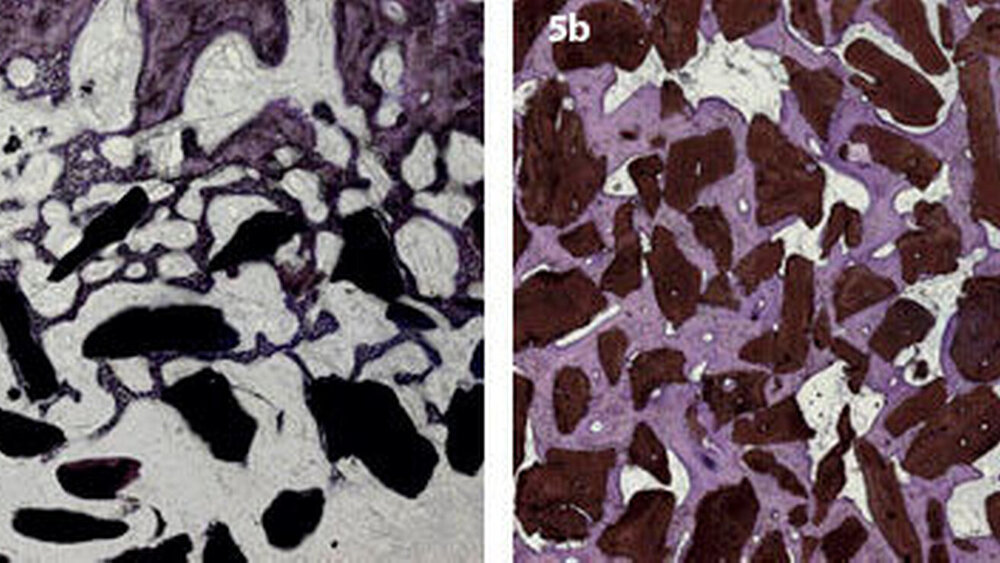
Das Verständnis von Knochenneubildung und Matrixorganisation auf zellulärer Ebene während der Implantateinheilung und der Integration von KEM ermöglichte eine partielle Biomimetik von Regulatoren der Wundheilung insbesondere an der Oberfläche mit dem Erfolg einer zeitlich beschleunigten und quantitativ gesteigerten ossären Integration. Für die klinisch zu fordernde, mechanisch stabile Integration von KEM-Partikeln ist eine primäre Adhärenz von Osteoblasten beziehungsweise deren Progenitorzellen auf der KEM-Oberfläche mit nachfolgender Osteoid-Synthese, interzellulärer Organisation und Kalzifizierung essenziell [Schlegel et al., 2006]. Im Gegensatz zu früheren Vorstellungen der knöchernen Defektregeneration, die eine sukzessive Defektdurchbauung unter Partikeleinschluss vom Rand des ortsständigen Knochens aus favorisierten, wird heute von einer auf der Partikeloberfläche beginnenden Ossifikation ausgegangen [Kim et al., 2006]. Diese primäre Adhärenz von Osteoblasten wird über spezifische Strukturmerkmale von Matrixproteinen realisiert. Beispielsweise wurde innerhalb Kollagen-I ein Strukturmotiv identifiziert, das einer spezifischen Sequenz aus 15 Aminosäuren (P-15) korrespondiert [Bhatnagar et al., 1999; Krauser et al., 2000]. Die rekombinante Herstellung dieses Strukturmotivs und dessen Verwendung als Beschichtung von HAbasierten KEM erbrachte eine signifikant beschleunigte und quantitativ erhöhte ossäre Integration von KEM [Thorwarth et al., 2005] (Abbildung 5). Ein weiterer, klinisch Erfolg versprechender Ansatz besteht in der Beschichtung von KEM mit einer synthetisch hergestellten, provisorischen Matrix, die spezifisch durch Enzyme der Knochenregeneration, insbesondere MMP-13, degradiert wird und somit der Osteoblastenadhärenz und -proliferation einen Selektionsvorteil gegenüber anderen Zellarten bietet [Chung et al., 2006; Springer et al., 2006].
Klinisch evaluierte Erkenntnisse zum Einsatz von Wachstumsfaktoren und Zytokinen in Kombination mit KEM liegen für die Morphogene der TGFß-Gruppe, insbesondere für BMP-2/4 vor [Schlegel et al., 2007; Wehrhan et al., 2004]. BMP-2/4, ein phylogenetisch hoch konserviertes Signalprotein, ist neben seiner pleiotropen Beteiligung an multiplen Induktionsprozessen während der embryonalen Entwicklung ein essenzieller Faktor der Osteogenese und der Knochenreparation. Die ektope Knochenbildung im Muskelgewebe durch BMP-2/4 Expressionsinduktion wurde gezeigt [Warnke et al., 2006]. Die für die Ossifikation maßgebliche Funktion von BMP-2/4 liegt in der Rekrutierung mesenchymaler Stammzellen für eine osteogene Differenzierung sowie in der Induktion der für die Proliferation und Maturation von Osteoblasten notwendigen Transkriptionsfaktoren Msx-1, Cbfa1 (Runx-2) und der alkalischen Phosphatase in Osteoblasten [Oka et al., 2007]. Der Einsatz von BMP-2 als Protein beziehungsweise dessen stimulierte Expression durch Gentransfer stellt eine Möglichkeit zur Osteoinduktion dar; die Applikation von BMP-2/4 resultierte klinisch in einer induzierten Knochenneubildung [Chung et al., 2006]. Derzeit ungeklärt ist jedoch die für klinische Anwendungen optimale, lokale BMP-2/-Konzentration, da endogenes BMP-2/4 in kaum messbar niedriger Konzentration an der Regulation der physiologischen Prozesse beteiligt ist, klinisch-therapeutisch und experimentell jedoch in einer 10 000- bis 100 000-fach höheren Konzentration benötigt wird [Schlegel et al., 2006; Park et al., 2006; Park et al., 2007].
Perspektiven
Derzeit sind eine Vielzahl biokompatibler, osteokonduktiver Knochenersatzmaterialien verfügbar. Insbesondere durch Modifikation der Oberflächen (P-15-Beschichtung, Porosität, Matrix, Zytokine) werden gegenwärtig die ossäre Integration und die frühzeitige mechanische Belastbarkeit verbessert. Eine zusätzliche Applikation von BMP-2/4, wie in einigen klinischen Studien bereits durchgeführt, wird durch die osteoinduktive Potenz von BMP-2/4 die Indikation zum Einsatz von Knochenersatzmaterial erweitern und die limitierte Verfügbarkeit autologen Knochens als idealem Transplantat partiell kompensieren.
Die Entwicklung ex-vivo durch Tissue Engineering generierten Knochens kann derzeit nicht als etabliert gelten. Obgleich Fortschritte im Bereich der verwendeten Matrices, der Kultivierung von Osteoprogenitorzellen und zunehmende Kenntnis der regulierenden Zytokine zu verzeichnen sind, ist bislang die Modellierung eines Bioreaktors in-vitro, der die physiologische Knochenregeneration simuliert, nicht möglich. Aktuelle, klinisch praktikable Tissue Engineering-Konzepte zur Knochenregeneration nutzen ektope Lokalisationen in-vivo [Warnke et al., 2006].
Die komplexen Interaktionen aus differenzierenden Zellen, pleiotropen Zytokinen und spezifischen Transkriptionsfaktoren während der Osteogenese und Knochenmaturation sind erst teilweise verstanden. Mit der vorhanden Möglichkeit der Kultivierung mesenchymaler Stammzellen und deren osteogener Differenzierung eröffnet sich eine unlimitierte Perspektive bezüglich eines nutzbaren Zellpools, jedoch stehen insbesondere Vorarbeiten aus, die die Knochenregeneration in Analogie zur embryonalen Knochenentwicklung beschreiben, da moderne Konzepte zu Wundheilung und Geweberegeneration diese als partiellen Rückgriff auf embryonale Differenzierung auffassen [Adzick et al., 1994; Oka et al., 2007].
Abschließende Bewertung der Indikation von KEM
Knochenersatzmaterialien können in Kombination mit dem autologen Knochentransfer zur gewünschten Lagermodellierung beitragen, sind aber allein nur indikationsabhängig klinisch einsetzbar. Insbesondere im Rahmen von Einlagerungsosteoplastiken (Sinusaugmentationen) sowie zur Augmentation raumschaffender Defekte können sie erfolgreich Einsatz finden. Im Bereich absoluter Kammaugmentationen, in vertikaler oder horizontaler Richtung sollten sie nur zur quantitativen Ergänzung von autologem Material eingesetzt werden.
Zusammenfassung
Ein ausreichendes periimplantäres Knochenangebot ist Voraussetzung zur langfristig erfolgreichen Implantation im Kieferknochen. Für die gegebenenfalls notwendige Augmentation werden autologer Knochen und bei geeigneter Indikation Knochenersatzmaterialien eingesetzt. Humane Allotransplantate sind bei guter Biokompatibilität mit dem Risiko von HIV, HCV- und Prionentransmission behaftet. Die aktuell verfügbaren, osteokonduktiven Materialien auf Hydroxylapatit- und Trikalziumphosphat-Basis weisen eine vergleichbar gute Biokompatibilität, jedoch unterschiedliche mechanische Festigkeit auf.
Die Modifikation von Knochenersatzmaterialien durch bioaktive Oberflächen beschleunigt die ossäre Integration und erweitert das mögliche Einsatzspektrum. Heute schon ermöglichen experimentell osteoinduktive Morphogene die Defektregeneration. Jedoch stehen klinische Studien zur Optimierung der notwendigen Wirkkonzentrationen rekombinanter Wachstumsfaktoren aus. Im Hinblick auf die Möglichkeit zur osteogenen Differenzierung mesenchymaler Stammzellen stellt das Tissue Engineering von Knochen eine Perspektive für die Zukunft dar, es fehlen derzeit Vorarbeiten zur Interaktion pleiotroper Zytokine, spezifischer Transkriptionsfaktoren und der Osteoprogenitorzellen zur erfolgreichen In-vitro-Knochendifferenzierung und Maturation.
Dr. med. Dr. med. dent. Falk WehrhanArzt und ZahnarztMund-, Kiefer- und Gesichtschirurgische KlinikGlückstraße 1191054 ErlangenFalk.Wehrhan@uk-erlangen.de
Priv.-Doz. Dr. med. Dr. med. dent.Emeka NkenkeLeitender OberarztMund-, Kiefer- und Gesichtschirurgische KlinikGlückstraße 1191054 ErlangenEmeka.Nkenke@uk-erlangen.de
Dr. med. dent. Safwan SrourFachzahnarzt für OralchirurgieMund-, Kiefer- und Gesichtschirurgische KlinikGlückstraße 1191054 ErlangenSafwan.Srour@uk-erlangen.de
Priv.-Doz. Dr. med. Dr. med. dent.Andreas SchlegelGeschäftsführender OberarztMund-, Kiefer- und Gesichtschirurgische KlinikGlückstraße 1191054 ErlangenAndreas.Schlegel@uk-erlangen.de