Orale Erstmanifestation eines Morbus Wegener
Ein 48-jähriger Patient wurde mit einer seit zwei Wochen bestehenden schmerzhaften Zahnfleischentzündung über die eigene Poliklinik für Mund-, Kiefer- und Gesichtschirurgie vorstellig. Anamnestisch klagte der Patient zudem über Schnupfen und Husten mit teils blutigem Auswurf. Seit zwei Jahren fühle er sich zunehmend müde und in seiner allgemeinen Leistungsfähigkeit eingeschränkt.
Bei der klinischen Untersuchung zeigte sich intraoral eine geschwollene, stark druckdolente und leicht blutende Gingiva mit auffälliger, girlandenförmiger marginaler Rötung und vereinzelten ulzerierten, nekrotischen Arealen (Abbildung 1). Der Zahnstatus wies keine wesentlichen Foci auf, das Orthopantomogramm (Abbildung 2) war ebenfalls unauffällig.
Eine Probebiopsie der Gingiva erbrachte zunächst die Diagnose einer schwerstgradigen ulzero-phlegmonösen unspezifischen Gin givitis. Aufgrund steigender laborserologischer Entzündungsparameter (CRP 226 mg/l, Leukozyten 11,1 / ηl, erhöhte BSG) und einer Verschlechterung des Allgemeinzustands wurde der Patient zur intravenösen Antibiose stationär aufgenommen, wodurch allerdings keine Besserung eintrat. Wegen der vom Patienten geschilderten Nasenwegsobstruktion mit blutiger Sekretion wurde eine Computertomographie des Nasennebenhöhlenbereichs durchgeführt, die Flüssigkeitsspiegel in den Nasennebenhöhlen darstellte (Abbildung 3). In der konsiliarischen Untersuchung durch die Kollegen der Hals-, Nasen- und Ohrenheilkunde imponierte eine entzündlich, polypös veränderte Schleimhaut der Nasenhauptund -nebenhöhlen. Die dabei endoskopisch gewonnene Gewebeprobe erbrachte die histologische Diagnose einer schweren Vaskulitis mit Granulomen, morphologisch einem Morbus Wegener entsprechend (Abbildung 4).
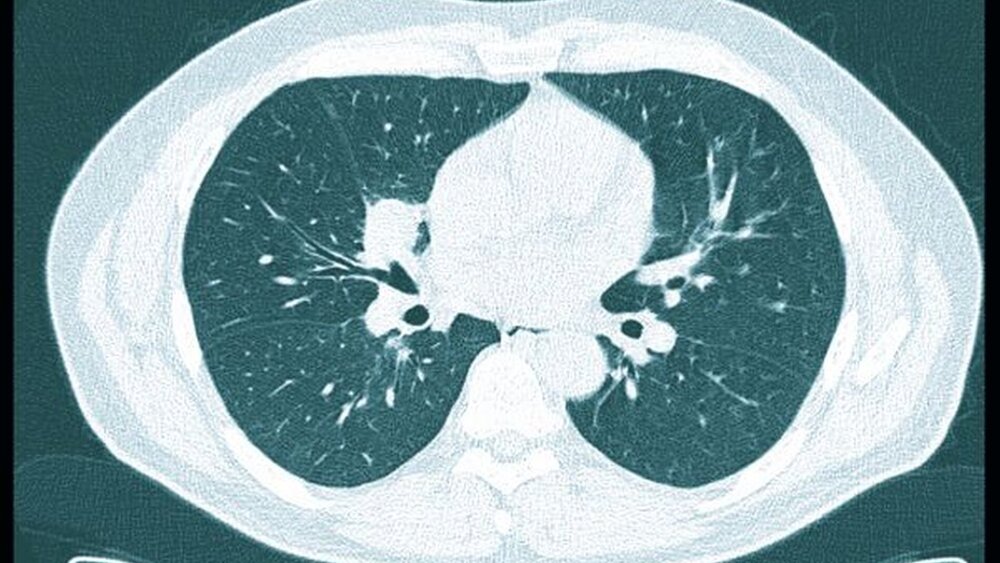
Die weitergehende laborserologische Diagnostik bestätigte die Wegener Granulomatose durch das Vorhandensein von c-ANCA (AntiNeutrophile Zytoplasmatische Antikörper). Die Urindiagnostik zeigte eine geringe glomeruläre Erythrozyturie. Die veranlasste Computertomographie des Thorax beschrieb intrapulmonale Rundherde, vereinbar mit Granulomen bei einem Morbus Wegener (Abbildung 5).
Der Patient wurde von den Kollegen der Rheumatologie zur Einleitung einer immunsuppressiven Therapie mit Prednisolon und Cyclophosphamid unter gleichzeitiger Antibiotikaprophylaxe übernommen.
Diskussion
Der Morbus Wegener beschreibt eine systemische Erkrankung, die durch eine nekrotisierende, granulomatöse Entzündung des oberen und des unteren Respirationstrakts, eine Glomerulonephritis und eine Vaskulitis kleiner und mittelgroßer Gefäße charakterisiert ist [Ponniah et al., 2005]. Der Krankheitsverlauf variiert zwischen milden, auf den Respirationstrakt beschränkten Symptomen und einem schweren Verlauf mit rascher Progredienz und lebensbedrohlichem Multiorganversagen. Bei über 80 Prozent der Patienten manifestieren sich die Symptome im Kopf-Hals-Bereich. So klagen die Patienten, wie auch im eigenen Fall geschildert, in der Initialphase unter anderem über eine persistierende Rhinorrhoe, eine Schmerzsymptomatik im Nasennebenhöhlenbereich, orale und nasale Ulzera sowie über Ohrenschmerzen bedingt durch Mittelohrergüsse [Gottschlich et al., 2004]. Ein Befall der Lunge mit Dyspnoe, Hämoptysen und den in der Bildgebung charakteristischen Granulomen ist häufig. Im weiteren Verlauf (Generalisationsstadium) kann es zu einem Befall der Nieren (Glomerulonephritis), der Gelenke (Arthralgien) oder auch der Augen (Episkleritis) kommen. Häufig geht die Erkrankung mit einer Reduktion des Allgemeinbefindens (Fieber, Nachtschweiß, Abgeschlagenheit und Gewichtsverlust) einher [Gottschlich et al., 2004].
Orale Schleimhautläsionen finden sich bei etwa jedem zehnten Patienten, in seltenen Fällen stellen sie die Erstmanifestation dar [Ponniah et al., 2005]. Dabei finden sich Schleimhautulzera, Gingivitiden oder auch oroantrale Fisteln. Eine charakteristische Frühmanifestation stellt die sogenannte „Strawberry Gingivitis“ mit ausgeprägter girlandenförmiger Rötung der marginalen Gingiva dar, wie sie auch der Patient in diesem Fall aufwies [Knight et al., 2000]. Differentialdiagnostisch müssen Gingivaläsionen bei Leukämien, hämorrhagischen Diathesen oder Langerhans-Zell-Histiozytosen sowie eine ANUG abgegrenzt werden [Manchanda et al., 2003].
Die Diagnostik des Morbus Wegener wird aus der Synopsis von Klinik, Histopathologie und Serologie entsprechend den Kriterien des „American College of Rheumatology“ (ACR, Tabelle) gestellt. Dabei müssen mindestens zwei dieser vier Kriterien erfüllt sein. Im eigenen Fall waren dies der nekrotischulzerierende Befund im Gingiva- und im Nasennebenhöhlenbereich, die Granulome im CT-Thorax sowie die Mikrohämaturie bei der Urin diagnostik.
Die histopathologische Befundsicherung ist der Goldstandard der Diagnostik. Klassischerweise ist der M. Wegener dabei durch eine Nekrose, eine granulierende Entzündung sowie eine Vaskulitis charakterisiert. Die Kombination aller drei Kriterien findet sich jedoch nur in etwa 20 Prozent der Fälle bei Biopsien im Kopf-Hals-Bereich [Devaney et al., 1990]. Oftmals zeigen sich lediglich unspezifische Entzündungszeichen, so auch bei der Gingivabiopsie des eigenen Patienten. Eine pseudoepitheliomatöse Hyperplasie, Mikroabszesse, Eosinophile und mehrkernige Riesenzellen gelten in Kombination mit dem klinischen Bild einer „Strawberry Gingivitis“ dennoch als hinweisend für die Diagnose einer Wegener Granulomatose.
Ein weiteres wichtiges Kriterium zur Diagnosesicherung stellt die serologische Bestimmung antineutrophiler zytoplasmatischer Antikörper (c-ANCA) dar. Diese c-ANCA, die auch beim eigenen Patienten detektiert werden konnten, sind in der Generalisationsphase bei etwa 70 bis 95 Prozent der Patienten vorhanden, im Initialstadium kann der c-ANCATest aber auch negativ sein [Gottschlich et al., 2005; Ettl et al., 2007].
Die Therapie besteht klassischerweise aus einer Kombinationstherapie aus Prednison und Cyclophosphamid (sogenannter „Fauci-Schema“). Während der Morbus Wegener unbehandelt häufig innerhalb eines Jahres zum Tode führt, werden durch dieses Therapieschema Remissionsraten von bis zu 90 Prozent erzielt [Reinhold-Keller et al., 2000]. Aufgrund therapiebedingter Folgeerkrankungen wie eine hämorrhagische Zystitis, ein Blasenkarzinom oder ein myelodysplastisches Syndrom sollte im Verlauf auf langzeitverträgliche Immunsuppressiva – wie Methotrexat oder Azathioprin – umgestellt werden [Pagnout et al., 2008]. Neuerdings werden als Alternativen zu Cyclophosphamid TNF-α-Blocker (Etanercept) und Anti-CD20-Antikörper (Rituximab), die bei gleicher Effektivität zu einer Reduktion der Nebenwirkungen führen, diskutiert [WGET, 2005; Stone et al., 2010].
Dr. Dr. Tobias EttlPriv.-Doz. Dr. Dr. Martin GosauProf. Dr. Dr. Torsten E. ReichertKlinik und Poliklinik für Mund-, Kiefer- undGesichtschirurgieUniversität RegensburgFranz-Josef-Strauß-Allee 1193053 RegensburgMartin.gosau@klinik.uni-regensburg.de
Dr. Katharina ZeitlerInstitut für PathologieUniversität RegensburgFranz-Josef-Strauß-Allee 1193053 Regensburg