Vergrößerungshilfen in der Endodontie
In der Zahnmedizin besteht zwischen dem Patienten und dem Behandler ein räumlich naher Kontakt, um diagnostische oder therapeutische Aufgabenstellungen erfolgreich realisieren zu können. Die Distanz kann je nach Erfahrung und Aufgabenstellung im klinischen Alltag zwischen 20 und 60 cm variieren.
Damit kleinste Details erkannt und differenziert werden können, wird häufig der Arbeitsabstand vom Behandler zum Patienten verringert. Mit dem Verkürzen des Arbeitsabstands kann die Vergrößerungsleistung des Auges zu einem gewissen Grad erweitert werden, so dass scheinbar ein großer Teil zahnärztlicher Leistungen ohne optische Hilfsmittel in hinreichender Qualität zu erbringen ist. Ab einem Lebensalter von etwa 40 Jahren gelingt die Nahakkommodation („Scharfstellung“ naher Objekte) aber nur noch unvollständig durch einen stetig zunehmenden Verlust an Elastizität der Linse und der Ermüdung des Ziliarmuskels am menschlichen Auge [Betz, 1998; Perrin et al., 2016].
Im Ergebnis dieser Kompensation können durch Fehlstellungen in der Körperhaltung akute und chronische Beschwerden im Stützapparat und der neuronalen Versorgung auftreten. [Rundcrantz, 1991; Kerschbaum & Hilger, 2000; Reitemeier et al., 2012]. Darüber hinaus erhöht sich durch die Verkürzung des Arbeitsabstands auf unter 50 cm das Risiko einer Infektionsübertragung. Infektiöse Aerosole stellen ein erhebliches Gesundheitsrisiko für das zahnärztliche Personal dar [Bentley et al., 1994; Leggat, 2001; Harrel & Molinari, 2004; Szymanska, 2007]. Insbesondere SARS-CoV-2 lassen sich auf Schleimhaut und Zunge des Patienten nachweisen und können über Aerosole übertragen werden [Xu et al., 2020].
Deshalb werden bereits seit vielen Jahren optische Hilfsmittel in der zahnärztlichen Diagnostik und Therapie empfohlen [Baumann, 1975; Velvart, 1996; Klimm, 2003; Friedmann, 2004; Arnold, 2007; Mamoun, 2009]. Einer Umfrage unter amerikanischen Endodontologen aus dem Jahr 1999 zufolge nutzten 52 Prozent der Befragten ein Mikroskop. Die Ergebnisse einer erneuten Befragung im Jahr 2007 zeigten bereits einen Anteil der Mikroskopnutzer von 90 Prozent [Kersten et al., 2008].
Vom OP- zum Dentalmikroskop
Erste Empfehlungen für den Einsatz von Mikroskopen in der Zahnmedizin finden sich bereits Anfang des 20. Jahrhunderts [Bowles, 1907]. In Deutschland wurde das Operationsmikroskop erstmals 1975 durch den Würzburger HNO-Arzt und Zahnarzt Baumann für den zahnärztlichen Einsatz empfohlen [Baumann, 1975]. Insbesondere für die zahnärztliche Diagnostik erschien das Mikroskop hilfreich [Jurkschat, 1979].
Erst mit der weiteren technischen Entwicklung von Operationsmikroskopen zu Dentalmikroskopen gelang in den 90er-Jahren eine bessere Integration in die zahnärztliche Praxis und in die zahnärztliche Ausbildung [Arnold & Klimm, 2004]. Ursache für die langsame Integration in die Praxis waren vor allem die schwere Beweglichkeit am Stativ, die unzureichende Beleuchtung und die fehlende Variabilität der Optik. Mit der Einführung von verbesserten mechanischen und magnetischen Bremsen, verbesserten Lichtleitern und dem Schwenktubus wurde ein flexibles Arbeiten am Patienten möglich.
Der Nutzen in der Endo
Der Nutzen des Mikroskops in der Zahnmedizin wurde vor allem in der Endodontie und Endochirurgie nachgewiesen [Saunders & Saunders, 1997; West, 2000; Kim & Baek, 2004]. In der Endodontie gelingt es nicht ohne Hilfe einer optischen Vergrößerung, Details am Wurzelkanaleingang oder innerhalb des Wurzelkanals zu differenzieren. Dabei spielen allerdings Lupenbrillen aufgrund der zu geringen Vergrößerung und Lichtzufuhr [Perrin et al., 2013] kaum eine Rolle – die in der Endodontie maßgebliche Vergrößerungshilfe ist das Mikroskop.
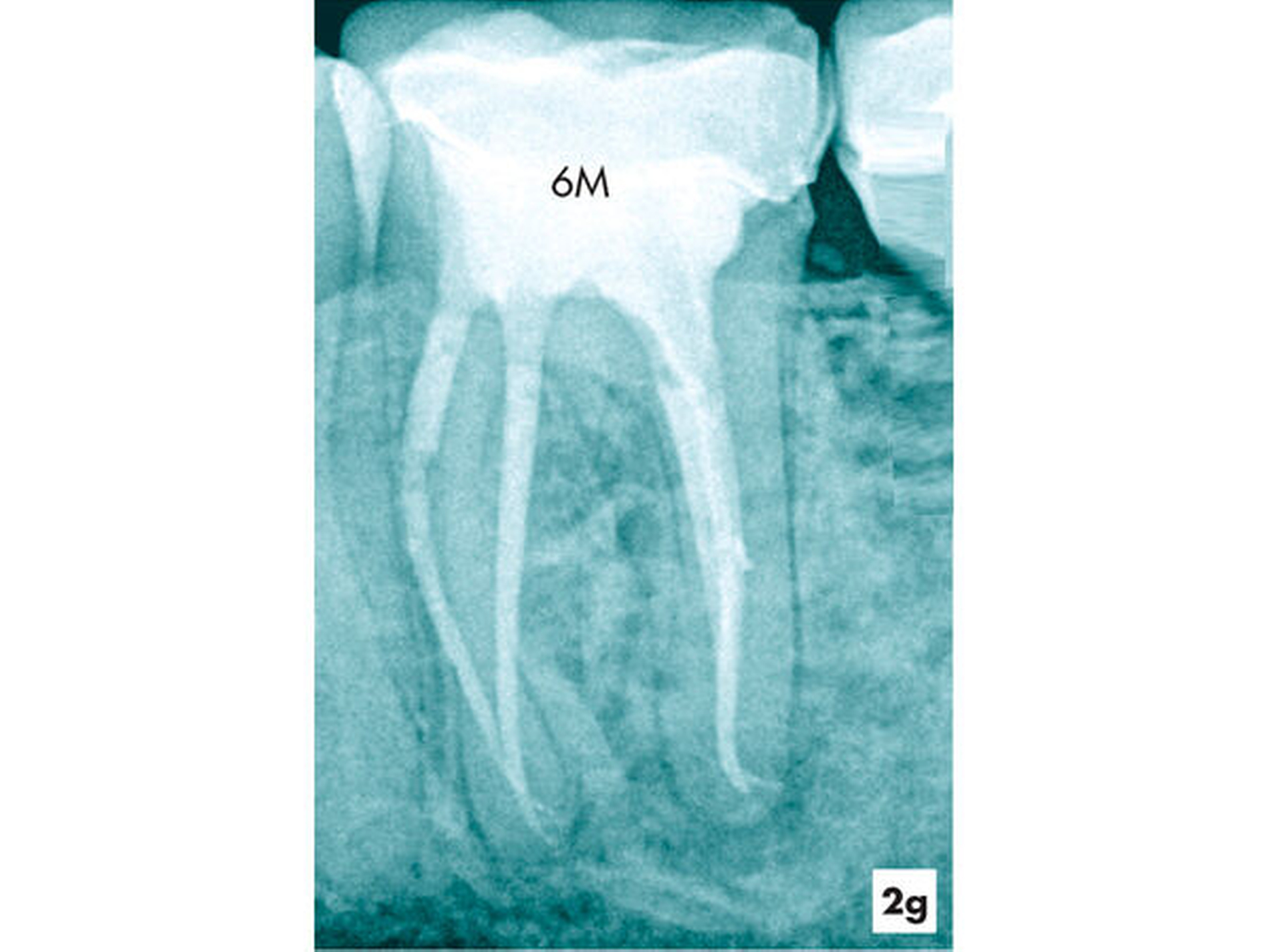
Mit der Nutzung des Dentalmikroskops gelingt es, Wurzelkanalsysteme sicher und reproduzierbar aufzufinden [Baldassari-Cruz et al., 2002; Brignardello-Peterson, 2017; de Oliveira et al., 2019; Görduysus et al., 2001; Karapinar-Kazandak et al., 2010; Schwarze et al., 2002]. So wurde am Beispiel der oberen ersten Molaren nachgewiesen, dass es mit dem Dentalmikroskop möglich ist, den MB2 der mesiobukkalen Wurzel reproduzierbar aufzufinden und das Risiko einer persistierenden apikalen Aufhellung und erneuten Therapie deutlich zu reduzieren [Khalighinejad, 2017] (Fallbeispiel 1).
Begünstigend für des Auffinden kleinster anatomischer Strukturen und Hohlräume ist das Erkennen von Dentinkanälchen und das Differenzieren verschiedener Dentinarten, so dass auch Obliterationen und Dentinsklerosen erkannt und überwunden werden können, ohne die Wurzel zu destabilisieren oder zu perforieren [Saunders & Saunders, 1997; Selden, 1989] (Fallbeispiel 2).
In der Ausbildung der Zahnmedizin gelang es, die Ergebnisse in der Endodontie zu verbessern [Arnold & Klimm, 2004; Rampado et al., 2004] (Abbildung 3). Während eine Lupenbrille den Studierenden beim Auffinden von Wurzelkanälen nicht half, konnten sie mit dem Mikroskop die besten Ergebnisse erzielen [Yoshioka et al., 2002]. Die Nutzung der Lupenbrille in der endodontischen Ausbildung kann jedoch ein erster Schritt zur Verbesserung der Lehrinhalte sein und wird deshalb empfohlen [Brown, 2020].
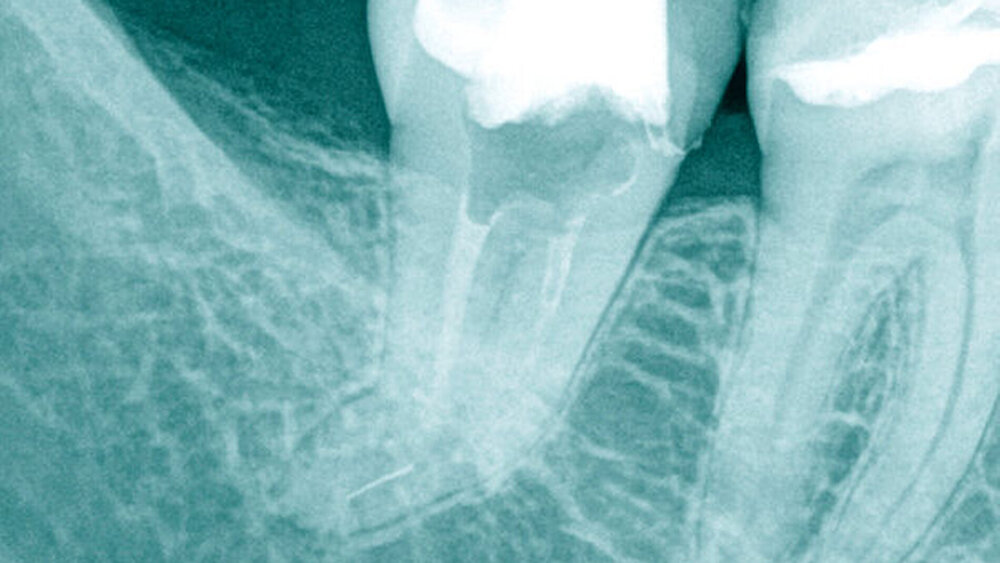
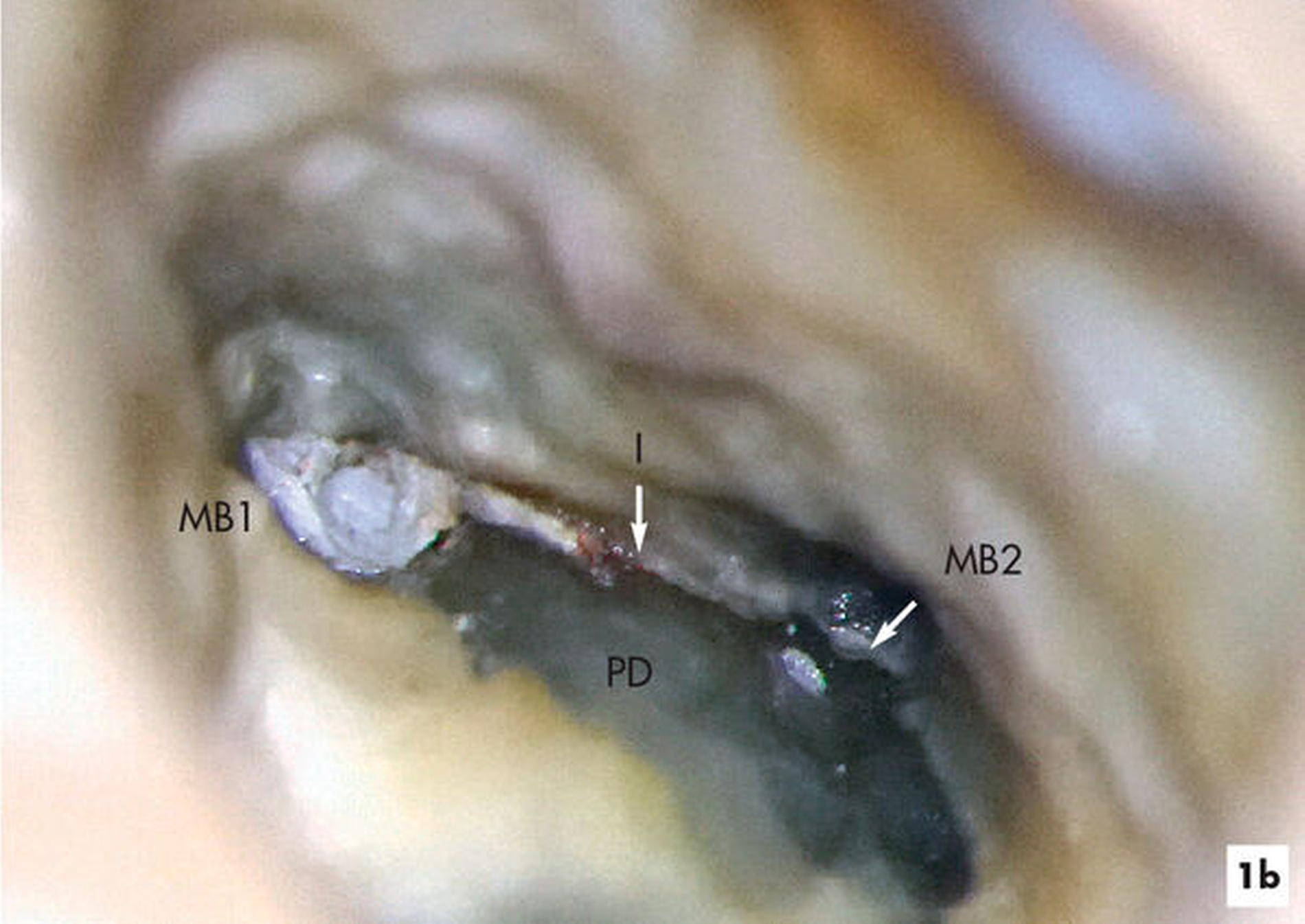
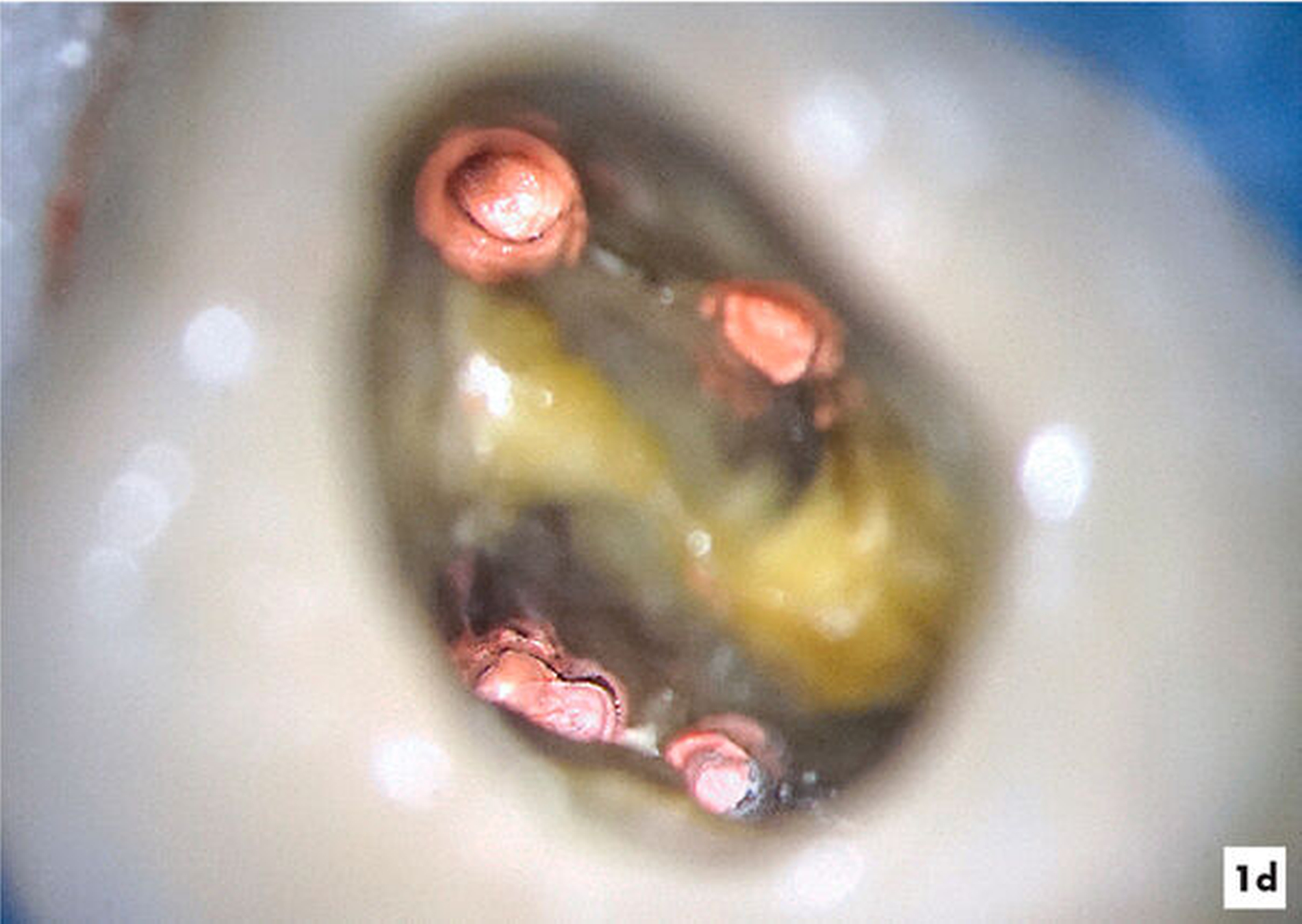
Fallbeispiel 1 (Abbildung 1)
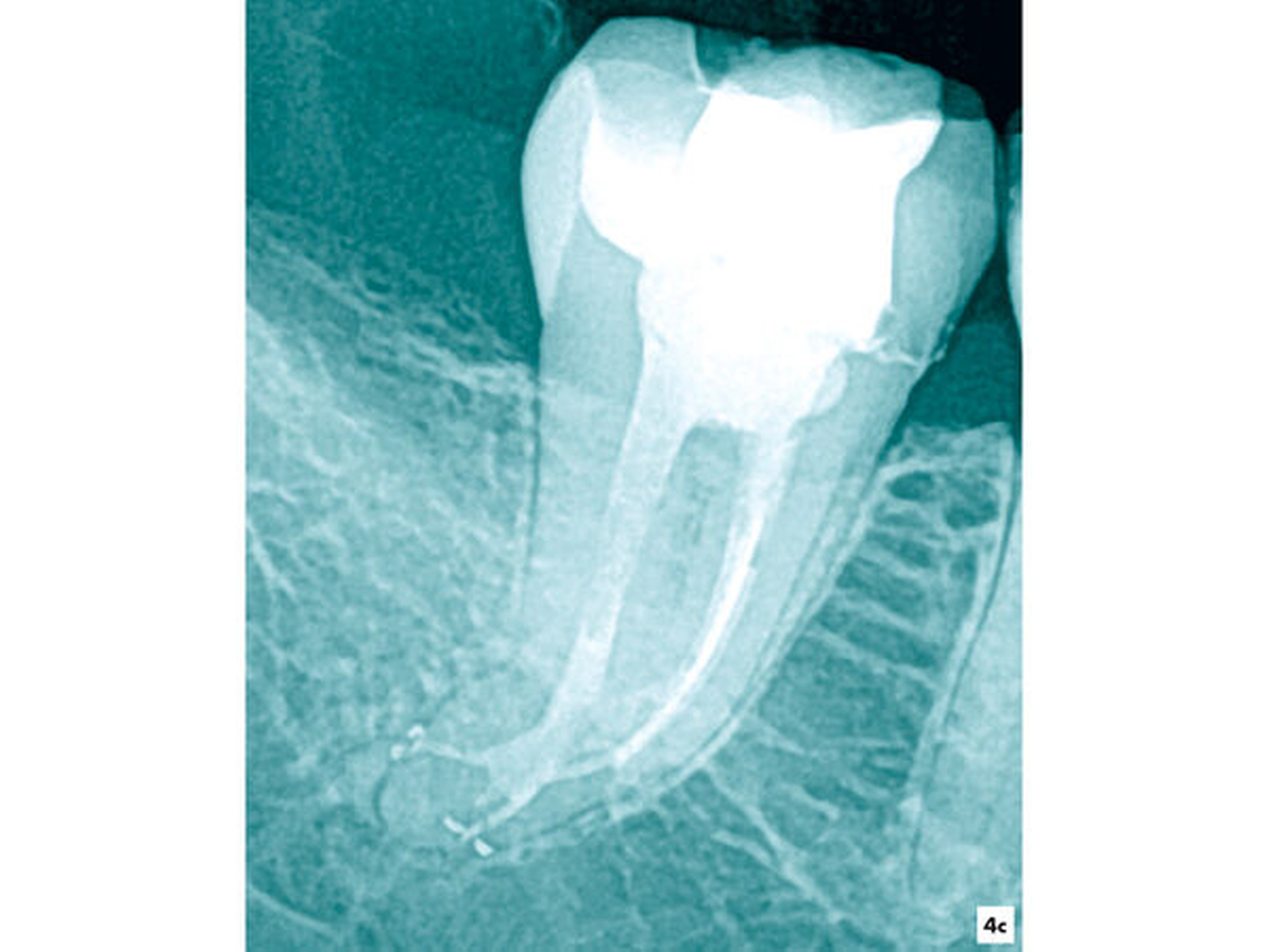
Aufgrund einer fortbestehenden mikrobiellen Infektion wurde eine endodontische Revision am Zahn 26 erforderlich. Unter vergrößerter Sicht mit einem Dentalmikroskop ließen sich drei in Einstifttechnik gefüllte Wurzelkanäle bei achtfacher Vergrößerung darstellen. Am Boden der Pulpakammer ist das Primärdentin von dem die Pulpakammer einengenden Sekundärdentin zu differenzieren, so dass unbehandelte endodontische Hohlräume gut erkannt werden können (Abbildung 1a).
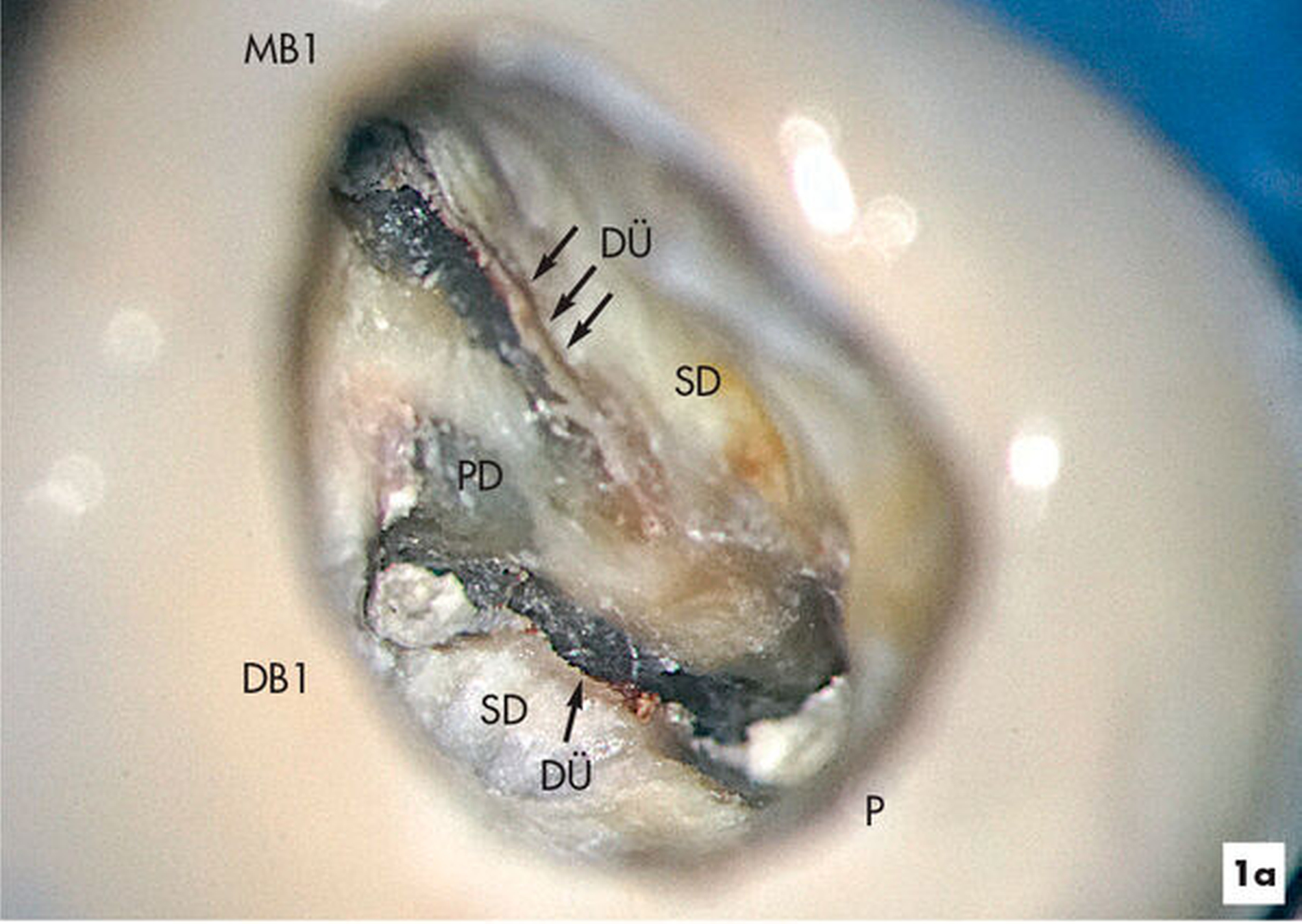
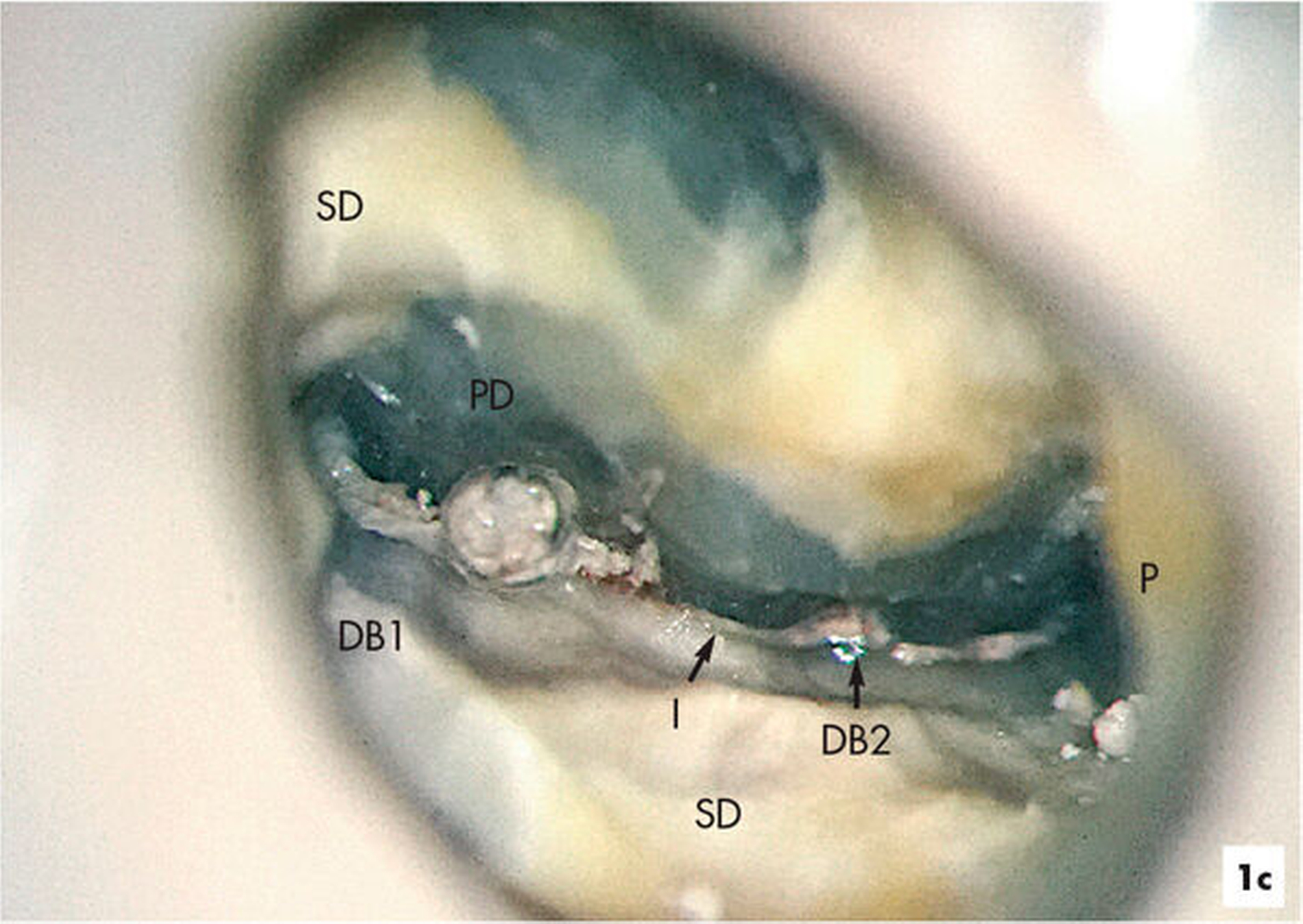
Im Verlauf des minimalinvasiven Abtrags von Sekundärdentin mit Langschaftrosenbohrern in absteigender Größe 012 bis 005 gelingt es, den zweiten Anteil des mesiobukkalen Wurzelkanalsystems (MB2) für eine mechanische Erweiterung, Reinigung und Desinfektion freizulegen (Abbildung 1b). Im Verlauf der Präparation des distobukkal teilweise gefüllten Wurzelkanals wird die Diskrepanz zwischen bisher aufbereitetem Volumen und tatsächlicher Dimension des Wurzelkanalsystems deutlich. Die Fusion der distobukkalen mit der palatinalen Wurzel hinterließ ein langgestrecktes, bandförmiges Wurzelkanalsystem mit fibrosierten und kalzifizierten nekrotischen Geweberesten (Abbildung 1c).
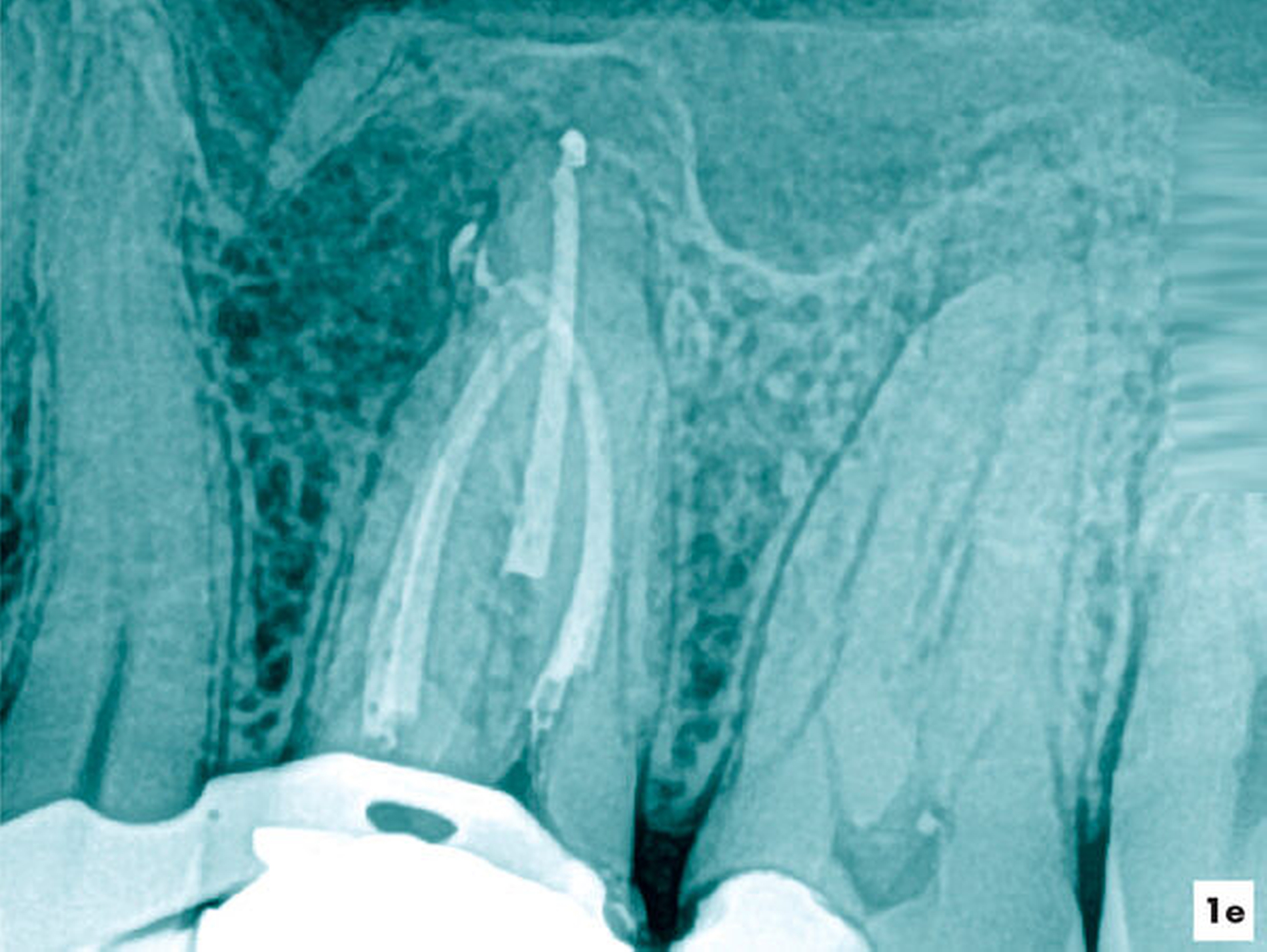
Unter kontinuierlicher mikroskopischer Kontrolle erfolgte die mechanische Erweiterung mit rotierenden NiTi-Instrumenten, so dass eine Desinfektion und eine vollständige thermoplastische Wurzelkanalfüllung möglich wurden (Abbildungen 1d und 1e).
Fallbeispiel 2 (Abbildung 2)
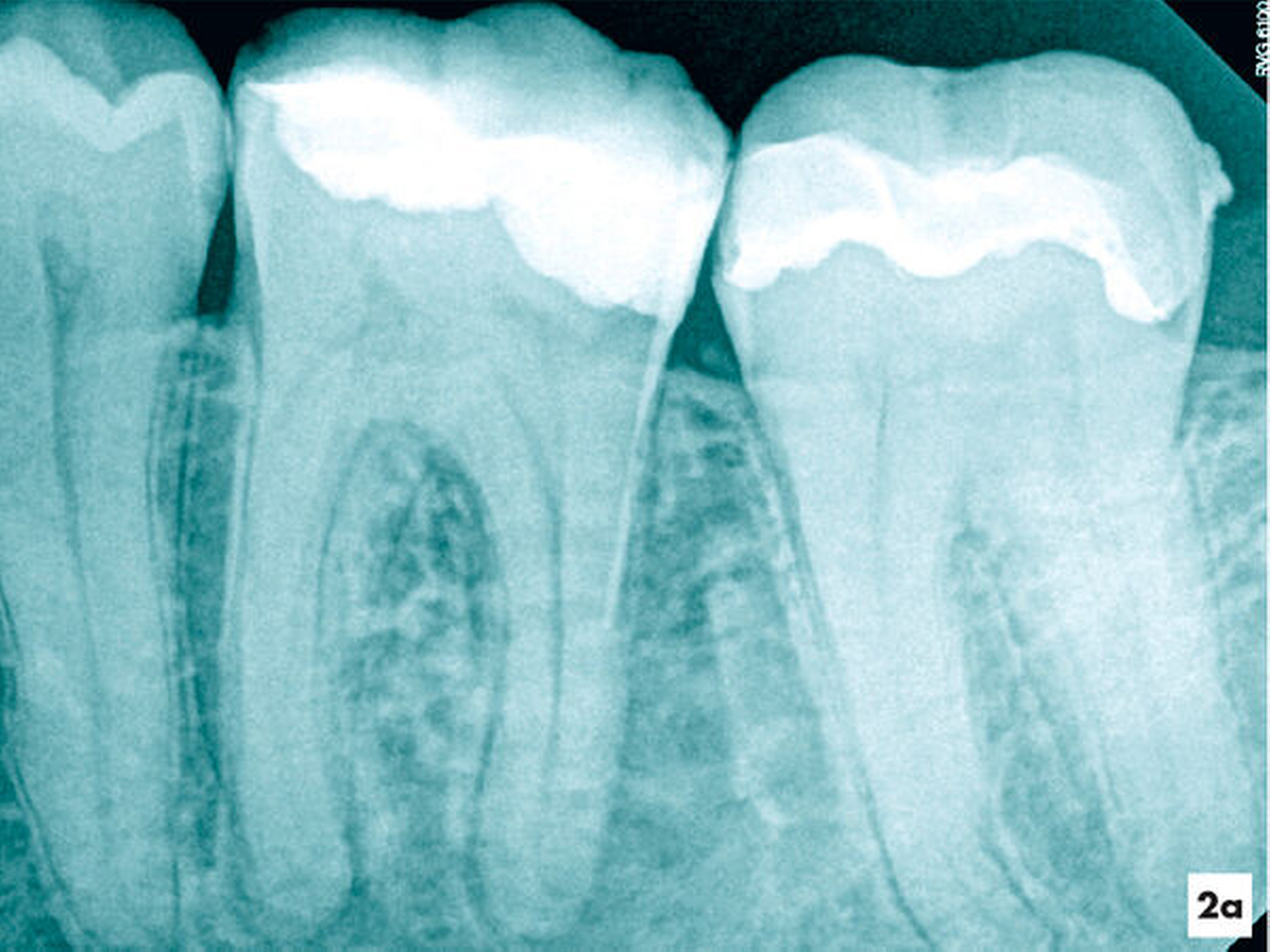
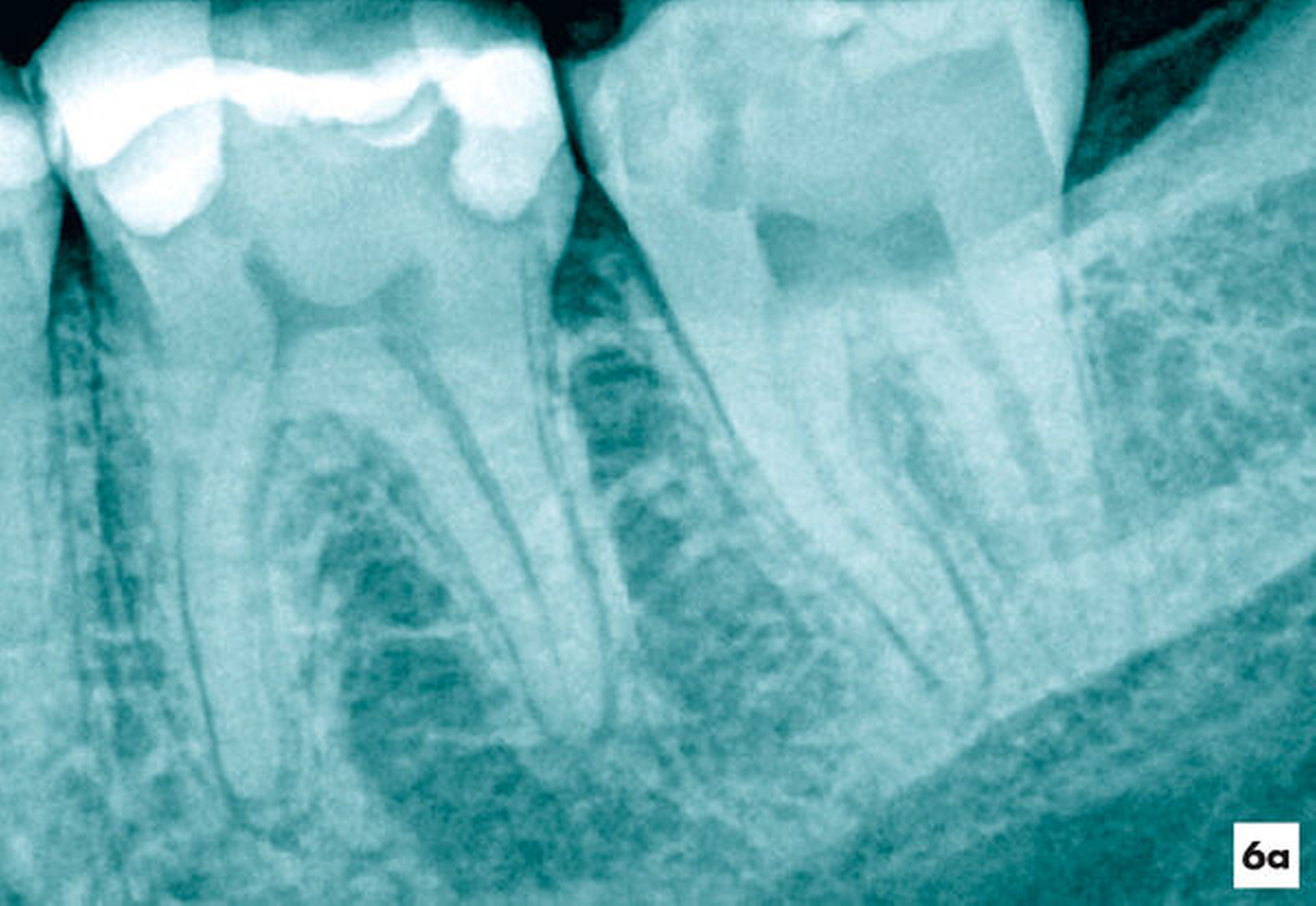
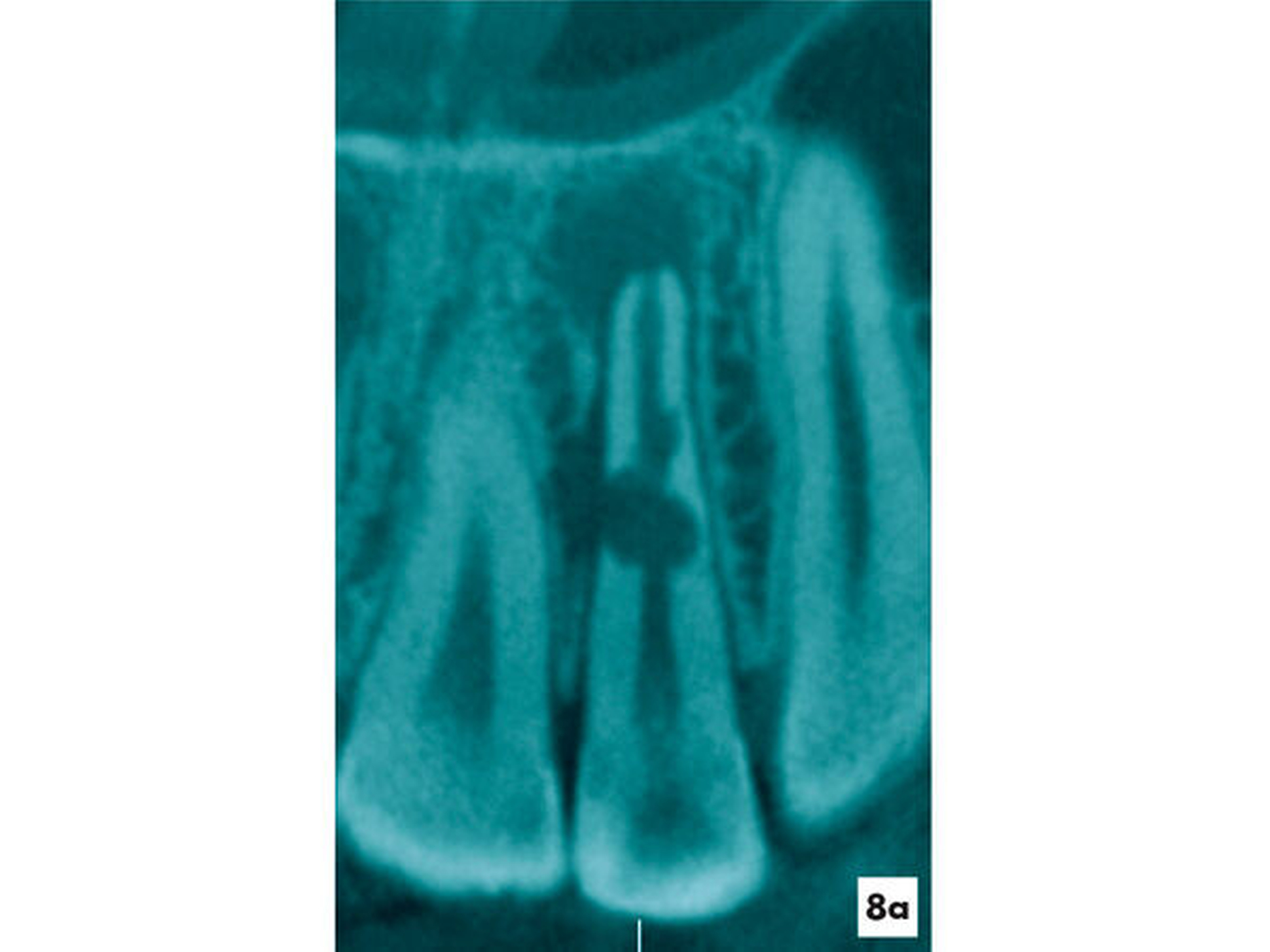
Eine ehemals profunde Karies führte über mehrere Jahre zu einer degenerativen Pulpaerkrankung am Zahn 36. Röntgenologisch ließ sich eine Obliteration der Pulpakammer und des mesialen Wurzelkanalsystems erkennen. Distal lag eine periapikale Aufhellung vor, die klinisch mit einer Fistel assoziiert war (Abbildung 2a).
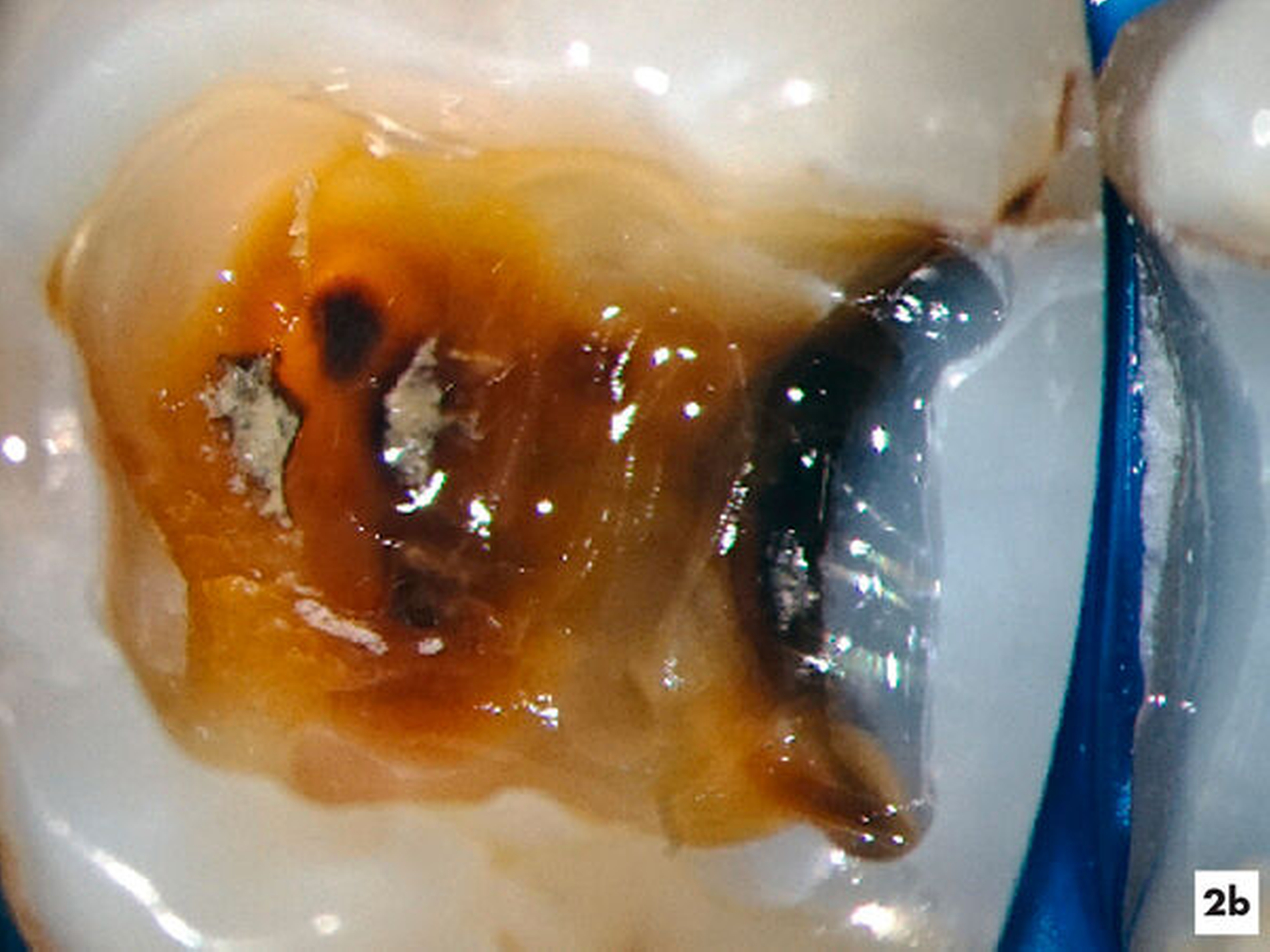
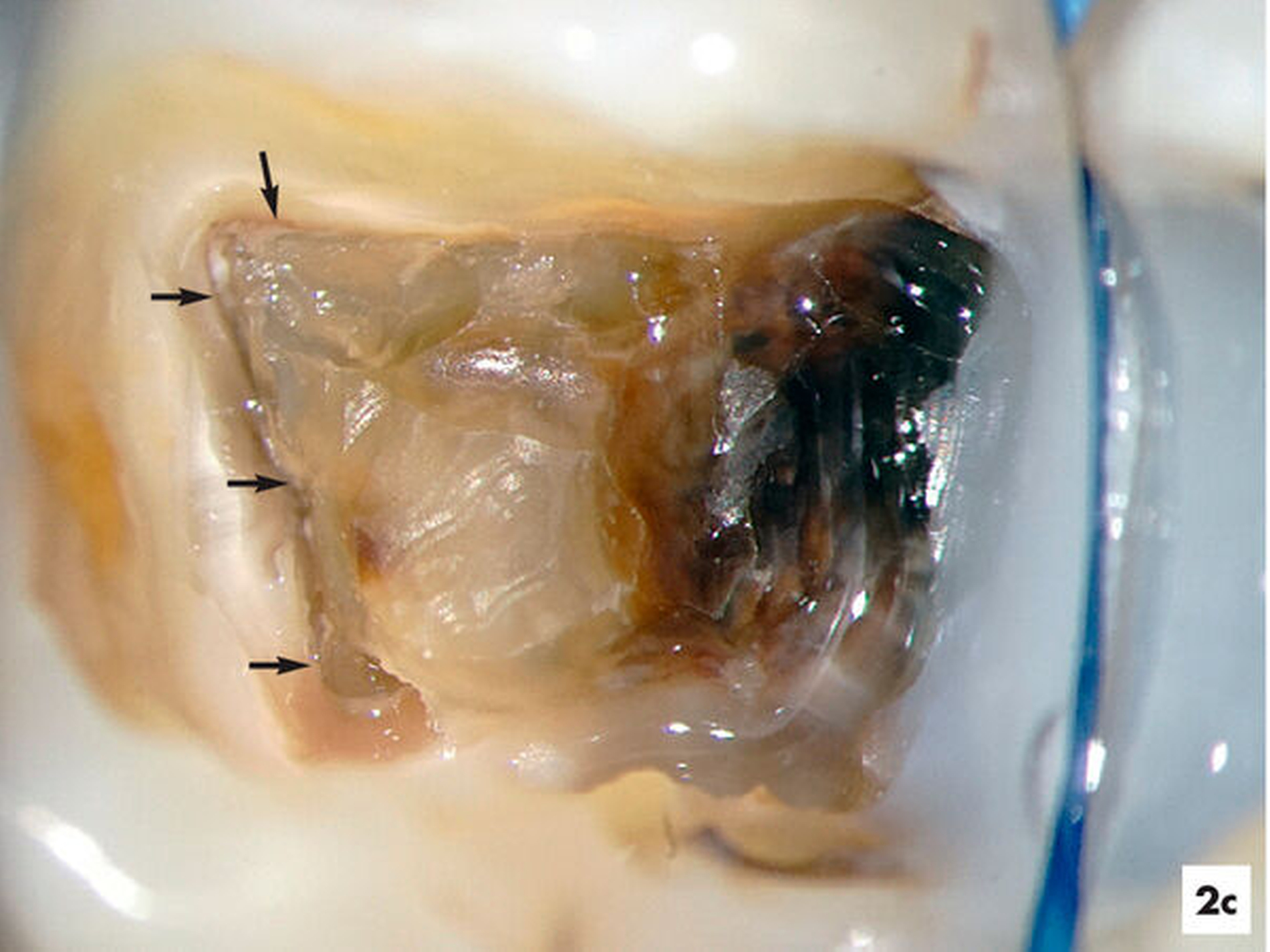
Unter absoluter Trockenlegung des Zahnes 36 mit Kofferdam erfolgte die Entfernung der Füllungsmaterialien. Im Verlauf der intrakoronalen Befundaufnahme und Diagnostik ließ sich bei 8- bis 16-facher Vergrößerung dunkel verfärbtes Dentin distal erkennen (Abbildung 2b). Innerhalb der Pulpakammer ließ sich ein dentinähnliches Hartgewebe zum Sekundärdentin differenzieren. Weichgewebige Einschlüsse am Rand ließen vermuten, dass es sich um eine reizgebundene Hartgewebeneubildung der Pulpa handelte (Abbildung 2c). Mit grazilen Rosenbohrern in absteigender Größe von ISO 012 bis 005 ließ sich das Hartgewebe sicher entfernen, so dass die mesialen Wurzelkanaleingänge für eine mechanische Erweiterung zugänglich waren (Abbildung 2d).
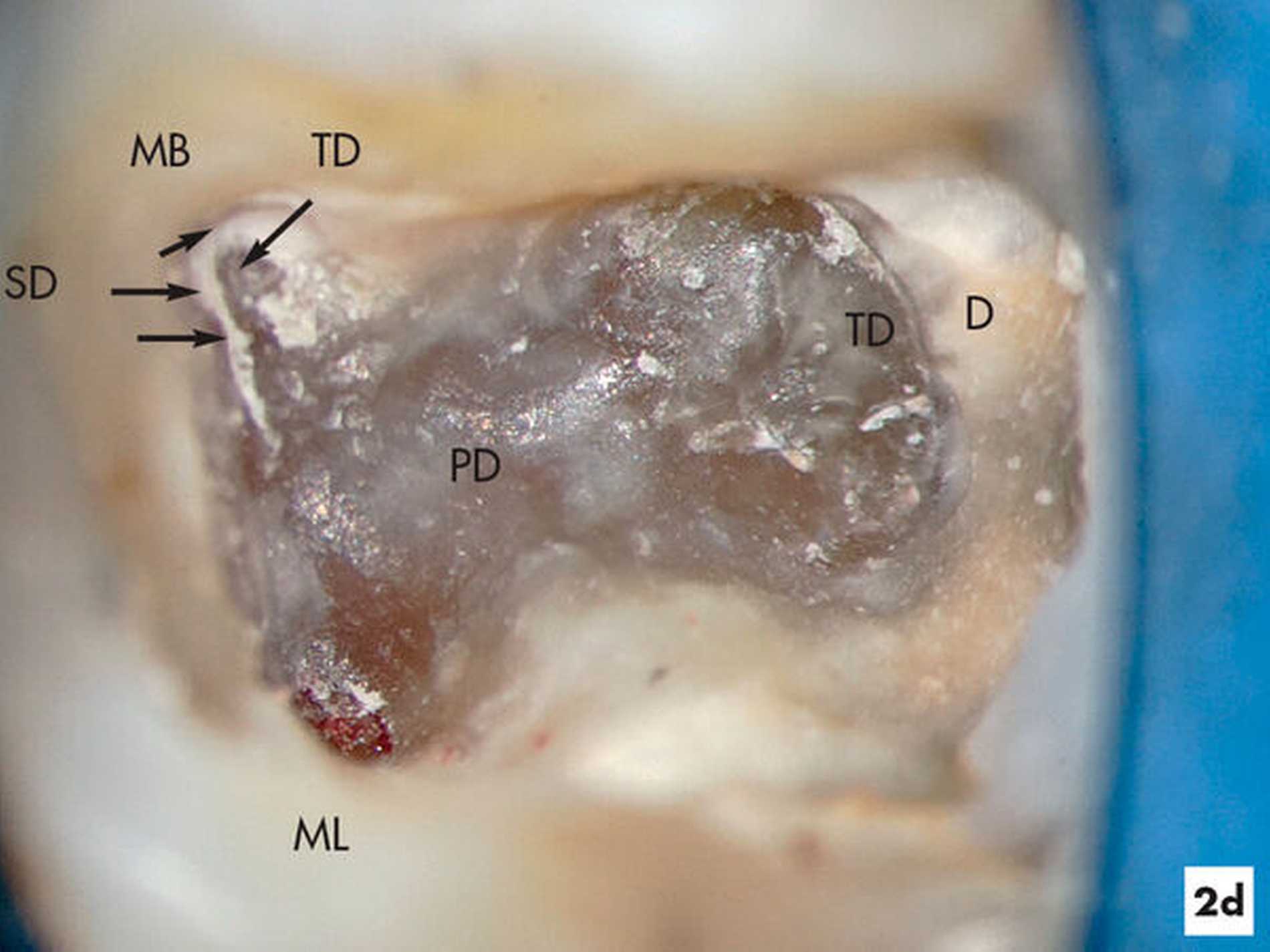
Während sich mesial vitales Pulpagewebe erhalten konnte, lag distal eine Pulpanekrose vor. Als Folge der Reizdentinbildung kam es auch in der distalen Wurzel zu einer Unterteilung in drei Wurzelkanäle, die bei 16-facher Vergrößerung substanzschonend erweitert, desinfiziert und gefüllt werden konnten (Abbildung 2e).
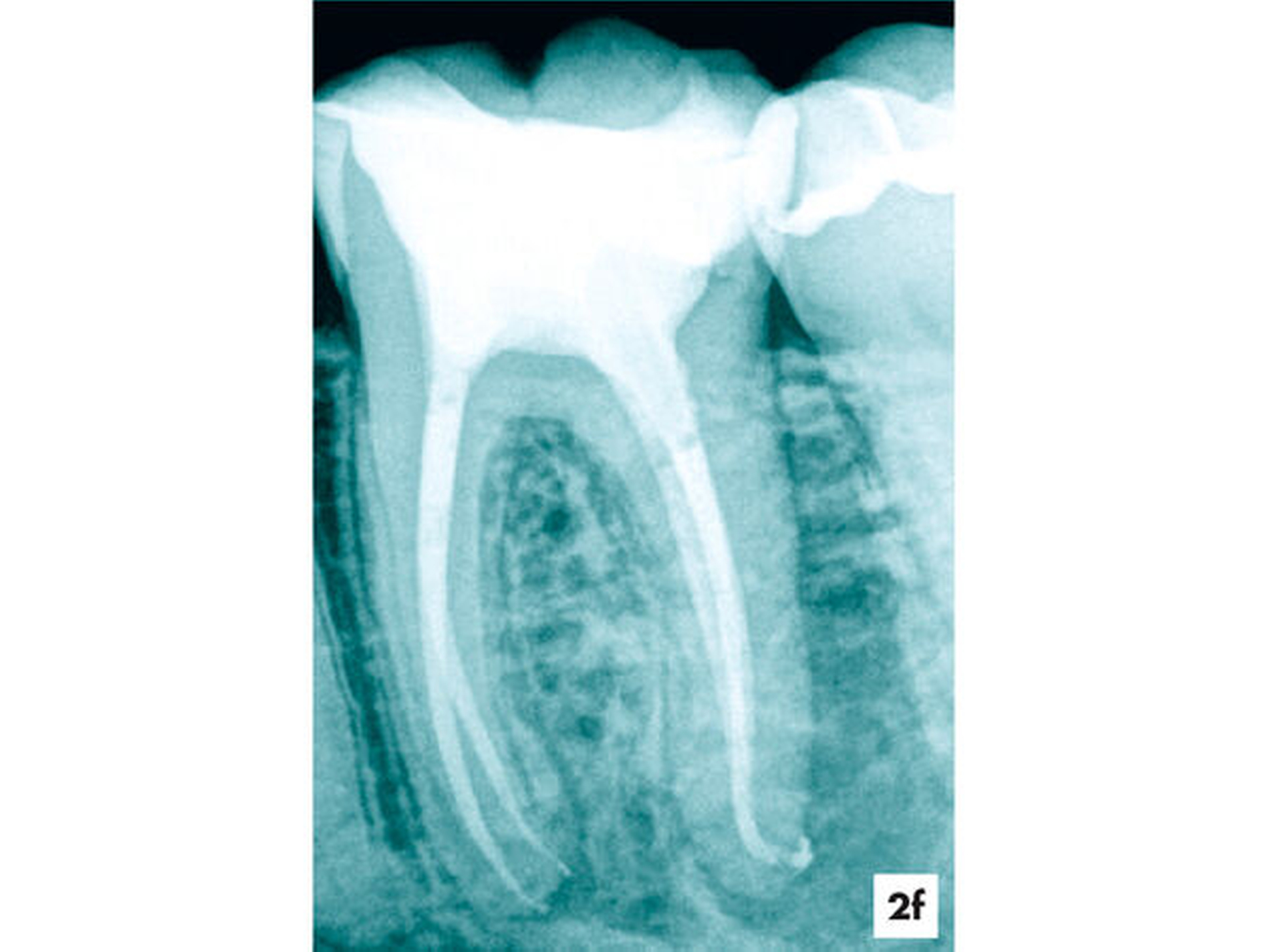
Zwei Tage nach Abschluss der einzeitigen Therapie war die Fistel verschlossen und zum 6-Monats-Recall ließ sich bereits eine deutliche Verringerung der periapikalen Aufhellung nachweisen (Abbildungen 2f und 2g).
Die endodontische Revision
Im Verlauf der endodontischen Revision müssen unterschiedlichste Füllungsmaterialien sicher und substanzschonend entfernt werden, damit eine Desinfektion mikrobiell infizierten Dentins wirksam werden kann. In Abhängigkeit zur klinischen Erfahrung, zu den speziellen Hilfsmitteln und der genutzten Vergrößerung können die Ergebnisse mit dem Dentalmikroskop verbessert werden [Wu et al., 2011]. So gelingt es unter Sicht mit dem Mikroskop, am Dentin anhaftendes Wurzelfüllungsmaterial besser zu entfernen [Baldassari-Cruz & Wilcox, 1999; de Mello et al., 2009]. Dazu können grazile Ultraschallansätze oder mikroabrasive Self-Adjusting-Files (SAF) genutzt werden.
In der Vergangenheit ließen sich ohne optische Hilfsmittel Fragmente in durchschnittlich 60 Prozent der Fälle erfolgreich entfernen [Hülsmann & Schinkel, 1999]. Zu den häufigsten Komplikationen zählten die Stufenpräparation, die Perforation des Wurzeldentins und die Vertikalfraktur als Folge des zu starken Zahnhartsubstanzverlusts. Die erfolgreiche Entfernung wurde angestrebt, konnte aber nicht zugesichert werden.
Mit der Nutzung des Dentalmikroskops und der Ultraschalltechnik können Fragmente in über 90 Prozent der Fälle erfolgreich und minimalinvasiv entfernt werden [Suter et al., 2005; Cuje et al., 2010]. Neue Entfernungstechniken konnten erst durch den Einsatz des Dentalmikroskops entwickelt und genutzt werden. So müssen Fragmente nicht mehr zirkulär, sondern häufig nur noch entlang einer Seite im Wurzelkanal mit Ultraschall frei präpariert werden, um sie luxieren und mit grazilen Drahtschlingen zwischen 0,1 und 0,3 mm entfernen zu können [Arnold, 2015].
Fallbeispiel 3 (Abbildung 4)
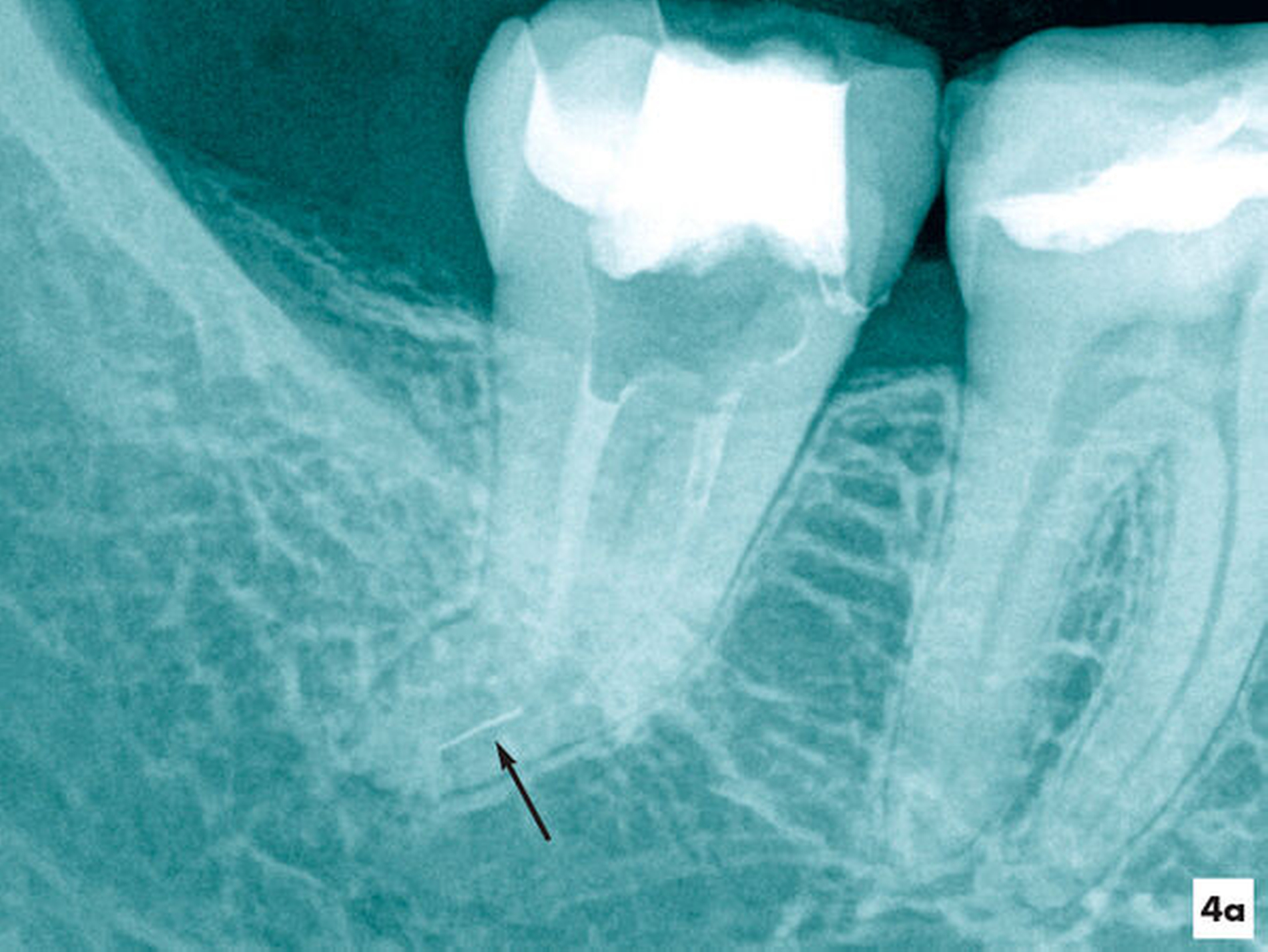
Im Verlauf der Erweiterung eines stark gekrümmten Wurzelkanalsystems kam es nach einer Vitalexstirpation am Zahn 47 zur Fraktur eines Wurzelkanalinstruments in apikaler Lage (Abbildung 4a). Unter Sicht mit dem Dentalmikroskop wurden die Wurzelkanäle bis ins apikale Wurzeldrittel mit NiTi-Feilen bis zum Fragment mechanisch erweitert. Nach einer ultraschallaktivierten Spülung und Desinfektion konnte das Fragment mit einer vorgebogenen Ultraschallfeile IrriK (VDW, München) in der Größe ISO 15 gelockert und entfernt werden, so dass eine vollständige Wurzelkanalbehandlung möglich wurde (Abbildungen 4b und 4c).
Fallbeispiel 3: Zahn 37 mit Fragment in apikaler Lage
Neue Techniken und Indikationserweiterungen
Die Indikationsgrenzen für die Therapieverfahren konnten unter Anwendung des Dentalmikroskops zugunsten der Zahnerhaltung unter Anwendung weiterer neuer Hilfsmittel verändert werden [Carr & Murgel, 2010].
Pulpotomie beim Erwachsenen
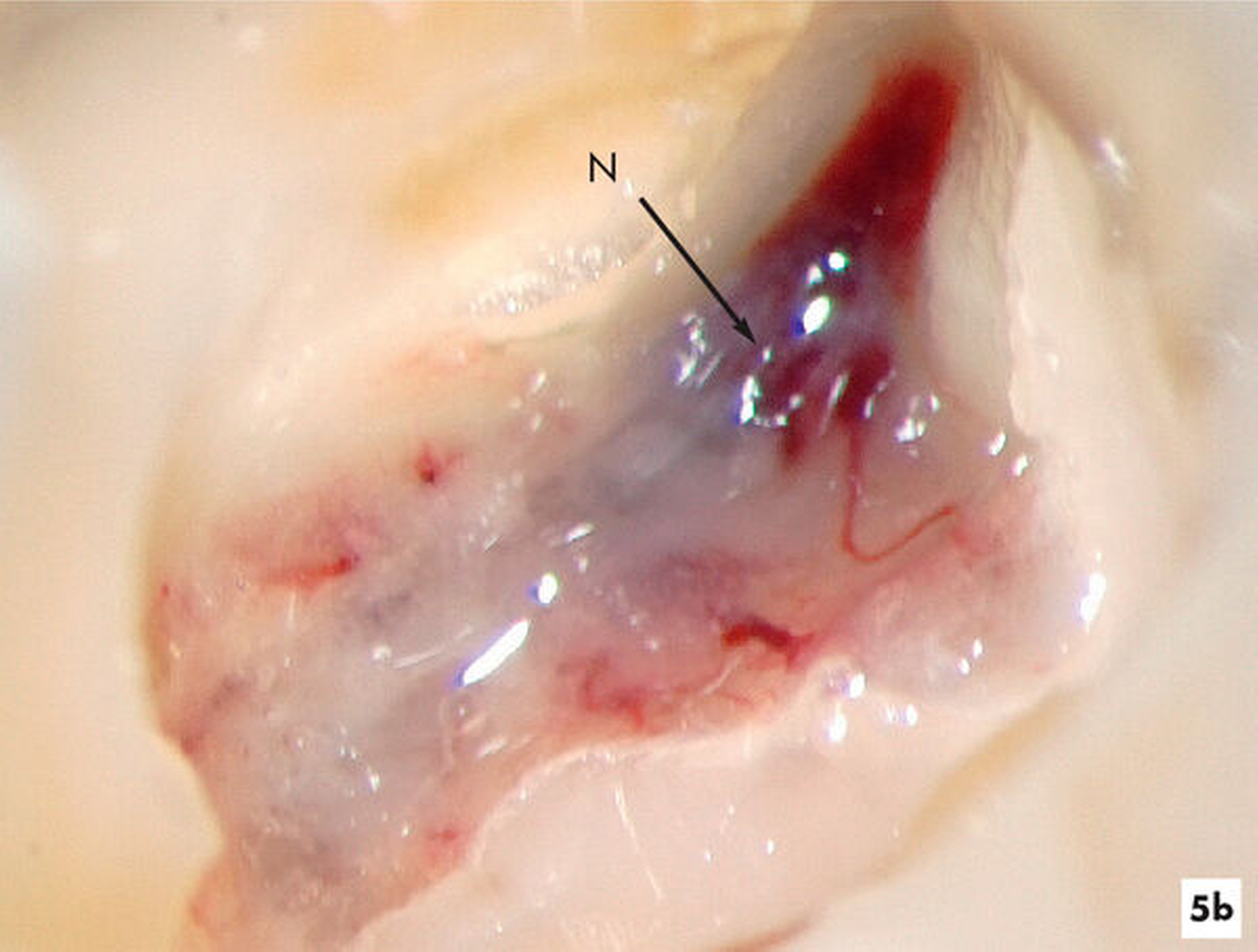
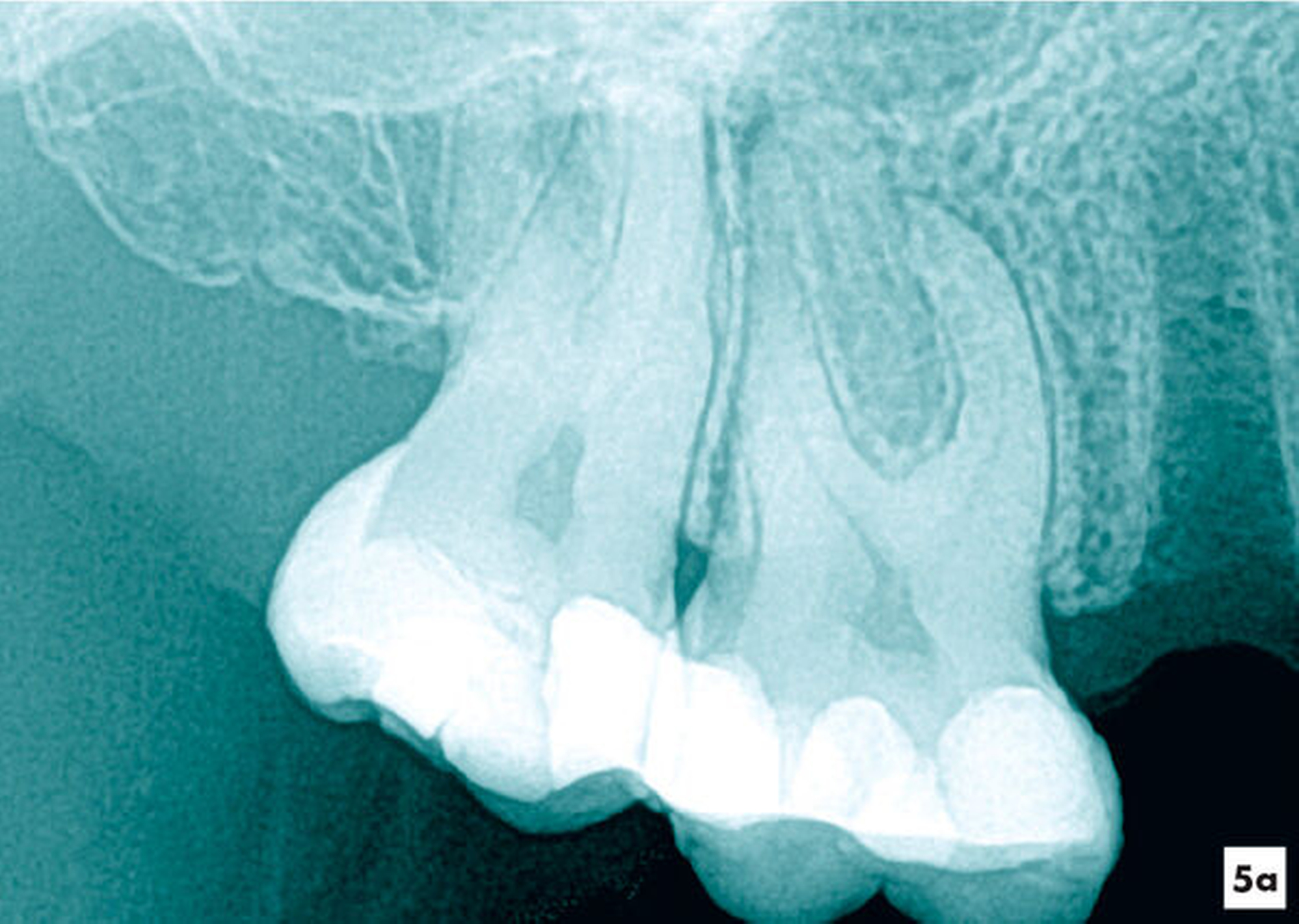
Wird im kariösen Dentin die Pulpa eröffnet, galt bislang die Pulpa bei abgeschlossenem Wurzelwachstum als verlorenes Organ und eine Vitalexstirpation wurde empfohlen [Klimm, 2003]. Auch die Eröffnungsfläche der Pulpa von mehr als 1 mm2 galt selbst im kariesfreien Dentin als Indikation für eine Vitalexstirpation, so dass eine komplette Wurzelkanalbehandlung empfohlen wurde. Aktuell werden Verfahren zur Vitalerhaltung genutzt, bei denen das geschädigte Pulpagewebe entfernt wird und die verbliebene Pulpa unter aseptischen Bedingungen mit einem Wundverband versorgt und erhalten wird [Duncan et al., 2019; Ricucci et al., 2019]. Grundlage für diese neue Therapie ist eine vergrößerte Sicht mit dem Dentalmikroskop auf das kariöse Dentin und das Pulpagewebe. So kann besser ermittelt werden, ob die Pulpa irreversibel geschädigt wurde und welche Anteile der Pulpa entfernt werden müssen [Ricucci et al., 2019] (Abbildungen 5a und 5b).
Beurteilung der Pulpa unter dem Mikroskop:
Fallbeispiel 4 (Abbildung 6)
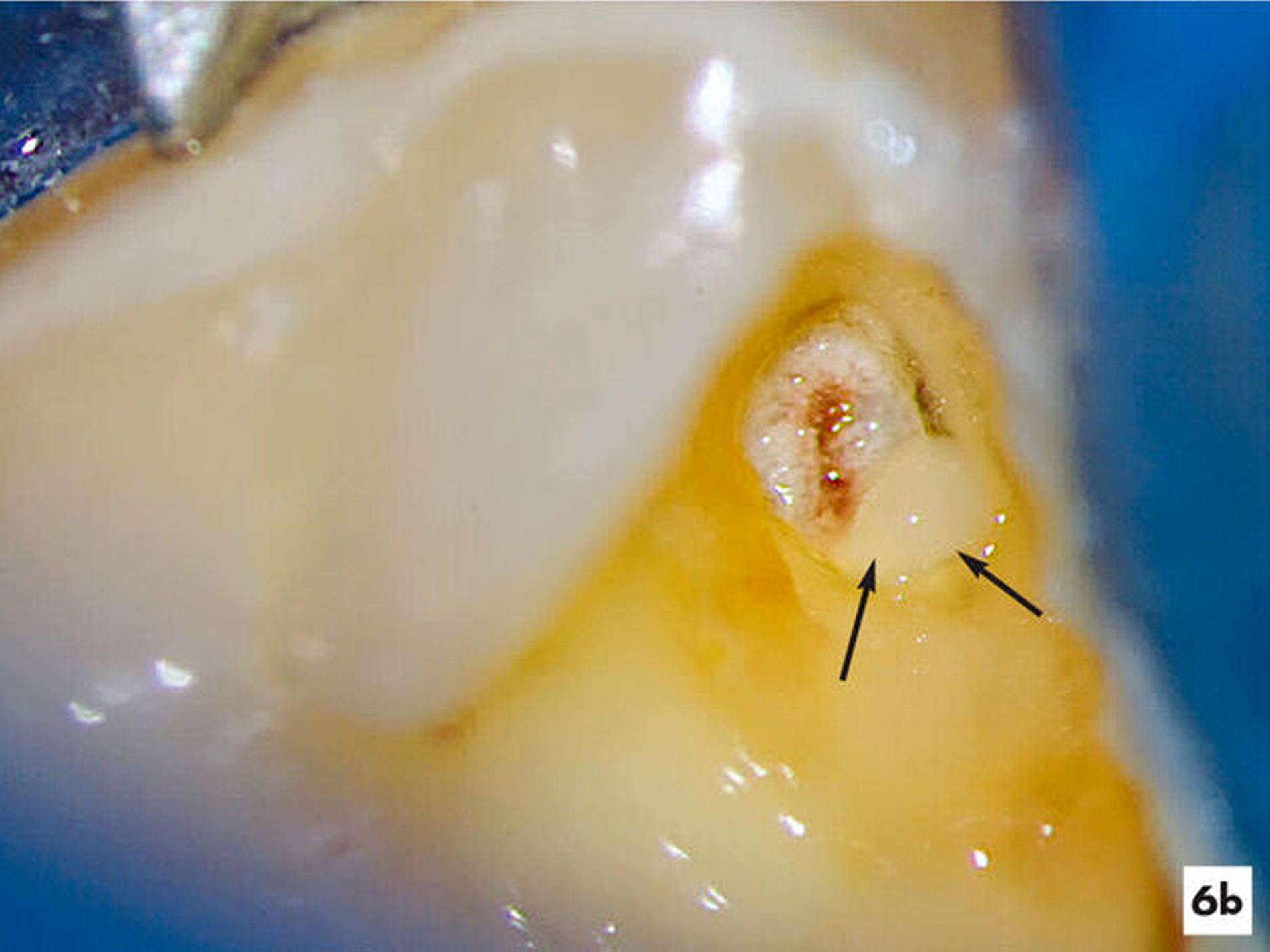
Eine 22-jährige Patientin verspürte nach einer direkten Überkappung mit Ledermix am Zahn 37 pulsierende Schmerzen. Die wiederholte Einnahme von Ibuprofen 400 führte nicht zu Schmerzfreiheit. Der Zahn wies keine pathologischen Sondierungswerte auf, war jedoch mit Zahnbeweglichkeit Grad II im Vergleich zum Restzahngebiss gelockert und perkussionssensibel. Es bestand der Verdacht auf eine irreversible Pulpitis (Abbildung 6a).
Fallbeispiel 4: Pulpotomie am Zahn 37
Unter Kofferdam wurde das Verschlussmaterial entfernt. Im Bereich der offen liegenden Pulpakammer ließ sich bei achtfacher Vergrößerung ein Pustropfen erkennen (Abbildung 6b). Daraufhin wurden das Pulpakammerdach im Bereich der ehemaligen kariösen Läsion und das Pulpagewebe oberflächlich unter Wasserkühlung mit einem Diamant abgetragen (Abbildung 6c). Nach einer zehn Minuten andauernden Oberflächendesinfektion mit 3-prozentigem NaOCl und Spülung mit Kochsalzlösung kam es zu keiner weiteren Blutung. Das intakte und homogen durchblutete Pulpagewebe ließ vermuten, dass die Pulpa weiterhin erhalten bleiben kann, so dass die etwa 5 mm2 große Pulpawunde mit MTA abgedeckt wurde. Die Kavität wurde mit Komposit verschlossen. Die Schmerzsymptomatik klang bereits nach einem Tag vollständig ab.
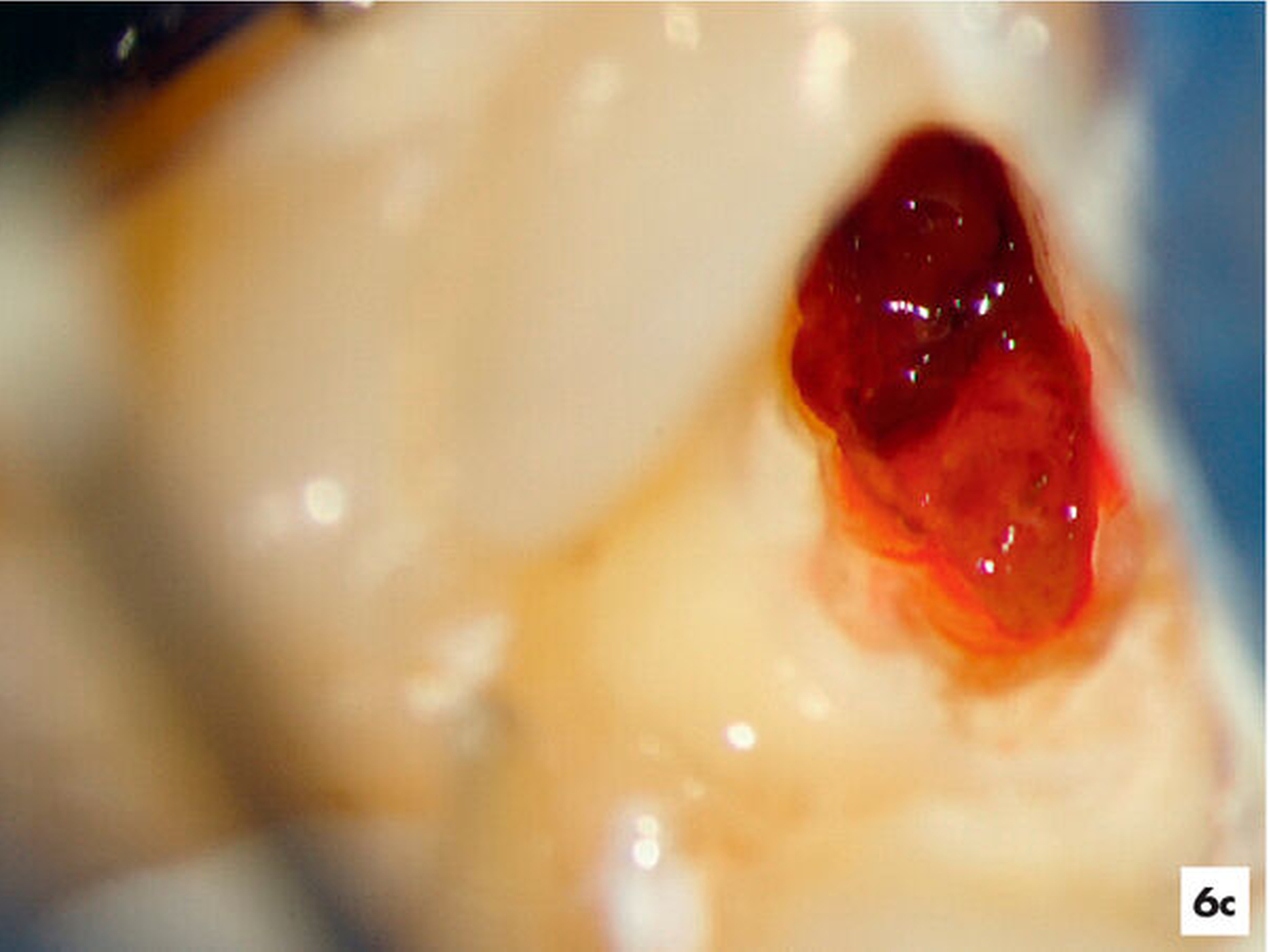
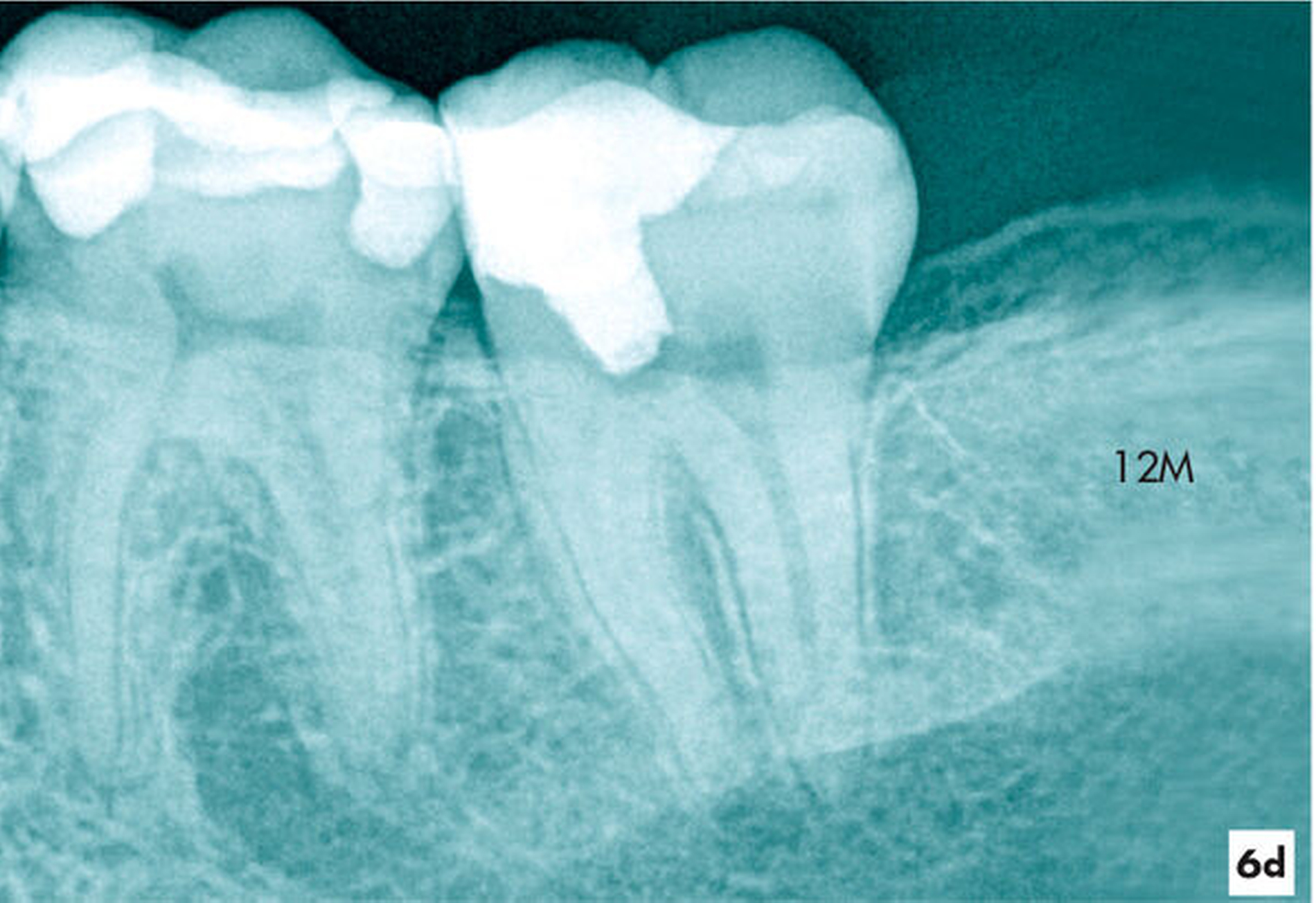
Zum Einjahresrecall reagierte der Zahn auf den thermischen und elektrischen Sensibilitätstest positiv. Die Zahnbeweglichkeit war physiologisch und röntgenologisch erschien der Desmodontalspalt im Vergleich zum Ausgangsbild in normaler Breite (Abbildung 6d).
Einzeitig versus mehrzeitig
Bereits seit über 150 Jahren besteht Einigkeit darin, dass nicht mikrobiell infizierte Wurzelkanalsysteme in einer Sitzung behandelt werden sollten [Tomes, 1861]. Auf der Basis der vorliegenden Untersuchungen gibt es auch bei infizierten Wurzelkanalsystemen keinen signifikanten Unterschied im klinischen Erfolg zwischen einzeitigen und mehrzeitigen Therapieverfahren [Balto, 2009; Figini et al., 2008]. Im zahnärztlichen Alltag überwiegt jedoch das mehrzeitige Therapieverfahren in der Endodontie [Sathorn et al., 2009]. Ursache für das Festhalten an mehrzeitigen Therapieverfahren kann die Unsicherheit sein, ob die chemomechanische Aufbereitung hinreichend zur Eliminierung der intrakanalären Infektion beigetragen hat. Ist der Patient frei von pathologischen Symptomen, erfolgt die Wurzelkanalfüllung. Die symptomorientierte Entscheidung für die Therapie hat sich bewährt, beinhaltet jedoch auch Risiken und Mehrbelastungen für den Patienten [Estrella et al., 2017; Arnold, 2018].
Ein visuell kontrolliertes Arbeiten mit dem Dentalmikroskop ermöglicht das rechtzeitige Erkennen von endodontischen Problemstellungen – zum Beispiel Perforationen, resorptiven Läsionen, tiefen Wurzelkanalaufteilungen, Isthmen oder weiten apikalen Foramen. Risikofaktoren für den Erfolg der Therapie können damit zu großen Teilen ausgeschlossen werden, so dass die objektiven Befunde im Verlauf der Behandlung auch bei infizierten oder symptomatischen Zähnen eine einzeitige Therapie rechtfertigen.
Fallbeispiel 5 (Abbildung 7)
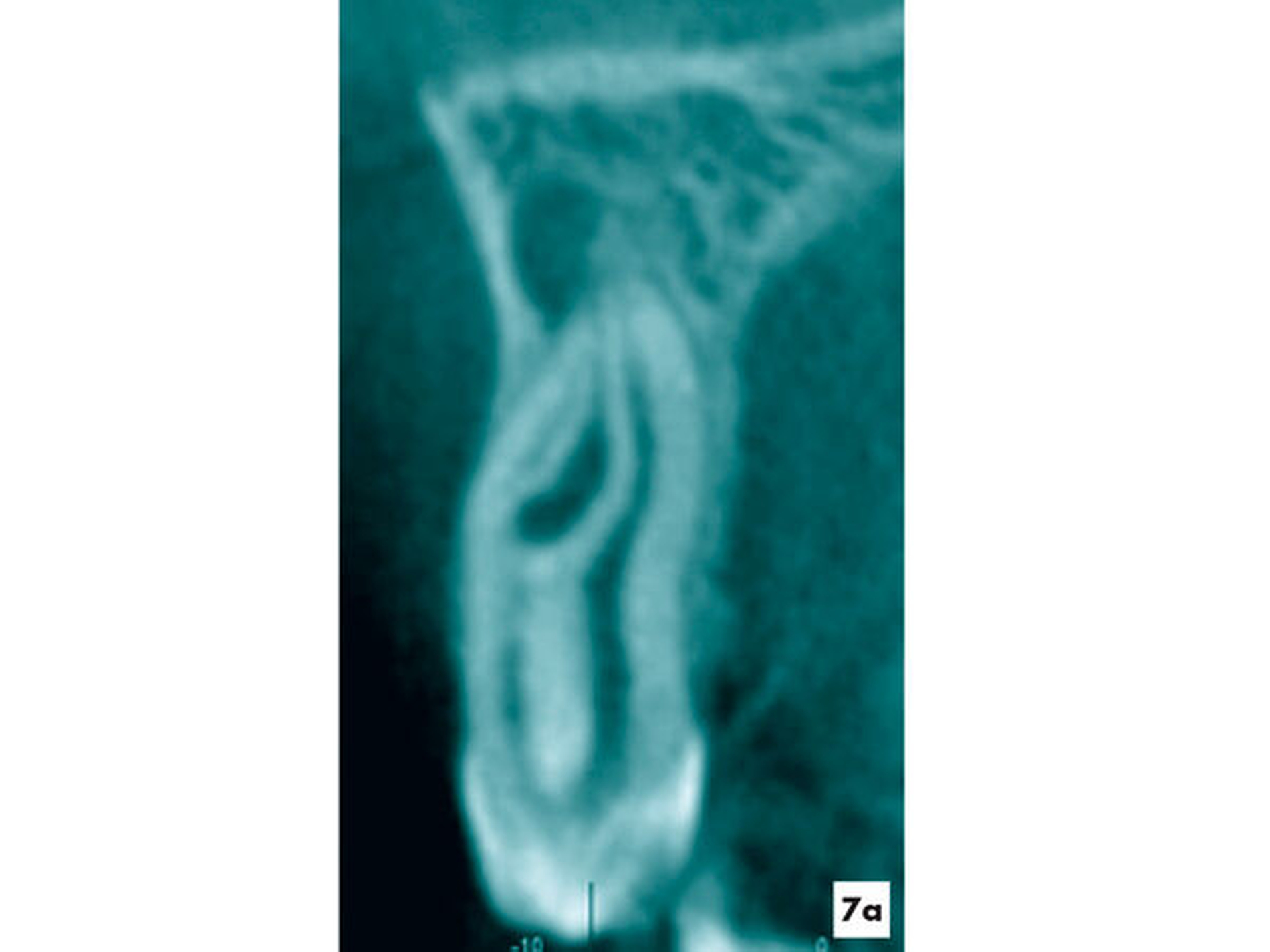
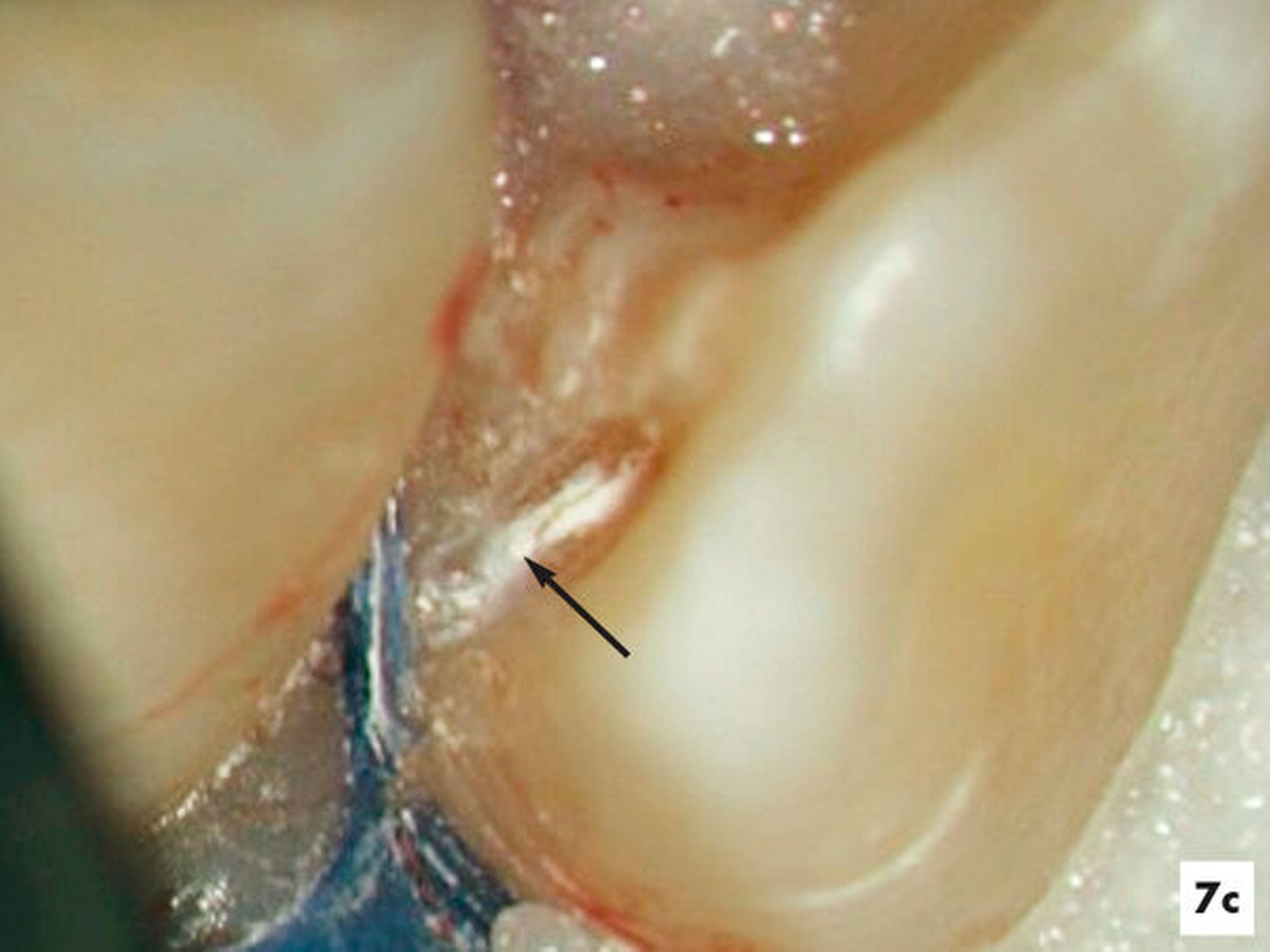
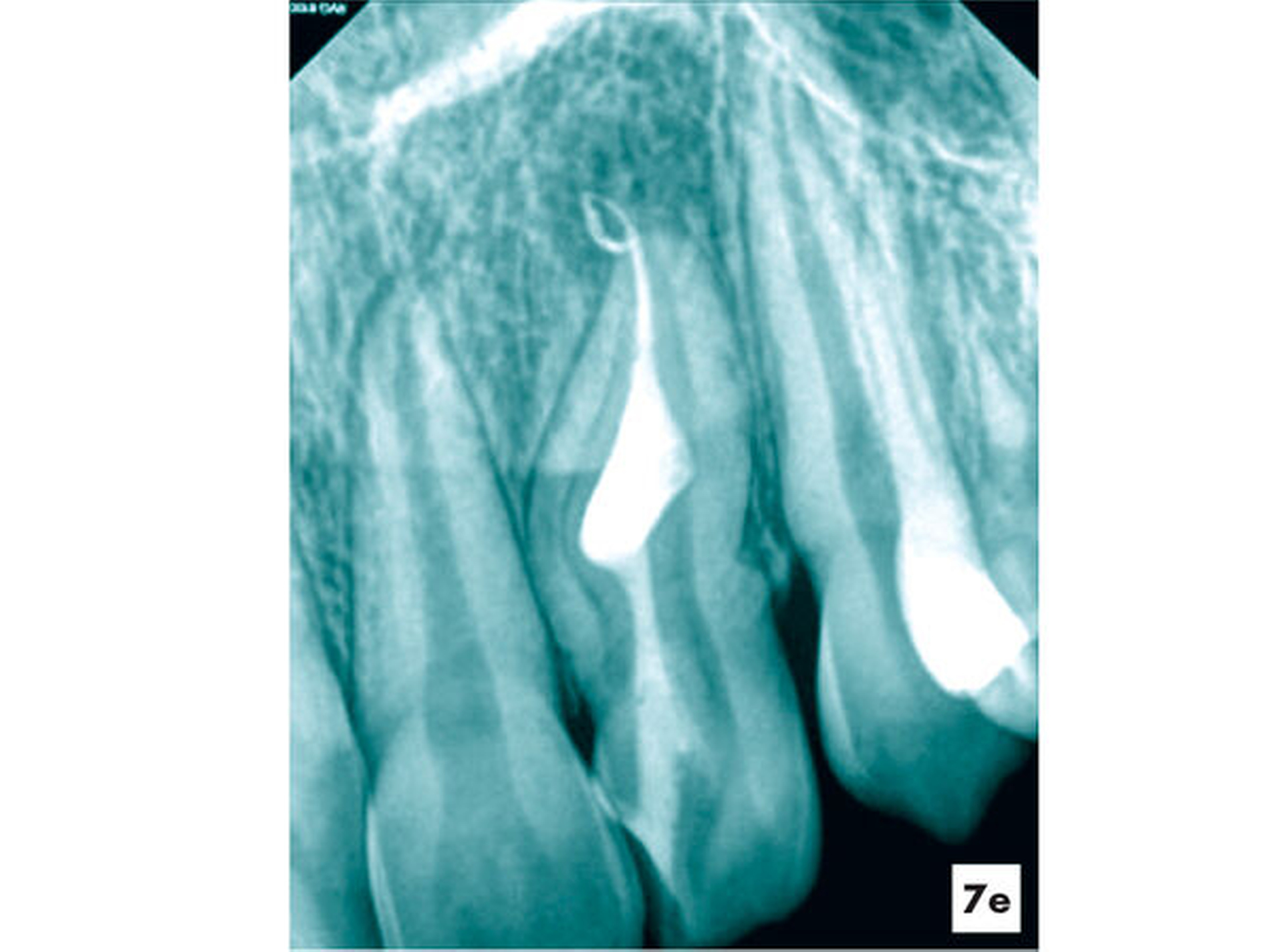
Im Rahmen einer Therapieplanung für eine kieferorthopädische Therapie bei einer elfjährigen Patientin wurde am Zahn 22 eine apikale Aufhellung mit einer hartgewebigen Einstülpung ermittelt. Der Zahn wies keine weiteren pathologischen Befunde auf. Auf den thermischen und elektrischen Sensibilitätstest reagierte die Patientin reproduzierbar positiv. Der radiologische Befund einer apikalen Aufhellung konnte mit der DVT-Aufnahme bestätigt werden (Abbildung 7a). Es lag eine seltene Form eines Dens invaginatus vom Typ 3b nach Oehlers vor.
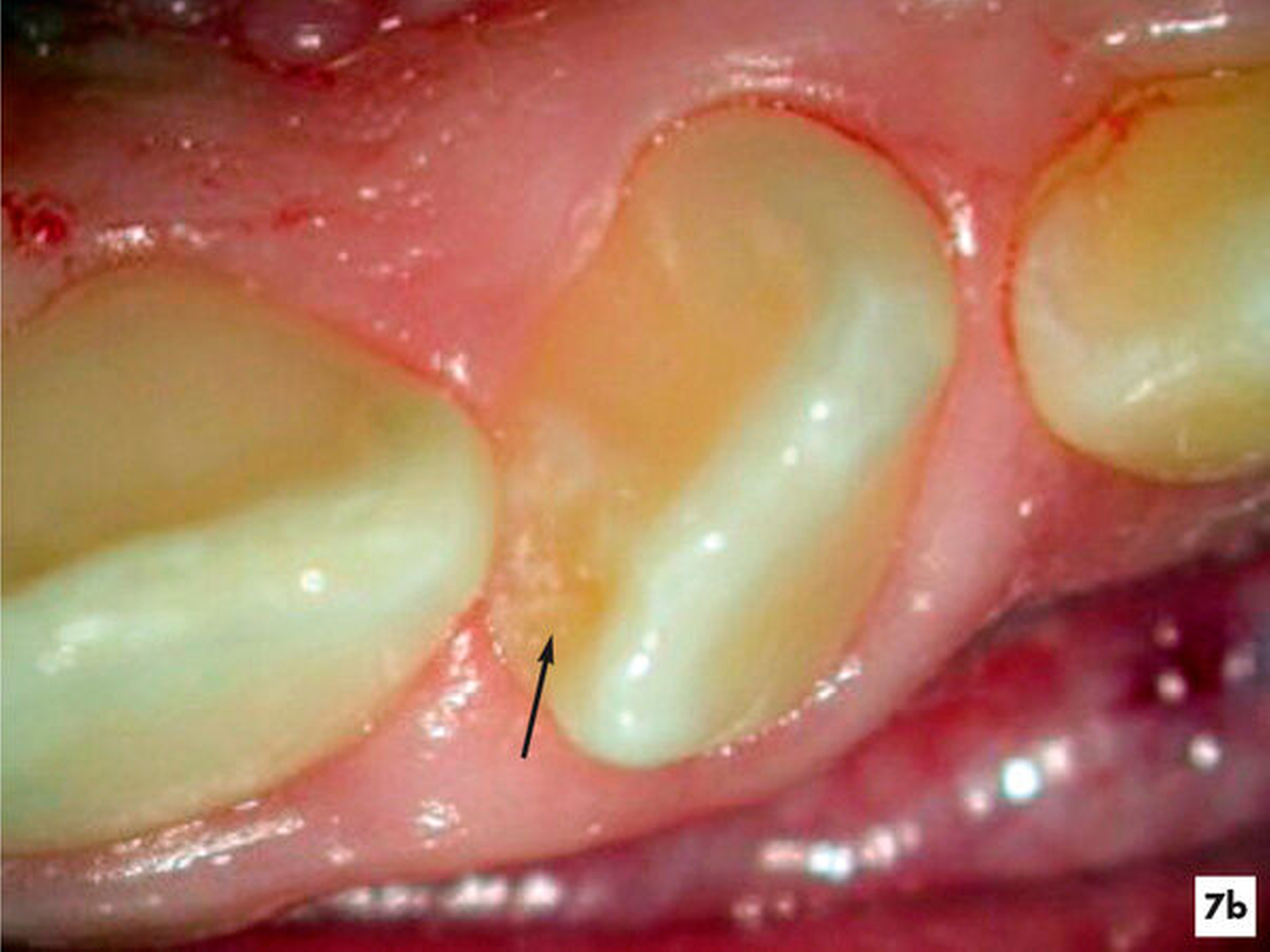
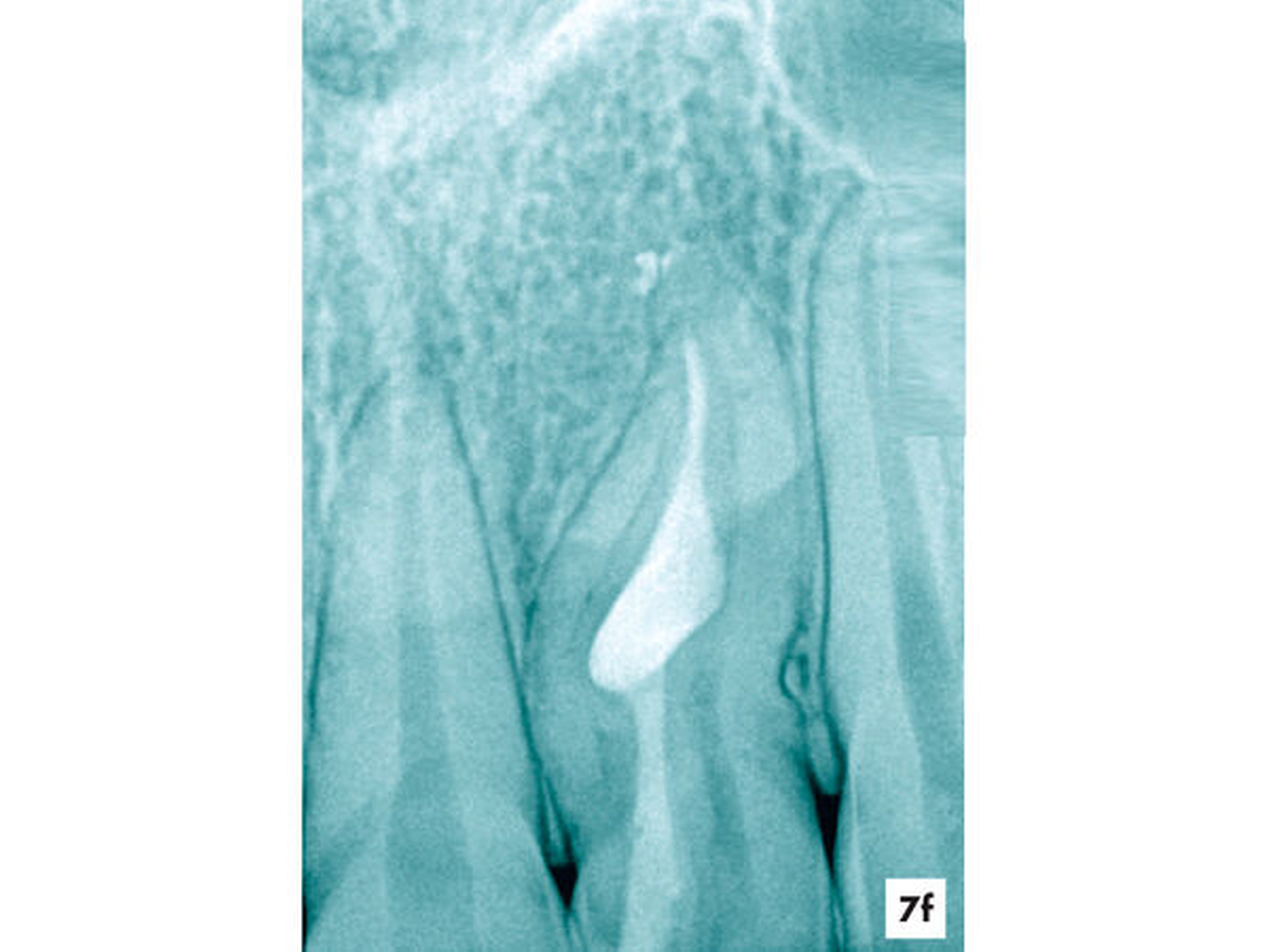
Unter Sicht mit dem Dentalmikroskop gelang es, den Zugang zur Invagination aufzufinden und minimalinvasiv zu erweitern (Abbildung 7b). Nach einer abschließenden Desinfektion konnte der Hohlraum vollständig mit Guttapercha und einem Epoxidharz-haltigen Sealer verschlossen werden, ohne die Vitalität des Zahnes zu beeinträchtigen. Fünf Jahre nach Abschluss der einzeitigen Wurzelkanalbehandlung reagierte der symptomlose Zahn positiv auf den Sensibilitätstest und die apikale Aufhellung erschien deutlich verkleinert (Abbildungen 7e und 7f).
Fallbeispiel 5: Eine seltene Anatomie
Biologische Reparatur
Neue Therapieansätze in der Endodontie verfolgen das Ziel, zerstörte biologische Strukturen im Rahmen eines reparativen Verfahrens wieder zu ersetzen. Erste klinische Fälle und Fallserien lassen vermuten, dass es gelingen kann, Pulpagewebe teilweise zu regenerieren [Iwaya, 2001; Zhujiang & Kim, 2016].
Diese Therapieverfahren sind extrem sensitiv, da bereits kleinste Abweichungen im Therapieablauf das Ergebnis negativ beeinflussen können. Unter mikroskopischer Kontrolle gelingt es dabei besser, die Qualität der therapeutischen Abfolge zu kontrollieren und Fehler zu vermeiden.
Fallbeispiel 6 (Abbildungen 8 und 9)
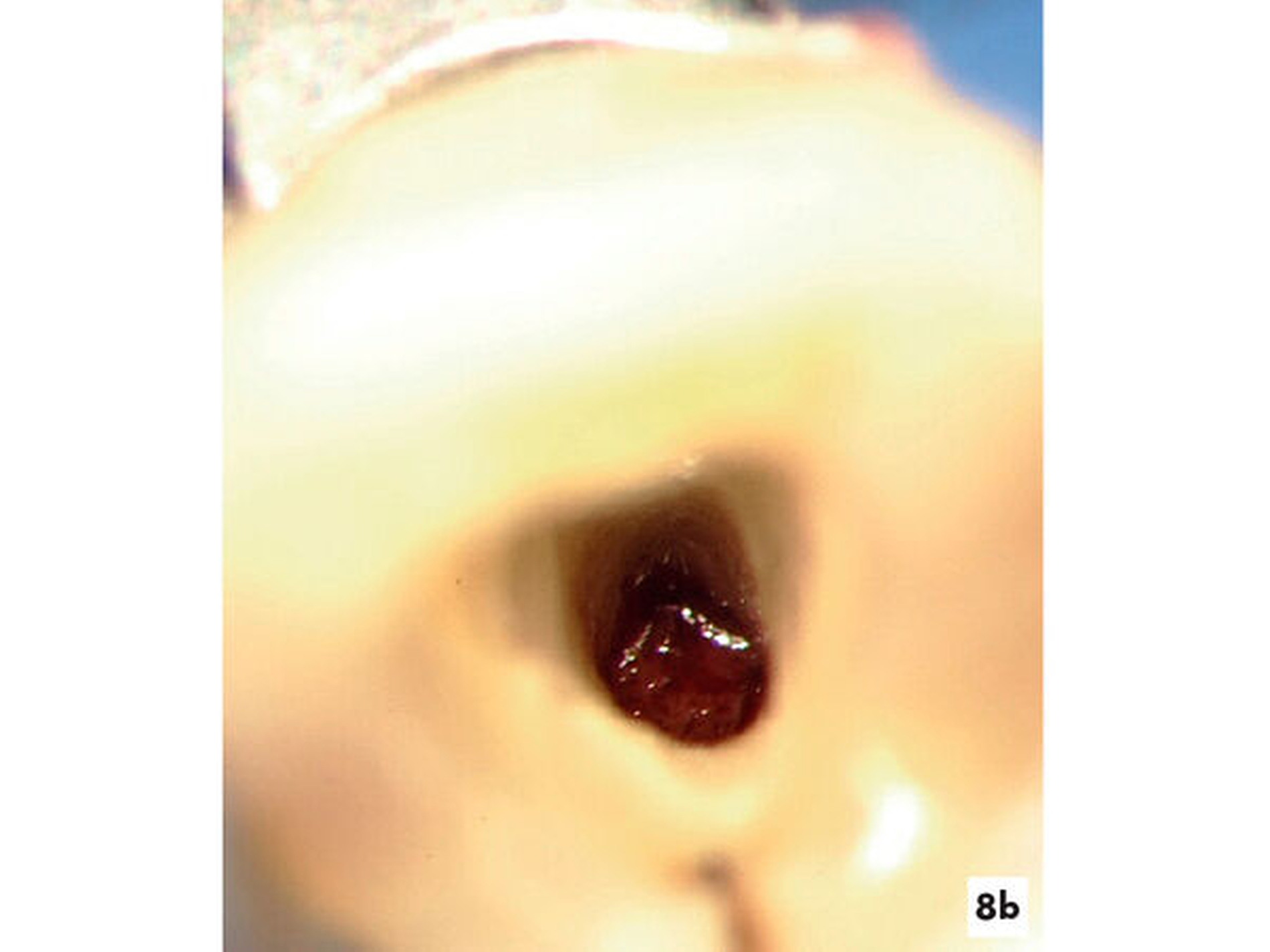
Eine 28-jährige Patientin wurde mit einer Schwellung und Fistel am Zahn 22 in eine auf Endodontie spezialisierte Praxis überwiesen. Die Patientin gab ein drei Jahre zurückliegendes Trauma am Zahn 22 an. Aufgrund des asymptomatischen Verlaufs wurde bisher keine Therapie erforderlich. Der Zahn wies keine pathologischen Sondierungswerte auf und reagierte nicht auf den thermischen und elektrischen Sensibilitätstest. Radiologisch konnte der Fistelverlauf zur lateralen Aufhellung nachgewiesen werden. Innerhalb des Wurzelkanals ließen sich rundliche Erweiterungen erkennen (Abbildung 8a). Es bestand der Verdacht auf eine infizierte Pulpanekrose mit interner Resorption. Im Verlauf der intrakoronalen Befundaufnahme konnte nach Entfernung des nekrotischen Pulpagewebes durchblutetes und sensibel reagierendes Gewebe bei 16-facher Vergrößerung ermittelt werden (Abbildung 8b). Es bestand das Ziel, die bakterielle Infektion zu eliminieren und das vitale Gewebe zu erhalten und zu einer Reparatur der resorptiven Defekte anzuregen.
Fallbeispiel 6: Reparatur einer internen Resorption
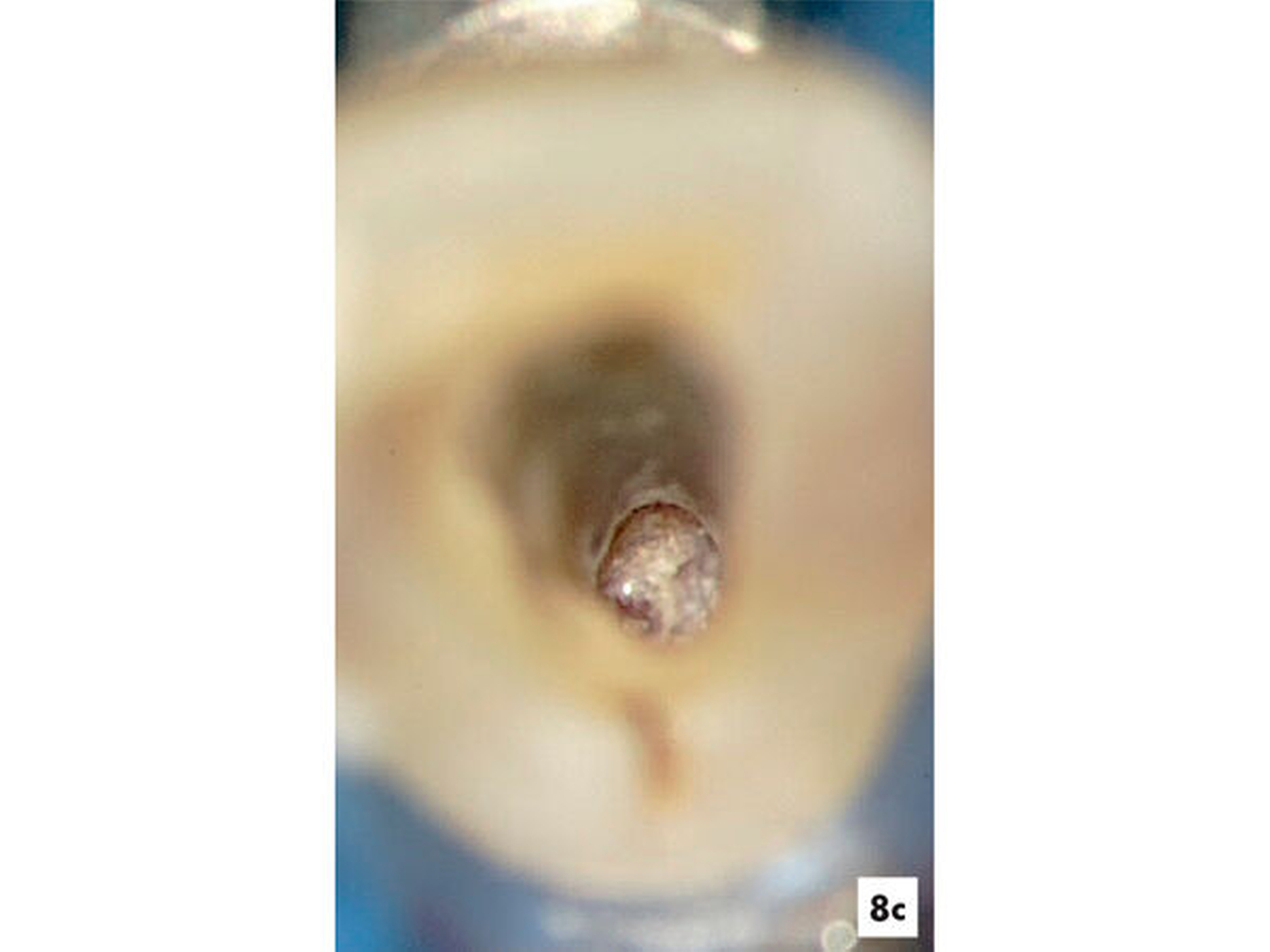
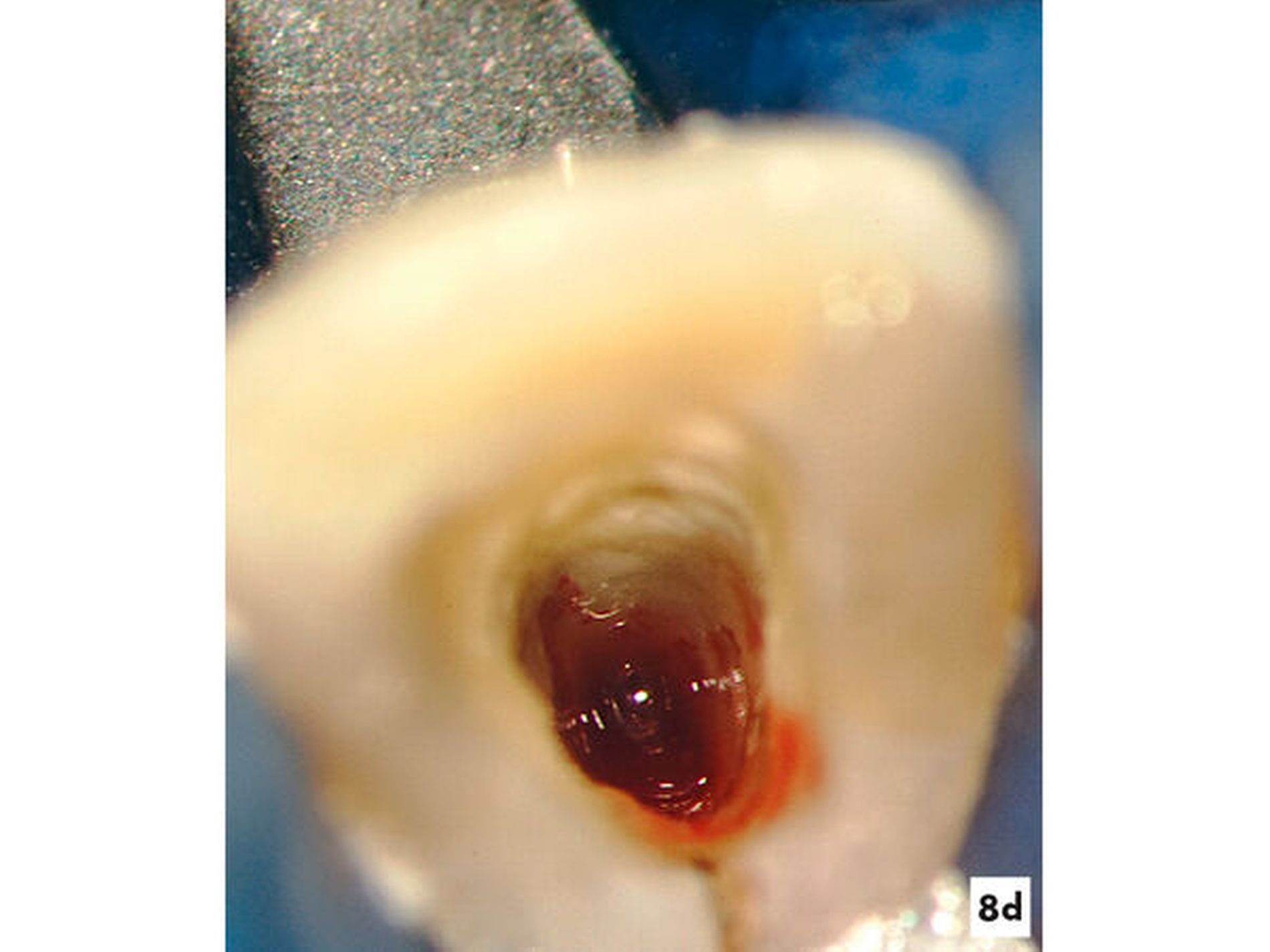
Nach einer mechanischen Erweiterung des koronalen Wurzelkanals und Desinfektion mit NaOCl in 3-prozentiger Konzentration wurde für einen Zeitraum von sechs Wochen frisch angemischtes Ca(OH)2 genutzt, um das Dentin zu desinfizieren. Im Anschluss wurde das Dentin mit 17-prozentiger EDTA-Lösung gespült und eine Blutung induziert, damit der gesamte resorptive Zahnhartsubstanzdefekt mit Ersatzgewebe gefüllt werden konnte (Abbildungen 8c und 8d). Das Blutkoagel wurde mit MTA abgedeckt und die Kavität mit Komposit zur Vermeidung einer Reinfektion verschlossen.
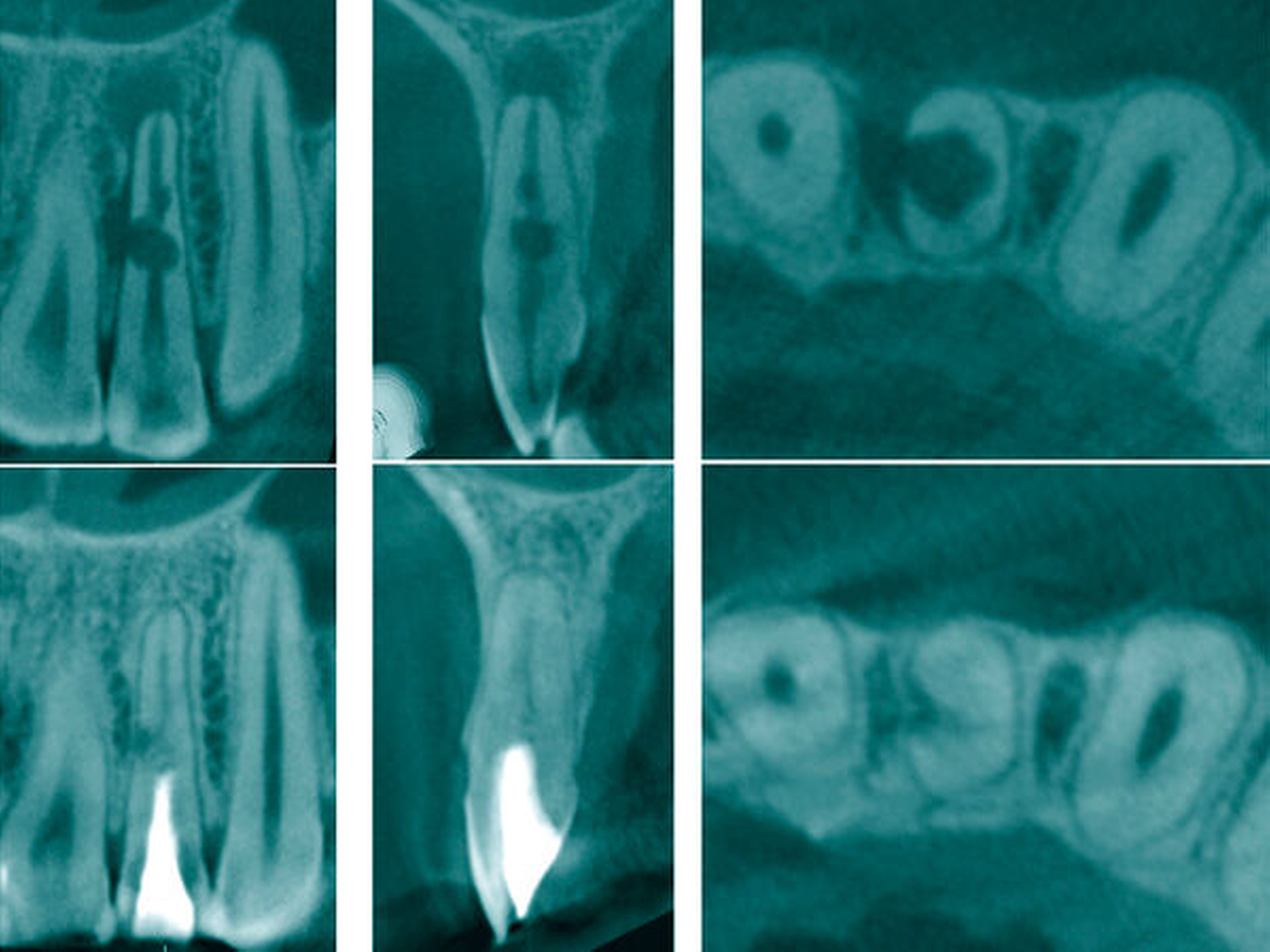
Drei Jahre nach Abschluss der Therapie ist der Zahn symptomlos, die Fistel und die periapikale Aufhellung sind abgeheilt. Innerhalb der resorptiven Defekte hat sich ein Zahnhartgewebe ausgebildet unter gleichzeitigem Erhalt eines Wurzelkanals (Abbildung 9).
Das Erkennen und Differenzieren von durchbluteten und nekrotischen Geweben innerhalb des Wurzelkanals gelingt nur unter Nutzung eines Mikroskops mit einer adäquaten Beleuchtung. Der Wechsel der desinfizierenden Einlagen darf das verbliebene vitale Gewebe nicht zusätzlich schädigen, so dass die genutzten Ultraschallfeilen unter optischer Kontrolle auf die maximale Eindringtiefe kontrolliert werden müssen Die Applikation von MTA-Zement auf einer Flüssigkeitssäule aus Blut innerhalb des Wurzelkanals lässt sich ohne Mikroskop nicht sicher realisieren.
Zusammenfassung
Mit Lupenbrillen ab 3,5-facher Vergrößerung und zusätzlicher Lichtquelle können erste Verbesserungen in der endodontischen Diagnostik und Therapie erzielt werden.
Die variable Vergrößerung und die tageslichtähnliche Beleuchtung eines Dentalmikroskops ermöglichen die Qualität bei bewährten Therapieverfahren zu verbessern. Durch die visuelle Kontrolle kann die Prozessqualität verbessert werden. Insbesondere minimalinvasives Arbeiten wird unterstützt durch die bessere Orientierungsmöglichkeit im Wurzelkanalsystem und durch eine verbesserte Feinmotorik. Einige neue Diagnostik- und Therapieansätze sind ohne Dentalmikroskop nicht durchführbar.
Der Einsatz von Vergrößerungshilfen in der Endodontie ist auch unter dem Aspekt des ergonomischen Arbeitens bedeutsam. Die aufrechte und abgestützte Körperhaltung hilft Über- und Fehlbelastungen vorzubeugen, so dass auch Langzeitbehandlungen in großer Detailschärfe und ermüdungsfrei bis ins höhere Lebensalter möglich werden.
Nicht zuletzt drängt sich im Licht der COVID-19-Pandemie noch ein weiteres Argument für den Einsatz von Vergrößerungshilfen in den Vordergrund: Durch die indirekte Arbeitsweise mit Lupenbrille oder Mikroskop können der Arbeitsabstand zum Patienten vergrößert und die Infektionsgefahr im Rahmen der endodontischen Therapie erheblich reduziert werden.
Literaturliste
1. Arnold M, Klimm W. Das Dentalmikroskop in der studentischen Ausbildung. Endodontie 2004;13:37-46.
2. Arnold M. Das Dentalmikroskop – Grundlage für bewährte und neue Verfahren bei der Wurzelkanalbehandlung. Endodontie 2007;16:105-114.
3. Arnold M. Entfernung schwer zugänglicher Fragmente aus dem Wurzelkanal mit einem neuen Hilfsmittel. Quintessenz 2015; 67:145-156.
4. Arnold M. Einzeitige Wurzelkanalbehandlung bei offen gelassenen Zähnen unter spezialisierten Bedingungen mit Erfolgskontrolle. Quintessenz 2018;69:18-31.
5. Balto K. Single- or multiple-visit endodontics: which technique results in fewest postoperative problems? Evid Based Dent 2009;10:16.
6. Baumann R. [What is the use of the microscope for the dentist?]. Quintessenz. 1975;26:33-34.
7. Baumann R. [Endodontics and operating microscope]. Quintessenz. 1975;26:55-58.
8. Baldassari-Cruz LA, Lilly JP, Rivera EM. The influence of dental operating microscope in locating the mesiolingual canal orifice. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002;93:190-194.
9. Baldassari-Cruz LA, Wilcox LR. Effectiveness of gutta-percha removal with and without the microscope. J Endod 1999;25:627-628.
10. Bentley CD, Burkhart NW, Crawford JJ. Evaluating spatter and aerosol contamination during dental procedures. JADA 1994;125: 579-84.
11. Betz W. Unterstützende Sehhilfen in der Zahn-, Mund und Kieferheilkunde. Stellungnahme der DGZMK 1998; V 1.0. DZZ 53.
12. Bowles SW: A New Adaptation of the Microscope to Dentistry. The Dental cosmos 1907,49,358-362.
13. Brignardello-Petersen R. Use of a microscope during endodontic treatment seems to have helped locating second mesiobuccal root in maxillary first molars that needed retreatment. J Am Dent Assoc 2017;148:e121.
14. Brown MG, Qualtrough AJE, McLean W. Magnification in undergraduate endodontic teaching in the UK and Ireland: a survey of teaching leads in Endodontology. Int Endod J 2020;53:553-561.
15. Carr GB, Murgel CA. The use of the operating microscope in endodontics. Dent Clin North Am 2010;54:191-214.
16. Cujé J, Bargholz C, Hülsmann M. The outcome of retained instrument removal in a specialist practice. Int Endod J 2010;43:545-554.
17. de Mello Junior JE, Cunha RS, Bueno CE, Zuolo ML. Retreatment efficacy of gutta-percha removal using a clinical microscope and ultrasonic instruments: part I--an ex vivo study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2009;108:e59-62.
18. de Oliveira LO, Silva MHC, Bastos HJS, de Jesus Soares A, Frozoni M. The impact of a dental operating microscope on the identification of mesiolingual canals in maxillary first molars. Gen Dent 2019;67:73-75.
19. Duncan HF, Bjørndal L, van der Sluis L, et al. Third European Society of Endodontology (ESE) research meeting: ACTA, Amsterdam, The Netherlands, 26th October 2018: Deep caries and the exposed pulp: current and emerging therapeutic perspectives. Int Endod J 2019;52:135‐138.
20. Estrela C, Pécora JD, Estrela CRA, et al. Common Operative Procedural Errors and Clinical Factors Associated with Root Canal Treatment. Braz Dent J 2017;28:179‐190.
21. Figini L, Lodi G, Gorni F, Gagliani M. Single versus multiple visits for endodontic treatment of permanent teeth: a Cochrane systematic review. J Endod 2008;34:1041-1047.
22. Friedman MJ. Magnification in a restorative dental practice: from loupes to microscopes. Compend Contin Educ Dent 2004;25:48,50,53-55.
23. Görduysus MO, Görduysus M, Friedman S. Operating microscope improves negotiation of second mesiobuccal canals in maxillary molars. J Endod 2001;27:683-686.
24. Harrel SK, Molinari J. Aerosols and splatter in dentistry: a brief review of the literature and infection control implications. J Am Dent Assoc 2004;135:429-437.
25. Hülsmann M, Schinkel I. Influence of several factors on the success or failure of removal of fractured instruments from the root canal. Endod Dent Traumatol 1999;15:252‐258.
26. Iwaya SI, Ikawa M, Kubota M (2001) Revascularization of an immature permanent tooth with apical periodontitis and sinus tract. Dent Traumatol 17:185-187.
27. Jurkschat U. Verfeinerung der stomatologischen Diagnostik mit Hilfe des Operationsmikroskopes II – I. Mitteilung. Stomatol DDR 1979;29:15-18.
28. Karapinar-Kazandag M, Basrani BR, Friedman S. The operating microscope enhances detection and negotiation of accessory mesial canals in mandibular molars. J Endod 2010;36:1289-1294.
29. Kerschbaum, Prof. Dr. Thomas & Hilger, Dr. Martin (2000): Der Zahnarzt und sein Körper. Ergonomie heute – eine Umfrage. In: Zahnärztliche Mitteilungen 2000, 38-42.
30. Kersten DD, Mines P, Sweet M. Use of the microscope in endodontics: results of a questionnaire. J Endod 2008;34:804-807.
31. Khalighinejad N, Aminoshariae A, Kulild JC, Williams KA, Wang J, Mickel A. The Effect of the Dental Operating Microscope on the Outcome of Nonsurgical Root Canal Treatment: A Retrospective Case-control Study. J Endod 2017;43:728-732
32. Kim S, Baek S. The microscope and endodontics. Dent Clin North Am 2004;48:11-18.
33. Klimm W. Endodontologie. Grundlagen und Praxis. Köln: Deutscher Zahnärzte Verlag, 2003.
34. Leggat PA, Kedjarune U. Bacterial aerosols in the dental clinic: a review. Int Dent J 2001;51:39-44.
35. Mamoun JS. A rationale for the use of high-powered magnification or microscopes in general dentistry. Gen Dent 2009;57:18-26.
36. Sathorn C, Parashos P, Messer H. Australian endodontists' perceptions of single and multiple visit root canal treatment. Int Endod J 2009;42:811-818.
37. Perrin P, Neuhaus KW, Lussi A. The impact of loupes and microscopes on vision in endodontics. Int Endod J 2014;47:425‐429.
38. Perrin P, Eichenberger M, Neuhaus KW, Lussi A. Visual acuity and magnification devices in dentistry. Swiss Dent J 2016;126:222-235.
39. Rampado ME, Tjäderhane L, Friedman S, Hamstra SJ. The benefit of the operating microscope for access cavity preparation by undergraduate students. J Endod 2004;30:863-867.
40. Reitemeier B, Arnold M, Scheuch K, Pfeifer G: Arbeitshaltung des Zahnarztes.Zahnmedizinup2date 2012; 2: 147-170.
41. Ricucci D, Siqueira JF Jr, Li Y, Tay FR. Vital pulp therapy: histopathology and histobacteriology-based guidelines to treat teeth with deep caries and pulp exposure. J Dent 2019;86:41‐52.
42. Rundcrantz BL. Pain and discomfort in the musculoskeletal system among dentists. Swed Dent J Suppl 1991;76:1-102.
43. Saunders WP, Saunders EM. Conventional endodontics and the operating microscope. Dent Clin North Am 1997;41:415-428.
44. Schwarze T, Baethge C, Stecher T, Geurtsen W. Identification of second canals in the mesiobuccal root of maxillary first and second molars using magnifying loupes or an operating microscope. Aust Endod J 2002;28:57-60.
45. Selden HS. The role of a dental operating microscope in improved nonsurgical treatment of „calcified“ canals. Oral Surg Oral Med Oral Pathol 1989;68:93-98.
46. Suter B, Lussi A, Sequeira P. Probability of removing fractured instruments from root canals. Int Endod J 2005;38:112-123.
47. Szymańska J. Dental bioaerosol as an occupational hazard in a dentist's workplace. Ann Agric Environ Med 2007;14:203‐207.
48. Tomes J. Ein System der Zahnheilkunde. 1. Auflage Arthur Felix Verlag, Leipzig 1861:388-389.
49. Velvart P. [The operating microscope. New dimensions in endodontics]. Schweiz Monatsschr Zahnmed 1996;106:356-367.
50. West JD. The role of the microscope in 21st century endodontics: visions of a new frontier. Dent Today 2000;19:62-4,66-69.
51. Wu D, Shi W, Wu J, Wu Y, Liu W, Zhu Q. The clinical treatment of complicated root canal therapy with the aid of a dental operating microscope. Int Dent J. 2011;61:261-266.
52. Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, Li T, Chen Q. High expression of ACE2 receptor of 2019-nCoV on the epithelial cells of oral mucosa. Int J Oral Sci. 2020;12:8.
53. Yoshioka T, Kobayashi C, Suda H. Detection rate of root canal orifices with a microscope. J Endod 2002;28:452-453.
54. Zhujiang A, Kim SG (2016) Regenerative Endodontic Treatment of an Immature Necrotic Molar with Arrested Root Development by Using Recombinant Human Platelet-derived Growth Factor: A Case Report. J Endod 42:72-75.