Pleurakarzinose bei metastasierendem oralem Plattenepithelkarzinom
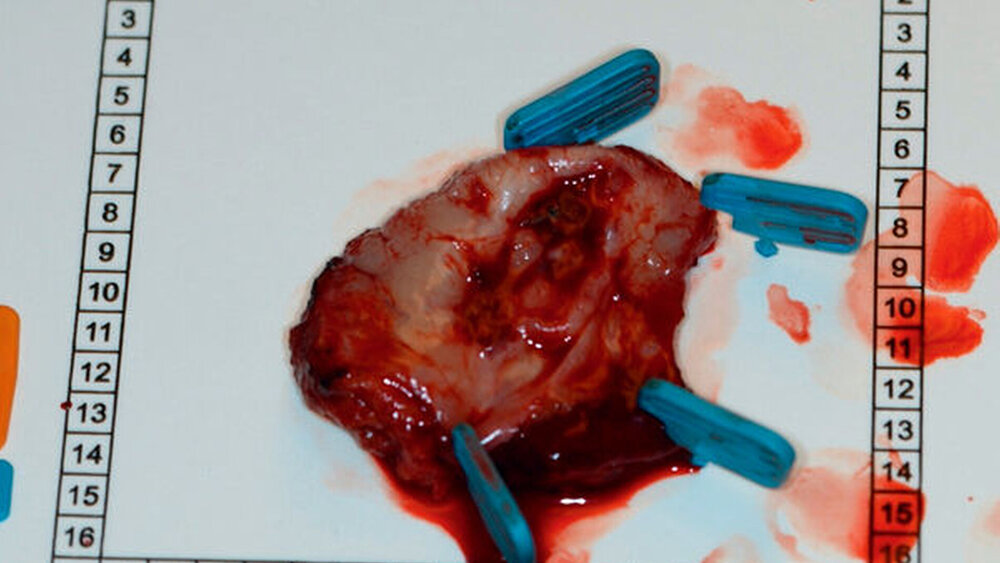
Im Oktober 2018 wurde bei einer damals 64-jährigen Patientin ein Plattenepithelkarzinom am rechten Zungenrand diagnostiziert. Nach komplettiertem Staging erfolgte in der Abteilung für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz die vollständige Tumorresektion (Abbildung 1), eine selektive zervikale Lymphadenektomie beidseits der Level I-III und die primäre Defektrekonstruktion mit einem freien mikrovaskulär-anastomisierten Ulnaristransplantat. Die abschließende Tumorklassifikation (TNM) lautete: pT2, N0, L1, Pn1, M0, R0. Aufgrund des Tumorstadiums in Kombination mit der diagnostizierten Lymphangiosis carcinomatosa (Infiltration der Lymphgefäßbahnen durch Tumorzellen) und Perineuralscheideninfiltration folgte eine adjuvante Radiotherapie der Primärtumorregion sowie des zervikalen Lymphabflussgebiets. So wurde die Region des Primärtumors mit einem Boost von 64 Gy Gesamtdosis und die Level I-IV des Lymphabflussgebiets beidseits mit einer Dosis von 54 Gy bestrahlt. Die akuten Strahlenschäden hielten sich bei einer moderaten Strahlendermatitis und einem ausgeprägten Mundsoor, der gut mit Amphomoronal-Tinktur behandelt werden konnte, in Grenzen. Im Februar 2019 konnte die Therapie nach Beendigung der adjuvanten Radiotherapie abgeschlossen werden.
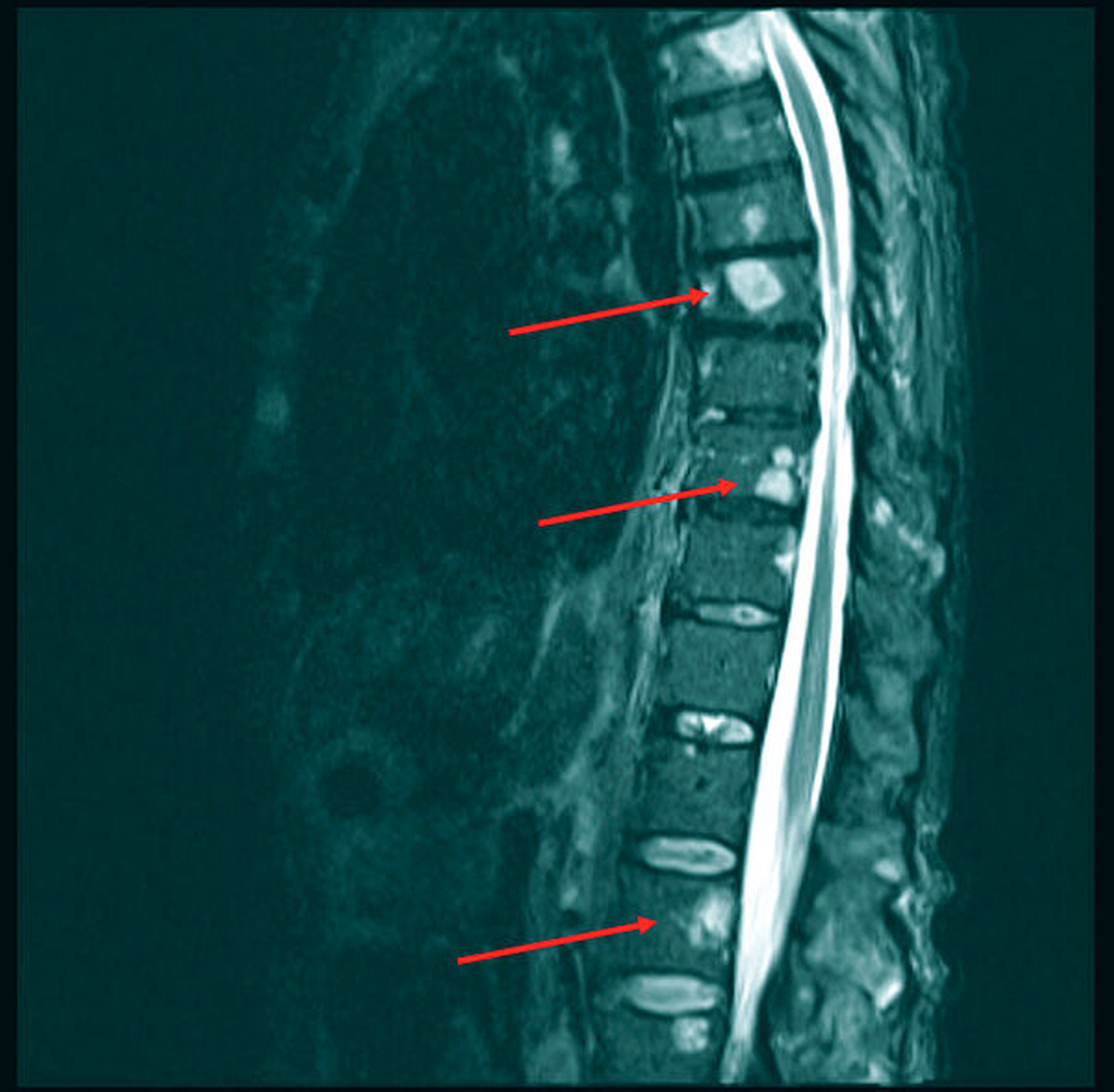
Im Rahmen der Leitlinien-gerechten Nachsorge mit jährlicher CT-Kontrolle und klinisch-sonografischer Inspektion alle ein bis drei Monate im ersten Jahr ergab sich kein Anhalt für das Vorliegen eines Lokalrezidivs, eines Zweitmalignoms oder einer lokalen Lymphknotenmetastasierung. Im Juli 2020 wurde die Patientin dann mit Atemnot und thorakalen Schmerzen sowie einer Belastungsdyspnoe notfallmäßig vorstellig. Der Befundbericht eines kürzlich extern bei Rückenschmerzen angefertigten MRTs beschrieb die Zeichen einer ossären Wirbelkörpermetastasierung sowie einen beidseitigen Pleuraerguss (Abbildung 2).
Im Rahmen der Weiterbehandlung durch die Kollegen der Pneumologie erfolgte der molekulargenetisch-differenzialdiagnostische Nachweis einer pulmonalen Fernmetastase des lokalrezidivierten Plattenepithelkarzinoms der Zunge. Auf Basis des interdisziplinären Tumorboardbeschlusses erfolgte dann die palliative Chemotherapie in vier Zyklen als TPEx-Regime (Cisplatin, Docetaxel, Cetuximab) mit anschließender Erhaltungstherapie mit dem monoklonalen Antikörper Cetuximab.
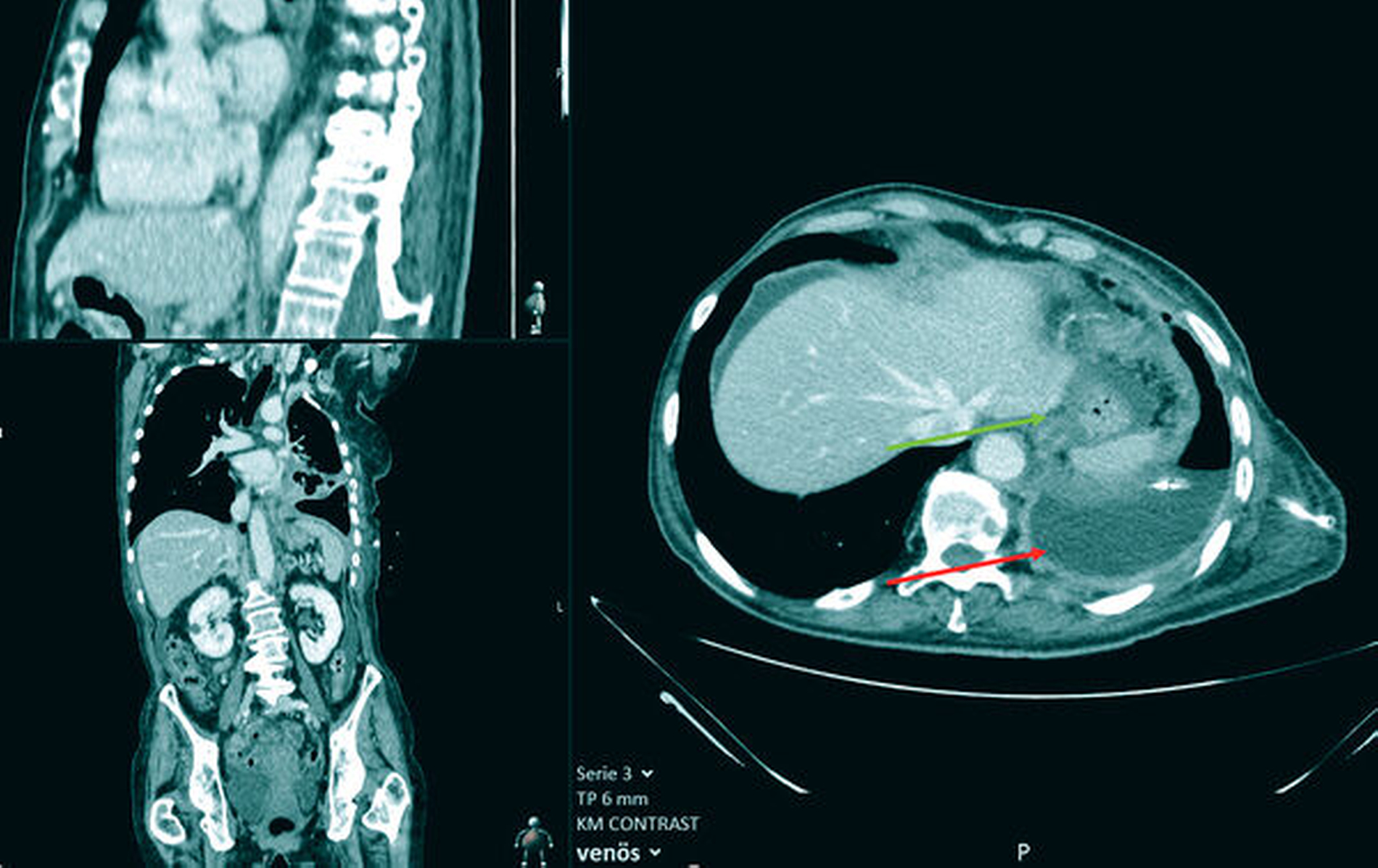
Trotz Radio- und Chemotherapie in den Jahren 2019 und 2020 imponierten in den nachfolgenden CT- und MRT-Untersuchungen weitere Metastasen in der Leber, in der rechten Niere sowie im Achsenskelett und in der Schädelkalotte als disseminierte osteolytische Knochenmetastasen (Abbildung 3). Weitere Therapiemaßnahmen lehnte die Patientin ab; sie wurde auf eigenen Wunsch in die Häuslichkeit entlassen.
Acht Monate nach der Diagnosefindung der Pleurakarzinose bei in sano operiertem und bestrahltem oralem Plattenepithelkarzinom verstarb die Patientin mit 67 Jahren.
Diskussion
Im Jahr 2016 betrafen fünf Prozent aller malignen Tumore die Mundhöhle, wobei der Anteil an Plattenepithelkarzinomen hierbei 95 Prozent betrug. Am häufigsten betroffen sind die Zunge und der Mundboden. In Deutschland liegt die Zahl der Neuerkrankungen an einem oralen Plattenepithelkarzinom bei etwa 10.000 im Jahr, wobei Männer häufiger erkrankt sind als Frauen [Barnes et al., 2016]. Aufgrund der Tatsache, dass die Diagnose in über 50 Prozent der Fälle in fortgeschrittenen Stadien (66 Prozent im Stadium III oder im Stadium IV) [Halicek et al., 2019] gestellt wird, ist die Prognose des oralen Plattenepithelkarzinoms mit einer Fünf-Jahres-Überlebensrate von weniger als 60 Prozent und einer Rezidivquote von 30 Prozent weiterhin schlecht [Blatt et al., 2016].
Die genauen Mechanismen der Pathogenese von Mundhöhlenkarzinomen sind noch nicht abschließend geklärt, wobei allgemeiner Konsens zu den beiden Hauptrisikofaktoren des chronischen Tabak- und Alkoholabusus besteht (in Kombination beider erhöht sich das Erkrankungsrisiko bis zu 30-fach) [Bagnardi et al., 2001]. Quantifiziert wird der Tabakkonsum in pack years (Zigarettenschachteln/Tag in Jahren), die bei der Patientin des oben beschriebenen Fallberichts 40 betrugen. Wichtigster Prognosefaktor ist neben der Primärtumorgröße, dem Grading, der Infiltrationstiefe des Primärtumors (> 4 mm), dem operativ erreichten Sicherheitsabstand und der Perineuralscheideninfiltration, der Status der Metastasierung (überwiegend regionäre Lymphknotenmetastasen, sehr selten primäre Fernmetastasen) [Sadick et al., 2012; „Leitlinien“, 2020].
Rein makroskopisch ist ein Plattenepithelkarzinom im Initialstadium differenzialdiagnostisch nicht immer leicht von anderen nicht-malignen Veränderungen oder (prä)malignen Erkrankungen abzugrenzen. Daher ist die Probenentnahme mit histopathologischer Untersuchung für die Diagnosestellung obligat. Bildgebende Untersuchungen zur Ausdehnungsdiagnostik und zum Ausschluss von Lymphknoten und Fernmetastasen sind weitere Bestandteile einer komplettierenden Staginguntersuchung. Vornehmlich zeigt das orale Plattenepithelkarzinom eine lokoregionäre Metastasierung in die Halslymphknoten. Bei bis zu 40 Prozent der Patienten liegen zum Zeitpunkt der Erstdiagnose trotz klinisch-radiologisch unauffälliger Befunde bereits Halslymphknotenmetastasen vor. Die Inzidenz synchroner Zweittumore oder Fernmetastasen liegt in Abhängigkeit von der Größe des Primärtumors zwischen 4 und 33 Prozent [Warner und Cox, 2003], betrifft dabei vornehmlich T3/T4-Befunde sowie Fälle mit Lymphknotenbefall in Level IV und ähnelt somit dem Rezidiv-Risikoprofil der Mundhöhlenkarzinome (circa 20 Prozent). Das Vorliegen pulmonaler Zweitkarzinome bei neu diagnostizierten Mundhöhlenkarzinomen ist mit 3,5 bis 3,8 Prozent hingegen als selten einzustufen, nimmt allerdings mit steigender Tumorgröße zu, so dass ein CT-Thorax bei T3/T4-Karzinomen als regelmäßige Staginguntersuchung empfohlen wird [Keith et al., 2006; „Leitlinien“, 2020]. Bei einer Fernmetastasierung gilt ein Patient nicht mehr als kurativ behandelbar [„Leitlinien“, 2020].
Fazit für die Praxis
Der Früherkennung von primären und Rezidiv-Mundhöhlenkarzinomen kommt eine zentrale Bedeutung zu. Eine verbesserte Aufklärung der Patienten ist notwendig, um die immer noch häufige Verschleppung der Diagnose zu vermeiden.
Ein Plattenepithelkarzinom im Initialstadium ist makroskopisch nicht immer sicher zu erkennen. Der histopathologische Ausschluss/Nachweis via Biopsie ist daher essenzieller Bestandteil eines jeden Stagings.
Zum Staging gehört auch eine Panoramaschichtaufnahme (PSA) zur zahnärztlichen Basisdiagnostik vor Beginn der Tumortherapie.
Bei einer Rezidivquote von 20 bis 30 Prozent sollten die regelmäßigen klinischen Nachsorgetermine den offiziellen AWMF-S3-Leitlinien-Empfehlungen (für das 1. und das 2. Jahr alle drei Monate, im 3. bis 5. Jahr alle sechs Monate) folgen. Auch bildgebende Untersuchungen (CT oder MRT) in regelmäßigen Abständen sind obligat, um mögliche Lokalrezidive, Zweitmalignome, Lymphknoten- oder Fernmetastasen auszuschließen oder frühzeitig erkennen zu können.
Auch bei geringen Inzidenzen von Fernmetastasen in der Literatur zeigt der obige Fallbericht, dass eine disseminiert-hämatogene Ausbreitung in seltenen Fällen auftritt und dabei auch primär äußerst selten tangierte Organe wie die Pleura betroffen sein können.
Im oben beschriebenen, durchaus seltenen Patientenfall wurde das Zweitkarzinom erst im Zuge der Entitäts- und Dignitätsklärung der klinisch-symptomatischen Pleurakarzinose diagnostiziert. Der im Anschluss diagnostizierte Pleuraerguss kann unterschiedliche Ursachen haben und wird entsprechend der Ergussbeschaffenheit in transsudative und exsudative Pleuraergüsse unterteilt. Erstere können infolge einer Herzinsuffizienz, einer Leberzirrhose, eines nephrotischen Syndroms oder in seltenen Fällen (20 Prozent) bei Lungenembolien entstehen. Pleuraergüsse als Exsudat werden verursacht durch Pneumonien, Malignome (beispielsweise Pleurametastasen), Lungenembolien oder Viruserkrankungen (virale Pleuritis) [Feller-Kopman et al., 2018].
Der metastatische Tumor ist das häufigste Neoplasma der Pleura. Die malignen Zellen finden den Weg zur Pleura durch die direkte Ausdehnung von benachbarten Stellen oder durch eine lymphatische und hämatogene Ausbreitung. Das mikroskopische Erscheinungsbild ist das des Primärtumors. Praktisch kann also jedes Neoplasma zur Pleura metastasieren. Eine Pleurabeteiligung deutet dabei auf ein fortgeschrittenes Stadium des Primärtumors hin. Es existieren keine Daten hinsichtlich des Anteils von oralen Plattenepithelkarzinomen bei der Entstehung von malignen Pleuraergüssen. In der Ätiologie führt das Bronchialkarzinom mit 30 Prozent, danach folgen das Mammakarzinom mit 25 Prozent, maligne Lymphome mit 20 Prozent und Ovarialkarzinome mit 6 Prozent [Ebert et al., 1993]. Hämatogene Fernmetastasen von oralen Plattenepithelkarzinomen betreffen primär die Lunge, die Knochen (insbesondere Wirbelsäule, Rippen und Schädelknochen) und die Leber [Heinrichs et al., 2015]. Bei der Patientin im beschriebenen Fall hat mit großer Wahrscheinlichkeit eine lymphatische Ausbreitung der malignen Zellen ins Rippenfell stattgefunden. Damit würde es sich hier um eine seltene und in der Literatur bislang nicht beschriebene Form der Metastasierung eines oralen Plattenepithelkarzinoms handeln.
Fabia Siegberg
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz, Augustusplatz 2, 55131 Mainz
Dr. Dr. Daniel G. E. Thiem
Weiterbildungsassistent, Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz, Augustusplatz 2, 55131 Mainz
Univ.-Prof. Dr. Dr. Peer W. Kämmerer, MA, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor, Klinik und Poliklinik für Mund-, Kiefer- und Gesichts chirurgie, Plastische Operationen
Universitätsmedizin Mainz, Augustusplatz 2, 55131 Mainz
Literaturliste
„Leitlinien“., A. d. W. M. F. A. S. K. L. A.-R. (2020). „S3-Leitlinie Diagnostik und Therapie des Mundhöhlenkarzinoms.“
Bagnardi, V., et al. (2001). „Alcohol consumption and the risk of cancer: a meta-analysis.“ Alcohol Res Health 25(4): 263-270.
Barnes, B., et al. (2016). „Bericht zum Krebsgeschehen in Deutschland 2016.“
Blatt, S., et al. (2016). „Diagnosing oral squamous cell carcinoma: How much imaging do we really need? A review of the current literature.“ Journal of Cranio-Maxillofacial Surgery 44(5): 538-549.
Ebert, W., et al. (1993). Der Stellenwert von Tumormarkerbestimmungen in der Diagnostik des malignen Pleuraergusses. Thoraxchirurgie, Springer: 37-53.
Feller-Kopman, D., et al. (2018). „Pleural Disease.“ New England Journal of Medicine 378(8): 740-751.
Halicek, M., et al. (2019). „Optical biopsy of head and neck cancer using hyperspectral imaging and convolutional neural networks.“ J Biomed Opt 24(3): 1-9.
Heinrichs, S., et al. (2015). Lungenmetastasen bei Karzinomen des Kopf-Hals-Bereiches. Lungenmetastasen, Springer: 151-165.
Keith, D., et al. (2006). „The role of thoracic computed tomography in staging newly-diagnosed oral squamous cell carcinoma.“ British Journal of Oral and Maxillofacial Surgery 44(3): 198-202.
Sadick, M., et al. (2012). „[Current oncologic concepts and emerging techniques for imaging of head and neck squamous cell cancer].“ Laryngorhinootologie 91 Suppl 1: S27-47.
Warner, G. C. and G. J. Cox (2003). „Evaluation of chest radiography versus chest computed tomography in screening for pulmonary malignancy in advanced head and neck cancer.“ J Otolaryngol 32(2): 107-109.