Eine Rarität: Der solitär fibröse Tumor der Mundhöhle
Ein 77-jähriger Mann stellte sich mit einer seit mehreren Monaten bestehenden Weichgewebsschwellung im Bereich des linken Tuber maxillae in der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie Mainz vor. Im selben Jahr war bereits eine Abszessinzision der Wange durchgeführt worden, woraufhin die Schwellung jedoch nicht abgenommen hatte.
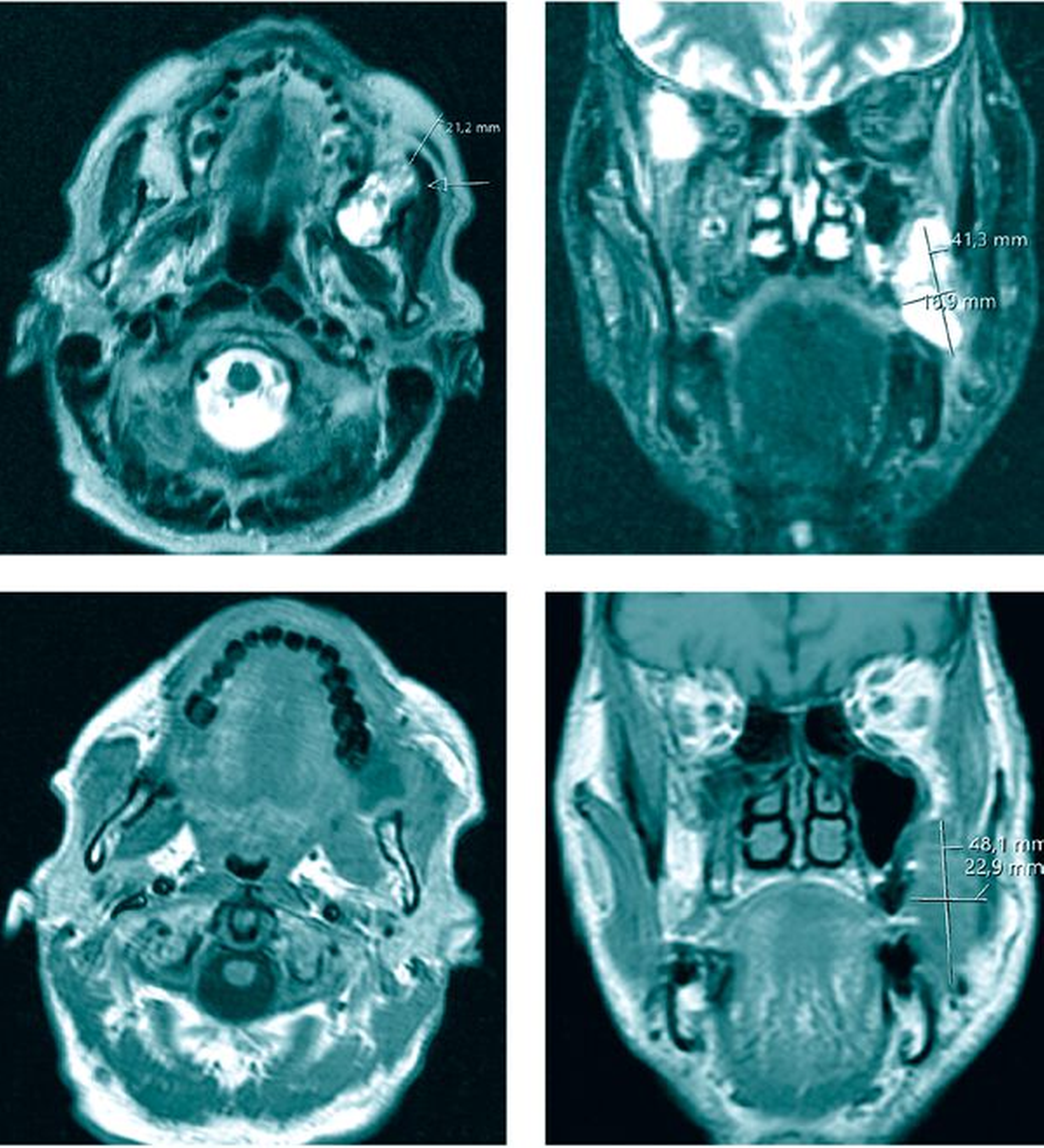
In Anbetracht des unklaren Befunds war vonseiten des behandelnden Arztes anschließend eine Magnetresonanztomografie veranlasst worden. Diese begründete den Verdacht auf das Vorliegen eines entzündlich einschmelzenden Residualbefunds im Bereich der linken Wange zwischen dem linken Oberkiefer und dem aufsteigenden Unterkieferast in direkter Nachbarschaft zur Kieferhöhlenwand (Abbildung 1).
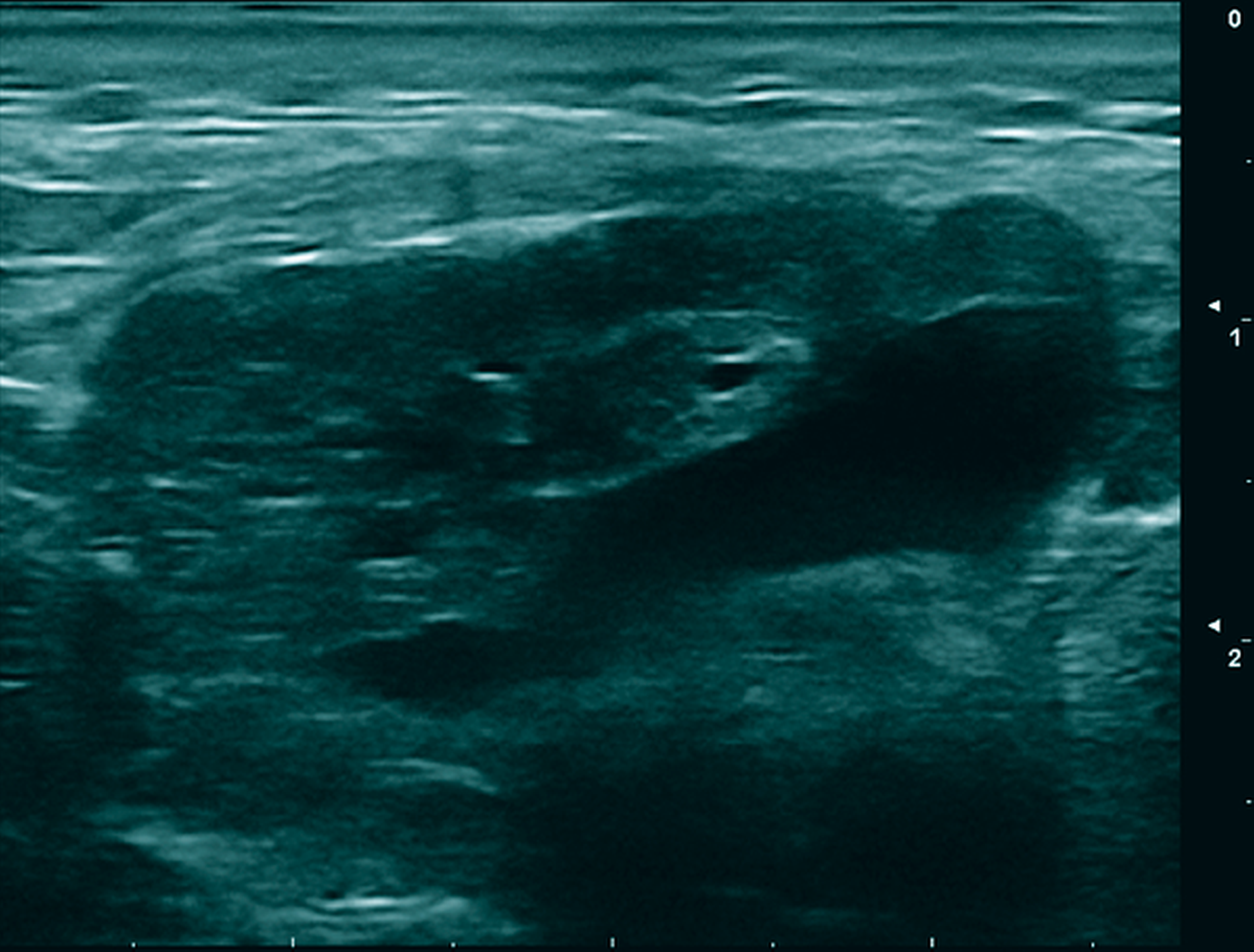
Bei weiter vorliegender Schwellung bei unklarer Ursache erfolgte die Vorstellung des Patienten in der Ambulanz der Universitätsmedizin Mainz. Nach der ausführlichen klinischen Untersuchung des Befunds wurde eine Sonografie durchgeführt. Dort zeigte sich eine ovoide Raumforderung inhomogener Echogenität mit zentral hypo- und peripher isoechogenen Bereichen (Abbildung 2).
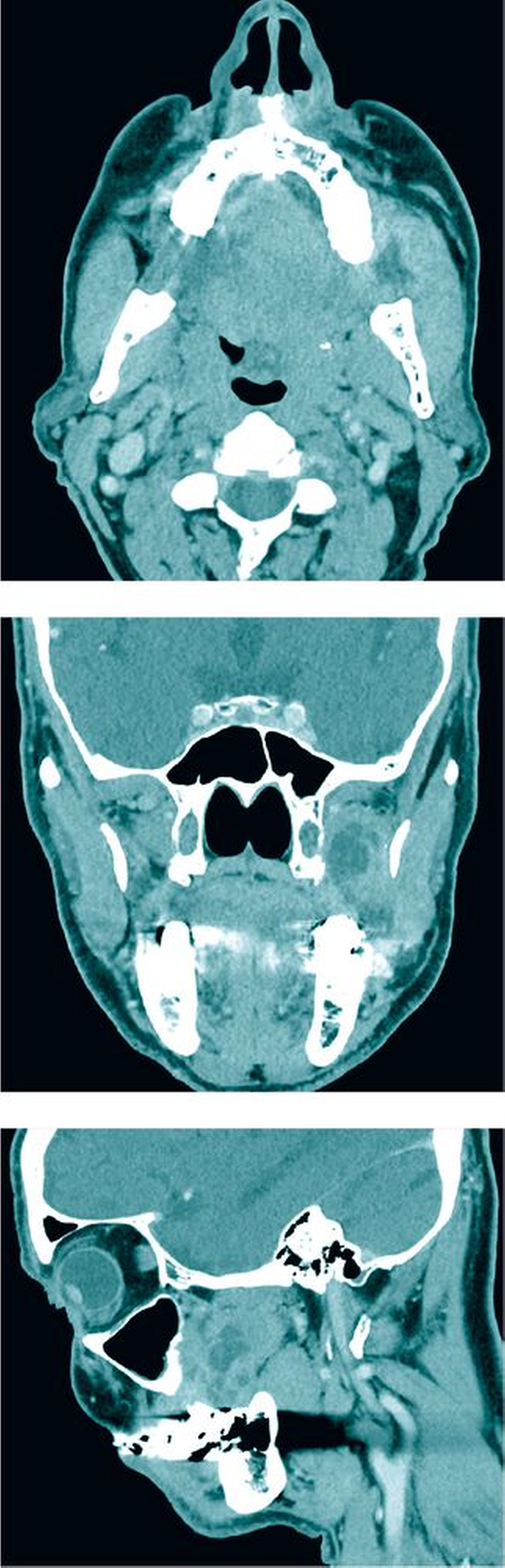
Mit der initialen Verdachtsdiagnose einer Neoplasie, differenzialdiagnostisch einer thrombosierten arterio-venösen Malformation oder eines Hämangiolymphoms wurde die Indikation zur Durchführung einer Computertomografie gestellt. Hier zeigte sich eine randständig kontrastmittelaufnehmende lobulierte Raumforderung im Mastikatorraum links mit einem maximalen Durchmesser von 41 mm und knöcherner Arrosion der Hinterwand des Sinus maxillaris. Bei Vorliegen von T2-hyperintensen Signalen wurden die Verdachtsdiagnosen eines Plattenepithelkarzinoms oder eines Chondrosarkoms, differenzialdiagnostisch eines entzündlichen Prozesses gestellt (Abbildung 3).
Allgemeinanamnestisch gab es keine Auffälligkeiten, der Patient war Nichtraucher und nahm keine Medikamente ein.
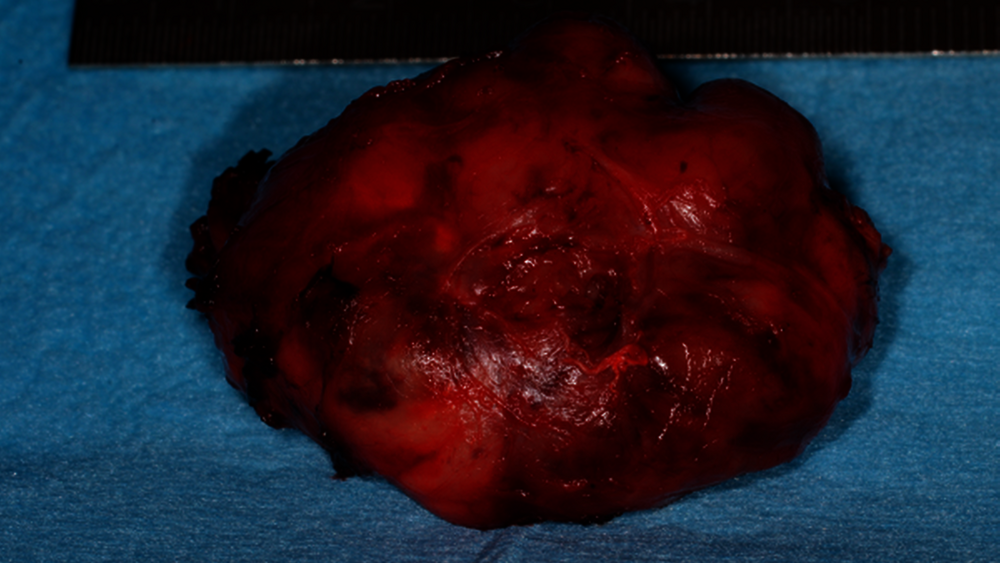
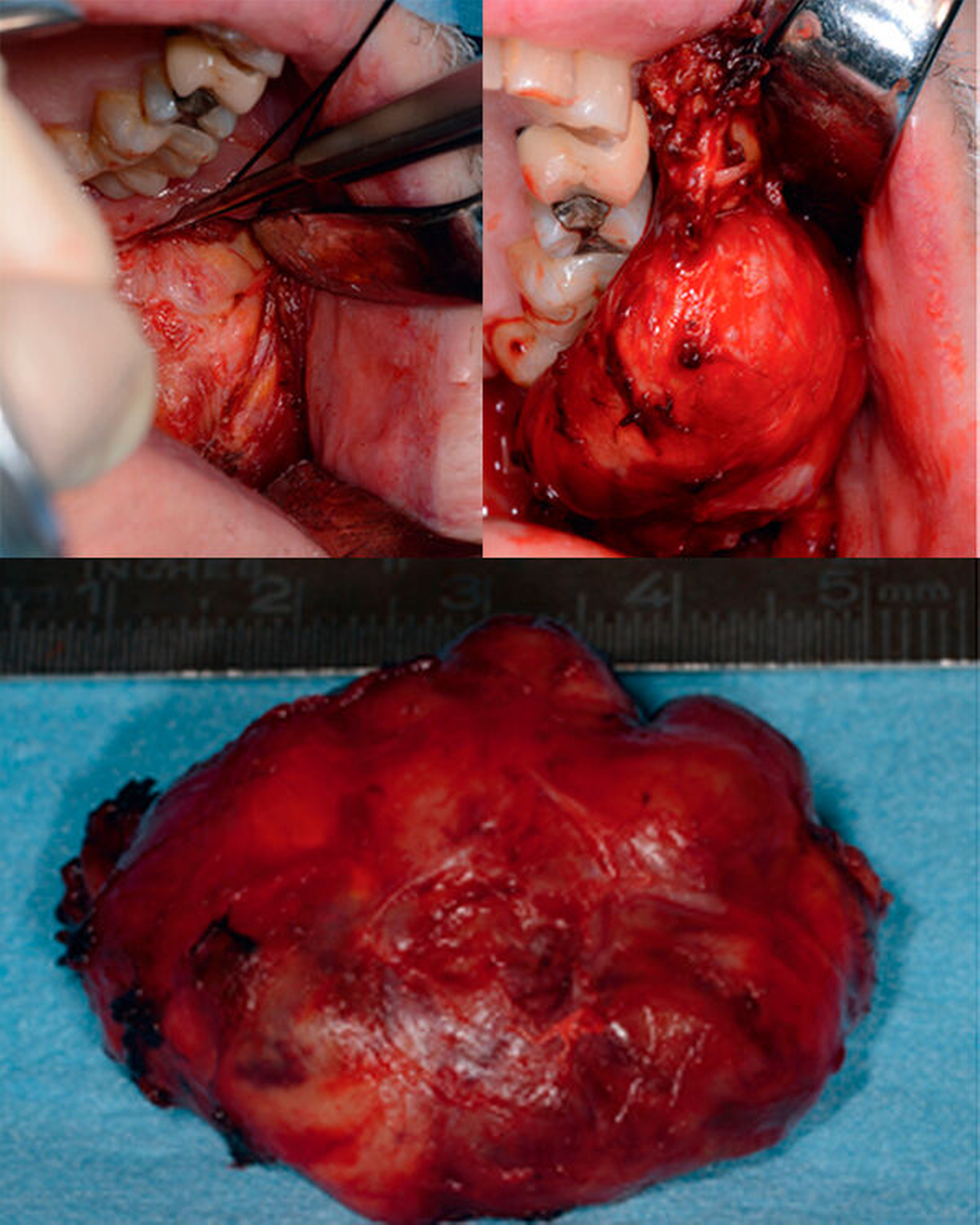
In Anbetracht des weiterhin unklaren Prozesses wurde die Indikation zur operativen Resektion des Tumors gestellt. Unter Intubationsnarkose erfolgte die Inzision parallel zum Ductus parotideus. Unmittelbar transmukosal konnte bereits die Kapsel der Raumforderung dargestellt und der Befund stumpf herausgelöst werden. Nach Entfernung des Tumors zeigte sich die direkte Lagebeziehung zum Ramus mandibulae und zu den Temporalisfasern ebenso wie retrotubär (Abbildung 4).
Die histopathologische Aufarbeitung des Exzidats zeigte makroskopisch einen glatt membranär überzogenen 4 cm x 3,4 cm x 1,5 cm messenden Befund mit beiger, partiell zystisch transformierter Schnittfläche. Mikroskopisch konnte ein knotiges, zellreiches, überwiegend solide und fokal zystisch wirkendes Proliferat beobachtet werden. Die immunhistochemischen Untersuchungen ergaben eine spezifische Reaktion auf CD34, allerdings eine Negativität auf S100. Der Proliferationsindex lag bei 10 bis 15 Prozent; es wurden 5 Mitosen pro 10 high power field (HPF) beobachtet.
Beobachtet werden konnte ein maligner, mäßig proliferationsaktiver Tumor mit Expression epithelialer und vaskulärer Marker und verstärkter mitotischer Aktivität, aber ohne einen genauen Hinweis auf die spezifische Tumorentität, so dass eine konsiliar-pathologische Mitbeurteilung durch ein externes Institut veranlasst wurde. Die hier ergänzend durchgeführte molekulare Analyse mittels RNA-Fusion-Panel ergab eine NAB2-STAT6-Fusion. Somit konnte abschließend die Diagnose eines solitär fibrösen Tumors der Kopf-Hals-Region mit aberranter Keratin-Überexpression gestellt werden.
Nach einem zweitägigen stationären Aufenthalt wurde der Patient in gutem Allgemeinzustand in die ambulante Weiterbetreuung entlassen.
Aufgrund des histopathologischen Befunds wurde der Patientenfall im interdisziplinären Kopf-Hals-Tumorboard besprochen. Bei Vorliegen einer Low-risk-Variante des solitär fibrösen Tumors wurde die Empfehlung zur klinischen Nachsorge mittels Magnetresonanztomografie nach drei bis sechs Monaten ausgesprochen.
Diskussion
Dieser Patientenfall demonstriert sehr präzise die schwierige Differenzialdiagnostik des solitär fibrösen Tumors (SFT) der Mundhöhle. Bei der spindelzellartigen mesenchymalen Neoplasie handelt es sich um einen meist intrathorakal auftretenden Befund, dessen erstmalige Beschreibung auf das Jahr 1931 zurückgeht [Klember und Rabin, 1931]. Das Synonym „Fibrosarkom der Pleura“ weist auf die Zuordnung der Entität zur Gruppe der Sarkome und auf den prädisponierten Hauptmanifestationsort hin.
Entgegen der primären Annahme, dass es sich um eine Variante des Mesothelioms handelt, wurde 1942 erstmals eine extrathorakale Manifestation des SFTs beschrieben. Zwischen 1931 und 2002 wurde in der Literatur von etwa 800 Fällen an unterschiedlichen Lokalisationen berichtet – 1991 konnte erstmals die Diagnose eines SFTs im Kopf-Hals-Bereich gestellt werden. Seit 2013 wird der SFT von der WHO als eigene Tumorentität anerkannt und findet Erwähnung in der WHO-Klassifikation der Kopf-Hals-Tumore [EI-Naggar et al., 2017; Kalla, 2018].
Die Berichte zu SFTs haben in den vergangenen Jahren stark zugenommen; allein die gelisteten Pubmed-Einträge zu diesem Thema unter dem Schlagwort „solitary fibrous tumour“ zeigen für das Jahr 2020 insgesamt 244 publizierte Artikel. Der SFT wird offiziell der Gruppe der „orphan diseases“ also der seltenen Erkrankungen mit einer Prävalenz von unter 1/100.000 Einwohnern zugeordnet, obwohl die genaue Erkrankungshäufigkeit in der Bevölkerung bisher unklar ist.
Die Gruppe der Weichgewebssarkome umfasst über hundert Tumore des Weich- und Stützgewebes. Diese Vielfalt, aber auch die Seltenheit und Heterogenität der Erkrankung bedingt die schwierige klinische und molekularbiologische Differenzialdiagnostik [Schütte et al., 2019]. Der SFT wird als fibroblastischer oder myofibroblastischer Tumor mit mittlerem biologischem Potenzial definiert. Er äußert sich durch eine langsam wachsende, indolente knotige Masse. Schmerzen sind durch die Kompression von Nachbarstrukturen möglich.
Vermutlich treten sechs Prozent aller SFTs im Kopf-Hals-Bereich auf, was 1/4 der extrathorakalen Manifestationen entspricht. Häufig betroffene Regionen sind die Orbita, die bukkale Mukosa ebenso wie der Sinunasaltrakt [Kalla, 2018]. In Zusammenschau des klinischen Befunds und der Lokalisation des Tumors kommen verschiedene Differenzialdiagnosen – wie die Mukozele, Speicheldrüsentumore, das Lipom oder vaskuläre Malformationen – in Betracht.
Etwa fünf bis zehn Prozent der SFTs sind mit paraneoplastischen Syndromen assoziiert. Bei dem Doege-Potter-Syndrom kommt es beispielsweise aufgrund einer erhöhten IGF-III-Sekretion zu häufigen Hypoglykämien, während das Vorliegen des Pierre-Marie-Bamberger-Syndroms mit Osteoarthropathien der Fingerendglieder vergesellschaftet ist [Schütte et al., 2019].
Das mittlere Alter bei Erstdiagnose eines SFT liegt bei 60 Jahren, obwohl Fälle in einer Spanne von 14 bis 67 Jahren beschrieben wurden. Männer und Frauen sind gleich häufig betroffen; es liegen keine gesicherten Risikofaktoren für die Entwicklung eines SFT vor. Da es sich bei den klinischen Charakteristika um unspezifische Symptome handelt, spielen bildgebende Maßnahmen ebenso wie die histopathologische Untersuchung eine große Rolle [Kalla, 2018; Schütte et al., 2019; de Morais et al., 2020]. In der Sonografie stellt sich der SFT typischerweise als klar umschriebene, hypoechogene Raumforderung mit variabler Vaskularisation oder aber als heterogene oder polyzyklische Masse dar. Die heterogene Struktur des Befunds kann auf nekrotische, hämorrhagische oder zystische Anteile hindeuten [Jiang et al., 2019]. In der Schichtbildgebung zeigt sich der SFT sowohl in der Computer- als auch in der Magnetresonanztomografie isodens/idointens zur Muskulatur und mit einem heterogenen Kontrastmittelverhalten [Satomi et al., 2014; Kalla, 2018].
Mikroskopisch besteht der SFT aus spindelförmigen bis ovoiden Zellen, die in ungeordneten Mustern hypo- und hyperzelluläre Areale bilden und von kleinen kapillarähnlichen Gefäßen oder „hirschgeweihartig“ angeordneten Gefäßen durchzogen sind. Da es zahlreiche histomorphologische Differenzialdiagnosen gibt, kommt der Immunhistochemie eine zentrale Bedeutung zu. Entgegen der ursprünglichen Annahme, dass es sich beim SFT um eine aus Mesothelgewebe entstandene Neoplasie handelt, zeigt sich diese Tumorentität negativ auf eine Färbung mit Keratin-Antikörpern. In 90 bis 100 Prozent der Fälle ist der SFT positiv für CD34 – ein durch hämatopoetische Stammzellen und vaskuläre Strukturen exprimiertes Transmembranprotein. Da es durch die NAB2/STAT6-Genfusion innerhalb der Tumorzellen zu einer erhöhten Konzentration an STAT6 im Zellkern kommt, reagiert dieser außerdem stark positiv auf entsprechende Antikörper. Das Ansprechen auf Vimentin-Antikörper spricht außerdem für den mesenchymalen Ursprung des Tumors.
Rein histologisch kommen verschiedene Differenzialdiagnosen wie das Spindelzellmelanom, ein Schwannom oder das fibröse Histiozytom in Betracht. Des Weiteren exprimieren auch andere Tumore wie das Kaposi-Sarkom, das Dermatofibrosarkom und primäre mesenchymale Spindelzelltumore, aber auch die akute Leukämie, das Transmembranprotein CD34 und erschweren so die Differenzialdiagnostik. Die Kombination aus CD34 und STAT6 stellt jedoch das histologische Hauptdiagnosekriterium für den SFT dar [Kalla, 2018].
Maligne SFTs werden anhand verschiedener histologischer Kriterien definiert. Dazu zählen zelluläre und nukleäre Polymorphismen, infiltrative Ränder, Hyperzellularität, der Mitotische Index und Nekrosen. Ab dem Vorliegen von drei der fünf Kriterien gilt der SFT als maligne [de Morais et al., 2020]. Malignes Verhalten wird mit einer Häufigkeit von 10 bis 37 Prozent angegeben, wobei eine deutliche Divergenz zwischen histologischen Malignitätskriterien und dem klinisch malignen Verhalten besteht [Kalla, 2018].
Die mediane Überlebenszeit von Patienten mit einem SFT ist stark abhängig von der Malignität des Befunds, liegt jedoch bei durchschnittlich 13 bis 15 Jahren; die Fünfjahresüberlebensrate beträgt bei benignen Befunden über 80 Prozent, während sie bei Vorliegen eines malignen SFT auf 50 bis 60 Prozent absinkt [Schütte et al., 2019]. Die Rezidivhäufigkeit wird mit 4,3 bis 6,7 Prozent angegeben, wobei diese meist innerhalb der ersten zwei Jahre auftreten; die Metastasierungshäufigkeit liegt bei etwa 5,4 Prozent.
Aufgrund der Seltenheit des Tumors besteht keine starke Evidenz bestimmter Therapieschemata, wobei sich wegen der klaren Begrenzung des Tumors die chirurgische Resektion als Therapie der Wahl durchgesetzt hat. Grundsätzlich gelten SFTs als Chemotherapie-insensitiv und sprechen insbesondere auf lokale Therapiemaßnahmen – auch auf die Strahlentherapie – an [Schütte et al., 2019]. Bei fortgeschrittenen Tumorstadien wird die Therapie mit Doxorubicin oder als Zweitlinientherapie Dacarbazin empfohlen. Vielversprechend sind – aufgrund der häufig guten Vaskularisation der Tumore – auch neuere Therapieschemata mit Angiogenesehemmern [Casali et al., 2018].
Da das langfristige Verhalten des SFT noch weitgehend unbekannt ist, wird ein Follow-up von drei bis fünf Jahren mit regelmäßigen klinischen und bildgebenden Kontrollen (Sonografie, Computertomografie, Magnetresonanztomografie) empfohlen [Satomi et al., 2014].
Dr. Med. Diana Heimes
Klinik und Poliklinik für Mund-, Kiefer und Gesichtschirurgie – plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
PD Dr. Dr. Keyvan Sagheb
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie – plastische Operationen
der Universitätsmedizin der Johannes Gutenberg- Universität Mainz
Augustusplatz 2, 55131 Mainz
Prof. Dr. Dr. Peer W.Kämmerer, Ma, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen,
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Fazit für die Praxis
Weichgewebssarkome machen etwa ein Prozent der Mundhöhlentumore aus.
Sie entstehen aus Bindegewebe, Muskulatur, Knorpel, Fett, Blut und Lymphgefäßen.
Bei unklarer Dignität einer enoralen Raumforderung sollte nach inkonklusiver Bildgebung eine Biopsie des Befunds zur Diagnosesicherung erfolgen.
Der solitär fibröse Tumor gehört zur Gruppe der Sarkome und stellt eine seltene Differenzialdiagnose der enoralen Raumforderung dar; er kann erst durch die immunhistochemische Untersuchung sicher diagnostiziert werden.
Bei Diagnose eines Tumors mit unsicherem oder potenziell malignem Potenzial bietet sich die Besprechung des Falls in einer Expertenrunde an, beispielsweise einem interdisziplinären Tumorboard, um die weitere Therapie abzustimmen.
Literaturliste
Casali, P. G., N. Abecassis, H. T. Aro, S. Bauer, R. Biagini, S. Bielack, S. Bonvalot, I. Boukovinas, J. Bovee, T. Brodowicz, J. M. Broto, A. Buonadonna, E. De Alava, A. P. Dei Tos, X. G. Del Muro, P. Dileo, M. Eriksson, A. Fedenko, V. Ferraresi, A. Ferrari, S. Ferrari, A. M. Frezza, S. Gasperoni, H. Gelderblom, T. Gil, G. Grignani, A. Gronchi, R. L. Haas, B. Hassan, P. Hohenberger, R. Issels, H. Joensuu, R. L. Jones, I. Judson, P. Jutte, S. Kaal, B. Kasper, K. Kopeckova, D. A. Krakorova, A. Le Cesne, I. Lugowska, O. Merimsky, M. Montemurro, M. A. Pantaleo, R. Piana, P. Picci, S. Piperno-Neumann, A. L. Pousa, P. Reichardt, M. H. Robinson, P. Rutkowski, A. A. Safwat, P. Schoffski, S. Sleijfer, S. Stacchiotti, K. Sundby Hall, M. Unk, F. Van Coevorden, W. T. A. van der Graaf, J. Whelan, E. Wardelmann, O. Zaikova, J. Y. Blay, E. G. Committee and Euracan (2018). „Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up.“ Ann Oncol 29(Suppl 4): iv51-iv67.
de Morais, E. F., H. D. D. Martins, K. S. Rodrigues, G. M. de Franca, E. J. D. da Silveira and R. A. Freitas (2020). „Clinicopathologic Analysis of Oral and Maxillofacial Solitary Fibrous Tumor.“ Am J Clin Pathol 154(1): 15-22.
EI-Naggar, A., J. Chan, J. K. CGrandis, T. Takata and P. J. Slootweg (2017). WHO Classification of Head and Neck Tumours (4th edition). Lyon.
Jiang, L., C. Hu, L. Chen and L. Chen (2019). „Diagnosis of solitary fibrous tumor in the submandibular gland: Case report and literature review.“ J Clin Ultrasound 47(8): 486-489.
Kalla, D. (2018). Der solitäre fibröse Tumor im Kopf-Hals Bereich : Literatur Review mit Patientenfall. D. Medizinische Universität Wien, 2018.
Satomi, T., O. Hasegawa, H. Abukawa, M. Kohno, A. Enomoto, D. Chikazu, J. Matsubayashi and T. Nagao (2014). „Exceptionally large solitary fibrous tumor arising from the cheek: an immunohistochemical and ultrastructural study with a review of the literature.“ Med Mol Morphol 47(2): 108-116.
Schütte, J., S. Bauer, T. Brodowicz, V. Grünwald, S. Hofer, P. Hohenberger, L. Jost, B. Kasper, L. Lindner, R. Pritzkuleit, P. Reichardt, M. Ressing, C. Rothermundt, M. Sinn, P. Tunn, E. Wardelmann and B. Wörmann (2019). Weichgewebssarkome (maligne Weichgewebstumoren) des Erwachsenen. O. Leitlinien.