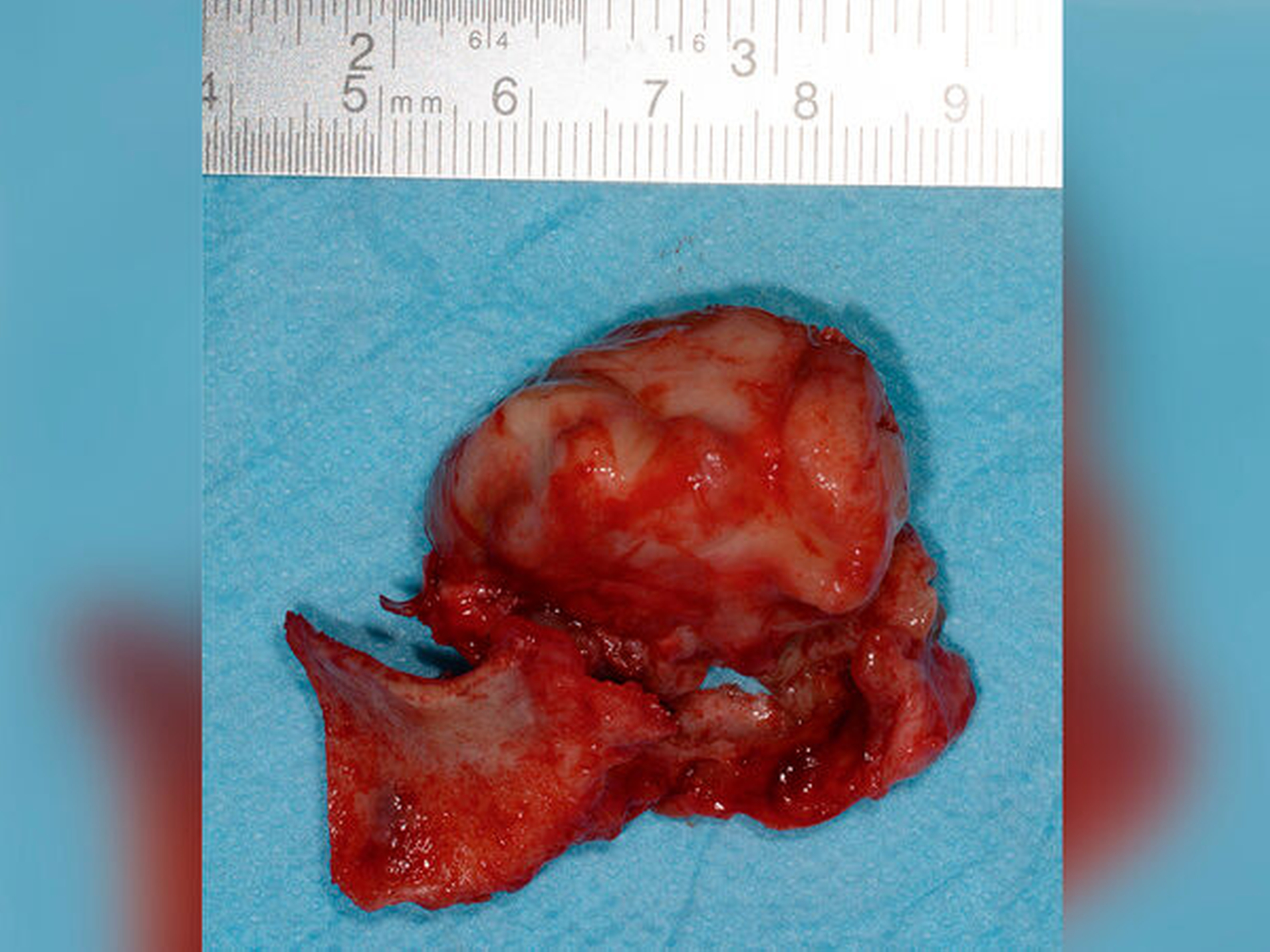
Unizystisch-murales, plexiformes Ameloblastom im Oberkiefer
Eine 62-jährige Patientin ohne Nebenerkrankungen stellte sich zur weiteren Therapie eines histologisch gesicherten Ameloblastoms im Bereich der linken Kieferhöhle vor, das im Rahmen einer Zahnsanierung bei einem niedergelassenen Oralchirurgen aufgefallen war. Der zahnärztliche Kollege hatte vier Wochen nach Extraktion des nicht erhaltungswürdigen Zahnes 27 aufgrund einer nicht abheilenden Wunde eine histologische Probebiopsie entnommen und ein plexiformes Ameloblastom diagnostiziert.
Anamnestisch gab die Frau keine Schmerzen an, sie verspürte lediglich ein minimales Druckgefühl. Bei der klinischen Untersuchung zeigte sich enoral eine Mund-Antrum-Verbindung (MAV). Extraoral fanden sich keine Sensibilitätsstörungen im Versorgungsgebiet des N. trigeminus.
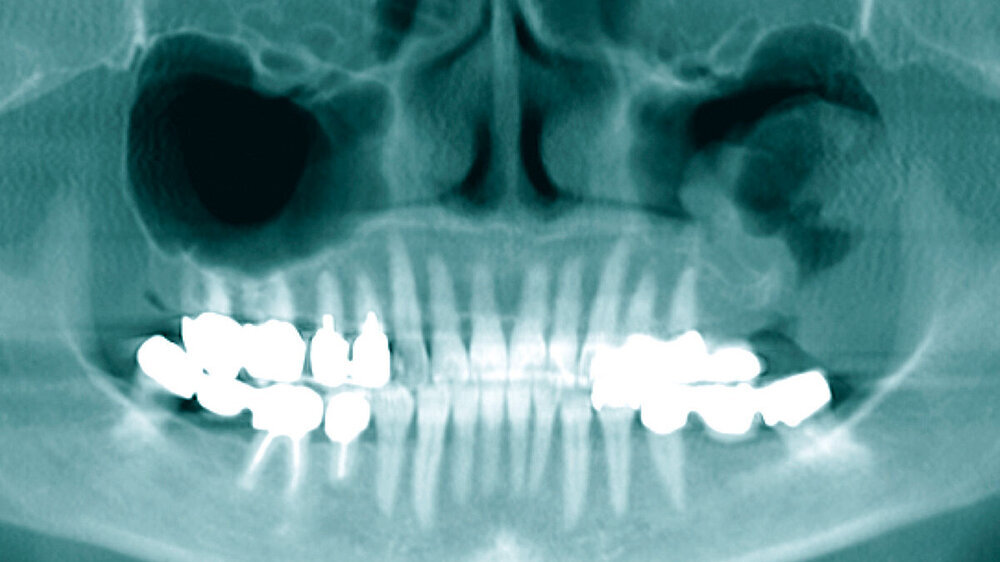
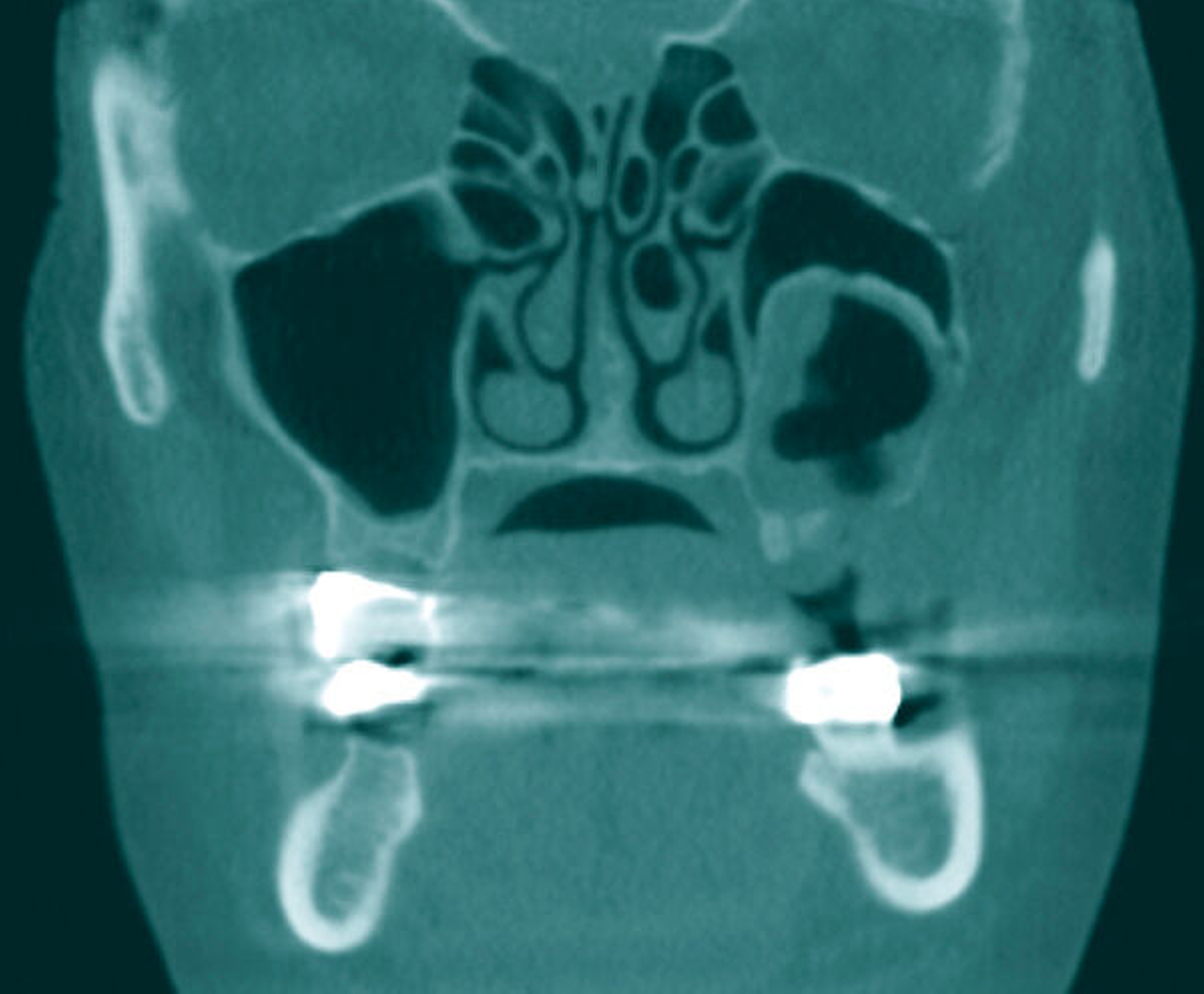
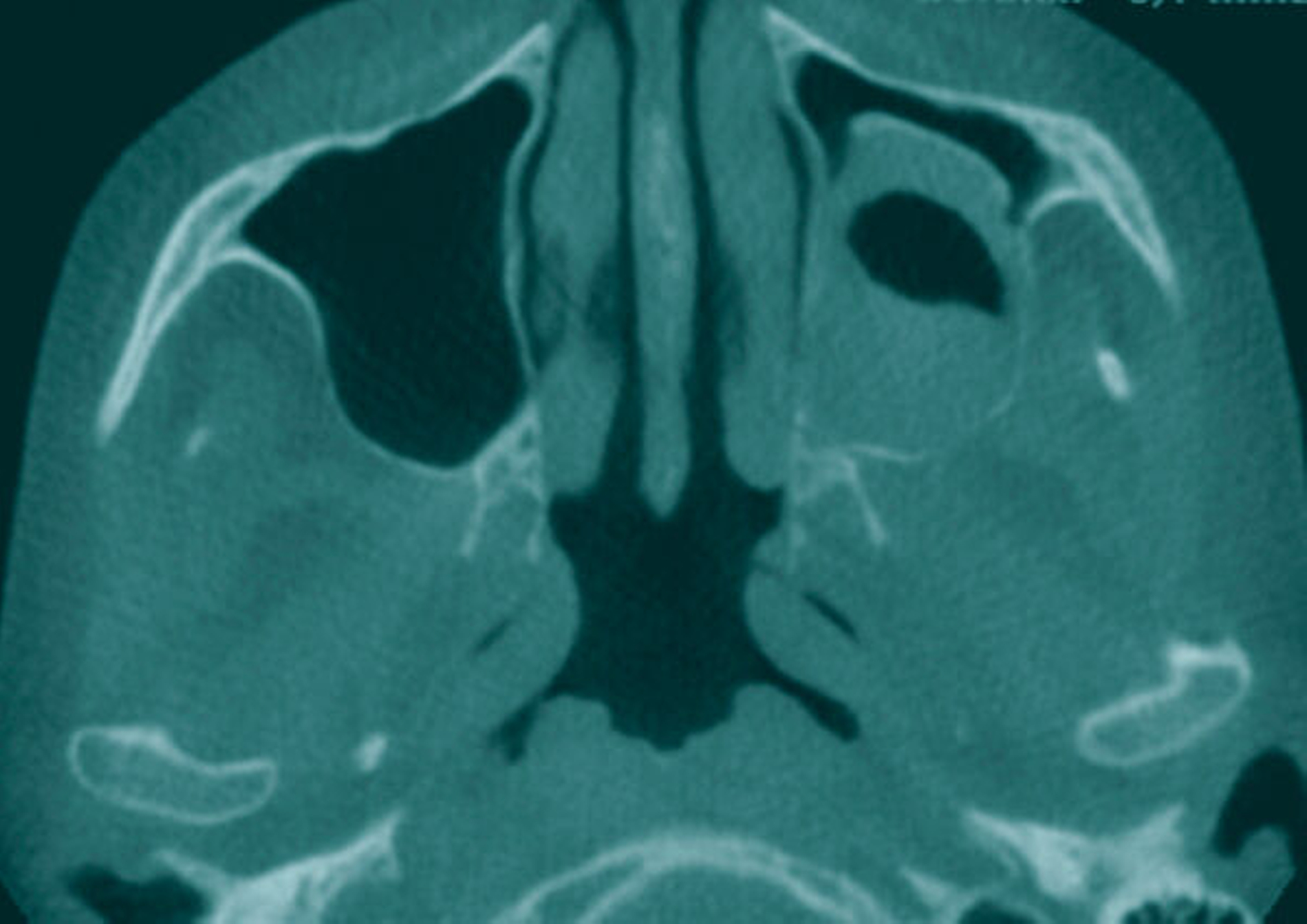
Die präoperativ durchgeführte Digitale Volumentomografie (DVT) zeigte eine zystische Raumforderung, die fast zwei Drittel der linken Kieferhöhle einnahm. Die Raumforderung hatte randständig eine weichgewebedichte Opazität mit zentraler Transluzenz und erschien fast „seifenblasenartig“. In regio 26/27 zeigte sich die bereits klinisch auffällige MAV. Radiologisch befand sich der Zahn 25 in direkter Nähe zum Befund. Das restliche Gebiss wies neben konservierenden und prothetischen Maßnahmen keine weiteren Auffälligkeiten auf (Abbildung 1).
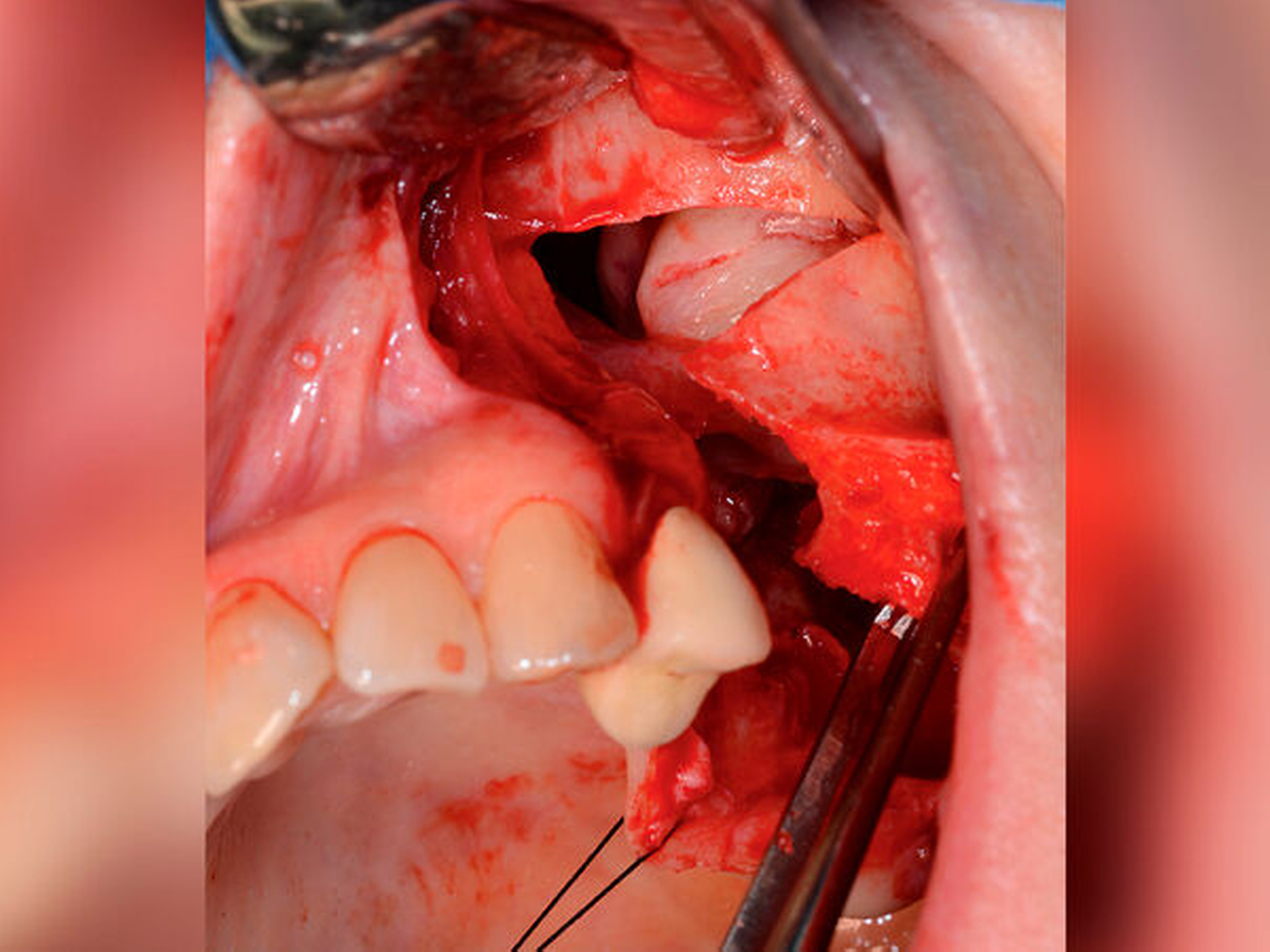
Es wurde die Indikation zur Entfernung der Raumforderung samt Extraktion des Zahnes 25 gestellt. Nach crestal palatinaler Inzision und Umschneidung der MAV konnte ein mukoperiostaler Lappen gebildet und die faziale Kieferhöhlenwand großflächig dargestellt werden. Der Zahn konnte komplikationslos entfernt werden. Zur Einhaltung eines ausreichenden Sicherheitsabstands erfolgte die großflächige Osteotomie des linken Oberkiefers mit der Knochensäge bis zur anterioren Kieferhöhlenwand parallel zur Okklusionsebene (Abbildung 2). Distal erfolgte das Absetzen mit dem Obwegeser-Meißel. Der Befund konnte anschließend in toto entfernt werden (Abbildung 3) und die MAV mittels einer plastischen Deckung nach Rehrmann unter Verwendung des Bichat‘schen-Fettpfropfs mehrschichtig verschlossen werden.
In der Histopathologie zeigte sich der Befund eines 3,8 cm großen muralen (Infiltration in die Zystenwand) Ameloblastoms mit plexiformem und zystischem Wachstumsmuster – von einer Resektion in toto mit einem Sicherheitsabstand von > 1,5 mm konnte ausgegangen werden. Eine Transformation in ein malignes Ameloblastom war nicht nachweisbar. Im Rahmen der nun dreijährigen Nachsorge konnte kein Hinweis auf ein Rezidiv gesehen werden. Eine Rekonstruktion des Knochens wurde bisher von der Patientin bei nicht vorhandenen Einschränkungen der Mastikation und der Phonation abgelehnt.
Diskussion
Das Ameloblastom ist in Deutschland nach dem Odontom der zweithäufigste odontogene Tumor: Die globale Inzidenz wird auf 0,5 Fälle pro Million Personenjahre geschätzt, wobei vornehmlich Frauen im Alter von 30 bis 60 Jahren betroffen sind. Meist handelt es sich bei klinisch vornehmlich schmerzlosen Kieferauftreibungen um (radiologische) Zufallsbefunde und das bei bis zu 80 Prozent der Fälle im posterioren Unterkiefer/Kieferwinkel. Die benigne epitheliale Läsion wächst langsam und lokal invasiv und weist in den meisten klinischen Fällen einen gutartigen Verlauf auf.
Nach der neuen WHO-Klassifikation von 2017 werden Ameloblastome in konventionelle, extraorale/periphere sowie unizystische und metastasierende Subtypen eingeteilt [Baumhoer, 2018; Schneider und Kämmerer, 2019]. So wird der früher als solide/multizystisch bezeichnete Tumor genauso wie die früher als desmoplastisch bezeichnete Läsion nun als konventionelles Ameloblastom bezeichnet [Baumhoer und Holler, 2018]. Das im vorliegenden Fall aufgetretene unizystische Ameloblastom ist ein Subtyp, der aus einer großen Zyste besteht, und zeigt eher ein gutartiges Wachstumsverhalten, auch bei konservativer Therapie wie zum Beispiel bei Kürettage oder Enukleation [Römer et al., 2020].
Der unizystische Typ wird weiter in luminal, intraluminal und mural eingeteilt, wobei das murale Ameloblastom durch ein infiltratives Wachstum in die Zystenwand gekennzeichnet ist. Aufgrund einer niedrigeren Rezidivrate werden der luminale und der intraluminale Subtyp konservativ mittels Enukleation behandelt und der murale Typ wie das konventionelle Ameloblastom mit einem ausreichenden Sicherheitsabstand reseziert [Baumhoer, 2018]. Die peripheren/extraossären Ameloblastome [Krüger et al., 2011] wurden in der Klassifikation beibehalten [Schneider und Kämmerer, 2019].
Schmerzen und Sensibilitätsstörungen sind selten, weshalb diese Tumore aufgrund des langsamen Wachstums in seltenen Fällen auch groteske Ausmaße erreichen können. Typischerweise präsentieren sich Ameloblastome radiologisch als „seifenblasenartig“ oder „bienenwabenartig“ und weisen oft auch Wurzelresorptionen an benachbarten Zähnen auf [Castro et al., 2012]. Andere odontogene Tumore zeigen oft ähnliche radiologische Muster, weshalb differenzialdiagnostisch unter anderem auch immer an eine Keratozyste (ehemals keratozystisch odontogener Tumor [Thiem et al., 2019]) gedacht werden sollte [Römer et al., 2020].
Die adäquate Therapie der Ameloblastome wird seit vielen Jahren kontrovers diskutiert und reicht von der Enukleation bis hin zur radikalen Resektion mit Sicherheitsabstand [Kim et al., 2017]. Da Ameloblastome dazu tendieren, im Bereich der Spongiosa zu infiltrieren, ohne radiologisch sichtbare Resorptionszeichen aufzuzeigen, wird jedoch zu einer radikaleren Resektion (0,5 bis 2 cm) im gesund erscheinenden Knochen mit anschließender Rekonstruktion geraten [Schneider und Kämmerer, 2019]. Die Rezidivraten belaufen sich – insbesondere bei Enukleation/Resektion ohne ausreichenden Sicherheitsabstand – laut Literatur auf bis zu 90 Prozent [Schneider und Kämmerer, 2019], erreichen aber auch bei radikaler Resektion 5 bis 15 Prozent.
Selbst fünf Jahre Rezidivfreiheit stellen keine Sicherheit dar und Ameloblastome können aufgrund des eher langsamen Wachstums auch nach dieser Zeit erneut in Erscheinung treten [Castro et al., 2012]. Dennoch sollte immer ein individuelles Therapiekonzept mit dem Patienten angestrebt werden, um große Rekonstruktionen – bei einem doch überwiegend jungen Patientenkollektiv – auf ein Minimum zu reduzieren [Parmar et al., 2016]. In sehr seltenen Fällen kann sich ein Ameloblastom zu einem malignen Tumor mit Metastasierungsfähigkeit transformieren. Dieses Verhalten wird jedoch mit einer Auftretenshäufigkeit von weniger als zwei Prozent beschrieben, wobei Metastasen hier vor allem in der Lunge zu finden sind [Yang et al., 2021].
Im vorliegenden Fall konnte das Ameloblastom mit 1,5 cm Sicherheitsabstand in sano entfernt werden. Prospektiv sollten weiterhin regelmäßige röntgenologische Verlaufskontrollen zum Ausschluss von Rezidiven erfolgen, da ein Rezidiv auch zehn Jahre oder später nach der Operation auftreten kann.
Fazit für die Praxis
Die Unterscheidung zwischen einer odontogenen Zyste und einem Ameloblastom ist bei unizystischem Auftreten klinisch häufig kompliziert.
Bei unklaren Befunden empfiehlt sich eine Probebiopsie, da die Therapien der odontogenen Zyste und des Ameloblastoms vor allem im Hinblick auf den chirurgischen Sicherheitsabstand unterschiedlich sind.
Bei Enukleation und Kürettage eines Ameloblastoms sind die Rezidivraten im Vergleich zur chirurgischen Exzision mit Sicherheitsabstand hoch. Entscheidet sich der Patient für eine solche Therapie, muss er darüber aufgeklärt werden.
Maligne Transformationen von Ameloblastomen treten nur selten auf.
Literaturliste
Baumhoer, D. (2018). „[Odontogenic tumours and bone tumours of the jaw : Changes in the new WHO classification].“ Pathologe 39(1): 35-41.
Baumhoer, D. and S. Holler (2018). „[Cystic lesions of the jaws].“ Pathologe 39(1): 71-84.
Castro, S., II, M. S. Israel, G. S. Lima and S. de Queiroz Chaves Lourenco (2012). „Difficulties in the diagnosis of plexiform ameloblastoma.“ Oral Maxillofac Surg 16(1): 115-118.
Kim, J., E. Nam and S. Yoon (2017). „Conservative management (marsupialization) of unicystic ameloblastoma: literature review and a case report.“ Maxillofac Plast Reconstr Surg 39(1): 38.
Krüger, M., P. Kämmerer and C. Walter (2011). „Differentialdiagnose von Schwellungen des Alveolarkamms: Extraossäres Ameloblastom.“ Zahnärztliche Mitteilungen 101(22): 48-49.
Parmar, S., L. Al-Qamachi and H. Aga (2016). „Ameloblastomas of the mandible and maxilla.“ Curr Opin Otolaryngol Head Neck Surg 24(2): 148-154.
Römer, P., F. Schnaith and P. W. Kämmerer (2020). „Der besondere Fall mit CME: Keratozyste oder Ameloblastom?“ Zahnärztliche Mitteilungen 110(21): 76-79.
Schneider, D. and P. W. Kämmerer (2019). „Ameloblastom – Einordnung gemäß der aktuellen WHO-Klassifikation.“ wissen kompakt 13: 83-89.
Thiem, D. G. E., B. K. Straub, M. Krüger and P. W. Kämmerer (2019). „Der besondere Fall mit CME: Keratozyste im Oberkiefer.“ Zahnärztliche Mitteilungen 109(9): 56-59.
Yang, X., K. Zhou, Y. Tao, S. Ge, W. Shang and K. Song (2021). „Treatment efficacy and prognosis of pulmonary metastasizing ameloblastoma: a systematic review.“ Int J Oral Maxillofac Surg.