Die Regeneration von verletzten Nerven
Verletzungen der Nerven sind in der Zahn-, Mund- und Kieferheilkunde vergleichsweise häufig anzutreffen. So gehen Traumata im mund-, kiefer- und gesichtschirurgischen Bereich zu etwa fünf Prozent mit Nervenverletzungen einher. Bedingt durch die häufig in räumlich engem Abstand zu Nerven stattfindenden zahnmedizinischen Behandlungen kommen auch iatrogene Nervenschädigungen im Gesichtsbereich häufiger vor als in anderen ärztlichen Disziplinen.
N. lingualis
Der N. lingualis ist der am häufigsten geschädigte Ast des N. trigeminus [Hillerup, 2007]. Die Extraktion der unteren dritten Molaren stellt dabei die häufigste Ursache für N.-lingualis- Schädigungen dar [Hölzle und Wolff, 2001], gefolgt von Knochenentnahmen im Bereich der Retromolarregion, endodontischen Behandlungen und Weichteileingriffen im Bereich der Glandula sublingualis und des Mundbodens [Eufinger et al., 2021]. Schädigungen durch die intraneurale Applikation von Lokalanästhetika sind selten und beschränken sich häufig auf temporäre Beschwerden mit Spontanheilungstendenz [Pogrel und Thamby, 2000; Hillerup und Jensen, 2006].
N. alveolaris inferior
Weisheitszahnextraktionen (Abbildungen 1 bis 3) und Implantatinsertionen (Abbildung 4) sind die häufigsten Ursachen einer Schädigung des N. alveolaris inferior [Dalle Carbonare et al., 2017; Eufinger et al., 2021]. Circa 90 Prozent davon verlaufen temporär über einen Zeitraum von durchschnittlich acht Wochen. Persistierende Beschwerden sind selten, können aber insbesondere bei komplizierten Weisheitszahnextraktionen auftreten (Abbildungen 1 bis 3) [Wang und Li, 2022]. Neben der Art und dem Ausmaß des Eingriffs und der Erfahrung des Chirurgen hat sich insbesondere die präoperative Planung des Eingriffs als wichtiger Faktor zur Beeinflussung des Verletzungsrisikos gezeigt. Zur Verringerung des Verletzungsrisikos wird daher in komplexen Fällen präoperativ ein digitales Volumentomogramm empfohlen (Abbildung 5) [Haug et al., 2009; Clé-Ovejero et al., 2017].
N. facialis
Der N. facialis ist mit circa 62 Prozent der Fälle am häufigsten von traumatischen Verletzungen betroffen [Wusiman et al., 2020]. Chirurgische Eingriffe, insbesondere im Bereich des Kiefergelenks und der Glandula parotidea, können mit einer Schädigung des N. facialis vergesellschaftet sein. Der häufigste Schädigungsort aufgrund von operativen Eingriffen ist in unmittelbarer Umgebung des N.-facialis-Stamms, der eine enge Lagebeziehung zur Ohrspeicheldrüse und zum Kiefergelenk hat [Dew und Shelton, 1996; Hohman et al., 2014].
Anatomie und Einteilung von Nervenverletzungen
Periphere Neurone bestehen aus einem Zellkörper, Dendriten und einem Axon. Der grundlegende Zellstoffwechsel und die Produktion von Neurotransmittern finden im Nervenzellkörper statt. Die Axone dienen der Weiterleitung von Aktionspotenzialen zu nachgeschalteten Nerven oder Zielorganen. Schnell leitende Axone wie Motoneurone werden von Schwann-Zellen mit einer Myelinscheide ausgekleidet, die zu 70 Prozent aus Lipiden und zu 30 Prozent aus Proteinen besteht. Diese Myelinscheiden dienen als Isolationsschicht und sind in Abständen von 1 bis 1,5 mm angeordnet.
Myelinisierte Abschnitte des Nervs werden von Arealen mit einer hohen Dichte von spannungsabhängigen Natrium-Kanälen, den sogenannten Ranvier’schen Schnürringen, unterbrochen. Die Reizweiterleitung in myelinisierten Nerven findet saltatorisch (sprunghaft über die Ranvier’schen Schnürringe) statt und erreicht so hohe Nervenleitgeschwindigkeiten.
Patientenfall: Mikrochirurgische Durchtrennung und Re-Anastomosierung des N. alveolaris inferior nach Neurombildung bei komplizierter Weisheitszahnentfernung
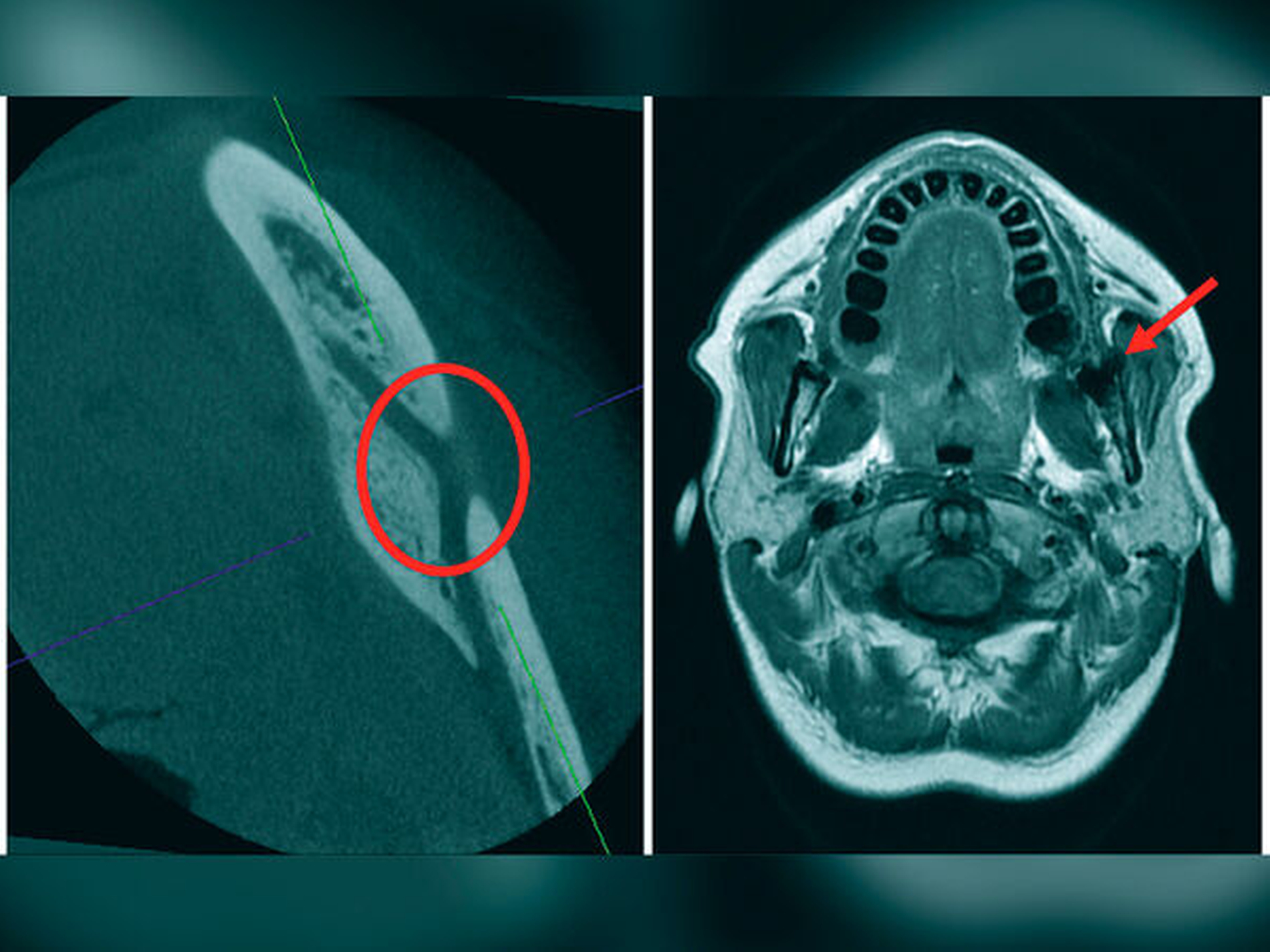
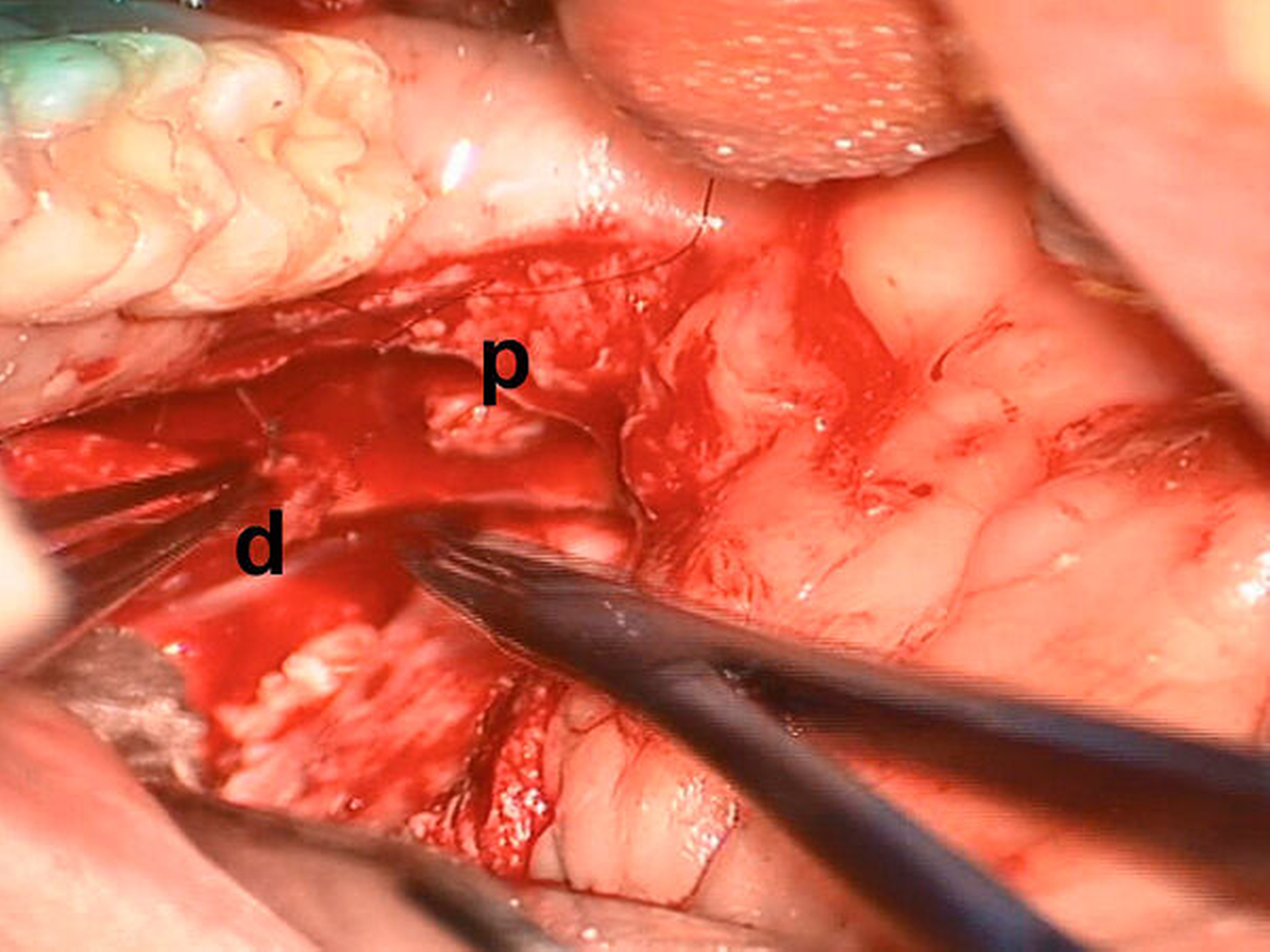
Das Axon beschreibt die kleinste Funktionseinheit innerhalb des peripheren Nervs und ist von kollagenfaserigen Hüllstrukturen umgeben: Das Endoneurium umgibt jedes Axon einzeln, das Perineurium fasst mehrere Axone zu einem Nervenfaszikel zusammen. Insbesondere Hirnnerven weisen häufig mehrere Faserqualitäten auf, so dass in einem peripheren Nerv Faszikel mit unterschiedlichen Faserqualitäten benachbart vorhanden sein können. Die Gesamtheit eines peripheren Nervs wird vom sogenannten Epineurium umgeben [Lundborg und Dahlin, 1996; Flores et al., 2000; Tezcan, 2017].
Seddon und Sunderland definierten periphere Nervenverletzungen entsprechend dem Verletzungsausmaß der kollagenfaserigen Hüllstrukturen (Tabelle 1) [Seddon, 1943; Sunderland, 1978]. Seddon unterteilt hierbei in drei Hauptkategorien: Die Neurapraxie (Sunderland I) beschreibt eine Verletzung der Myelinscheide, die als geringste Form der Nervenschädigung spontan in Tagen bis Wochen verheilen kann. Die Axonotmesis (Sunderland II) beschreibt eine ausgedehntere neuronale Verletzung der Axone innerhalb ihrer intakten Hüllstrukturen. Nervenverletzungen, die mit einer Unterbrechung der kollagenhaltigen Hüllstrukturen (weitgehende Durchtrennung der Nerven) einhergehen, werden als Neurotmesis bezeichnet (Sunderland III–IV).
Pathophysiologie von Nervenverletzungen
Im Unterschied zu vielen anderen Geweben reagiert Nervengewebe auf eine Traumatisierung nicht mit einer Steigerung der Mitoserate oder einer Zellproliferation. Bei ausgedehnteren peripheren Nervenverletzungen setzt eine anterograde axonale Degeneration des distalen Nervenstumpfs ein [Jessen und Mirsky, 2019]. Dieser Prozess ist auch als Waller-Degeneration bekannt und ist ein Alleinstellungsmerkmal des Nervengewebes. Die Waller-Degeneration beginnt bereits 24 bis 36 Stunden nach dem Ereignis und beschreibt die vollständige phagozytäre Auflösung der Myelinscheide und des Axons distal vom Ort der Schädigung [Waller und Owen, 1850].
In den Raum, der von den phagozytierten Axonen und Myelinscheiden hinterlassen wird, können im Rahmen der Regeneration anschließend nachwachsende Axone des proximalen Nervenstumpfs einsprießen. Hierfür ist es maßgeblich, dass neuronale Hüllstrukturen vorhanden sind, um diesen Regenerationsprozess zu leiten. Schwann-Zellen haben hierbei eine zentrale Rolle, da sie neurotrophe Faktoren ausschütten, die die Aussprossung von Axonen fördern und darüber hinaus sogenannte Büngner‘sche Bänder bilden. Diese Bänder dienen der gerichteten Aussprossung von Axonen aus dem proximalen Stumpf entlang des Nervenverlaufs. Die Regenerationsgeschwindigkeit beträgt dabei maximal 1 bis 2 mm/d [Burnett und Zager, 2004; Jessen und Mirsky, 2019].
Zu berücksichtigen ist, dass insbesondere Muskelgewebe in der Zeit der Denervation atrophiert. Erreichen die aussprossenden Axone eines motorischen Nervs das muskuläre Erfolgsorgan zu spät, sind die motorischen Endplatten bereits atrophiert. Um diesem Effekt vorzubeugen, sollte eine Nervenrekonstruktion spätestens innerhalb von vier bis sechs Monaten erfolgen. Es gilt allgemein zu beachten, dass auch bei adäquat durchgeführten Nervenrekonstruktionen lediglich mit einer erwartungsgemäßen funktionellen Rehabilitation von 50 bis 60 Prozent des Ursprungszustands auszugehen ist [Schwerdtfeger et al., 2013; Grinsell und Keating, 2014].
Chirurgische Prinzipien bei der Therapie
Klinische Kontrolle bei Neurapraxie und Axonotmesis
Die Art und das Ausmaß der Nervenverletzung bestimmen die Notwendigkeit und die zeitliche Dringlichkeit einer chirurgischen Intervention. Drucklähmungen oder Quetschverletzungen können eine Neurapraxie oder Axonotmesis verursachen. Häufige Ursachen sind zum Beispiel eine fehlerhafte Patientenlagerung während einer Allgemeinanästhesie, die Arbeit mit vibrierenden Geräten oder eine „Saturday Night“-Lähmung mit einer Kompression von Nerven während des Schlafes.
Im zahnärztlichen Bereich ist zum Beispiel die Nervenkompression durch die Infiltration von Lokalanästhetika oder durch Instrumentendruck bei einer Osteotomie zu nennen. Obwohl diese milden Formen der Nervenverletzungen aufgrund der erhaltenen Hüllstrukturen eine gute Spontanheilungstendenz haben, können sie klinisch mit eindrücklichen Taubheits- oder Lähmungsgefühlen imponieren. Die Therapie der Wahl besteht in einer engmaschigen klinischen Reevaluation durch einen Spezialisten. Bei Ausbleiben einer symptomatischen Besserung kann im Verlauf eine chirurgische Intervention nötig sein, um eine gegebenenfalls vorhandene Schädigungsursache (zum Beispiel fehlerhaft inserierte Implantate oder überstopftes Wurzelfüllmaterial) zu beseitigen [Griffin et al., 2013; Grinsell und Keating, 2014; Tezcan, 2017].
Chirurgische Therapie bei Ausbleiben einer Spontanheilung und bei Neurotmesis
Nervenverletzungen, die trotz eines vermutlich geringen Schädigungsmusters nach drei Monaten keine Heilungstendenz zeigen, sowie eine gesicherte Neurotmesis sollten in einer Fachklinik oder von einem Spezialisten untersucht oder chirurgisch exploriert werden, um die neuronalen Hüllstrukturen wiederherzustellen und eine gerichtete Regeneration zu ermöglichen. Unterschiedliche mikrochirurgische Ansätze werden abhängig vom vorliegenden Schädigungsmuster angewendet [Griffin et al., 2013; Grinsell und Keating, 2014; Tezcan, 2017]. Wird eine gesicherte intraoperative Neurotmesis bemerkt, ist eine zeitnahe Revision prognostisch am günstigsten.
Direkte Koaptation
Bei glatter Durchtrennung eines Nervs empfiehlt sich die direkte Koaptation. Falls keine glattwandige Beschädigung der Nervenenden besteht, sollte die substanzschonende Entfernung der irregulär verletzten Nervenanteile erfolgen, um eine anschließende Koaptation der Nervenendigungen zu ermöglichen. Die Koaptation sollte dabei stets spannungsfrei erfolgen, da sonst keine Regeneration des Nervs durch axonale Aussprossung erfolgen kann. Neuronale Defizite um bis zu 5 mm können nach erfolgter Neurolyse spannungsfrei koaptiert werden (Abbildung 2). Die Verbindung des proximalen und des distalen Nervenstumpfs kann mit Naht oder mit Fibrinkleber erfolgen. Die primäre Nervennaht erfolgt mit feinem Nahtmaterial (Fadenstärke 9 bis 0 und dünner) und unter Vergrößerung.
Prinzipiell ist die epineurale Nervennaht von der perineuralen Nervennaht zu unterscheiden [Cabaud et al., 1976]. Die epineurale Nervennaht beschreibt die Koaptation des Nervens an seiner äußersten, makroskopisch sichtbaren, bindegewebigen Hülle. Die perineurale Nervennaht strebt die Verbindung einzelner Faszikel an, die ohne Zuhilfenahme eines Operationsmikroskops nicht durchführbar ist. Diese Technik bietet den Vorteil, dass insbesondere bei Nerven mit mehreren Faserqualitäten eine Fehlinnervation nach chirurgischer Rekonstruktion vermieden werden kann. Das gustolakrimale Phänomen nach Defektheilung des N. facialis geht beispielsweise auf eine derartig gerichtete Fehlinnervation zurück.
Die Verwendung von Fibrinkleber begegnet dem Risiko der Neurombildung (Abbildung 1) wirksam, da diese nahtfrei erfolgen kann. Ein weiterer Vorteil liegt in der einfachen und schnellen Verwendung. Der mechanische Halt von geklebten Nervenanastomosen ist jedoch nicht so sicher wie die Koaptation mittels Naht [Sameem et al., 2011). Die Verwendung von Fibrinklebern eignet sich zudem nicht zur perineuralen Nervenkoaptation [Grinsell und Keating, 2014; Tezcan, 2017; Panagopoulos et al., 2019].
Autologe Nerventransplantation
Nervenverletzungen mit langstreckigen Defiziten (> 5 mm) benötigen ein Interponat, um eine spannungsfreie Adaptation der Nervenstümpfe zu ermöglichen. Die Verwendung autologer Nerventransplantate hat aufgrund der geringen Abstoßungsreaktionen die besten Einheilungstendenzen, erfordert jedoch die Entnahme eines Nervens an anderer Stelle. Häufig verwendete Transplantate sind der N. suralis und der N. cutaneus antebrachii medialis, die gut zugänglich für eine Entnahme sind und mit einer nur geringen Entnahmekomorbidität einhergehen. Der Nachteil bei der Verwendung eines Nerveninterponats besteht prinzipiell in der Notwendigkeit von zwei mikrochirurgischen Nervenanastomosen.
Ein chirurgisch eingebrachtes autologes Nerventransplantat unterliegt, ebenso wie ein distaler Nervenstumpf nach direkter Koaptation, der Waller-Degeneration. Nach erfolgreicher Einlage eines transplantierten Nervs verbleiben lediglich die Hüllstrukturen des Interponats, während die Axone und die Myelinscheiden im Rahmen eines zeitintensiven Regenerationsprozesses neu gebildet werden. Dieser Prozess wird zusätzlich durch die Ausschüttung neurotropher Faktoren – durch die an der Nervenregeneration beteiligten Schwann-Zellen – gefördert [Millesi, 2007; Tezcan, 2017].
Allogene Nerventransplantation
Die begrenzte Verfügbarkeit autologer Nerventransplantate sowie die entstehende Entnahmekomorbidität erzeugen eine Nachfrage nach allogenen Transplantaten, die zum Beispiel bei Organspendern entnommen und für eine spätere Verwendung aufbereitet werden können. Da zur erfolgreichen Nervenregeneration lediglich ein dreidimensionales kollagenfaseriges Gerüst notwendig ist, das die axonale Aussprossung leiten kann, wurden Ansätze zur chemischen Dezellularisierung von Spendernerven entwickelt. Diese allogenen Spendernerven können ohne Entnahme eines Nervs am Patienten eingebracht werden und werden vorrangig für Nervenverletzungen mit geringem Durchmesser und geringer Länge verwendet (Avance ® Nerve Graft, Fa. Axogen, Alachua, Florida, USA) [Evans et al., 1994; Tezcan, 2017].
Andere biologische und synthetische Interponate
Aus der Überlegung heraus, dass die Nervenregeneration auch entlang einer dreidimensionalen Leitstruktur geschehen könnte, die nicht neuronalen Ursprungs ist, wurden unterschiedliche Ansätze zur Verwendung verschiedener autologer Gewebe sowie biologischer und synthetischer Materialien als Conduits in der Nervenregeneration verfolgt. Die Verwendung von autologen Arterien und Venen wurde ebenso wie Kollagen-Conduits und allogenes Gewebe aus Nabelschnüren zur Nervenkonduktion und -protektion beschrieben.
Polyesterbasierende synthetische Materialien wie Polyhydroxyessigsäure (PGA) und Polylactid (PLA) sind als resorbierbare Materialien zur Nervenrekonstruktion ebenfalls verfügbar. Der Einsatz von Nerv-Conduits im klinischen Alltag erfolgt vorwiegend protektiv und ergänzend zu den Techniken mit körpereigenen neuronalen Geweben [Pogrel und Maghen, 2001; Colen et al., 2009; Tezcan, 2017].
Nerventransfer
Als alternative Rekonstruktionsmöglichkeit kann die Verpflanzung eines ortsständigen unversehrten Nervens an den Stumpf eines verletzten Nervs erfolgen. Insbesondere bei proximalen Nervenverletzungen in der Nähe des Nervenzellkörpers kann dies von Vorteil sein, da in diesen Fällen die axonale Regeneration entlang eines langstreckig degenerierten Nervensegments zu viel Zeit in Anspruch nehmen würde. Bei Nervendefekten von mehr als 7,2 cm Länge ist die Durchführung eines Nerventransfers vielversprechender als die Verwendung eines Interponats. Um eine rasche Funktionswiederherstellung zu erreichen, ist es von Vorteil, wenn Spender- und Empfängernerven synergistische Funktionen haben, so dass durch gezieltes Training eine rasche neuronale Re-Edukation stattfinden kann.
Die End-zu-End-Anastomose beschreibt die erfolgreichste Art des Nerventransfers und kann zur Regeneration motorischer und sensorischer Nerven gewählt werden. End-zu-Seit-Anastomosen sind ebenfalls möglich und können komplementär zu einer anatomischen Nervenrekonstruktion durchgeführt werden, um zusätzlich eine frühzeitige Innervation des Zielorgans sicherzustellen [Vanaclocha-Vanaclocha et al., 2017; Panagopoulos et al., 2019].
Chirurgische Rekonstruktion in der Zahnmedizin
Rekonstruktion des N. lingualis
Bei einer Verletzung des N. lingualis im Rahmen einer Weisheitszahnextraktion wird eine chirurgische Exploration über die vorbestehende Operationsnarbe vorgenommen und eine Erweiterung des Zugangs nach anterior vorgenommen. Nach vollständiger Darstellung der Nervenstümpfe wird zunächst eine externe Neurolyse durchgeführt. Liegt eine oberflächliche Schädigung des N. lingualis vor, ist die Abtragung epineuralen Narbengewebes ausreichend, während eine vollständige Durchtrennung des Nervens meist die Einlage eines Interponats erfordert.
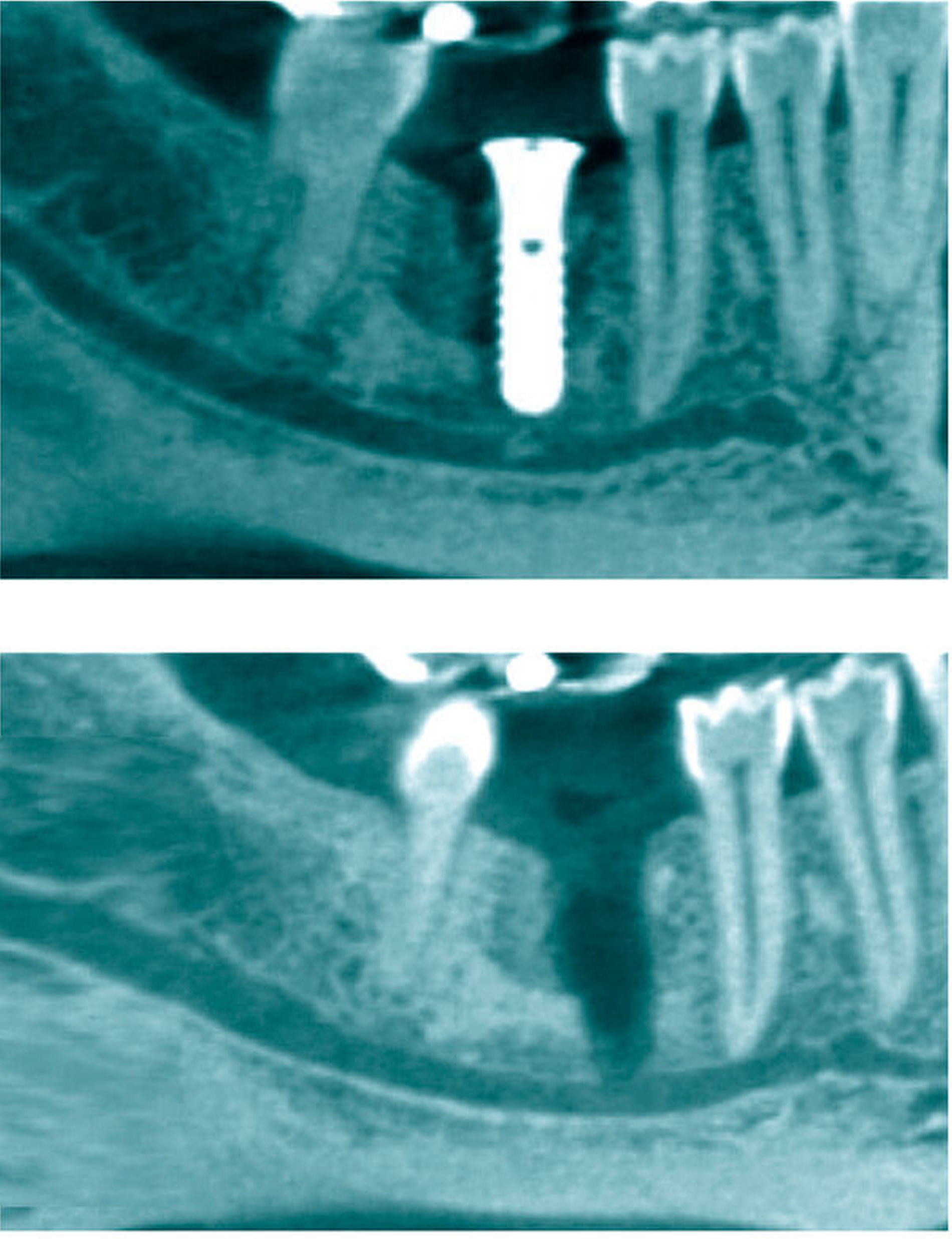
Um eine Gefährdung der Nervenanastomose sowie des Interponats zu vermeiden, sollte eine sekundäre Rekonstruktion idealerweise erst nach Abheilung der Operationswunde (nach circa drei bis vier Wochen) durchgeführt werden [Schmelzeisen, 2000; Hausamen, 2003; Panagopoulos et al., 2019; Eufinger et al., 2021].
Rekonstruktion des N. alveolaris inferior
Die chirurgische Darstellung des N. alveolaris inferior wird meist ausgehend vom Foramen mentale durchgeführt. Durch modellierendes Abtragen der bukkalen Kortikalis mittels Piezo-Technik kann der Canalis mandibulae mit dem enthaltenen Nerven schonend freigelegt werden, wobei im anterioren Bereich insbesondere das mögliche Vorliegen eines „anterioren Loops“ berücksichtigt werden muss. In allen Fällen einer gesicherten Durchtrennung des N. alveolaris inferior ist die Rekonstruktion des Nervens mittels eines Interponats angezeigt. Der rekonstruierte Nerv wird nach erfolgter Osteoplastik lateral des Knochens positioniert, um einer mechanischen Schädigung vorzubeugen [Schmelzeisen, 2000; Panagopoulos et al., 2019; Eufinger et al., 2021].
Rekonstruktion des N. facialis
Die vorzunehmenden chirurgischen Maßnahmen nach einer Schädigung des N. facialis sind stark abhängig vom Schädigungsmuster sowie von der Zeit, die seit der Schädigung vergangen ist. Wenn eine direkte Koaptation oder die Einlage eines Interponats nicht infrage kommt, empfiehlt sich die End-zu-Seit-Verbindung eines Astes des N. hypoglossus mit dem geschädigten Fazialisast. Mit der sogenannten Hypoglossus-Fazialis-Jump-Anastomose kann bei proximalen Verletzungen des N. facialis verhindert werden, dass die Gesichtsmuskulatur irreversibel atrophiert. Im Rahmen einer sogenannten Cross-Face-Nerve-Graft-Operation besteht darüber hinaus die Möglichkeit eines Anschlusses des geschädigten Nervs der betroffenen Seite an einen der Rr. Temporales oder zygomatici des N. facialis der Gegenseite.
Bei länger zurückliegenden Schädigungen mit bereits eingetretener Atrophie der mimischen Muskulatur kann auch die Rekonstruktion mittels Muskeltransfer, Zügelungsplastik oder der Insertion von Implantaten (zum Beispiel Goldgewichte im Bereich des Augenlids) angezeigt sein [Schmelzeisen, 2000; Vanaclocha-Vanaclocha et al., 2017; Panagopoulos et al., 2019; Eufinger et al., 2021]. Muskeltransfers können durch die Verlagerung lokaler Muskulatur wie zum Beispiel des M. temporalis erfolgen oder durch den Transfer von Muskulatur aus anderen Körperregionen wie der M. gracilis.
Pharmakologische Ansätze
Um die komplexen Vorgänge der Waller-Degeneration und der hiermit verbundenen axonalen Aussprossung in der akuten Phase der Nervenverletzung zu unterstützen, ist die umfangreiche Vermehrung von Schwann-Zellen am Schädigungsort erforderlich. Diese induzieren die Ausbildung der Büngner‘schen Bänder, die Sezernierung von neurotrophen Faktoren und wirken auch unterstützend in den Prozess der Phagozytose ein, der notwendig ist, um anfallenden Zellschutt zu beseitigen.
In zahlreichen aktuellen Studien wurde gezeigt, dass eine Kombination von Vitamin B12 mit weiteren B-Vitaminen (Vitamin B Komplex) eine höhere Expression von neurotrophen Faktoren bewirken kann und die Nukleinsäuresynthese fördert. Die bisherige S3-Leitlinie (2013) spricht lediglich eine offene Empfehlung für die Verabreichung von Vitamin B aus, da ein durchschlagender klinischer Effekt beim Menschen bisher nicht gezeigt werden konnte [Schwerdtfeger et al., 2013]. Die Verabreichung von Vitamin B Komplex kann bei einem günstigen Risiko-Nutzen-Verhältnis jedoch in den ersten Wochen nach Ereignis erwogen werden [Goyal, 2015; Baltrusch, 2021].
Bei der Verwendung von Allografts zur Nervenrekonstruktion sind mögliche Abstoßungsreaktionen zu berücksichtigen. Wie in anderen Gebieten der Transplantationsmedizin ist deshalb der Einsatz von immunmodulierenden Medikamenten wie zum Beispiel Tacrolimus, Methylprednisolon oder Cyclosporin A angezeigt. Neben der Abschwächung von Immunreaktionen ist die Einnahme dieser Substanzen mit einer verringerten Narbenbildung vergesellschaftet, wodurch die mechanische Beanspruchung der mikrochirurgischen Nervenanastomose durch Narbenzüge verringert werden kann [Bavetta et al., 1999; Yan et al., 2013].
Zum heutigen Zeitpunkt gibt es keine zugelassenen Medikamente, die eine effektive Beschleunigung der Nervenregeneration erzeugen können.
Stammzelltherapie
Aufgrund der limitierten Geschwindigkeit der Nervenregeneration (1 bis 2 mm pro Tag) und den hieraus resultierenden Einschränkungen bei der neuromikrochirurgischen Nervenregeneration zielen Ansätze aus der Stammzelltherapie auf die Beschleunigung dieses Prozesses ab. Ausgehend von der wichtigen Rolle der Schwann-Zellen während des Regenerationsprozesses wurde die Fähigkeit von Stammzellen entdeckt, in Schwann-Zell-ähnliche Ausprägungen (engl. Schwann-cell-like Cells) zu differenzieren [Mosahebi et al., 2002].
Um ethischen Bedenken bei der Verwendung embryonaler Stammzellen und invasiven Entnahmemethoden bei der Entnahme von Knochenmark-Stammzellen zu entgehen, wurden Tissue-Engineering-Verfahren entwickelt, mit denen multipotente adipöse mesenchymale Stammzellen in „Schwann-cell-like“-Zellen differenziert werden. Diese können die Nervenregeneration durch die Bildung neurotropher Faktoren beschleunigen. Obwohl eine entsprechende medizinische Anwendung aktuell noch nicht zum klinischen Alltag gehört, sind die Ergebnisse der Stammzellforschung vielversprechend [Tremp und Kalbermatten, 2019; Yi et al., 2020].
Zusammenfassung
Nervenverletzungen treten häufig bei Verunfallten oder infolge von chirurgischen Eingriffen auf und können eine gravierende Symptomatik mit hohem Rehabilitationsaufwand verursachen. Druck- und Quetschlähmungen von Nerven gehen häufig mit dem Erhalt der Nervenhüllstrukturen einher und können daher überwiegend konservativ behandelt werden. Persistierende neurologische Defizite und ausgedehntere Nervenverletzungen mit einer Beschädigung des Epi- oder Perineuriums sollten einer mikrochirurgischen Rekonstruktion unterzogen werden.
Abhängig vom Schädigungsmuster gehört hierzu nicht nur die alleinige Wiederherstellung anatomischer Verhältnisse durch eine direkte Naht, sondern auch der Einsatz von Interponaten oder Nerventransfers. Die Zeit von der Verletzung bis zur Intervention ist entscheidend für die Reinnervation und sollte vier bis sechs Monate nicht übersteigen.
Die Verwendung autologer Transplantate ist stets der Verwendung von allo- oder xenogenen Materialien vorzuziehen. Die Verwendung von biotechnologischen und synthetischen Materialien als mechanische Conduits kann die chirurgische Therapie jedoch sinnvoll ergänzen.
Die aktuellen Forschungsergebnisse bestätigen die neuroprotektive Wirkung von Vitamin B Komplex, so dass die Einnahme in der Akutphase nach der Verletzung erwogen werden kann. Bei der Verwendung von Allografts ist zudem die Einnahme von immunmodulierenden Medikamenten angezeigt. Die kontinuierlich wachsenden Erkenntnisse in der Stammzellforschung sind vielversprechend, weshalb Tissue-Engineering-Methoden in Zukunft zur Unterstützung und Beschleunigung der Nervenregeneration eingesetzt werden könnten.
Literaturliste
Alhassani, A.A. and AlGhamdi, A.S.T. (2010) ‘Inferior Alveolar Nerve Injury in Implant Dentistry: Diagnosis, Causes, Prevention, and Management’, Journal of Oral Implantology, 36(5), pp. 401–407. Available at: doi.org/10.1563/AAID-JOI-D-09-00059.
Baltrusch, S. (2021) ‘The Role of Neurotropic B Vitamins in Nerve Regeneration’, BioMed Research International, 2021, p. 9968228. Available at: doi.org/10.1155/2021/9968228.
Bavetta, S. et al. (1999) ‘The Effects of FK506 on Dorsal Column Axons Following Spinal Cord Injury in Adult Rats: Neuroprotection and Local Regeneration’, Experimental Neurology, 158(2), pp. 382–393. Available at: doi.org/10.1006/exnr.1999.7119.
Bergmeister, K.D. et al. (2020) ‘Acute and long-term costs of 268 peripheral nerve injuries in the upper extremity’, PLoS ONE, 15(4), p. e0229530. Available at: doi.org/10.1371/journal.pone.0229530.
Birch, R. et al. (2012) ‘Nerve injuries sustained during warfare: part I--Epidemiology’, The Journal of Bone and Joint Surgery. British Volume, 94(4), pp. 523–528. Available at: doi.org/10.1302/0301-620X.94B4.28483.
Burnett, M.G. and Zager, E.L. (2004) ‘Pathophysiology of peripheral nerve injury: a brief review’, Neurosurgical Focus, 16(5), pp. 1–7. Available at: doi.org/10.3171/foc.2004.16.5.2.
Cabaud, H.E. et al. (1976) ‘Epineurial and perineurial fascicular nerve repairs: A critical comparison’, The Journal of Hand Surgery, 1(2), pp. 131–137. Available at: doi.org/10.1016/S0363-5023(76)80006-8.
Clé-Ovejero, A. et al. (2017) ‘Does 3-dimensional imaging of the third molar reduce the risk of experiencing inferior alveolar nerve injury owing to extraction?: A meta-analysis’, Journal of the American Dental Association (1939), 148(8), pp. 575–583. Available at: doi.org/10.1016/j.adaj.2017.04.001.
Colen, K.L., Choi, M. and Chiu, D.T.W. (2009) ‘Nerve Grafts and Conduits’, Plastic and Reconstructive Surgery, 124(6S), p. e386. Available at: doi.org/10.1097/PRS.0b013e3181bf8430.
Dalle Carbonare, M. et al. (2017) ‘Injury to the inferior alveolar and lingual nerves in successful and failed coronectomies: systematic review’, The British Journal of Oral & Maxillofacial Surgery, 55(9), pp. 892–898. Available at: doi.org/10.1016/j.bjoms.2017.09.006.
Dew, L.A. and Shelton, C. (1996) ‘Iatrogenic Facial Nerve Injury: Prevalence and Predisposing Factors’, Ear, Nose & Throat Journal, 75(11), pp. 724–729. Available at: doi.org/10.1177/014556139607501110.
Duscher, D. and Shiffman, M.A. (2019) Regenerative Medicine and Plastic Surgery: Skin and Soft Tissue, Bone, Cartilage, Muscle, Tendon and Nerves. 1st ed. 2019 Edition. Springer.
Eser, F. et al. (2009) ‘Etiological factors of traumatic peripheral nerve injuries’, Neurology India, 57(4), p. 434. Available at: doi.org/10.4103/0028-3886.55614.
Eufinger, H., Kübler, A. and Schliephake, H. (2021) Mund-, Kiefer- und Gesichtschirurgie : Operationslehre und -atlas. 5th edn. Heidelberg: Springer.
Evans, P.J., Midha, R. and Mackinnon, S.E. (1994) ‘The peripheral nerve allograft: A comprehensive review of regeneration and neuroimmunology’, Progress in Neurobiology, 43(3), pp. 187–233. Available at: doi.org/10.1016/0301-0082(94)90001-9.
Flores, A., Lavernia, C. and Owens, P. (2000) ‘Anatomy and Physiology of Peripheral Nerve Injury and Repair’, The American Journal of Orthopedics [Preprint]. Available at: www.academia.edu/49298007/Anatomy_and_Physiology_of_Peripheral_Nerve_Injury_and_Repair (Accessed: 17 June 2022).
Goyal, V. (2015) ‘Vitamin B12 – A brief overview’, Vitamin B, 2(4), p. 6.
Griffin, J.W. et al. (2013) ‘Peripheral Nerve Repair and Reconstruction’, JBJS, 95(23), pp. 2144–2151. Available at: doi.org/10.2106/JBJS.L.00704.
Grinsell, D. and Keating, C.P. (2014) ‘Peripheral Nerve Reconstruction after Injury: A Review of Clinical and Experimental Therapies’, BioMed Research International, 2014, p. e698256. Available at: doi.org/10.1155/2014/698256.
Haug, R.H. et al. (2009) ‘Evidenced-based decision making: the third molar’, Dental Clinics of North America, 53(1), pp. 77–96, ix. Available at: doi.org/10.1016/j.cden.2008.09.004.
Hausamen, J.-E. (2003) ‘Differentialtherapie nach Läsionen des N. alveolaris inferior und N. lingualis’, zm-online [Preprint], (17). Available at: www.zm-online.de/archiv/2003/17/zahnmedizin/differentialtherapie-nach-laesionen-des-n-alveolaris-inferior-und-n-lingualis/ (Accessed: 28 June 2022).
Hillerup, S. (2007) ‘Iatrogenic injury to oral branches of the trigeminal nerve: records of 449 cases’, Clinical Oral Investigations, 11(2), pp. 133–142. Available at: doi.org/10.1007/s00784-006-0089-5.
Hillerup, S. and Jensen, R. (2006) ‘Nerve injury caused by mandibular block analgesia’, International Journal of Oral and Maxillofacial Surgery, 35(5), pp. 437–443. Available at: doi.org/10.1016/j.ijom.2005.10.004.
Hohman, M.H., Bhama, P.K. and Hadlock, T.A. (2014) ‘Epidemiology of iatrogenic facial nerve injury: A decade of experience’, The Laryngoscope, 124(1), pp. 260–265. Available at: doi.org/10.1002/lary.24117.
Hölzle, F.W. and Wolff, K.D. (2001) ‘Anatomic position of the lingual nerve in the mandibular third molar region with special consideration of an atrophied mandibular crest: an anatomical study’, International Journal of Oral and Maxillofacial Surgery, 30(4), pp. 333–338. Available at: doi.org/10.1054/ijom.2001.0064.
Jessen, K.R. and Mirsky, R. (2019) ‘The Regeneration of Peripheral Nerves Depends on Repair Schwann Cells’, in D. Duscher and M.A. Shiffman (eds) Regenerative Medicine and Plastic Surgery: Skin and Soft Tissue, Bone, Cartilage, Muscle, Tendon and Nerves. Cham: Springer International Publishing, pp. 425–435. Available at: doi.org/10.1007/978-3-030-19962-3_29.
Kouyoumdjian, J.A., Graça, C.R. and Ferreira, V.F.M. (2017) ‘Peripheral nerve injuries: A retrospective survey of 1124 cases’, Neurology India, 65(3), p. 551. Available at: doi.org/10.4103/neuroindia.NI_987_16.
Lee, R.C. and Ping, J. (1990) ‘Calcium antagonists retard extracellular matrix production in connective tissue equivalent’, Journal of Surgical Research, 49(5), pp. 463–466. Available at: doi.org/10.1016/0022-4804(90)90197-A.
Lundborg, G. and Dahlin, L.B. (1996) ‘Anatomy, Function, and Pathophysiology of Peripheral Nerves and Nerve Compression’, Hand Clinics, 12(2), pp. 185–193. Available at: doi.org/10.1016/S0749-0712(21)00303-6.
Millesi, H. (2007) ‘Bridging defects: autologous nerve grafts’, in H. Millesi and R. Schmidhammer (eds) How to Improve the Results of Peripheral Nerve Surgery. Vienna: Springer (Acta Neurochirurgica Supplementum), pp. 37–38. Available at: doi.org/10.1007/978-3-211-72958-8_8.
Mosahebi, A. et al. (2002) ‘Effect of Allogeneic Schwann Cell Transplantation on Peripheral Nerve Regeneration’, Experimental Neurology, 173(2), pp. 213–223. Available at: doi.org/10.1006/exnr.2001.7846.
Nicholson, K.J. et al. (2014) ‘Riluzole effects on behavioral sensitivity and the development of axonal damage and spinal modifications that occur after painful nerve root compression: Laboratory investigation’, Journal of Neurosurgery: Spine, 20(6), pp. 751–762. Available at: doi.org/10.3171/2014.2.SPINE13672.
Panagopoulos, G.N., Megaloikonomos, P.D. and Mavrogenis, A.F. (2019) ‘Current Trends and Future Perspectives for Peripheral Nerve Regeneration’, in D. Duscher and M.A. Shiffman (eds) Regenerative Medicine and Plastic Surgery: Skin and Soft Tissue, Bone, Cartilage, Muscle, Tendon and Nerves. Cham: Springer International Publishing, pp. 411–423. Available at: doi.org/10.1007/978-3-030-19962-3_28.
Pogrel, M.A. and Maghen, A. (2001) ‘The use of autogenous vein grafts for inferior alveolar and lingual nerve reconstruction’, Journal of Oral and Maxillofacial Surgery, 59(9), pp. 985–988. Available at: doi.org/10.1053/joms.2001.25821.
Pogrel, M.A. and Thamby, S. (2000) ‘Permanent nerve involvement resulting from inferior alveolar nerve blocks’, Journal of the American Dental Association (1939), 131(7), pp. 901–907. Available at: doi.org/10.14219/jada.archive.2000.0308.
Razaq, S. et al. (2015) ‘The pattern of peripheral nerve injuries among Pakistani soldiers in the war against terror’, Journal of the College of Physicians and Surgeons--Pakistan: JCPSP, 25(5), pp. 363–366. Available at: doi.org/05.2015/JCPSP.363366.
‘S3-Leitlinie Mundhöhlenkarzinom’ (2021), p. 157.
Sameem, M., Wood, T.J. and Bain, J.R. (2011) ‘A Systematic Review on the Use of Fibrin Glue for Peripheral Nerve Repair’, Plastic and Reconstructive Surgery, 127(6), pp. 2381–2390. Available at: doi.org/10.1097/PRS.0b013e3182131cf5.
Schmelzeisen, R. (2000) ‘Mikronervenchirurgie’, Mund-, Kiefer- und Gesichtschirurgie, 4(1), pp. S331–S342. Available at: doi.org/10.1007/PL00014556.
Schwerdtfeger, K., Assmus, H. and Wuestner, M. (2013) ‘S3 Leitlinie zur Versorgung peripherer Nervenverletzungen’. AWMF. Available at: www.awmf.org/uploads/tx_szleitlinien/005-010l_S3_Versorgung_peripherer_Nervenverletzungen_2013-06-abgelaufen.pdf.
Seddon, H.J. (1943) ‘Three Types of Nerve Injury’, Brain, 66(4), pp. 237–288. Available at: doi.org/10.1093/brain/66.4.237.
Shortland, P.J. et al. (2006) ‘Riluzole promotes cell survival and neurite outgrowth in rat sensory neurones in vitro’, European Journal of Neuroscience, 24(12), pp. 3343–3353. Available at: doi.org/10.1111/j.1460-9568.2006.05218.x.
Strupp, M. et al. (2017) ‘Aminopyridines for the treatment of neurologic disorders’, Neurology: Clinical Practice, 7(1), pp. 65–76. Available at: doi.org/10.1212/CPJ.0000000000000321.
Sunderland, S.S. (1978) Nerves and Nerve injuries. New York, NY: Churchill Livingstone.
Tezcan, A.H. (2017) Peripheral Nerve Injury and Current Treatment Strategies, Peripheral Nerve Regeneration - From Surgery to New Therapeutic Approaches Including Biomaterials and Cell-Based Therapies Development. IntechOpen. Available at: doi.org/10.5772/intechopen.68345.
Torres, R.Y. and Miranda, G.E. (2015) ‘Epidemiology of Traumatic Peripheral Nerve Injuries Evaluated by Electrodiagnostic Studies in a Tertiary Care Hospital Clinic’, Boletin de la Asociacion Medica de Puerto Rico, 107(3), pp. 79–84.
Tremp, M. and Kalbermatten, D.F. (2019) ‘Adipose-Derived Stem Cells (ASCs) for Peripheral Nerve Regeneration’, in D. Duscher and M.A. Shiffman (eds) Regenerative Medicine and Plastic Surgery: Skin and Soft Tissue, Bone, Cartilage, Muscle, Tendon and Nerves. Cham: Springer International Publishing, pp. 437–446. Available at: doi.org/10.1007/978-3-030-19962-3_30.
Tseng, K.-C. et al. (2016) ‘4-Aminopyridine promotes functional recovery and remyelination in acute peripheral nerve injury’, EMBO molecular medicine, 8(12), pp. 1409–1420. Available at: doi.org/10.15252/emmm.201506035.
Vanaclocha-Vanaclocha, V. et al. (2017) Nerve Transfers in the Treatment of Peripheral Nerve Injuries, Peripheral Nerve Regeneration - From Surgery to New Therapeutic Approaches Including Biomaterials and Cell-Based Therapies Development. IntechOpen. Available at: doi.org/10.5772/67948.
Waller, A.V. and Owen, R. (1850) ‘XX. Experiments on the section of the glossopharyngeal and hypoglossal nerves of the frog, and observations of the alterations produced thereby in the structure of their primitive fibres’, Philosophical Transactions of the Royal Society of London, 140, pp. 423–429. Available at: doi.org/10.1098/rstl.1850.0021.
Wang, Q. and Li, Y. (2022) ‘A review: Inferior alveolar nerve injury related to the impacted wisdom tooth’, Oral Surgery, 15(2), pp. 186–189. Available at: doi.org/10.1111/ors.12697.
Wusiman, P. et al. (2020) ‘Epidemiology and Pattern of Oral and Maxillofacial Trauma’, Journal of Craniofacial Surgery, 31(5), p. e517. Available at: doi.org/10.1097/SCS.0000000000006719.
Yan, L. et al. (2013) ‘Immunomodulatory effectiveness of tacrolimus in preventing epidural scar adhesion after laminectomy in rat model’, European Journal of Pharmacology, 699(1), pp. 194–199. Available at: doi.org/10.1016/j.ejphar.2012.11.037.
Yi, S. et al. (2020) ‘Application of stem cells in peripheral nerve regeneration’, Burns & Trauma, 8. Available at: doi.org/10.1093/burnst/tkaa002.
Zaliska, O. et al. (2022) ‘Health impacts of the Russian invasion in Ukraine: need for global health action’, The Lancet, 399(10334), pp. 1450–1452. Available at: doi.org/10.1016/S0140-6736(22)00615-8.










