Trockenes Auge, trockener Mund – das Sjögren-Syndrom
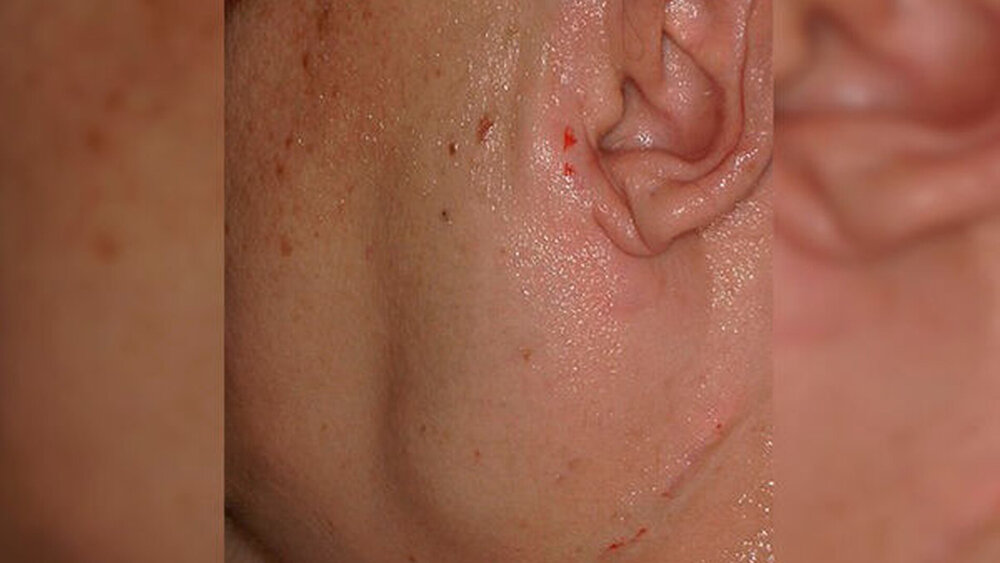
Eine 36-jährige Patientin stellte sich mit einer ausgeprägten druckdolenten Schwellung präaurikulär links in der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz vor. In der klinischen Untersuchung zeigte sich eine einseitige, deutliche Schwellung der linken Präaurikularregion mit Anzeichen für eine Infektion (Abbildung 1). Die orientierende neurologische Untersuchung ergab keinen Hinweis auf eine Beeinträchtigung der Motorik oder der Sensibilität im Versorgungsgebiet der Nn. facialis und trigeminus. Der Zahnstatus der Patientin wies keinen Fokuszahn auf; die Mundschleimhaut war unauffällig. Die Patientin berichtete von einem vorbekannten Sjögren-Syndrom, jedoch ohne Okklusionssymptomatik innerhalb der vergangenen Tage. Schwellungen seien in diesem Gebiet rezidivierend aufgetreten, jedoch nie derart ausgeprägt gewesen.
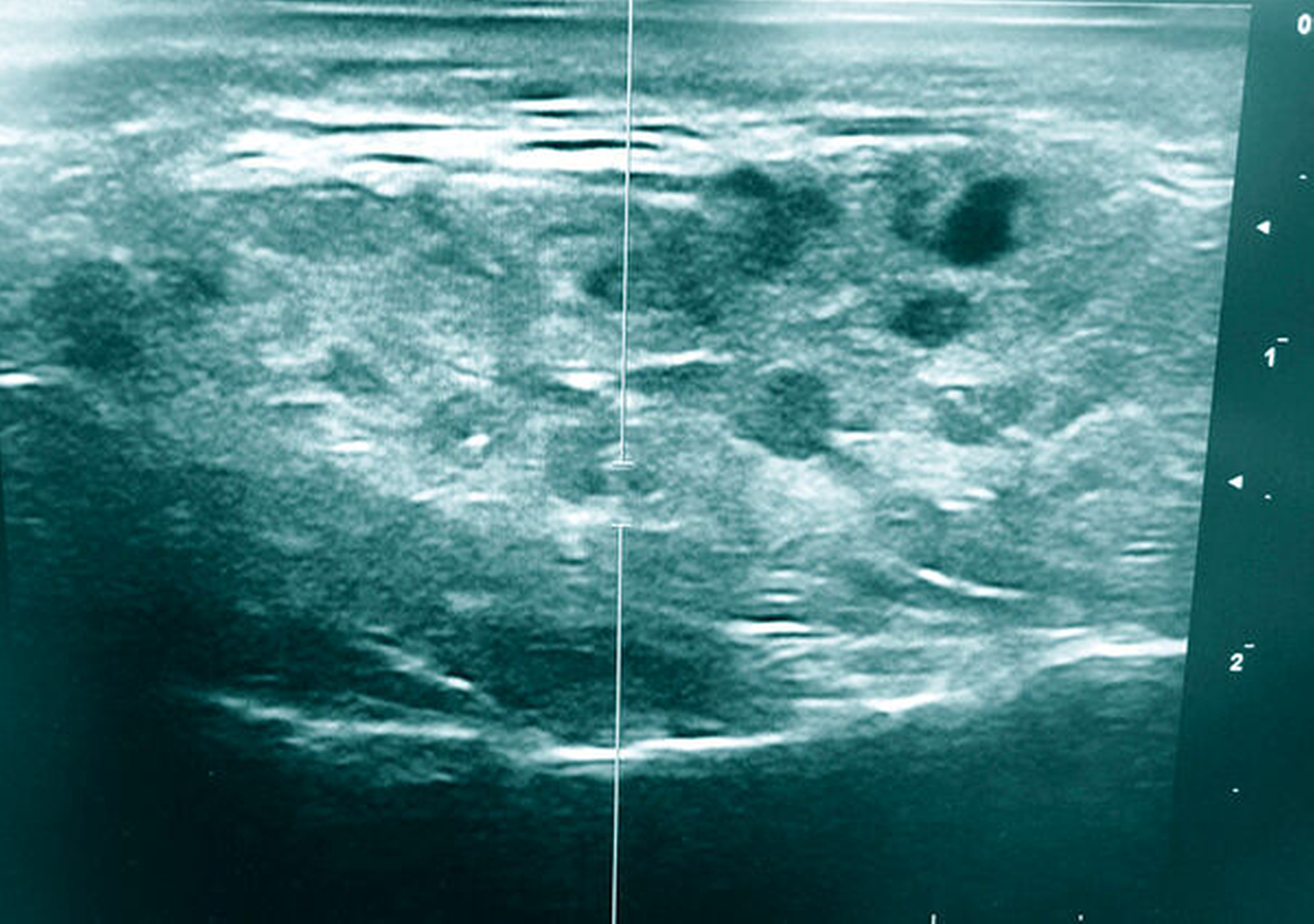
In Anbetracht der allgemeinen und der speziellen Anamnese der Patientin ergab sich die Verdachtsdiagnose einer Sialadenitis. Klinisch konnte bei Massage der Drüse zwar keine putride Sekretion aus dem Ductus parotideus provoziert, der Gang jedoch auch nicht tiefer als 1 cm sondiert werden. Unter Sondierung lösten sich kleinere Konkremente unter Abgang geringer Mengen Pus aus dem Gang. Bei Verdacht auf das Vorliegen einer Sialadenitis auf dem Boden einer Sialolithiasis wurde zur weiterführenden Diagnostik eine Sonografie durchgeführt (Abbildung 2). Darin zeigte sich Drüsengewebe mit heterogener Echotextur und intraparenchymal gelegenen, runden bis ovalen hypoechogenen Bereichen im Sinne fokaler Dilatationen intraparotidaler Gänge. Ein Abszess oder Sialolith waren sonografisch nicht nachweisbar.
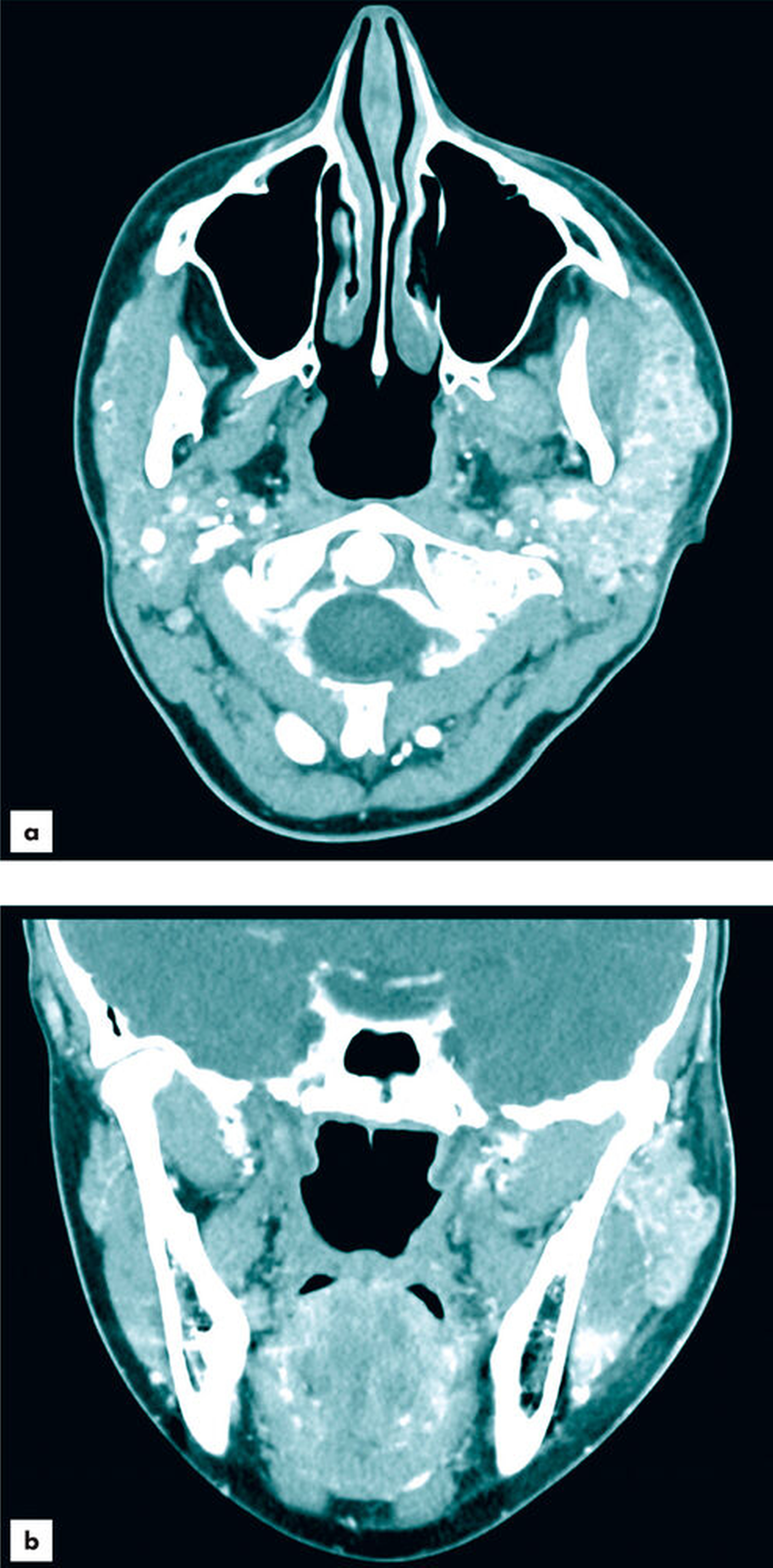
Weiterführend wurde zur genaueren Beurteilung des Befunds und zur Identifizierung eines potenziell vorliegenden obstruierenden Sialoliths eine Computertomografie mit Kontrastmittel veranlasst (Abbildung 3). Darin zeigte sich die linke Glandula parotidea mit differenzialdiagnostisch im Rahmen einer Sklerodermie vergrößertem, kleinzystischem Drüsengewebe diffus entzündlich verändert. Kleinere kalkdichte Konkremente waren erkennbar, jedoch kein größerer, okkludierender Sialolith. Der Stenon-Gang zeigte keinen Aufstau, eine Abszessformation war ebenfalls nicht erkennbar.
Die Patientin wurde zur intravenösen antibiotischen und abschwellenden Therapie stationär aufgenommen und konnte in deutlich gebessertem Allgemeinzustand nach einem dreitägigen stationären Aufenthalt wieder in die ambulante Betreuung entlassen werden. Nach dem vollständigen Abklingen der Entzündung wird eine Magnetresonanztomografie zur Darstellung der Drüsenstruktur ohne inflammationsbedingte Veränderung angestrebt. Hiernach soll – bei schon in der Vorgeschichte rezidivierenden Parotitiden – eine partielle Entfernung des sklerotisch veränderten Drüsengewebes zur Prophylaxe zukünftiger Ereignisse eruiert werden.
Diskussion
Beim Sjögren-Syndrom handelt es sich um eine chronisch-entzündliche Autoimmunerkrankung unklarer Genese. Sie äußert sich durch einen zunehmenden Umbau insbesondere der Tränen- und Speicheldrüsen mit der typischen klinischen Leittrias aus Xerostomie, Xerophthalmie und Arthritis [Herold, 2018]. Bei 30 bis 50 Prozent der betroffenen Patienten treten zusätzlich extraglanduläre Organmanifestationen auf: Darunter fallen die nicht-erosive Polyarthritis (50 Prozent), Neuropathien, Hautmanifestationen (entstehend durch eine Vaskulitis der kleinen Gefäße), interstitielle Lungenerkrankungen oder tubulointerstitielle Nephropathien [Witte, 2019].
Die epidemiologischen Daten in Bezug auf das Sjögren-Syndrom sind aufgrund der unterschiedlichen Studiendesigns und Klassifikationskriterien relativ heterogen. Ausgegangen wird von einer Gesamtprävalenz der deutschen erwachsenen Bevölkerung von mindestens 0,4 Prozent [Westhoff und Zink, 2010]. Für das seltenere primäre Sjögren-Syndrom wurde eine weltweite Prävalenz von 61 auf 100.000 Einwohner ermittelt, wobei die Zahlen in Europa am höchsten sind. Das mittlere Alter bei Diagnosestellung beträgt 56 Jahre. Frauen erkranken durchschnittlich zehnmal häufiger als Männer [Qinet al., 2015].
Die Krankheit kann entweder als primäres Sjögren-Syndrom selektiv exokrine Drüsen betreffen oder als sekundäres Sjögren-Syndrom mit Assoziation zu anderen chronischen Erkrankungen auftreten [Suttorpet al., 2016]. Letzteres wird häufig mit Systemerkrankungen wie dem systemischem Lupus erythematodes (SLE), rheumatoider Arthritis oder systemischer Sklerodermie assoziiert [Tomiak und Dörner, 2006]. Dabei kann sich die zugrunde liegende Erkrankung auch primär durch eine Sicca-Symptomatik (trockenes Auge, trockener Mund aufgrund einer Benetzungsstörung) äußern und sich erst später mit einer zunehmenden Progredienz demaskieren. Ein nicht therapierter SLE kann schwerwiegende Organmanifestationen zur Folge haben. Dabei reichen die Pathologien von kognitiven Veränderungen und Psychosen bis hin zu einer Pleuritis, einer Perikarditis oder einer Lupusnephritis, die die Gefahr eines terminalen Nierenversagens birgt. Gerade in Anbetracht solcher Verläufe wird deutlich, weshalb es nicht selten zu einer verzögerten Diagnosestellung autoimmuner Erkrankungen kommt und die korrekte Einordnung der Pathologie durch den Zahnarzt für den Patienten von zentraler Bedeutung ist.
Zu Beginn der Erkrankung kommt es zu einer Entzündung der glandulären Epithelzellen. Dabei werden durch deren Apoptose Autoantigene, wie die nachweisbaren Kernproteine SS-A [Ro] und SS-B [La], freigesetzt. Daraufhin kommt es zur Einwanderung dendritischer Zellen sowie von B- und T-Lymphozyten, die dort ein Keimzentrum bilden. Die Immunzellen werden durch freigesetzte Zytokine wie Interferone, Interleukin-12 und BAFF (B-Zell aktivierender Faktor) stimuliert. In den gebildeten Keimzentren reifen schließlich Plasmazellen aus. Diese produzieren Antikörper gegen muskarinerge Acetylcholinrezeptoren, die durch nervale Stimulation der Drüse zu deren Blockierung und somit zur Minderfunktion des Drüsengewebes führen, obwohl anfangs histologisch fast keine Auffälligkeiten erkennbar sind [Witte, 2019].
Die initiale Symptomatik der Patienten kann jedoch von der typischen klinischen Symptomtrias abweichen. Zur besseren Übersicht lassen sich glanduläre von extraglandulären Manifestationen unterscheiden. Zu den Erstgenannten zählen besonders Xerostomie und Xerophthalmie. Betroffen können aber auch andere exokrine Drüsen des Aerodigestivtrakts sein. Insbesondere bei Patienten mit primärem Sjögren-Syndrom tritt in 34 Prozent der Fälle eine beidseitige Schwellung der Parotis auf. Arthralgien oder eine nicht-erosive Polyarthritis sind mit 50 Prozent die häufigsten extraglandulären Manifestationen [Ramos-Casals et al., 2014].
In 40 Prozent der Fälle findet sich ein sekundäres Raynaud-Syndrom (Gefäßerkrankung, die durch vorübergehende Gefäßspasmen hervorgerufen wird) als Begleiterkrankung in der Frühphase; dieses kann einer Sicca-Symptomatik um mehrere Jahre vorausgehen und stellt somit ein wichtiges Frühdiagnosekriterium dar. Pulmonale Begleiterscheinungen können in Form der pathognomonischen lymphozytären interstitiellen Pneumonie zutage treten. Eine Vaskulitis der kleinen und der mittleren Gefäße ist ebenso typisch [Ramos-Casals et al., 2014]. Renal sind tubulointerstitielle Veränderungen zu beobachten – hier ist auf eine reduzierte Elimination nierengängiger Medikamente und die Anpassung von nephrotoxischen Therapeutika zu achten [Evans et al., 2015]. Im späten Krankheitsverlauf werden insbesondere die sensorische Neuropathie und die Beeinträchtigung des zentralen Nervensystems klinisch relevant [Pavlakis et al., 2012]. Die dabei auftretenden multifokalen Läsionen können differenzialdiagnostisch schwer von einer multiplen Sklerose zu unterscheiden sein und mit der Entwicklung einer Depression oder mit Gedächtnisstörungen einhergehen [Margaretten, 2017]. Besonders schwer fällt die Einordnung unspezifischer Symptome wie Fatigue, Antriebslosigkeit oder diffuser Schmerzen.
Diagnostik
In der Diagnostik steht die Objektivierung der eingeschränkten Sekretproduktion im Vordergrund, auch wenn primär keine Sicca-Symptomatik vorliegt. Um einen klinischen Nachweis der reduzierten Flussrate der Speicheldrüse zu ermöglichen, stehen quantitative Messverfahren zur Verfügung. Der eher historisch zu sehende Saxon-Test dient der Messung der Speichelsekretion durch Abwiegen eines im Mund verbliebenen Wattebauschs. Die Sialometrie (unstimulierter Gesamtspeichel-Test) ist eine einfache Alternative, bei der 15 Minuten lang der Speichel gesammelt und anschließend die Menge des Speichels gemessen wird. Aufgrund des Aufwands und der geringen Aussagekraft spielen Szintigrafie und Sialografie im klinischen Alltag keine Rolle mehr [Aeby und Distler, 2017].
Zur Objektivierung der Tränenproduktion stehen verschiedene Testverfahren zu Verfügung. Beim Schirmer-Test handelt es sich um das wohl bekannteste Testverfahren. Die Kriterien zur Diagnose des Sjögren-Syndroms sind in der Tabelle zusammengefasst.
Die Sonografie der betroffenen Speicheldrüsen spielt in Anbetracht der fehlenden Strahlenbelastung, der guten Zugänglichkeit der Untersuchungsregion, der breiten Verfügbarkeit und der geringen Kosten eine wichtige Rolle in der Diagnostik des Sjögren-Syndroms. Das oben dargestellte sonografische Bild ist charakteristisch für das sklerodermatisch veränderte, inhomogene Drüsenparenchym. Ebenfalls kann eine Sonografie bei der Abgrenzung des primären Sjögren-Syndroms von anderen Erkrankungen wie einer IgG4-assoziierten Erkrankung oder einer undifferenzierten Kollagenose behilflich sein [Ferro et al., 2016].
Laborchemisch sind ein erhöhter Titer für Antinukleäre Antikörper (ANA), der Nachweis von Rheumafaktoren, eine polyklonale Hypergammaglobulinämie als Zeichen einer erhöhten B-Zell-Aktivität sowie ein erhöhter SS-A-Titer diagnostisch relevant. Antikörper gegen SS-A kommen bei der Hälfte der Patienten mit primärem Sjögren-Syndrom, jedoch auch bei 50 Prozent der SLE-Patienten vor. Daher wird den SS-A-Antikörpern eine hohe Wertigkeit in den neuen Klassifikationskriterien eingeräumt, sie reichen aber nicht aus, um eine Diagnose alleinig zu sichern. SS-B-Antikörper sind spezifischer, treten jedoch nur bei 25 bis 30 Prozent der Fälle und häufig mit SS-A-Antikörpern zusammen auf [Shiboski et al., 2017].
Bei einem klinischen Verdacht, aber negativen Autoantikörpern, sollte eine Lippenspeicheldrüsenbiopsie der Unterlippe (alternativ der Glandula parotis) in Betracht gezogen werden. Histologisch zeigen sich in einem positiven Befund entzündlich veränderte Speicheldrüsenanteile mit fokaler lymphozytärer Infiltration (fokale lymphozytäre Sialadenitis). Die Infiltrate bestehen bei milden, kleineren Läsionen aus CD4-positiven T-Zellen, bei fortgeschrittenen oder schweren Läsionen vorwiegend aus B-Zellen [Carubbi et al., 2014]. Eine unspezifische, nicht fokale Sialadenitis ist auch in der Normalbevölkerung, besonders bei älteren Menschen, häufig zu beobachten.
Bei Patienten mit einem primären Sjögren-Syndrom ist differenzialdiagnostisch die Abgrenzung eines malignen Non-Hodgkin-Lymphoms der B-Zell-Reihe zu beachten. Bei fünf Prozent der Betroffenen können Lymphome im Rahmen einer malignen Transformation auftreten. Als signifikante Prädiktoren dafür gelten eine chronische Schwellung der Parotis, ein verminderter C4-Komplementspiegel, Purpura, Kryoglobulinämie, Lymphadenopathie sowie der ektope Nachweis von Keimzentren in Biopsien der Speicheldrüsen. Als hierfür ursächlich erachtet werden dabei die Freisetzung von Speicheldrüsenepithelzellen, eine abweichende Zielführung autoreaktiver B- und T-Zellen, die Aktivierung von Epithelzellen durch Zytokine, ebenso die Nekrose und die Freisetzung von Autoantigenen. Besonders die im Rahmen des Sjögren-Syndroms stimulierte Freisetzung von BAFF soll bei der veränderten Differenzierung von B-Zellen und damit ursächlich zur Entwicklung eines Lymphoms beitragen [Nishishinya et al., 2015].
In Anbetracht des heterogenen Symptomkomplexes ergeben sich für das Sjögren-Syndrom eine Vielzahl von weiteren relevanten Differenzialdiagnosen. Eine Xerostomie oder Xerophthalmie kann in Form unerwünschter Arzneimittelwirkungen auch im Rahmen der Polymedikation (Beta-Blocker, Diuretika, Antidepressiva oder Antihistaminika) oder der physiologischen Drüsenatrophie im Alter auftreten. Chronisch-entzündliche Erkrankungen wie Sarkoidose oder IgG4-assoziierte Erkrankungen können ebenso wie Mumps, HCV- oder HIV-Infektionen und Tuberkulose ursächlich für eine lymphozytäre Sialadenitis sein und damit zu einer bilateralen Schwellung der Speicheldrüsen führen. Ein vorrangig extraglandulär manifestiertes Sjögren-Syndrom ist differenzialdiagnostisch schwer gegenüber systemischen Krankheitsbildern abzugrenzen, da Arthritis, Polyneuropathie oder eine Vaskulitis bei fast allen chronisch entzündlichen Erkrankungen auftreten können.
Therapie
Eine ursächliche Therapie des primären Sjögren-Syndroms ist nicht möglich. Die Behandlung erfolgt patientenindividuell und lediglich symptomatisch. Dabei steht vor allem die Verbesserung der Lebensqualität durch Behandlung der Sicca- und der Fatigue-Symptomatik im Vordergrund. Verschiedene Tränenersatzmittel in Form von Augentropfen können zur Behandlung der Xerophthalmie verwendet werden [Stefanski et al., 2017]. Die Xerostomie und die Stomatitis sicca stellen für Zahnärzte ein besonderes Problem dar, da sich die komplexen Funktionen des Speichels therapeutisch nicht optimal kompensieren lassen. Das führt zu einer erhöhten Kariesprävalenz sowie zu vermehrt auftretenden Infektionen mit Candida albicans. Darüber hinaus entwickeln Patienten Probleme bei der Nahrungsaufnahme und berichten von Schwierigkeiten bei längerem Sprechen. Nicht zuletzt ist auch die Toleranz der Schleimhaut gegenüber herausnehmbarem Zahnersatz deutlich herabgesetzt.
Die Therapie der Xerostomie umfasst Maßnahmen zur Steigerung des Speichelflusses wie Kauen von Kaugummis, die regelmäßige Zufuhr von Flüssigkeit und nicht zuletzt auch die Gabe von Sialogoga wie Pilocarpin oder Cevimelin. Des Weiteren sollten zur Kariesprophylaxe topische Fluoride Anwendung finden. Bei einem sekundären Sjögren-Syndrom richtet sich die Behandlungsindikation nach der Grunderkrankung. Aufgrund der hohen Komplexität sollte die Therapie in einem interdisziplinären Team erfolgen [Manfrè et al., 2020].
Besteht eine chronische Schwellung der Speicheldrüsen, kann die Entfernung des betroffenen Drüsengewebes als eine Therapieoption diskutiert werden. Mögliche Indikationen für diesen Eingriff sind kosmetische Gründe, chronische Schmerzen oder der Verdacht auf das Vorliegen eines Non-Hodgkin-Lymphoms. Aufgrund der engen Lagebeziehung zum Plexus intraparotideus des Nervus facialis birgt dieser Eingriff jedoch die Gefahr der Facialisparese, daher sollte eine chirurgische Intervention sorgfältig erwogen und geplant werden [E. Stennert, 2001].
Die Lebenserwartung von Patienten mit einem sekundären Sjögren-Syndrom hängt im Wesentlichen von der auslösenden Grunderkrankung ab, während Patienten mit einem primären Sjögren-Syndrom eine Lebenszeitprognose vergleichbar mit der der Normalbevölkerung aufweisen. In der zahnärztlichen Praxis sollte vor allem auf eine ausführliche Beratung des Patienten im Hinblick auf kariespräventive Maßnahmen – überdurchschnittliche Mundhygiene, regelmäßige Fluoridierung, Nikotinkarenz und die additive Nutzung von Sialogoga – Wert gelegt werden.
Fazit für die Praxis
Nicht selten kommt es beim Sjögren-Syndrom durch die Leitsymptomatik der Xerostomie zur Erstvorstellung des Patienten beim Hauszahnarzt. Gründe sind meist Folgeerscheinungen durch den verminderten Speichelfluss wie eine vermehrte Kariesanfälligkeit oder lokale Infektionen der Mundhöhle.
Eine länger als drei Monate anhaltende Trockenheit des Mundes und der Augen sollten nach Ausschluss anderer Ursachen an ein Sjögren-Syndrom denken lassen.
0,4 Prozent der Deutschen sind vom Sjögren-Syndrom betroffen; die Prävalenz liegt bei Frauen viel höher als bei Männern.
Die Symptome können vielschichtig sein: Neben der typischen Leittrias aus Xerostomie, Xerophthalmie und Arthralgie sind auch Fatigue, Lungen- und Nierenschäden sowie periphere Neuropathien typische Anzeichen.
Beim Verdacht auf Sjögren-Syndrom ist eine Überweisung zu einem Rheumatologen indiziert, um eventuelle systemische Grunderkrankungen frühzeitig zu diagnostizieren.
Die Therapie erfolgt nur symptomatisch, ist jedoch essenziell für den Erhalt der Lebensqualität der Patienten.
Literaturliste
Aeby M, M., B, Distler O: Das primäre Sjögren-Syndrom – eine Systemerkrankung: Teil 1. Schweiz Med Forum 2017;17(47):1027-1038.
Carubbi, F., et al. (2014). „Is minor salivary gland biopsy more than a diagnostic tool in primary Sjögren׳s syndrome? Association between clinical, histopathological, and molecular features: a retrospective study.“ Semin Arthritis Rheum 44(3): 314-324.
E. Stennert, M. J. (2001). „Chirurgie der Glandula parotis einschließlich rekonstruktiver Fazialis-Chirurgie: Standard undQualitätssicherung.“ Laryngo-Rhino-Otologie(80): 156-197.
Evans, R., et al. (2015). „Renal involvement in primary Sjögren's syndrome.“ Rheumatology (Oxford) 54(9): 1541-1548.
Ferro, F., et al. (2016). „One year in review 2016: Sjögren's syndrome.“ Clin Exp Rheumatol 34(2): 161-171.
Herold, G. (2018). Innere Medizin. Köln, Herold, Gerd.
Manfrè, V., et al. (2020). „One year in review 2020: comorbidities, diagnosis and treatment of primary Sjögren's syndrome.“ Clin Exp Rheumatol 38 Suppl 126(4): 10-22.
Margaretten, M. (2017). „Neurologic Manifestations of Primary Sjögren Syndrome.“ Rheum Dis Clin North Am 43(4): 519-529.
Nishishinya, M. B., et al. (2015). „Identification of lymphoma predictors in patients with primary Sjögren's syndrome: a systematic literature review and meta-analysis.“ Rheumatol Int 35(1): 17-26.
Pavlakis, P. P., et al. (2012). „Peripheral neuropathies in Sjögren's syndrome: a critical update on clinical features and pathogenetic mechanisms.“ J Autoimmun 39(1-2): 27-33.
Qin, B., et al. (2015). „Epidemiology of primary Sjögren's syndrome: a systematic review and meta-analysis.“ Ann Rheum Dis 74(11): 1983-1989.
Ramos-Casals, M., et al. (2014). „Systemic involvement in primary Sjogren's syndrome evaluated by the EULAR-SS disease activity index: analysis of 921 Spanish patients (GEAS-SS Registry).“ Rheumatology (Oxford) 53(2): 321-331.
Shiboski, C. H., et al. (2017). „2016 American College of Rheumatology/European League Against Rheumatism Classification Criteria for Primary Sjögren's Syndrome: A Consensus and Data-Driven Methodology Involving Three International Patient Cohorts.“ Arthritis Rheumatol 69(1): 35-45.
Stefanski, A. L., et al. (2017). „The Diagnosis and Treatment of Sjögren's Syndrome.“ Dtsch Arztebl Int 114(20): 354-361.
Suttorp, N., et al. (2016). Harrisons Innere Medizin, ABW Wissenschaftsverlagsgesellschaft.
Tomiak, C. and T. Dörner (2006). „[Sjögren's syndrome. Current aspects from a rheumatological point of view].“ Z Rheumatol 65(6): 505-517; quiz 518-509.
Westhoff, G. and A. Zink (2010). „[Epidemiology of primary Sjörgren's syndrome].“ Z Rheumatol 69(1): 41-49.
Witte, T. (2019). „[Sjögren's syndrome].“ Z Rheumatol 78(6): 511-517.