Zahnerhalt versus Extraktion und Implantation bei Parodontitispatienten
In der Parodontologie stehen gute und Erfolg versprechende Therapiekonzepte zur Verfügung, die in vielen Fällen den Erhalt von primär kritisch eingestuften Zähnen auch über einen längeren Zeitraum möglich machen. Implantate sind bei ausreichendem Knochenangebot eine gute Behandlungsoption für den Ersatz fehlender Zähne, zeigen aber bei Parodontitispatienten im Gegensatz zu parodontal Gesunden ein häufigeres Auftreten von Periimplantitis. Nach wie vor gibt es für die Periimplantitis kein entsprechendes Therapieregime, das das Wiederauftreten periimplantärer Erkrankungen dauerhaft und voraussagbar einheitlich verhindern kann [Ramanauskaite, 2021].
Zahnerhalt mittels Parodontitistherapie
Können wir Zähne vorhersagbar länger erhalten?
Eine bestehende Parodontitis kann gut und vorhersagbar behandelt werden. Je nach Schweregrad und Defektmorphologie stehen verschiedene Therapiemöglichkeiten zur Verfügung. Parodontal erkrankte Patienten sollten nach einem stufenweise aufeinander aufbauenden Therapiekonzept behandelt werden [DG PARO, 2021]. In der ersten Therapiestufe werden Patienten motiviert und unterstützt, Risikofaktoren (wie Rauchen, unkontrollierter Diabetes mellitus, Plaqueakkumulation) zu beeinflussen. In der zweiten Therapiestufe erfolgt die subgingivale Instrumentierung aller behandlungsbedürftigen Parodontien (≥ 4 mm Sondierungstiefe). Diese Maßnahme stellt ein wirksames Mittel zur Entzündungskontrolle dar. Nach der Ausheilung der parodontalen Gewebe schließt sich eine Reevaluation an, um das Behandlungsergebnis zu beurteilen. Bei vielen Patienten führt diese nicht-chirurgische Therapieform bereits zu einem erfolgreichen Ergebnis und zum Erreichen von gewünschten Endpunkten (Taschensondierungstiefe ≤ 4 mm ohne Bluten auf Sondieren). Bei flachen Taschen (4 bis 6 mm) kann mit einer Reduktion der Taschensondierungstiefe von 1,4 mm nach sechs bis acht Monaten gerechnet werden, tiefere Taschen (> 6 mm) zeigen eine größere mittlere Reduktion der Taschensondierungstiefe von 2,6 mm und der mittlere Anteil an geschlossenen Taschen liegt nach dieser Therapieform bei 74 Prozent [Suvan et al., 2020]. Das Bluten auf Sondieren reduziert sich durchschnittlich um 63 Prozent. Liegen noch Resttaschen von 4 mm mit Blutung und ≥ 5 mm vor, wird eine Reinstrumentierung vorgenommen. Die adjuvante Anwendung bestimmter systemischer Antibiotika kann für bestimmte Risikogruppen (zum Beispiel generalisierte Parodontitis Stadium III oder IV bei jungen Erwachsenen) erwogen werden. Insbesondere die Kombination aus Amoxicillin und Metronidazol kann das Resultat der subgingivalen Instrumentierung verbessern [Teughels et al., 2020].
Bereiche, die nicht adäquat auf die zweite Therapiestufe angesprochen haben, werden in einer dritten Therapiestufe (Chirurgische Parodontitistherapie) behandelt. Hierzu zählen Bereiche, die der subgingivalen Reinigung häufig nicht ausreichend zugänglich sind, wie tiefe parodontale Taschen (≥ 6 mm), Knochentaschen und Furkationsdefekte [Sanz-Sanchez et al., 2020]. Das Ziel ist es, den Zugang zu diesen Bereichen zu erhalten, um sie adäquat zu reinigen und sie je nach Indikation zu regenerieren oder auch resektiv zu behandeln. Von großer Wichtigkeit ist es, Patienten nach Abschluss der Therapiestufen I bis III und nach Erreichen der Endpunkte in die unterstützende Parodontitistherapie (UPT/„Recall“) aufzunehmen. Deren Frequenz wird individuell an das Risikoprofil und den parodontalen Status der Patienten angepasst [Trombelli et al., 2015].
Ist Zahnerhalt auch bei prognostisch ungünstigen Zähnen möglich?
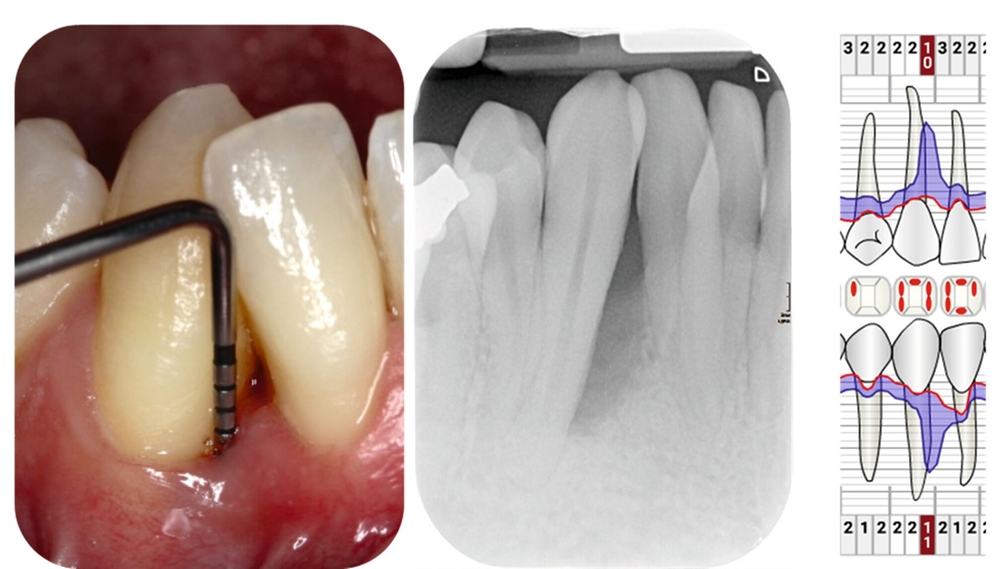
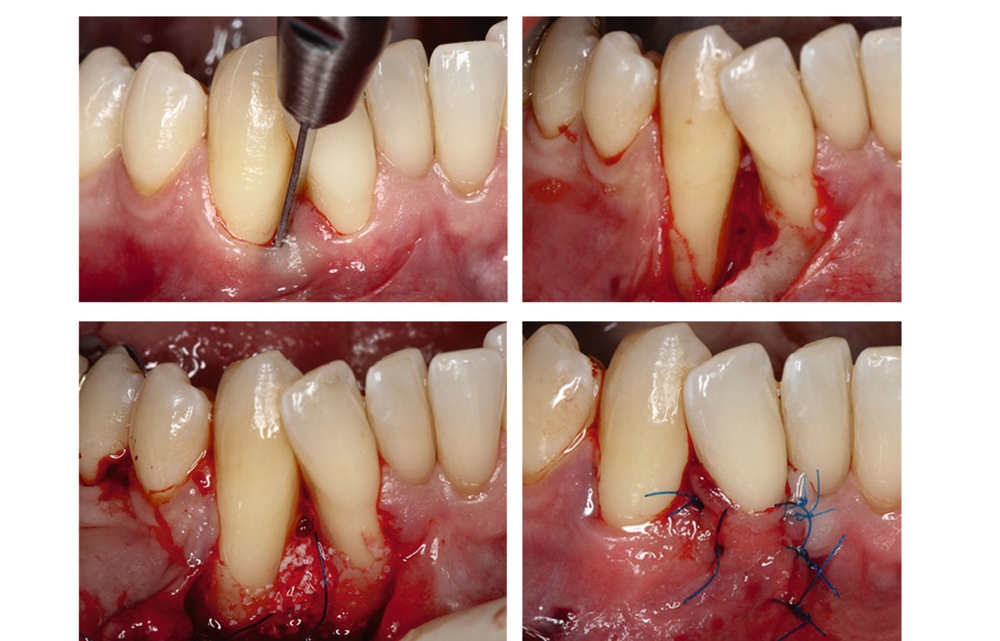
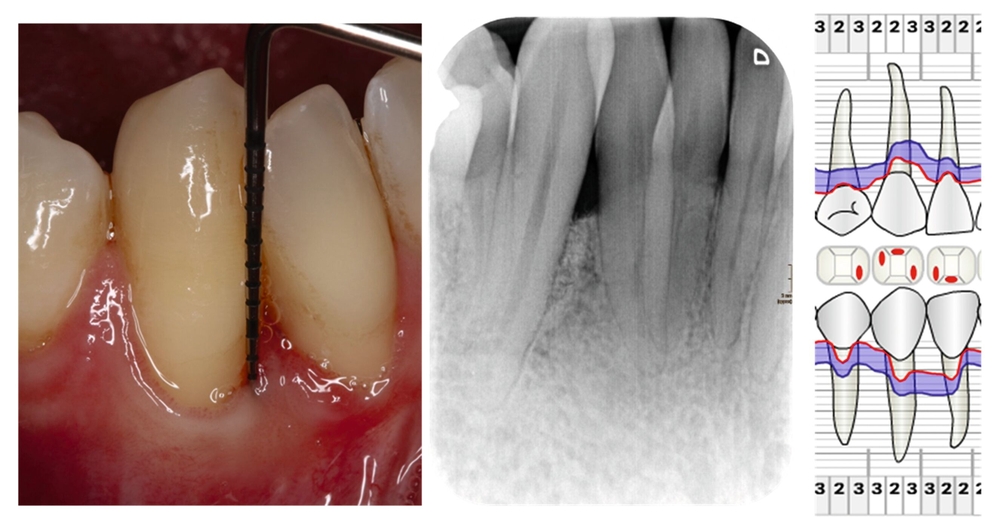
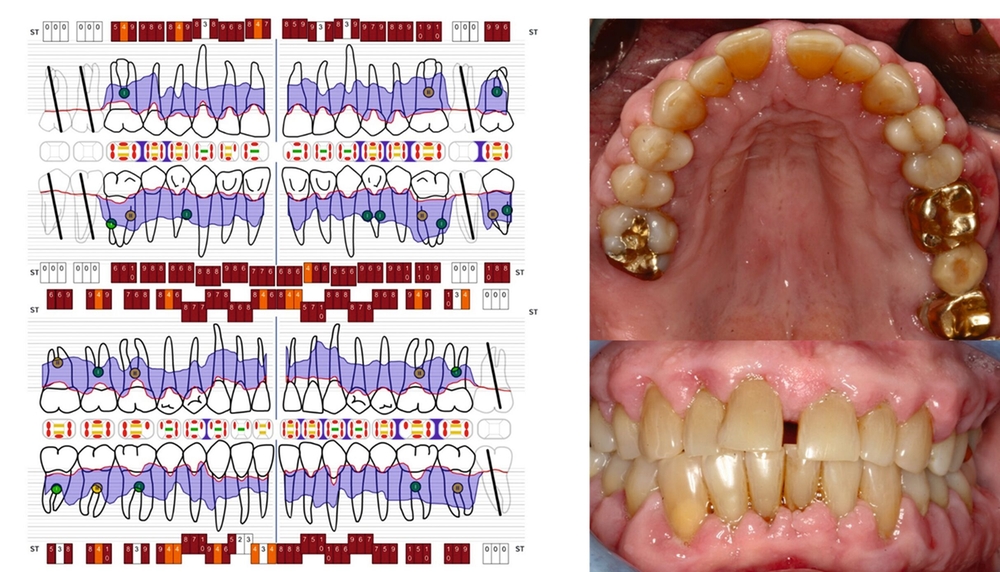
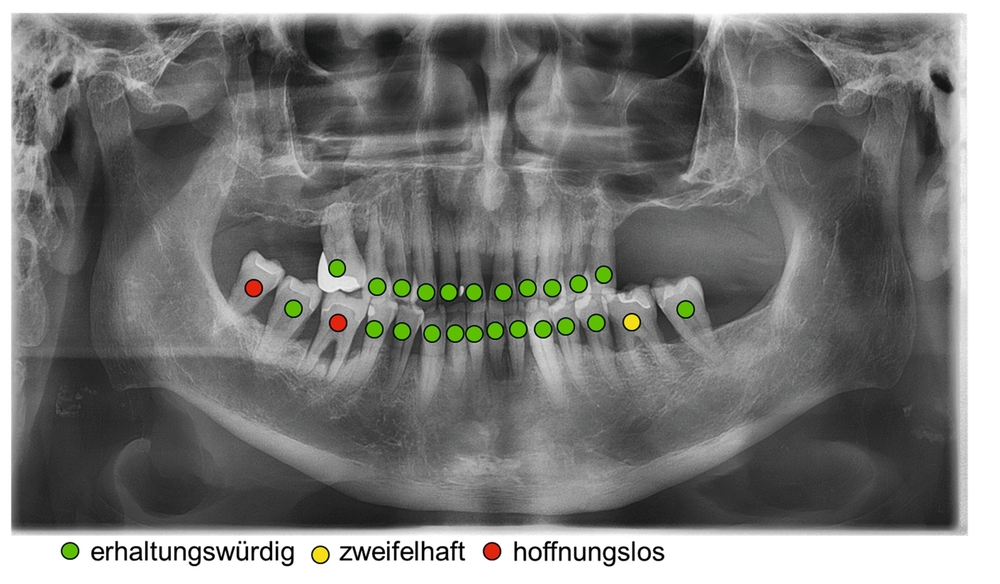
Die parodontale Regeneration ist eine gute Therapiemöglichkeit, um die Prognose von stark betroffenen Zähnen mit tiefen Resttaschen und Knochendefekten oder Furkationsdefekten zu verbessern. Der zusätzliche Nutzen für den Attachmentgewinn liegt bei durchschnittlich 1,34 mm und für die Reduktion der Sondierungstiefen bei 1,2 mm [Nibali et al., 2020]. Eine gute Plaquekontrolle wirkt sich dabei positiv auf das Heilungsergebnis aus und sollte deshalb die Basis für alle parodontalchirurgischen Maßnahmen sein [Rosling et al., 1976]. Auch Zähne mit Furkationsbefall sollten in die Parodontaltherapie einbezogen werden. Bei Furkationen von Unterkiefermolaren Grad II und Oberkiefermolaren mit bukkalem Furkationsbefund Grad II sollten regenerative parodontalchirurgische Maßnahmen in Betracht gezogen werden [Jepsen et al., 2020]. Zur Unterstützung der Regeneration von Knochentaschen oder Furkationsbefall Grad II stehen gut untersuchte Biomaterialien wie Membranen oder Schmelz-Matrix-Proteine mit oder ohne Zusatz von Knochenersatzmaterial zur Verfügung [Nibali et al., 2020]. Die Abbildungen 1 bis 3 zeigen einen Fall, bei dem durch eine regenerative Parodontalchirurgie die Prognose des Zahnes maßgeblich verbessert wurde.
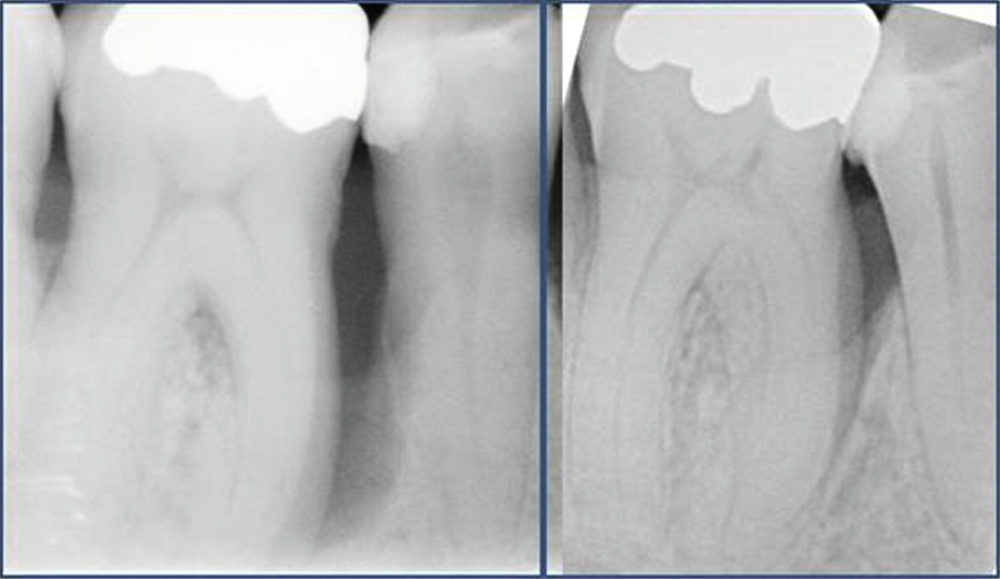
Mehrere Studien berichten über gute Langzeitergebnisse nach dieser Therapieform, insbesondere auch bei primär „hoffnungslos“ eingestuften Zähnen [Cortellini und Tonetti, 2004; Pretzl et al., 2009; Nygaard-Østby et al, 2010; Cortellini et al., 2020; Sculean et al., 2008]. In einer Studie von Cortellini et al. [2020] wurden 50 Patienten mit je einem „hoffnungslos“ prognostizierten Zahn (Knochenabbau ad apex) entweder der Testgruppe (regenerative Behandlung) oder der Kontrollgruppe (Extraktion mit Implantation durch festsitzenden Zahnersatz) zugeteilt. Die Überlebensraten nach zehn Jahren betrugen 88 Prozent für die Test- und 100 Prozent für die Kontrollgruppe. Die Kosten der Therapie waren in der Testgruppe signifikant geringer. Auch wenn die Ergebnisse beeindrucken, ist kritisch anzumerken, dass alle Patienten im Zeitraum von zehn Jahren vierteljährliche Recall-Sitzungen erhielten und die Therapie in einer hoch spezialisierten Praxis durchgeführt wurde. Das heißt, dass diese techniksensitive Therapie in einer allgemeinzahnärztlichen Praxis nicht unbedingt den gleichen Erfolg erzielen würde. Dennoch zeigt die Studie, dass auch bei schwer erkrankten Zähnen noch Regenerationspotenzial besteht und man sich auf die erste prognostische Einschätzung nicht einhundertprozentig verlassen kann. Auch mit nicht-chirurgischer Parodontitistherapie und konsequenter Erhaltungstherapie konnten in einer weiteren Studie 88,2 Prozent der primär als fraglich und 59,5 Prozent der primär als hoffnungslos eingestuften Zähne über einen Zeitraum von 15 Jahren erhalten werden [Graetz et al., 2011]. Dabei ist häufig ein beachtliches regeneratives Potenzial allein durch die nicht-chirurgische Parodontitistherapie festzustellen (Abbildung 4).
Die kürzlich erschienene S3-Leitlinie der European Federation of Periodontology (EFP) gibt eine Empfehlung zum klinischen Vorgehen bei schwer parodontal erkrankten Zähnen im Stadium IV [Herrera et al., 2022]. Danach soll bei intakter Zahnreihe zunächst die Möglichkeit des Erhalts aller Zähne geprüft werden, um Zahnersatz zu vermeiden. Nach gründlicher Diagnostik sollte auch die parodontale Behandlung der zu Beginn als hoffnungslos eingestuften Zähne durchgeführt werden. Gleichzeitig müssten Patienten in die Entscheidungsfindung eingebunden werden. Weiterhin wird empfohlen, besonders stark gelockerte Zähne zu schienen.
Grenzen des Zahnerhalts
Dem Vorhaben des maximalen Zahnerhalts steht oftmals nicht nur das Risiko des Misserfolgs, sondern stehen zusätzlich die Fragen nach Wirtschaftlichkeit, Behandlungsrichtlinien oder finanziellen Beschränkungen von Patientenseite entgegen. Klare Extraktionskriterien würden somit die Entscheidungsfindung für Zahnärzte und Patienten enorm erleichtern. Nur in wenigen Punkten scheint es hier einen breiten Konsens zu geben. Zum einen gilt es, eine geschlossene Zahnreihe so lange wie möglich zu erhalten [Herrera et al., 2022]. Zum anderen konstatiert der gemeinsame Bundesausschuss (G-BA) in der aktuellen PAR-Richtlinie, dass bei „fortgeschrittenem Knochenabbau von über 75 Prozent oder einem Furkationsbefall von Grad III [...] bei gleichzeitigem Vorliegen eines Lockerungsgrades III in der Regel die Entfernung des Zahnes angezeigt“ ist [G-BA, 2022].
In der Vergangenheit gab es wiederholt Bemühungen, ein geeignetes Prognosesystem zu entwickeln, um das Überleben und die Stabilität von Zähnen anhand von verschiedenen Kriterien vorherzusagen. Die vielzitierte Einteilung nach McGuire und Nunn zieht dabei ähnlich wie die aktuelle PAR-Richtlinie vor allem lokale zahnbezogene Faktoren wie Attachmentverlust, Furkationsgrad, Reinigungsmöglichkeit und die Wurzelform in Betracht und bewertet einzelne Zähne mit den fünf möglichen Prognoseeinteilungen „gut“, „mäßig“, „schlecht“, „fraglich“ und „hoffnungslos“ [McGuire und Nunn, 1996]. Während „fragliche“ Zähne hier > 50 Prozent Attachmentverlust, ein ungünstiges Kronen-Wurzel-Verhältnis, Furkationsgrad II mit schlechter Reinigungsfähigkeit beziehungsweise Furkationsgrad III, Lockerungsgrad II und/oder engbenachbarte Wurzeln aufweisen, werden „hoffnungslose“ Zähne mit einem inadäquaten Attachment beschrieben, das den Zahn als nicht erhaltungswürdig einstuft. Das System von Checchi et al. sieht innerhalb von drei möglichen Prognosegraden (gut, fraglich, hoffnungslos) Zähne als hoffnungslos an, wenn sie > 75 Prozent Knochenabbau oder einer Kombination aus zwei zutreffenden Kriterien für fragliche Zähne (anguläre Defekte, Furkationsbeteiligung und/oder 50 bis 75 Prozent Knochenabbau) entsprechen [Checci et al., 2002]. Diese und andere Systeme zeigten jedoch den Nachteil, dass lediglich die Prognose „gut“ in den meisten Fällen in den folgenden Jahren noch zutraf, aber „hoffnungslose“ Zähne weitaus länger erhalten blieben, als ursprünglich prognostiziert wurde [Saydzai et al., 2022]. Andere Arbeiten konnten zeigen, dass patientenbezogene Faktoren wie Adhärenz in Form von regelmäßiger Teilnahme an der parodontalen Nachsorge, Tabakkonsum, aber auch nicht beeinflussbare Risikofaktoren wie das Alter einen starken Einfluss auf das Überleben von Zähnen haben [Eickholz et al., 2008]. Dabei fiel auf, dass durch regelmäßige Nachsorge selbst deutlich kompromittierte und als „hoffnungslos“ bezeichnete Zähne überwiegend den Zeitraum von bis zu 20 Jahren überlebten [Pretzl et al., 2018].
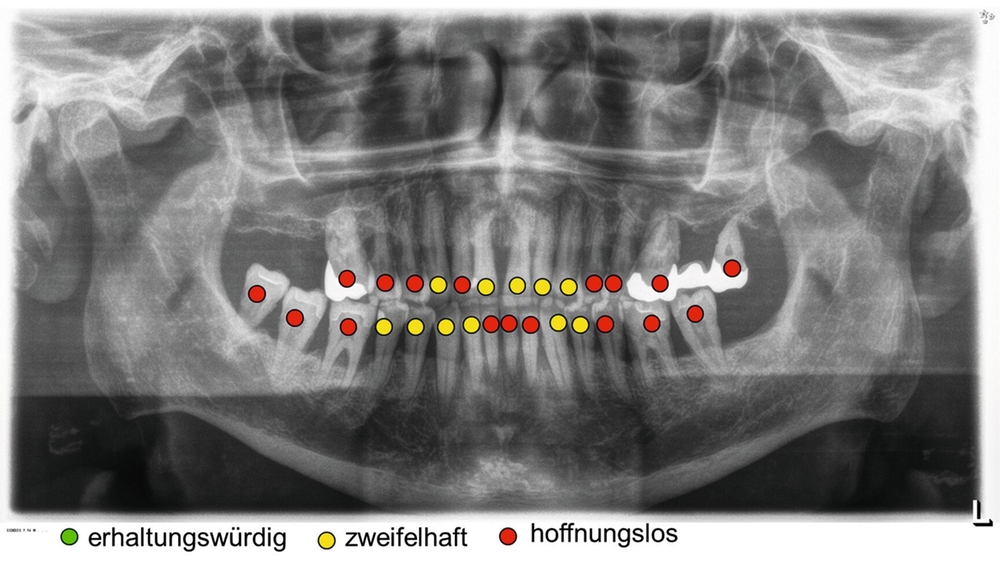
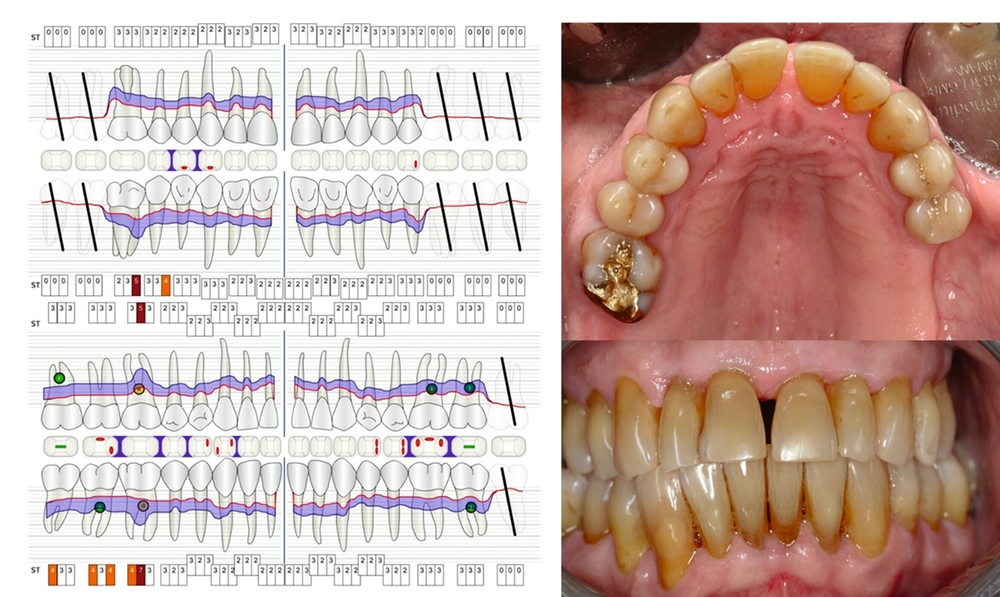
Dennoch geben Prognosesysteme, insbesondere bei komplexen Situationen, eine Hilfestellung bei der Entscheidung über den Zahnerhalt. Jedoch sollte man diese zu unterschiedlichen Zeitpunkten innerhalb der Parodontitistherapie erneut durchführen und sich wiederholt die Frage stellen, ob durch die derzeitige Therapie eine parodontale Stabilität des Zahnes erreicht werden kann [Kwok und Caton, 2007]. Die Abbildungen 5 bis 8 stellen diese Situation bei einem 56-jährigen Patienten mit Parodontitis dar, bei dem sich die zahnbezogenen Prognosen nach drei Jahren Parodontitistherapie deutlich verbessert haben.
Im Zusammenhang mit einer anstehenden prothetischen Versorgung wird — ebenfalls in einer Richtlinie des G-BA — vorausgesetzt, dass nicht erhaltungswürdige Zähne und Wurzelreste extrahiert werden sowie eine Parodontalbehandlung vorgenommen wird, bevor definitiver Zahnersatz hergestellt wird. Da entsprechend der dargestellten Faktoren eine primäre Prognosestellung beim ersten Termin ungenügend ist, wird bis zum Erreichen von parodontaler Gesundheit ein Immediatersatz als Überbrückung empfohlen [G-BA, 2022a].
Bei der Entscheidungsfindung für oder gegen eine Extraktion gilt es zudem, die Patienten einzubeziehen. Nur diese können Faktoren wie Adhärenz und Risikofaktoren beurteilen. Nicht zuletzt spielen die Erfahrung und die Qualifikation von Zahnärztinnen und Zahnärzten bei der Zahnerhaltung und insbesondere bei parodontalchirurgischen Eingriffen eine maßgebliche Rolle für den Erfolg [Cortellini und Tonetti, 2000; Kozlovsky et al., 2018].
Die Alternative Extraktion plus Implantat im Vergleich
Haben Implantate eine bessere Prognose als parodontal geschädigte Zähne?
Bei dieser Frage muss zunächst beachtet werden, ob die Implantate bei parodontal gesunden oder bei Patienten mit Parodontitis eingesetzt wurden. Dies ist insofern besonders relevant, da die Faktoren, die zum Zahnverlust bei Parodontitispatienten geführt haben, ja auch weiterhin auf das Implantat einwirken. In der Tat zeigen vergleichende Studien, dass um Implantate bei Parodontitispatienten eine mehr als doppelt so hohe Prävalenz an Periimplantitis auftritt als um Implantate bei parodontal gesunden Patienten [Cho-Yan Lee et al., 2012; Roccuzzo et al., 2010]. Dieses Risiko kann jedoch durch eine effektiv durchgeführte Parodontitistherapie und eine hohe Patientenadhärenz in der unterstützenden Parodontitistherapie minimiert werden [Cho-Yan Lee et al., 2012; Roccuzzo et al., 2010]. Dies wurde nun auch in einer 20 Jahre betrachtenden prospektiven Studie herausgefunden [Roccuzzo et al., 2022]. Eine vorbereitende Checkliste vor Implantation, um entsprechend Periimplantitis zu vermeiden, wurde vor Kurzem von der eigenen Arbeitsgruppe veröffentlicht [Wölber und Fretwurst, 2022].
Diese Zusammenhänge bedeuten allerdings auch, dass die frühe Extraktion und Implantation bei nicht-adhärenten Parodontitispatienten und nicht-effektiver Parodontitistherapie mit einem stark erhöhten Risiko für den Implantatverlust einhergehen muss.
Sind bei funktionierender Nachsorge Implantate mit Zähnen vergleichbar?
In einer retrospektiven Studie von Guarnieri et al. konnte gezeigt werden, dass selbst bei effektiver Nachsorgetherapie der Verlust von Zähnen mit Parodontitishistorie über einen Zeitraum von zehn Jahren geringer war (0,07 Zahn/Patient/Jahr) als der von Implantaten (0,4 Implantat/Patient/Jahr) [Guarnieri et al., 2021]. Auch in einem systematischen Review von Tomasi et al. zeigten Patienten, die sich in regelmäßiger Nachsorge befanden, geringeren Zahn- als Implantatverlust [Tomasi et al., 2008].
Bezüglich der Sorge, dass parodontal kompromittierte Zähne womöglich eine Gefahr für den Knochenabbau im zukünftigen Implantatbett darstellen, zeigten Untersuchungen sogar im Gegenteil, dass der „palliative“ Zahnerhalt unter weiterhin durchgeführter Nachsorge sogar eher zu Knochenerhalt führte und die Extraktion auf jeden Fall mit Knochenverlust einherging [Machtei und Hirsch, 2007].
Liefert die Periimplantitistherapie vorhersagbare Ergebnisse?
Auch wenn mittlerweile Fortschritte in der nicht-chirurgischen Therapie von Periimplantitis gemacht werden konnten, scheint die Therapie nur begrenzt voraussagbar zu sein und ein langfristiges Wiederauftreten von Entzündungszeichen nicht verhindern zu können [Muthukuru et al., 2012]. Kombinierte nicht-chirurgische und chirurgische Therapien bei Periimplantitis scheinen bei effektiver Implantatnachsorge jedoch zumindest im Bereich von sieben Jahren ein Implantatüberleben von 70 bis 99 Prozent zu ermöglichen [Roccuzzo et al., 2018].
Basierend auf der Annahme, dass in der Ätiologie der Periimplantitis weitaus mehr Risikofaktoren einen Einfluss ausüben als bei der Parodontitis (wie beispielsweise Zementüberschüsse, Partikelabrieb, Implantat-Abutment-Leakage, biofilmadhärente Oberflächen [Fretwurst und Nelson, 2021]) und sich die anatomischen Gegebenheiten zwischen Zähnen und Implantaten unterscheiden, erscheint es nur logisch, dass die Therapie der Periimplantitis in ihrer Effektivität der Parodontitistherapie unterlegen sein muss.
Präferenzen und Kosten
Für Patienten sind in der Regel Schmerzfreiheit, Kaufunktion, Ästhetik, minimale Invasivität und geringe Kosten von hoher Bedeutung, wobei dies immer im persönlichen Zahnarzt-Patienten-Gespräch eruiert werden muss (personalisierte Zahnmedizin). Für eine gemeinsame Entscheidungsfindung, wie sie heute State of the Art sein sollte, spielen aber natürlich die Einstellung und die Informationsgabe durch die Zahnärzte eine wesentliche Rolle.
Interessanterweise zeigte eine Untersuchung, dass sich Zahnärzte mit einer postgradualen Weiterbildung im Bereich der Implantologie dreimal häufiger für den Zahnerhalt bei parodontal kompromittierten Zähnen entschieden anstatt für die Extraktion und Implantation im Vergleich zu Kolleginnen und Kollegen ohne implantologische Weiterbildung [Lang-Hua et al., 2014]. Dies stand im Einklang mit einer Untersuchung unter allgemeinzahnärztlichen Kollegen, die in einer Implantatversorgung generell (80 Prozent) eine bessere Versorgung sahen als in einem konventionellen Zahnersatz [Lang-Hua et al., 2013]. Diese Betrachtung stimmt vor allem dann nicht, wenn die Patienten gewichtige Risikofaktoren für Periimplantitis aufweisen (wie Rauchen, Diabetes mellitus, Parodontitis). Entsprechend scheinen hier weitere Aufklärung und die Einbindung des Themas in die Lehre und zahnärztliche Fort- und Weiterbildung notwendig zu sein.
Auch die finanziellen Implikationen der therapeutischen Optionen sind bereits in einer Studie verglichen worden: Hier konnte gezeigt werden, dass der parodontale Erhalt von Zähnen mit Furkationsbeteiligung kurz- und langfristig weniger Kosten verursacht als eine entsprechende Extraktion und Implantation [Schwendicke et al., 2014].
Fazit und Empfehlungen
Implantate stellen heutzutage eine wichtige therapeutische Möglichkeit für den Zahnersatz dar, um die Kaufähigkeit und die Ästhetik mit einer guten langfristigen Prognose wiederherzustellen. Sie sind allerdings nicht die „besseren Zähne“.
Entsprechend der dargestellten Faktoren wird deutlich, dass die Abwägung zwischen dem Versuch des Zahnerhalts und der Alternative Extraktion/Implantation vor allem beim ersten Patientenkontakt immer zugunsten des Zahnerhalts entschieden werden sollte. Eine frühe Extraktionsplanung (vor allem unter alleiniger Betrachtung des Röntgenbildes) ist obsolet, denn die Erhaltbarkeit von parodontal kompromittierten Zähnen zeigt sich erst im Laufe der Parodontitistherapie.
Vor allem die Einbindung der Patienten in eine systematische und anschließend unterstützende Parodontitistherapie verbessert sowohl die Prognose von parodontal kompromittierten Zähnen als auch die von eventuell später inserierten Implantaten relevant. Allerdings scheint hierbei selbst bei adäquater Nachsorge der Knochenabbau um Zähne geringer zu sein als um Implantate – parodontale Komplikationen können dementsprechend bei Zähnen im Vergleich zu Implantaten als besser beherrschbar angesehen werden.
Daher sind Konzepte interessant, wie beispielsweise die von Lundgren et al. [2008] empfohlene Vorgehensweise, nach der die Zahnextraktion möglichst so lange hinausgezögert werden soll, dass zu erwartende periimplantäre Komplikationen wie Explantationen im hohen Patientenalter nicht mehr zu erwarten sind (Abbildung 9).
Knochenabbau in Relation zum Lebensalter
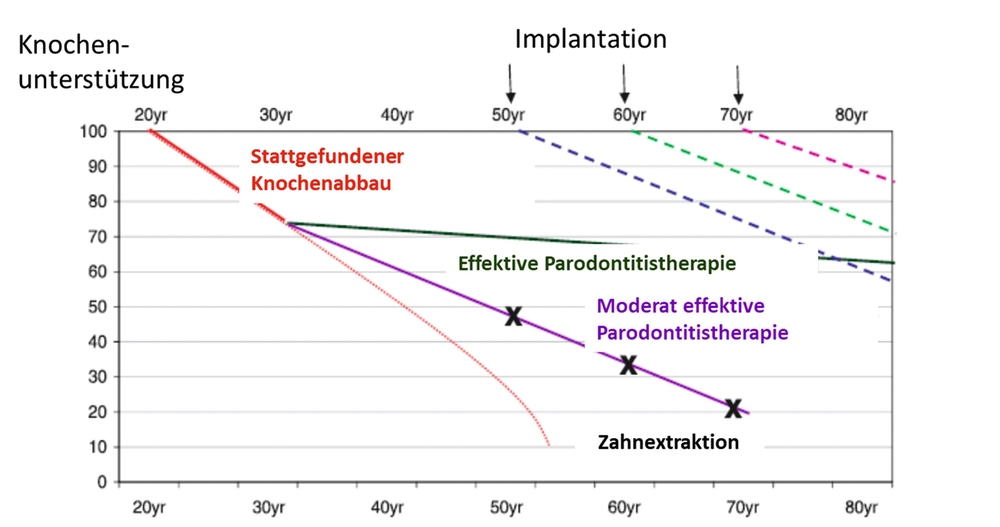
Natürlich sollte der dabei zu erhaltende Zahn die Patientinnen und Patienten nicht in ihrer Lebensqualität durch Schmerzen oder reduzierte Kaufunktion einschränken. Es sollte auch nicht leichtfertig auf stark parodontal vorgeschädigten Zähnen kostenintensiver Zahnersatz angefertigt werden. Wie aber dargestellt, lässt sich beispielsweise durch Immediatprothesen oder Langzeitprovisorien Zeit gewinnen, um eine aussagekräftigere Prognose zu erhalten.
Literatur:
1. Ramanauskaite A, Fretwurst T, Schwarz F. Efficacy of alternative or adjunctive measures to conventional non-surgical and surgical treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. Int J Implant Dent. 2021;7:112. 2. Broers DLM, Dubois L, de Lange J, Su N, de Jongh A. Reasons for Tooth Removal in Adults: A Systematic Review. Int Dent J. 2022;72:52–7. 3. Jordan RA, Bodechtel C, Hertrampf K, Hoffmann T, Kocher T, Nitschke I, u. a. The Fifth German Oral Health Study (Fünfte Deutsche Mundgesundheitsstudie, DMS V) - rationale, design, and methods. BMC Oral Health. 2014;14:161. 4. IDZ | Vierte Deutsche Mundgesundheitsstudie (DMS IV) [Internet]. Köln: Deutscher Zahnärzte Verlag, DÄV; 2006 [zitiert 8. August 2022]. Verfügbar unter: https://www.idz.institute/publikationen/buecher/vierte-deutsche-mundgesundheitsstudie-dms-iv.html5. Moraschini V, Poubel LA da C, Ferreira VF, Barboza E dos SP. Evaluation of survival and success rates of dental implants reported in longitudinal studies with a follow-up period of at least 10 years: a systematic review. Int J Oral Maxillofac Surg. 2015;44:377–88. 6. Lekholm U, Gröndahl K, Jemt T. Outcome of oral implant treatment in partially edentulous jaws followed 20 years in clinical function. Clin Implant Dent Relat Res. 2006;8:178–86. 7. Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol. 2015;42 Suppl 16:S158-171. 8. Barmer. Zahnreport 2017 | BARMER [Internet]. [zitiert 8. August 2022]. Verfügbar unter: https://www.barmer.de/presse/infothek/studien-und-reporte/zahnreporte/zahnreport-2017-10652569. Richtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen: Erstfassung - Gemeinsamer Bundesausschuss [Internet]. [zitiert 8. August 2022]. Verfügbar unter: https://www.g-ba.de/beschluesse/4623/10. Deutsche Gesellschaft für Parodontologie e.V. Die deutsche Implementierung der S3-Leitlinie “Treatment of stage I-III periodontitis” der European Federation of Periodontology (EFP). AWMF online; 2021. 11. Suvan J, Leira Y, Moreno Sancho FM, Graziani F, Derks J, Tomasi C. Subgingival instrumentation for treatment of periodontitis. A systematic review. J Clin Periodontol. 2020;47 Suppl 22:155–75. 12. Teughels W, Feres M, Oud V, Martín C, Matesanz P, Herrera D. Adjunctive effect of systemic antimicrobials in periodontitis therapy: A systematic review and meta-analysis. J Clin Periodontol. 2020;47 Suppl 22:257–81. 13. Sanz-Sánchez I, Montero E, Citterio F, Romano F, Molina A, Aimetti M. Efficacy of access flap procedures compared to subgingival debridement in the treatment of periodontitis. A systematic review and meta-analysis. J Clin Periodontol. 2020;47 Suppl 22:282–302. 14. Trombelli L, Franceschetti G, Farina R. Effect of professional mechanical plaque removal performed on a long-term, routine basis in the secondary prevention of periodontitis: a systematic review. J Clin Periodontol. 2015;42 Suppl 16:S221-236. 15. Nibali L, Koidou VP, Nieri M, Barbato L, Pagliaro U, Cairo F. Regenerative surgery versus access flap for the treatment of intra-bony periodontal defects: A systematic review and meta-analysis. J Clin Periodontol. 2020;47 Suppl 22:320–51. 16. Rosling B, Nyman S, Lindhe J, Jern B. The healing potential of the periodontal tissues following different techniques of periodontal surgery in plaque-free dentitions. A 2-year clinical study. J Clin Periodontol. 1976;3:233–50. 17. Jepsen S, Gennai S, Hirschfeld J, Kalemaj Z, Buti J, Graziani F. Regenerative surgical treatment of furcation defects: A systematic review and Bayesian network meta-analysis of randomized clinical trials. J Clin Periodontol. 2020;47 Suppl 22:352–74. 18. Cortellini P, Tonetti MS. Long-term tooth survival following regenerative treatment of intrabony defects. J Periodontol. 2004;75:672–8. 19. Pretzl B, Kim T-S, Steinbrenner H, Dörfer C, Himmer K, Eickholz P. Guided tissue regeneration with bioabsorbable barriers III 10-year results in infrabony defects. J Clin Periodontol. 2009;36:349–56. 20. Nygaard-Østby P, Bakke V, Nesdal O, Susin C, Wikesjö UME. Periodontal healing following reconstructive surgery: effect of guided tissue regeneration using a bioresorbable barrier device when combined with autogenous bone grafting. A randomized-controlled trial 10-year follow-up. J Clin Periodontol. 2010;37:366–73. 21. Cortellini P, Stalpers G, Mollo A, Tonetti MS. Periodontal regeneration versus extraction and dental implant or prosthetic replacement of teeth severely compromised by attachment loss to the apex: A randomized controlled clinical trial reporting 10-year outcomes, survival analysis and mean cumulative cost of recurrence. J Clin Periodontol. 2020;47:768–76. 22. Sculean A, Kiss A, Miliauskaite A, Schwarz F, Arweiler NB, Hannig M. Ten-year results following treatment of intra-bony defects with enamel matrix proteins and guided tissue regeneration. J Clin Periodontol. 2008;35:817–24. 23. Graetz C, Dörfer CE, Kahl M, Kocher T, Fawzy El-Sayed K, Wiebe J-F, u. a. Retention of questionable and hopeless teeth in compliant patients treated for aggressive periodontitis. J Clin Periodontol. 2011;38:707–14. 24. Herrera D, Sanz M, Kebschull M, Jepsen S, Sculean A, Berglundh T, u. a. Treatment of stage IV periodontitis: The EFP S3 level clinical practice guideline. J Clin Periodontol. 2022;49 Suppl 24:4–71. 25. PAR-Richtlinie - Gemeinsamer Bundesausschuss [Internet]. [zitiert 10. August 2022]. Verfügbar unter: https://www.g-ba.de/richtlinien/124/26. McGuire MK, Nunn ME. Prognosis versus actual outcome. II. The effectiveness of clinical parameters in developing an accurate prognosis. J Periodontol. 1996;67:658–65. 27. Checchi L, Montevecchi M, Gatto MRA, Trombelli L. Retrospective study of tooth loss in 92 treated periodontal patients. Journal of Clinical Periodontology. 2002;29:651–6. 28. Saydzai S, Buontempo Z, Patel P, Hasan F, Sun C, Akcalı A, u. a. Comparison of the efficacy of periodontal prognostic systems in predicting tooth loss. Journal of Clinical Periodontology. 2022;49:740–8. 29. Eickholz P, Kaltschmitt J, Berbig J, Reitmeir P, Pretzl B. Tooth loss after active periodontal therapy. 1: patient-related factors for risk, prognosis, and quality of outcome. J Clin Periodontol. 2008;35:165–74. 30. Pretzl B, El Sayed S, Weber D, Eickholz P, Bäumer A. Tooth loss in periodontally compromised patients: Results 20 years after active periodontal therapy. J Clin Periodontol. 2018;45:1356–64. 31. Kwok V, Caton JG. Commentary: Prognosis Revisited: A System for Assigning Periodontal Prognosis. Journal of Periodontology. 2007;78:2063–71. 32. Zahnersatz-Richtlinie - Gemeinsamer Bundesausschuss [Internet]. [zitiert 19. August 2022]. Verfügbar unter: https://www.g-ba.de/richtlinien/26/33. Cortellini P, Tonetti MS. Clinical concepts for regenerative therapy in intrabony defects. Periodontol 2000. 2015;68:282–307. 34. Kozlovsky A, Rapaport A, Artzi Z. Influence of operator skill level on the clinical outcome of non-surgical periodontal treatment: a retrospective study. Clin Oral Investig. 2018;22:2927–32. 35. Cho-Yan Lee J, Mattheos N, Nixon KC, Ivanovski S. Residual periodontal pockets are a risk indicator for peri-implantitis in patients treated for periodontitis. Clin Oral Implants Res. 2012;23:325–33. 36. Roccuzzo M, De Angelis N, Bonino L, Aglietta M. Ten-year results of a three-arm prospective cohort study on implants in periodontally compromised patients. Part 1: implant loss and radiographic bone loss. Clin Oral Implants Res. 2010;21:490–6. 37. Roccuzzo A, Imber J-C, Marruganti C, Salvi GE, Ramieri G, Roccuzzo M. Clinical outcomes of dental implants in patients with and without a history of periodontitis. A 20-year prospective study. Journal of Clinical Periodontology [Internet]. [zitiert 19. August 2022];n/a. Verfügbar unter: https://onlinelibrary.wiley.com/doi/abs/10.1111/jcpe.1371638. Woelber JP, Fretwurst T. Patient-related risk factors for peri-implantitis and pre-implant treatment - Online DZZ. 01. 2022;01:36–36. 39. Guarnieri R, Di Nardo D, Di Giorgio G, Miccoli G, Testarelli L. Longevity of Teeth and Dental Implants in Patients Treated for Chronic Periodontitis Following Periodontal Maintenance Therapy in a Private Specialist Practice: A Retrospective Study with a 10-Year Follow-up. Int J Periodontics Restorative Dent. 2021;41:89–98. 40. Tomasi C, Wennström JL, Berglundh T. Longevity of teeth and implants - a systematic review. J Oral Rehabil. 2008;35 Suppl 1:23–32. 41. Machtei EE, Hirsch I. Retention of hopeless teeth: the effect on the adjacent proximal bone following periodontal surgery. J Periodontol. 2007;78:2246–52. 42. Muthukuru M, Zainvi A, Esplugues EO, Flemmig TF. Non-surgical therapy for the management of peri-implantitis: a systematic review. Clin Oral Implants Res. 2012;23 Suppl 6:77–83. 43. Roccuzzo M, Layton DM, Roccuzzo A, Heitz-Mayfield LJ. Clinical outcomes of peri-implantitis treatment and supportive care: A systematic review. Clin Oral Implants Res. 2018;29 Suppl 16:331–50. 44. Fretwurst T, Nelson K, Tarnow DP, Wang HL, Giannobile WV. Is Metal Particle Release Associated with Peri-implant Bone Destruction? An Emerging Concept. J Dent Res. 2018 Mar;97(3):259-265. doi: 10.1177/0022034517740560. Epub 2017 Nov 12. PMID: 29130804.45. Lang-Hua BH, McGrath CPJ, Lo ECM, Lang NP. Factors influencing treatment decision-making for maintaining or extracting compromised teeth. Clin Oral Implants Res. 2014;25:59–66. 46. Lang-Hua BH, Lang NP, Lo ECM, McGrath CPJ. Attitudes of general dental practitioners towards implant dentistry in an environment with widespread provision of implant therapy. Clin Oral Implants Res. 2013;24:278–84. 47. Schwendicke F, Graetz C, Stolpe M, Dörfer CE. Retaining or replacing molars with furcation involvement: a cost-effectiveness comparison of different strategies. J Clin Periodontol. 2014;41:1090–7.
Literatur
1. Ramanauskaite A, Fretwurst T, Schwarz F. Efficacy of alternative or adjunctive measures to conventional non-surgical and surgical treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. Int J Implant Dent. 2021;7:112.
2. Broers DLM, Dubois L, de Lange J, Su N, de Jongh A. Reasons for Tooth Removal in Adults: A Systematic Review. Int Dent J. 2022;72:52–7.
3. Jordan RA, Bodechtel C, Hertrampf K, Hoffmann T, Kocher T, Nitschke I, u. a. The Fifth German Oral Health Study (Fünfte Deutsche Mundgesundheitsstudie, DMS V) - rationale, design, and methods. BMC Oral Health. 2014;14:161.
4. IDZ | Vierte Deutsche Mundgesundheitsstudie (DMS IV) [Internet]. Köln: Deutscher Zahnärzte Verlag, DÄV; 2006 [zitiert 8. August 2022]. Verfügbar unter: https://www.idz.institute/publikationen/buecher/vierte-deutsche-mundgesundheitsstudie-dms-iv.html
5. Moraschini V, Poubel LA da C, Ferreira VF, Barboza E dos SP. Evaluation of survival and success rates of dental implants reported in longitudinal studies with a follow-up period of at least 10 years: a systematic review. Int J Oral Maxillofac Surg. 2015;44:377–88.
6. Lekholm U, Gröndahl K, Jemt T. Outcome of oral implant treatment in partially edentulous jaws followed 20 years in clinical function. Clin Implant Dent Relat Res. 2006;8:178–86.
7. Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol. 2015;42 Suppl 16:S158-171.
8. Barmer. Zahnreport 2017 | BARMER [Internet]. [zitiert 8. August 2022]. Verfügbar unter: https://www.barmer.de/presse/infothek/studien-und-reporte/zahnreporte/zahnreport-2017-1065256
9. Richtlinie zur systematischen Behandlung von Parodontitis und anderer Parodontalerkrankungen: Erstfassung - Gemeinsamer Bundesausschuss [Internet]. [zitiert 8. August 2022]. Verfügbar unter: https://www.g-ba.de/beschluesse/4623/;
10. Deutsche Gesellschaft für Parodontologie e.V. Die deutsche Implementierung der S3-Leitlinie “Treatment of stage I-III periodontitis” der European Federation of Periodontology (EFP). AWMF online; 2021.
11. Suvan J, Leira Y, Moreno Sancho FM, Graziani F, Derks J, Tomasi C. Subgingival instrumentation for treatment of periodontitis. A systematic review. J Clin Periodontol. 2020;47 Suppl 22:155–75.
12. Teughels W, Feres M, Oud V, Martín C, Matesanz P, Herrera D. Adjunctive effect of systemic antimicrobials in periodontitis therapy: A systematic review and meta-analysis. J Clin Periodontol. 2020;47 Suppl 22:257–81.
13. Sanz-Sánchez I, Montero E, Citterio F, Romano F, Molina A, Aimetti M. Efficacy of access flap procedures compared to subgingival debridement in the treatment of periodontitis. A systematic review and meta-analysis. J Clin Periodontol. 2020;47 Suppl 22:282–302.
14. Trombelli L, Franceschetti G, Farina R. Effect of professional mechanical plaque removal performed on a long-term, routine basis in the secondary prevention of periodontitis: a systematic review. J Clin Periodontol. 2015;42 Suppl 16:S221-236.
15. Nibali L, Koidou VP, Nieri M, Barbato L, Pagliaro U, Cairo F. Regenerative surgery versus access flap for the treatment of intra-bony periodontal defects: A systematic review and meta-analysis. J Clin Periodontol. 2020;47 Suppl 22:320–51.
16. Rosling B, Nyman S, Lindhe J, Jern B. The healing potential of the periodontal tissues following different techniques of periodontal surgery in plaque-free dentitions. A 2-year clinical study. J Clin Periodontol. 1976;3:233–50.
17. Jepsen S, Gennai S, Hirschfeld J, Kalemaj Z, Buti J, Graziani F. Regenerative surgical treatment of furcation defects: A systematic review and Bayesian network meta-analysis of randomized clinical trials. J Clin Periodontol. 2020;47 Suppl 22:352–74.
18. Cortellini P, Tonetti MS. Long-term tooth survival following regenerative treatment of intrabony defects. J Periodontol. 2004;75:672–8.
19. Pretzl B, Kim T-S, Steinbrenner H, Dörfer C, Himmer K, Eickholz P. Guided tissue regeneration with bioabsorbable barriers III 10-year results in infrabony defects. J Clin Periodontol. 2009;36:349–56.
20. Nygaard-Østby P, Bakke V, Nesdal O, Susin C, Wikesjö UME. Periodontal healing following reconstructive surgery: effect of guided tissue regeneration using a bioresorbable barrier device when combined with autogenous bone grafting. A randomized-controlled trial 10-year follow-up. J Clin Periodontol. 2010;37:366–73.
21. Cortellini P, Stalpers G, Mollo A, Tonetti MS. Periodontal regeneration versus extraction and dental implant or prosthetic replacement of teeth severely compromised by attachment loss to the apex: A randomized controlled clinical trial reporting 10-year outcomes, survival analysis and mean cumulative cost of recurrence. J Clin Periodontol. 2020;47:768–76.
22. Sculean A, Kiss A, Miliauskaite A, Schwarz F, Arweiler NB, Hannig M. Ten-year results following treatment of intra-bony defects with enamel matrix proteins and guided tissue regeneration. J Clin Periodontol. 2008;35:817–24.
23. Graetz C, Dörfer CE, Kahl M, Kocher T, Fawzy El-Sayed K, Wiebe J-F, u. a. Retention of questionable and hopeless teeth in compliant patients treated for aggressive periodontitis. J Clin Periodontol. 2011;38:707–14.
24. Herrera D, Sanz M, Kebschull M, Jepsen S, Sculean A, Berglundh T, u. a. Treatment of stage IV periodontitis: The EFP S3 level clinical practice guideline. J Clin Periodontol. 2022;49 Suppl 24:4–71.
25. PAR-Richtlinie - Gemeinsamer Bundesausschuss [Internet]. [zitiert 10. August 2022]. Verfügbar unter: https://www.g-ba.de/richtlinien/124/
26. McGuire MK, Nunn ME. Prognosis versus actual outcome. II. The effectiveness of clinical parameters in developing an accurate prognosis. J Periodontol. 1996;67:658–65.
27. Checchi L, Montevecchi M, Gatto MRA, Trombelli L. Retrospective study of tooth loss in 92 treated periodontal patients. Journal of Clinical Periodontology. 2002;29:651–6.
28. Saydzai S, Buontempo Z, Patel P, Hasan F, Sun C, Akcalı A, u. a. Comparison of the efficacy of periodontal prognostic systems in predicting tooth loss. Journal of Clinical Periodontology. 2022;49:740–8.
29. Eickholz P, Kaltschmitt J, Berbig J, Reitmeir P, Pretzl B. Tooth loss after active periodontal therapy. 1: patient-related factors for risk, prognosis, and quality of outcome. J Clin Periodontol. 2008;35:165–74.
30. Pretzl B, El Sayed S, Weber D, Eickholz P, Bäumer A. Tooth loss in periodontally compromised patients: Results 20 years after active periodontal therapy. J Clin Periodontol. 2018;45:1356–64.
31. Kwok V, Caton JG. Commentary: Prognosis Revisited: A System for Assigning Periodontal Prognosis. Journal of Periodontology. 2007;78:2063–71.
32. Zahnersatz-Richtlinie - Gemeinsamer Bundesausschuss [Internet]. [zitiert 19. August 2022]. Verfügbar unter: https://www.g-ba.de/richtlinien/26/
33. Cortellini P, Tonetti MS. Clinical concepts for regenerative therapy in intrabony defects. Periodontol 2000. 2015;68:282–307.
34. Kozlovsky A, Rapaport A, Artzi Z. Influence of operator skill level on the clinical outcome of non-surgical periodontal treatment: a retrospective study. Clin Oral Investig. 2018;22:2927–
35. Cho-Yan Lee J, Mattheos N, Nixon KC, Ivanovski S. Residual periodontal pockets are a risk indicator for peri-implantitis in patients treated for periodontitis. Clin Oral Implants Res. 2012;23:325–33.
36. Roccuzzo M, De Angelis N, Bonino L, Aglietta M. Ten-year results of a three-arm prospective cohort study on implants in periodontally compromised patients. Part 1: implant loss and radiographic bone loss. Clin Oral Implants Res. 2010;21:490–6.
37. Roccuzzo A, Imber J-C, Marruganti C, Salvi GE, Ramieri G, Roccuzzo M. Clinical outcomes of dental implants in patients with and without a history of periodontitis. A 20-year prospective study. Journal of Clinical Periodontology [Internet]. [zitiert 19. August 2022];n/a. Verfügbar unter: https://onlinelibrary.wiley.com/doi/abs/10.1111/jcpe.13716
38. Woelber JP, Fretwurst T. Patient-related risk factors for peri-implantitis and pre-implant treatment - Online DZZ. 01. 2022;01:36–36.
39. Guarnieri R, Di Nardo D, Di Giorgio G, Miccoli G, Testarelli L. Longevity of Teeth and Dental Implants in Patients Treated for Chronic Periodontitis Following Periodontal Maintenance Therapy in a Private Specialist Practice: A Retrospective Study with a 10-Year Follow-up. Int J Periodontics Restorative Dent. 2021;41:89–98.
40. Tomasi C, Wennström JL, Berglundh T. Longevity of teeth and implants - a systematic review. J Oral Rehabil. 2008;35 Suppl 1:23–32.
41. Machtei EE, Hirsch I. Retention of hopeless teeth: the effect on the adjacent proximal bone following periodontal surgery. J Periodontol. 2007;78:2246–52.
42. Muthukuru M, Zainvi A, Esplugues EO, Flemmig TF. Non-surgical therapy for the management of peri-implantitis: a systematic review. Clin Oral Implants Res. 2012;23 Suppl 6:77–83.
43. Roccuzzo M, Layton DM, Roccuzzo A, Heitz-Mayfield LJ. Clinical outcomes of peri-implantitis treatment and supportive care: A systematic review. Clin Oral Implants Res. 2018;29 Suppl 16:331–50.
44. Fretwurst T, Nelson K, Tarnow DP, Wang HL, Giannobile WV. Is Metal Particle Release Associated with Peri-implant Bone Destruction? An Emerging Concept. J Dent Res. 2018 Mar;97(3):259-265. doi: 10.1177/0022034517740560. Epub 2017 Nov 12. PMID: 29130804.
45. Lang-Hua BH, McGrath CPJ, Lo ECM, Lang NP. Factors influencing treatment decision-making for maintaining or extracting compromised teeth. Clin Oral Implants Res. 2014;25:59–66.
46. Lang-Hua BH, Lang NP, Lo ECM, McGrath CPJ. Attitudes of general dental practitioners towards implant dentistry in an environment with widespread provision of implant therapy. Clin Oral Implants Res. 2013;24:278–84.
47. Schwendicke F, Graetz C, Stolpe M, Dörfer CE. Retaining or replacing molars with furcation involvement: a cost-effectiveness comparison of different strategies. J Clin Periodontol. 2014;41:1090–7.