Materialunverträglichkeiten bei dentalen, enossalen Implantaten
Aufgrund der weit verbreiteten Verwendung von metallischen Biomaterialien wie Titan wurde in der Zahnmedizin seit einigen Jahren verstärkt der Fokus auf mögliche materialbedingte Auswirkungen von Titanimplantaten auf die periimplantären Gewebe gelenkt. In der wissenschaftlichen Literatur verdichten sich Hinweise darauf, dass die Oberflächen von Implantaten im menschlichen Körper durch die Freisetzung von Partikeln eine potenzielle Quelle für eine systemische Kontamination mit Titanmaterial sein können.
Angesichts des häufigen Einsatzes von Titanimplantaten in der Zahnmedizin und aufgrund der durchaus langen Liegezeit dieser Implantate im menschlichen Körper, ist es unerlässlich, ein umfassendes Verständnis der möglichen langfristigen Auswirkungen zu erlangen, denn kein Metall und keine Metalllegierung verhalten sich in vivo vollkommen inert. Eine erste Zusammenfassung der bestehenden Evidenz zu diesem Thema hat die Leitliniengruppe in der S3-Leitlinie „Materialunverträglichkeiten bei dentalen, enossalen Implantaten“ vorgenommen.
Titandioxid löst keine „klassische Allergie“ aus
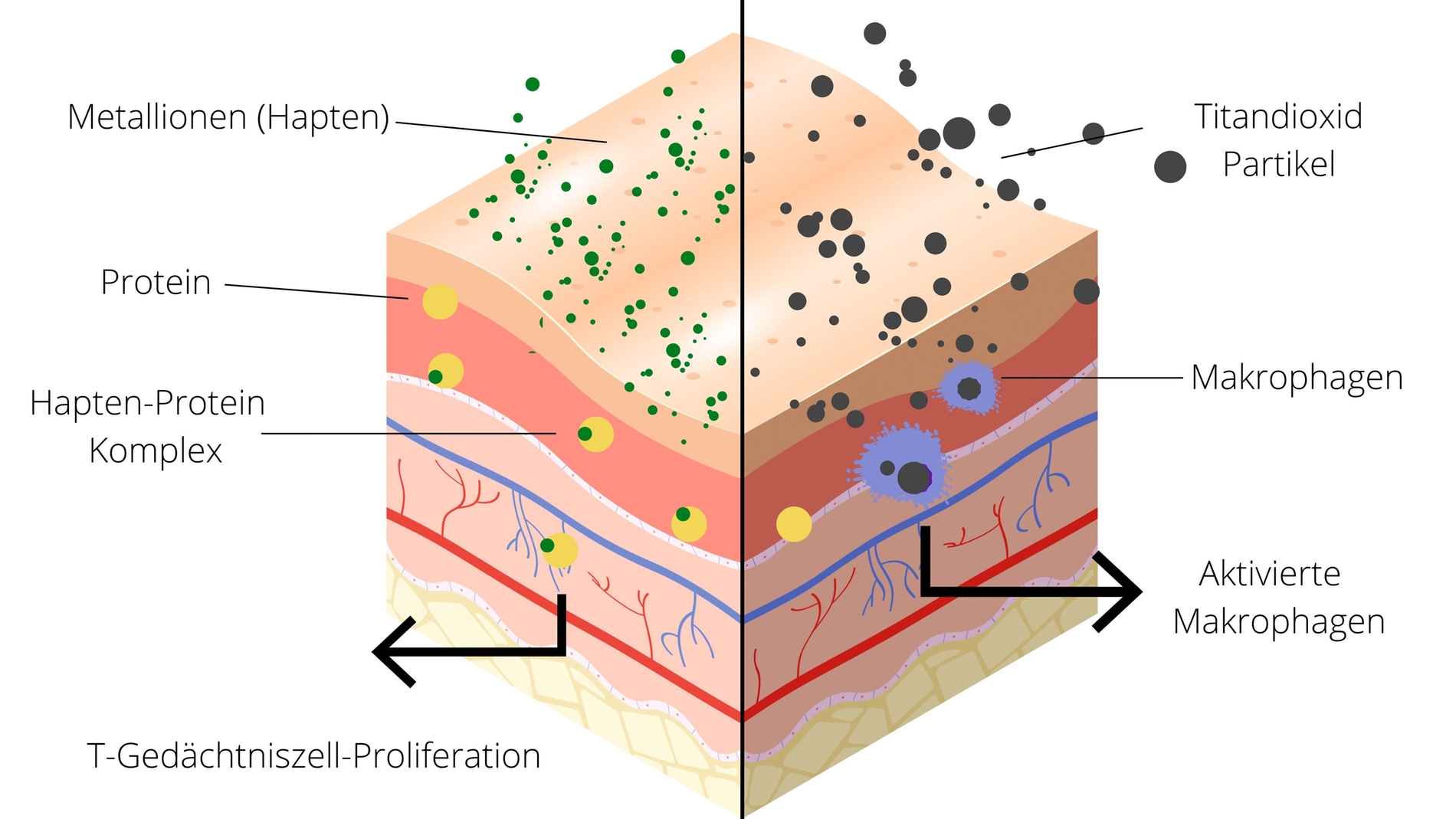
Allergische Reaktionen vom Typ IV, auch als Überempfindlichkeitsreaktionen vom verzögerten Typ oder zellvermittelte Allergien bezeichnet, gegenüber Titan sind außergewöhnlich selten, da Titan aufgrund seiner hohen Affinität zu Sauerstoff sofort nach einem beliebigen Kontakt Oxidverbindungen bildet. Aufgrund ihrer Beschaffenheit können Oxide keine Bindungen mit Proteinen eingehen, weshalb sie per Definition nicht als sogenanntes „Hapten“ fungieren können. Ein Hapten ist ein chemisches Molekül, das für sich allein keine Immunantwort auslöst – wird es aber an ein größeres Trägermolekül gebunden, beispielsweise an ein Protein, kann es dagegen eine Immunreaktion hervorrufen.
Titanoxid kann nicht als Hapten fungieren und eben aus diesem Grund keine klassische Allergie im engeren Sinn hervorrufen. Eine Ausnahme bilden Titanlegierungen, in denen sich andere Metallkomponenten in der Legierung als Ion präsentieren und direkt Verbindungen mit Proteinen bilden können – in diesem Fall kann sehr wohl allergenes Potenzial entstehen (zum Beispiel Implantate aus Titan Grad 5).
Pathophysiologisch ist es eine Unverträglichkeitsreaktion
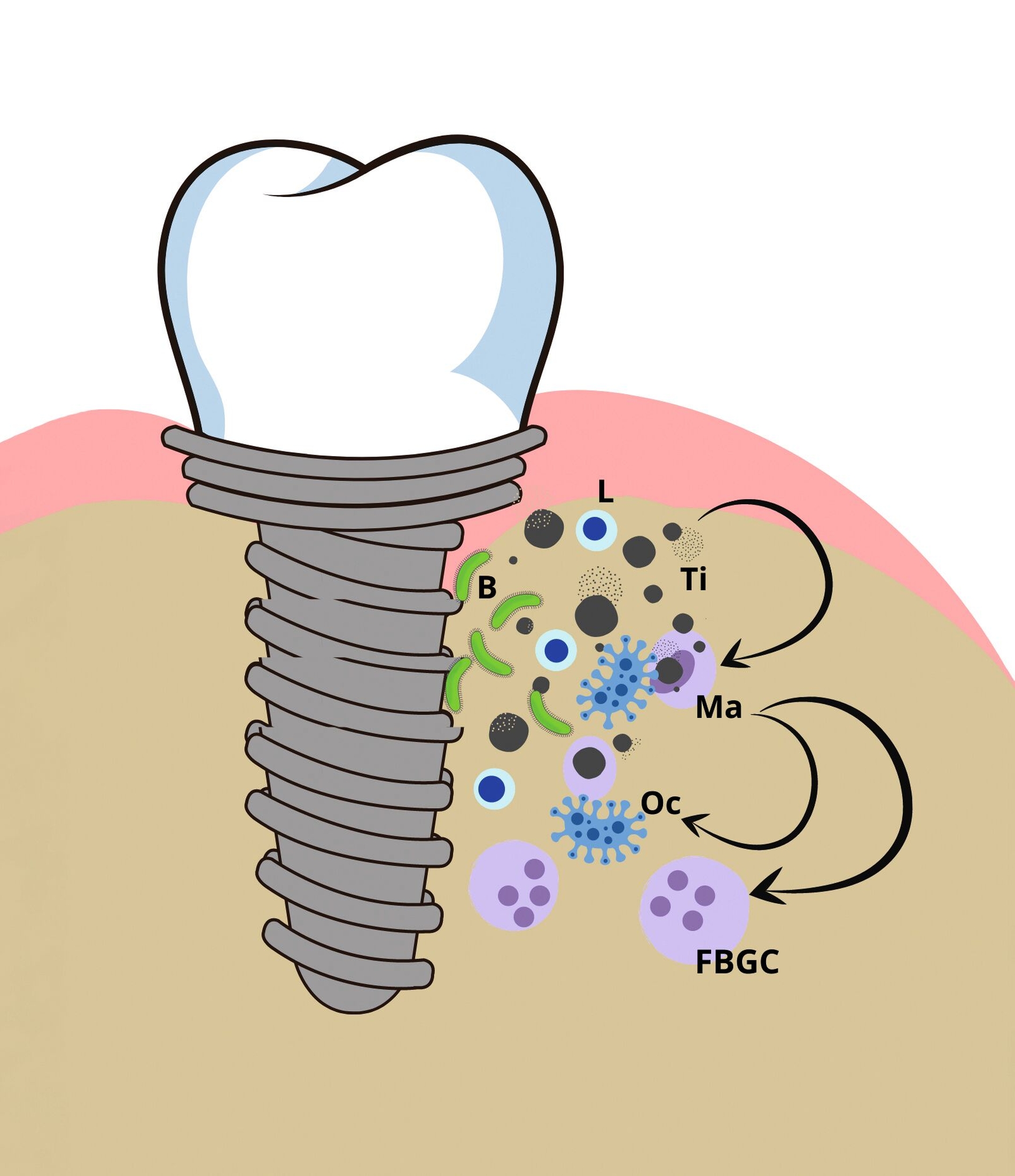
Wenngleich eine klassische Allergie durch reines Titan nicht ausgelöst werden kann, sind Unverträglichkeitsreaktionen gegenüber dem Material möglich. Diese werden durch eine übermäßige entzündliche Reaktion von Gewebemakrophagen ausgelöst, die mit den ins Gewebe disseminierten Titanoxidpartikeln in Kontakt kommen. Makrophagen haben die Fähigkeit, kleine Titandioxidpartikel (< 10 μm) zu phagozytieren, was wiederum zur Produktion und Ausschüttung proinflammatorischer Zytokine anregt [Bi et al., 2001; Cadosch et al., 2009; Zhou et al., 2021], die sowohl in vitro als auch in vivo nachgewiesen werden können. Lymphozyten scheinen bei diesem Vorgang die Adhäsion und Fusion von Makrophagen an Fremdmaterialoberflächen zu verstärken [Ding et al., 2012]. Auf der anderen Seite sorgen gegenregulatorische Zytokine wie zum Beispiel das IL-10 für eine Toleranzinduktion gegenüber dem Implantat [Thomas et al., 2013].
Titanpartikel gelangen durch partikulären Abrieb (Debris) in das periimplantäre Gewebe. Im Gewebe rund um das Implantat wurden Titanpartikel in Konzentrationen von 100 bis 300 ppm nachgewiesen [Tibau et al., 2019]. Sowohl durch mechanische Reibung beim Inserieren in den Knochen [Romanos et al., 2021] und durch kontinuierliche Mikrobewegungen an der Implantat-Abutment-Verbindung als auch durch einen Korrosionsprozess werden an der Oberfläche des Implantats Titanpartikel freigesetzt (Biotribokorrosion). Die elektrolytische Korrosion wird gefördert durch den bei der Gewebeentzündung vorliegenden sauren pH-Wert, hervorgerufen durch Stoffwechselprodukte von parodontopathogenen Bakterien im Biofilm. Die freigesetzten Titanpartikel können daraufhin im umliegenden Weich- und Hartgewebe immunologische Unverträglichkeitsreaktionen auslösen [Schliephake et al., 1993; Suarez-Lopez Del Amo et al., 2018; Mombelli et al., 2018].
Die Intensität einer proinflammatorischen Reaktion hängt höchstwahrscheinlich von individuellen Veranlagungen beziehungsweise der Stärke der inflammatorischen Immunantwort des Körpers ab. Hierbei können auch genetische Faktoren eine Rolle spielen [Summer et al., 2022]. Sobald eine proinflammatorische Kaskade abläuft, kann diese zum Zusammenbruch des „foreign body equilibrium“, also des Gleichgewichts zwischen Implantat und Gewebereaktion auf das Implantat, führen. Die aktivierten Makrophagen aktivieren Osteoklasten oder fusionieren zu mehrkernigen Riesenzellen, die Knochenmineralstrukturen auflösen können [ten Harkel et al., 2015]. Der Pathomechanismus der Inflammasom-Aktivierung in Makrophagen durch Lipoproteine parodontaler Pathogene sowie durch Titanpartikel wurde in der Literatur bereits beschrieben. Es konnte gezeigt werden, dass sowohl die LPS parodontopathogener Keime als auch Titanpartikel über die gleichen Toll-like-Rezeptoren die Entzündungskaskade im Makrophagen aktivieren. Beide Trigger wirken synergistisch und verstärken die Produktion des proentzündlichen Zytokins IL-1b im Inflammasom und damit die Entzündungsreaktion [Pettersson et al, 2016], jedoch gibt es bisher keine Belege für die Beteiligung spezifischer Lymphozyten [Maloney et al., 1993; Kumazawa et al., 2002].
Klassische Allergietests werden nicht empfohlen
Da Titanoxid keine klassische Allergie im engeren Sinn bewirkt, werden Allergietests wie der Epikutantest oder der Lymphozytentransformationstest in der Leitlinie nicht als zielführende Tests empfohlen. Dabei sollen diese Tests weder für die „prophetische“ Testung aller Patienten empfohlen, noch bei Patienten mit anamnestisch relevanten Vorerkrankungen und auch nicht bei Patienten mit Verdacht auf klinische Unverträglichkeitsreaktion post implantationem durchgeführt werden. Auf der anderen Seite sind Allergietests auf andere Metalle (zum Beispiel Nickel), die in Titanlegierungen zu einem geringen Anteil enthalten sind, durchaus sinnvoll, um diese Reaktionen gegenüber einer Titanunverträglichkeitsreaktion als Ursache auszuschließen [von Baehr et al, 2001].
Empfehlungen der Leitlinie
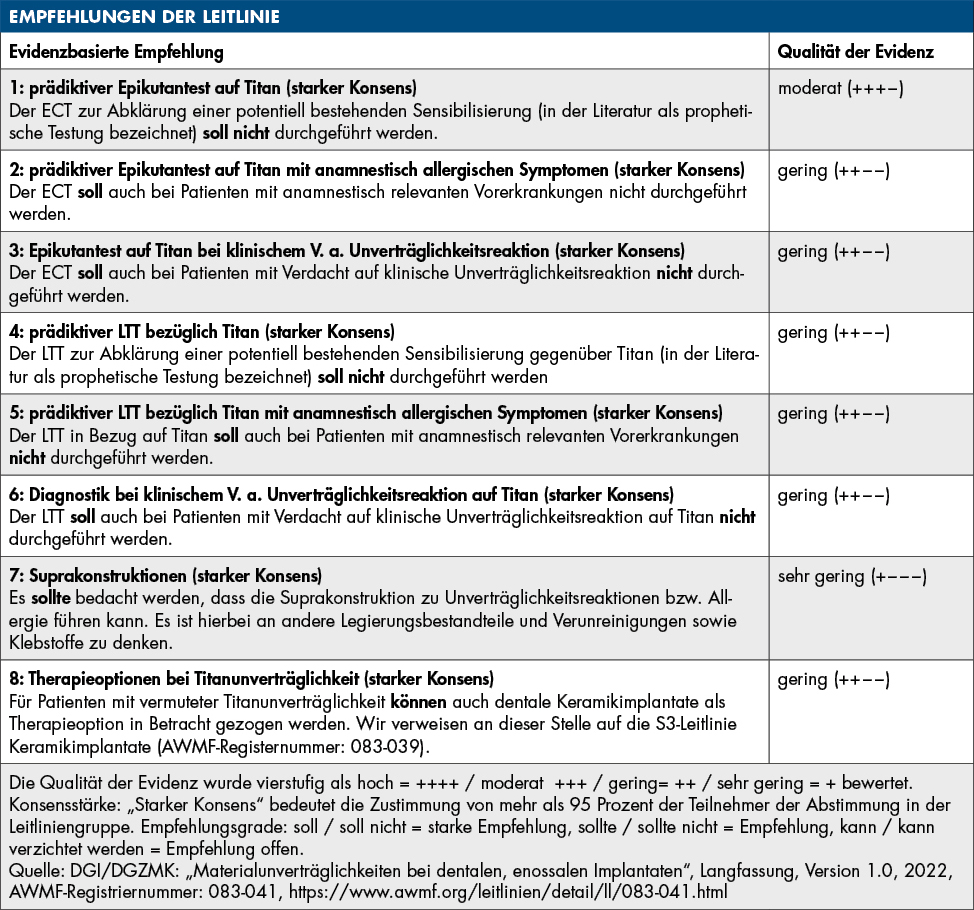
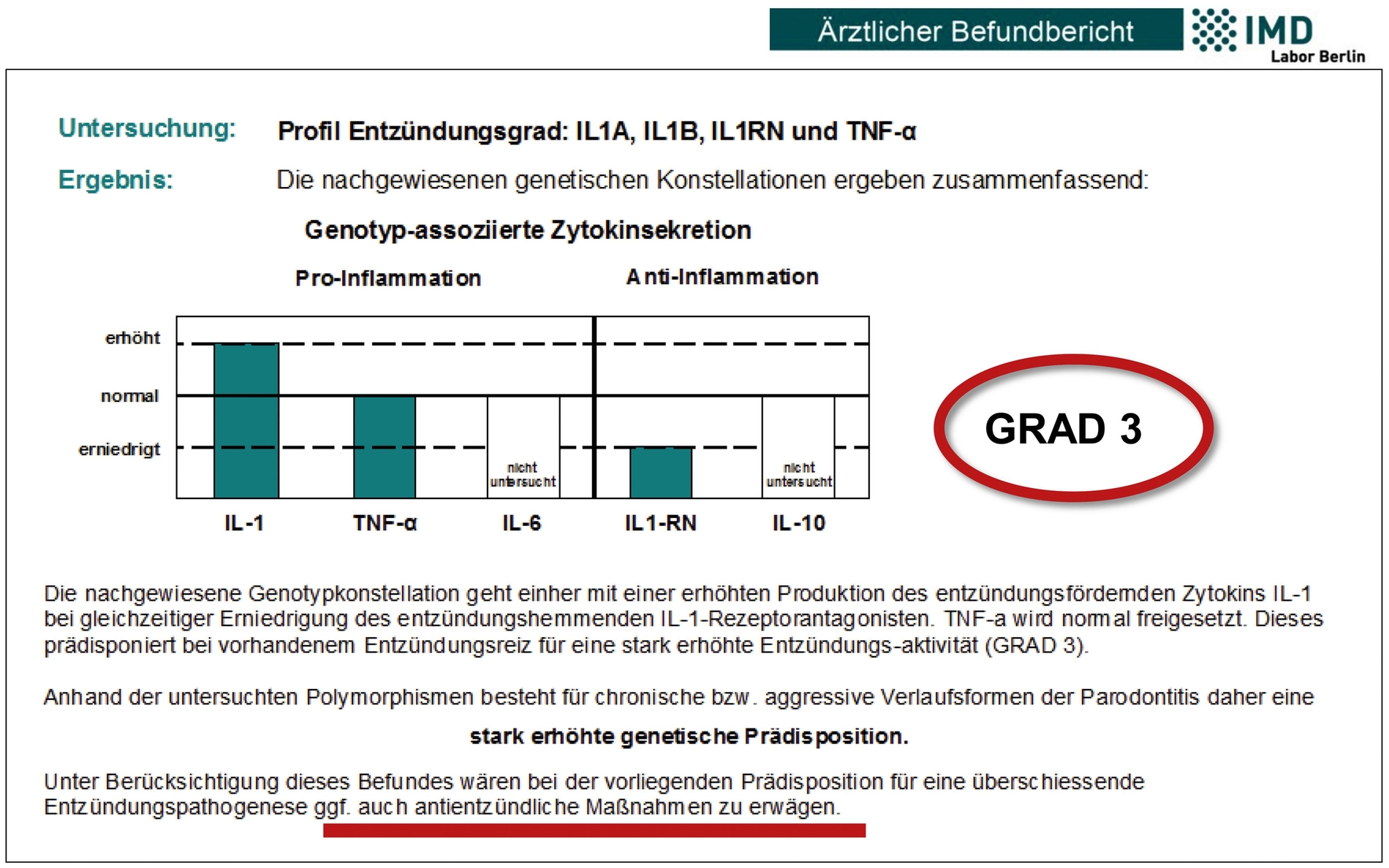
In diversen Studien wurde nachgewiesen, dass entzündete periimplantäre Gewebe (Periimplantitis/Mukositis) mit einer höheren Ansammlung von Titanpartikeln assoziiert sind. Funktionelle Makrophagenstimulationstests versuchen, diese immunologischen Reaktionen in vitro im individuellen Patientenblut zu analysieren [Dörner et al., 2006]. Es ist zudem nachgewiesen, dass Patienten genetische Prädispositionen für individuell unterschiedlich starke Entzündungsreaktionen aufweisen, die mittels genetischer Tests identifiziert werden können [Jacobi-Gresser et al., 2013; Stolzer et al., 2023]. Dem auslösenden Reiz steht immer eine individuelle immunologische Wirtsreaktion gegenüber, die durch genetische Varianten (funktionell relevante Polymorphismen) in den für die Entzündungsreaktion relevanten Genen bei jedem Patienten unterschiedlich ausfällt [Kornman et al., 1997].
Die enge Assoziation von genetischen Varianten zum Schweregrad der Entzündung wurde für die Parodontitis/Periimplantitis durch eine Vielzahl von Studien belegt [Deng et al., 2013; Mao et al., 2013; Ding et al., 2012; Ding et al., 2014]. Dabei ist zu beachten, dass Assoziationen zwar belegt sind, eine Kausalität aber nicht ohne Weiteres abzuleiten ist.
Die klinischen Symptome sind maßgeblich
Liegt der Verdacht auf eine Unverträglichkeitsreaktion vor, sind die klinischen Symptome der Patienten von entscheidender Bedeutung für die therapeutische Entscheidungsfindung. Diese Symptome zeigen sich durch lokale immunologisch bedingte Entzündungsreaktionen, die wiederum die ossäre Integration beeinträchtigen können.
Eine Abgrenzung zur ausschließlich bakteriell ausgelösten Periimplantitis kann sich mitunter schwierig gestalten, da sich bakterielle Trigger und partikelinduzierte Entzündungsreaktionen gegenseitig verstärken können. Eine leitlinienkonforme Periimplantitistherapie wird deshalb empfohlen.
Patientenfall mit vermuteter Titanunverträglichkeit
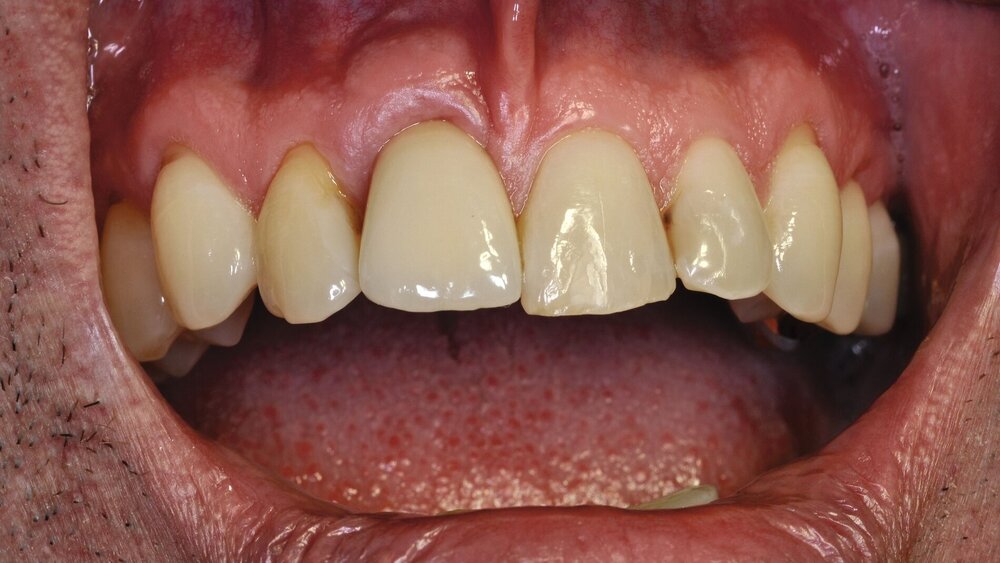
Einer Patientin (*1942) wurden 2011 Titanimplantate in den regiones 35 und 36 inseriert. 2016 zeigten sich erste Hinweise auf eine Entzündung der periimplantären Gewebe an Implantat 35. Zu diesem Zeitpunkt wurden die Bestimmung parodontologischer Markerkeime und lokale antientzündliche Maßnahmen (EMS AIRFLOW, ätherische Parodontitis-Ölmischung) durchgeführt, die eine Progression der Periimplantitis nicht mehr verhindern konnten. 2017 wurden die Explantation und eine histologische Untersuchung des periimplantären Entzündungsgewebes durchgeführt. Das benachbarte Implantat 36 ist über zwölf Jahre bis heute ohne Entzündungszeichen.
Abb. 1: Sondierung der 8 mm tiefen vestibulären Tasche mit diskreter putrider Sekretion beim regelmäßigen Hygiene-Recall: Die Patientin ist ohne Beschwerden.
Abb. 2: Sondierung nach Entfernung der verblockten Suprakonstruktion 35, 36 und Vorbereitung zur Entfernung von Implantat 35
Abb. 3: Zielaufnahme zur Darstellung des knöchernen Defekts an Implantat 35: Es zeigt sich distal ein schüsselförmiger Knochenverlust, der das benachbarte Implantat 36 noch nicht erfasst hat.
Abb. 4: Die mikrobiologische Analyse ergibt das Vorliegen von zwei parodontopathogenen Keimen (Pg, Tf) des roten Komplexes in stark erhöhter Konzentration.
Aa = Aggregatibacter actinomycetemcomitans, Pg = Porphyromonas gingivalis, Pi = Prevotella intermedia, Tf = Tannerella forsythensis, Td = Treponema denticola
Abb. 5: Das histologische Präparat (HE-Färbung) zeigt disseminierte Titanpartikel (Pfeile) mit angrenzender granulozytärer Entzündung (linke Bildhälfte).
Abb. 6: In der CD-68-Histoimmunfärbung sind die rot angefärbten aktivierten Makrophagen in der Nähe von Titanpartikeln zu erkennen. Ebenso finden sich Partikel intrazellulär, die durch Phagozytose vom Makrophagen aufgenommen wurden.
Suprakonstruktionen haben auch Gewebekontakt
Wenn es um die Debatte über Metallallergien oder Unverträglichkeitsreaktionen gegenüber Titan geht, ist es wichtig zu berücksichtigen, dass enossale Implantate hauptsächlich aus Reintitan (Grad 4) bestehen. Allerdings finden insbesondere in Suprakonstruktionen Titanlegierungen Grad 5 und andere Metalllegierungen Verwendung. Für bestimmte Metalle und Legierungen empfiehlt die deutsche Gesellschaft für Kontaktallergien (DGK) eine Epikutantestung beim Verdacht auf Vorliegen einer Allergie, diese beinhalten beispielsweise Amalgam (mit Zink), Zinn-II-chlorid oder Natriumthiosulfatoaurat (die Liste ist abrufbar unter dkg.ivdk.org/testreihen.html). Einige Metalllegierungen, die Kontaktsensibilisierungen auslösen, kommen auch in chirurgischen Instrumenten vor. Eine differenzierte und individuelle Betrachtung der Situation ist daher vorzunehmen.
Ein Auslassversuch der Suprakonstruktion sowie die leitliniengerechte Durchführung einer Periimplantitistherapie sollen erfolgen. Erst als letztes Mittel kommt eine Explantation in Betracht. Für Patienten, bei denen eine Titanunverträglichkeit vermutet wird, könnte die Verwendung von zahnmedizinischen Keramikimplantaten als mögliche Therapieoption in Betracht gezogen werden. Hierbei möchten wir auf die S3-Leitlinie für Keramikimplantate (AWMF-Registernummer: 083-039) verweisen. Da es für kieferorthopädische Verankerungsschrauben keine keramischen Alternativprodukte gibt, empfiehlt es sich, auf herkömmliche Verankerungsmethoden zurückzugreifen.
Literaturliste
von Baehr, V.; Mayer, W.; Liebenthal, C.; Baehr, R.; Bieger, W.; Volk, H.-D. Improving the in vitro antigen specific T cell proliferation assay: The use of interferon-alpha to elicit antigen specific stimulation and decrease bystander proliferation. Journal of immunological methods 2001, 251, 63-71, doi:10.1016/S0022-1759(01)00297-6.
Bi, Y.; Van De Motter, R.R.; Ragab, A.A.; Goldberg, V.M.; Anderson, J.M.; Greenfield, E.M. Titanium particles stimulate bone resorption by inducing differentiation of murine osteoclasts. J Bone Joint Surg Am 2001, 83, 501-508, doi:10.2106/00004623-200104000-00004.
Cadosch, D.; Chan, E.; Gautschi, O.P.; Meagher, J.; Zellweger, R.; Filgueira, L. Titanium IV ions induced human osteoclast differentiation and enhanced bone resorption in vitro. J Biomed Mater Res A 2009, 91, 29-36, doi:10.1002/jbm.a.32183.
Deng, J.S.; Qin, P.; Li, X.X.; Du, Y.H. Association between interleukin-1β C (3953/4)T polymorphism and chronic periodontitis: evidence from a meta-analysis. Hum Immunol 2013, 74, 371-378, doi:10.1016/j.humimm.2012.11.018.
Ding, C.; Zhao, L.; Sun, Y.; Li, L.; Xu, Y. Interleukin-1 receptor antagonist polymorphism (rs2234663) and periodontitis susceptibility: a meta-analysis. Arch Oral Biol 2012, 57, 585-593, doi:10.1016/j.archoralbio.2012.01.016.
Ding, C.; Ji, X.; Chen, X.; Xu, Y.; Zhong, L. TNF-α gene promoter polymorphisms contribute to periodontitis susceptibility: evidence from 46 studies. J Clin Periodontol 2014, 41, 748-759, doi:10.1111/jcpe.12279.
Dörner T, Haas J, Loddenkemper C, von Baehr V, Salama A. Implant-related inflammatory arthritis. Nat Clin Pract Rheumatol. 2006;2(1):53-56.
Jacobi-Gresser, E.; Huesker, K.; Schütt, S. Genetic and immunological markers predict titanium implant failure: a retrospective study. International journal of oral and maxillofacial surgery 2013, 42, 537-543, doi:10.1016/j.ijom.2012.07.018.
Kornman, K.S.; Crane, A.; Wang, H.Y.; di Giovine, F.S.; Newman, M.G.; Pirk, F.W.; Wilson, T.G., Jr.; Higginbottom, F.L.; Duff, G.W. The interleukin-1 genotype as a severity factor in adult periodontal disease. J Clin Periodontol 1997, 24, 72-77, doi:10.1111/j.1600-051x.1997.tb01187.x.
Kumazawa, R.; Watari, F.; Takashi, N.; Tanimura, Y.; Uo, M.; Totsuka, Y. Effects of Ti ions and particles on neutrophil function and morphology. Biomaterials 2002, 23, 3757-3764, doi:10.1016/s0142-9612(02)00115-1.
Maloney, W.J.; Smith, R.L.; Castro, F.; Schurman, D.J. Fibroblast response to metallic debris in vitro. Enzyme induction cell proliferation, and toxicity. The Journal of bone and joint surgery. American volume 1993, 75, 835-844, doi:10.2106/00004623-199306000-00005.
Mao, M.; Zeng, X.T.; Ma, T.; He, W.; Zhang, C.; Zhou, J. Interleukin-1α -899 (+4845) C→T polymorphism increases the risk of chronic periodontitis: evidence from a meta-analysis of 23 case-control studies. Gene 2013, 532, 114-119, doi:10.1016/j.gene.2013.09.043.
Mombelli, A.; Hashim, D.; Cionca, N. What is the impact of titanium particles and biocorrosion on implant survival and complications? A critical review. Clin Oral Implants Res 2018, 29 Suppl 18, 37-53, doi:10.1111/clr.13305.
Pettersson M, Kelk P, Belibasakis GN, Bylund D, Molin Thoren M, Johansson A (2016): Titanium ions form particles that activate and execute interleukin-1beta release from lipopolysaccharide-primed macrophages. J Periodontal Res. 52(1):21-32.
Romanos, G.E.; Fischer, G.A.; Delgado-Ruiz, R. Titanium Wear of Dental Implants from Placement, under Loading and Maintenance Protocols. Int J Mol Sci 2021, 22, doi:10.3390/ijms22031067.
Schliephake, H.; Reiss, G.; Urban, R.; Neukam, F.W.; Guckel, S. Metal release from titanium fixtures during placement in the mandible: an experimental study. The International journal of oral & maxillofacial implants 1993, 8, 502-511.
Stolzer, C.; Müller, M.; Gosau, M.; Henningsen, A.; Fuest, S.; Aavani, F.; Smeets, R. Do Titanium Dioxide Particles Stimulate Macrophages to Release Proinflammatory Cytokines and Increase the Risk for Peri-implantitis? J Oral Maxillofac Surg 2023, 81, 308-317, doi:10.1016/j.joms.2022.10.019.
Suarez-Lopez Del Amo, F.; Garaicoa-Pazmino, C.; Fretwurst, T.; Castilho, R.M.; Squarize, C.H. Dental implants-associated release of titanium particles: A systematic review. Clin Oral Implants Res 2018, doi:10.1111/clr.13372.
Summer, B.; Lill, D.; Remmel, K.; Schraml, A.; Schopf, C.; Banke, I.J.; Kuechenhoff, H.; Maierhofer, T.; Endres, S.; Thomas, P. An interleukin-1 polymorphism additionally intensified by atopy as prognostic factor for aseptic non-mechanical complications in metal knee and hip arthroplasty. Front Immunol 2022, 13, 1050315, doi:10.3389/fimmu.2022.1050315.
ten Harkel, B.; Schoenmaker, T.; Picavet, D.I.; Davison, N.L.; de Vries, T.J.; Everts, V. The foreign body giant cell cannot resorb bone, but dissolves hydroxyapatite like osteoclasts. PLoS One 2015, 10, e0139564, doi:10.1371/journal.pone.0139564.
Thomas, P.; Iglhaut, G.; Wollenberg, A.; Cadosch, D.; Summer, B. Allergy or tolerance: reduced inflammatory cytokine response and concomitant IL-10 production of lymphocytes and monocytes in symptom-free titanium dental implant patients. Biomed Res Int 2013, 2013, 539834, doi:10.1155/2013/539834.
Tibau, A.V.; Grube, B.D.; Velez, B.J.; Vega, V.M.; Mutter, J. Titanium exposure and human health. Oral Science International 2019, 16, 15-24, doi:https://doi.org/10.1002/osi2.1001.
Zhou, Z.; Shi, Q.; Wang, J.; Chen, X.; Hao, Y.; Zhang, Y.; Wang, X. The unfavorable role of titanium particles released from dental implants. Nanotheranostics 2021, 5, 321-332, doi:10.7150/ntno.56401.