Biologisches Wunddebridement mit Fliegenmaden
Ein 63-jähriger Patient stellte sich als Notfall in unserer Fachabteilung für Mund-, Kiefer- und Gesichtschirurgie der Helios Dr. Horst Schmidt Kliniken in Wiesbaden vor. Vorausgegangen war einen Monat vorher ein stationärer Aufenthalt in der Augenklinik zur Therapie einer Orbitaphlegmone mit einem CRP-Wert von 33,9 mg/dl.
Bei schlechtem Allgemeinzustand, Fieber, Tachykardie und Leukozytose war seitens der Kollegen initial ein Sepsisausschluss mittels Blutkulturen erfolgt. Aufgrund temporoparietaler Effloreszenzen mit Bläschenbildung wurde die Verdachtsdiagnose eines Herpes zoster gestellt. Bei dem Mann waren außerdem ein nicht eingestellter Diabetes mellitus Typ 2 (HbA1c = 10,5), eine Leberzirrhose und eine präsenile Demenz bekannt. Die begonnene intravenöse antibiotische und antivirale Therapie zeigte initial eine Befundverbesserung, so dass der Patient vonseiten der augenärztlichen Kollegen in die ambulante Nachsorge entlassen wurde.
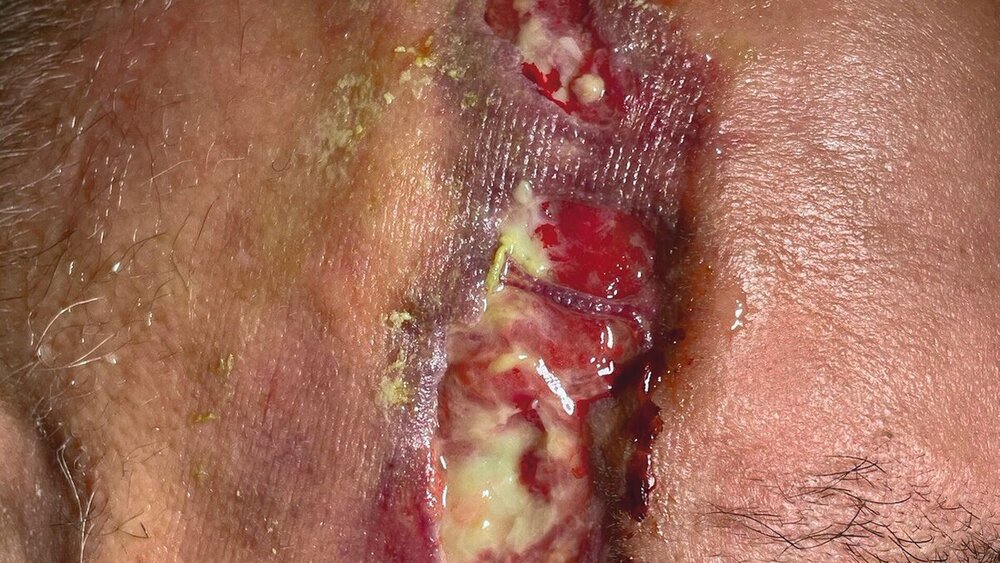
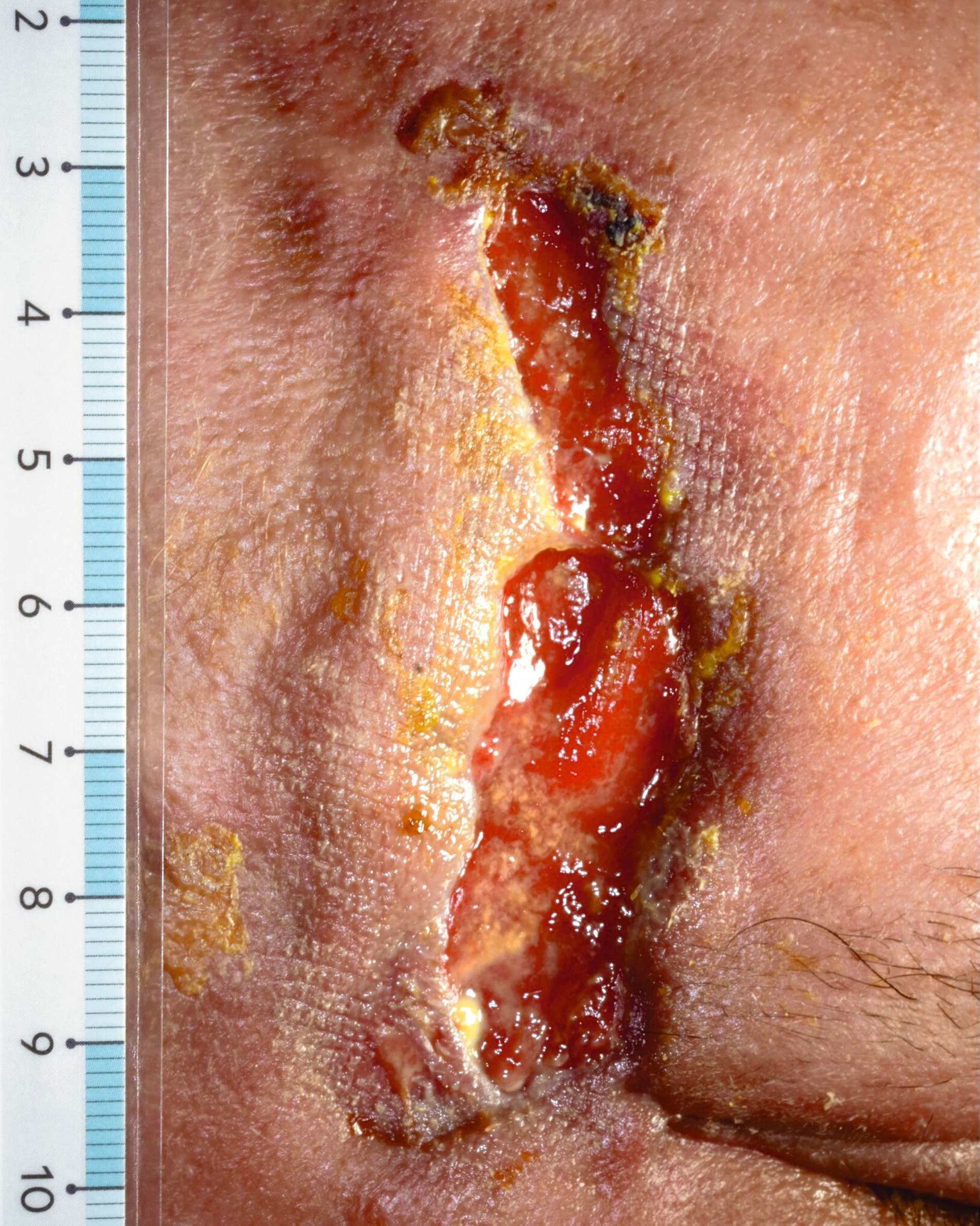
Vier Wochen später wurde er mit progredienter Schmerzsymptomatik und einer offenen, nässenden Wunde mit zentralen Gewebenekrosen temporoparietal rechts in unserer Fachabteilung vorstellig und im Folgenden stationär betreut (Abbildung 1). Aufgrund der ursprünglichen Therapie der Opthalmologen setzten wir die antivirale Therapie zunächst fort.
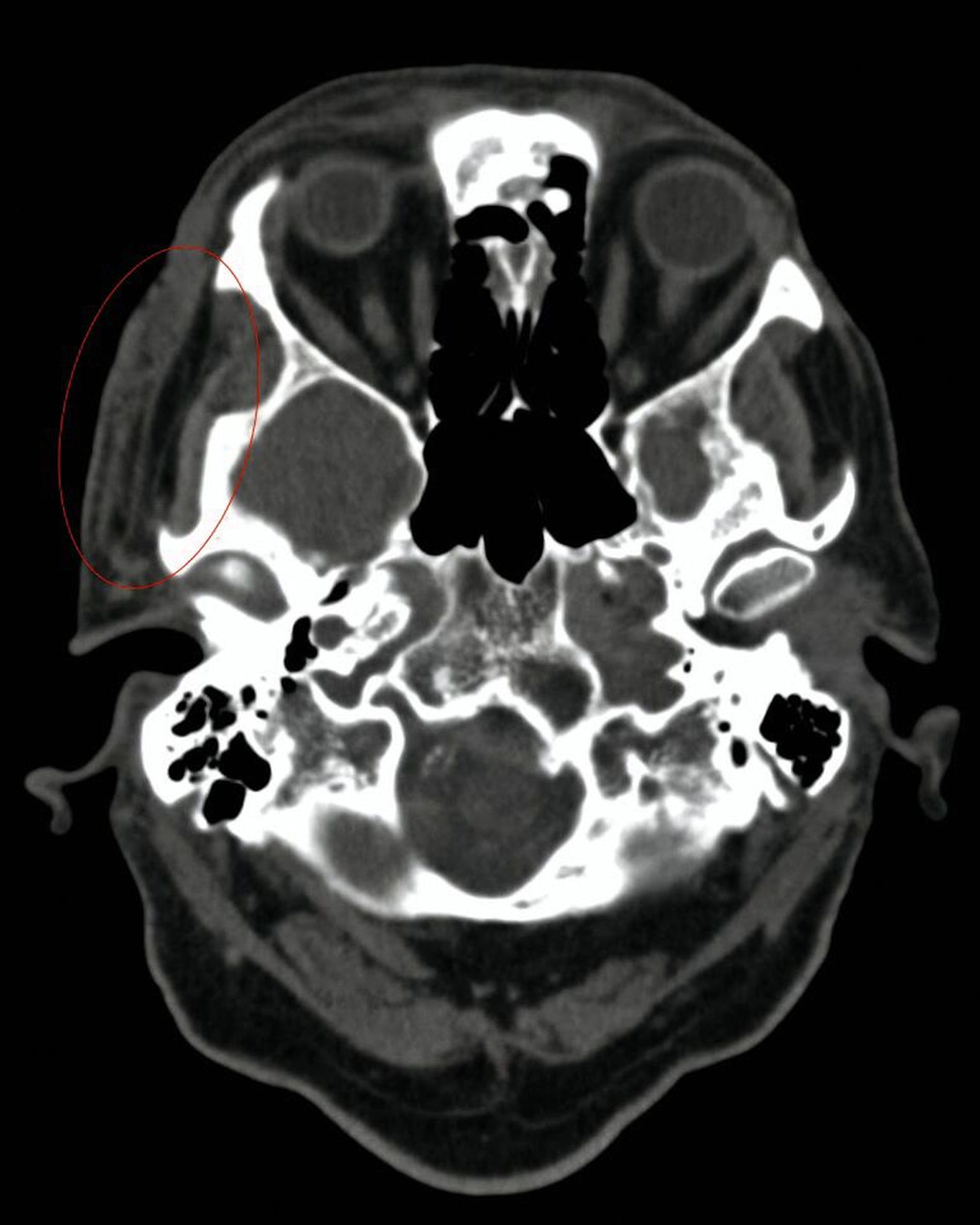
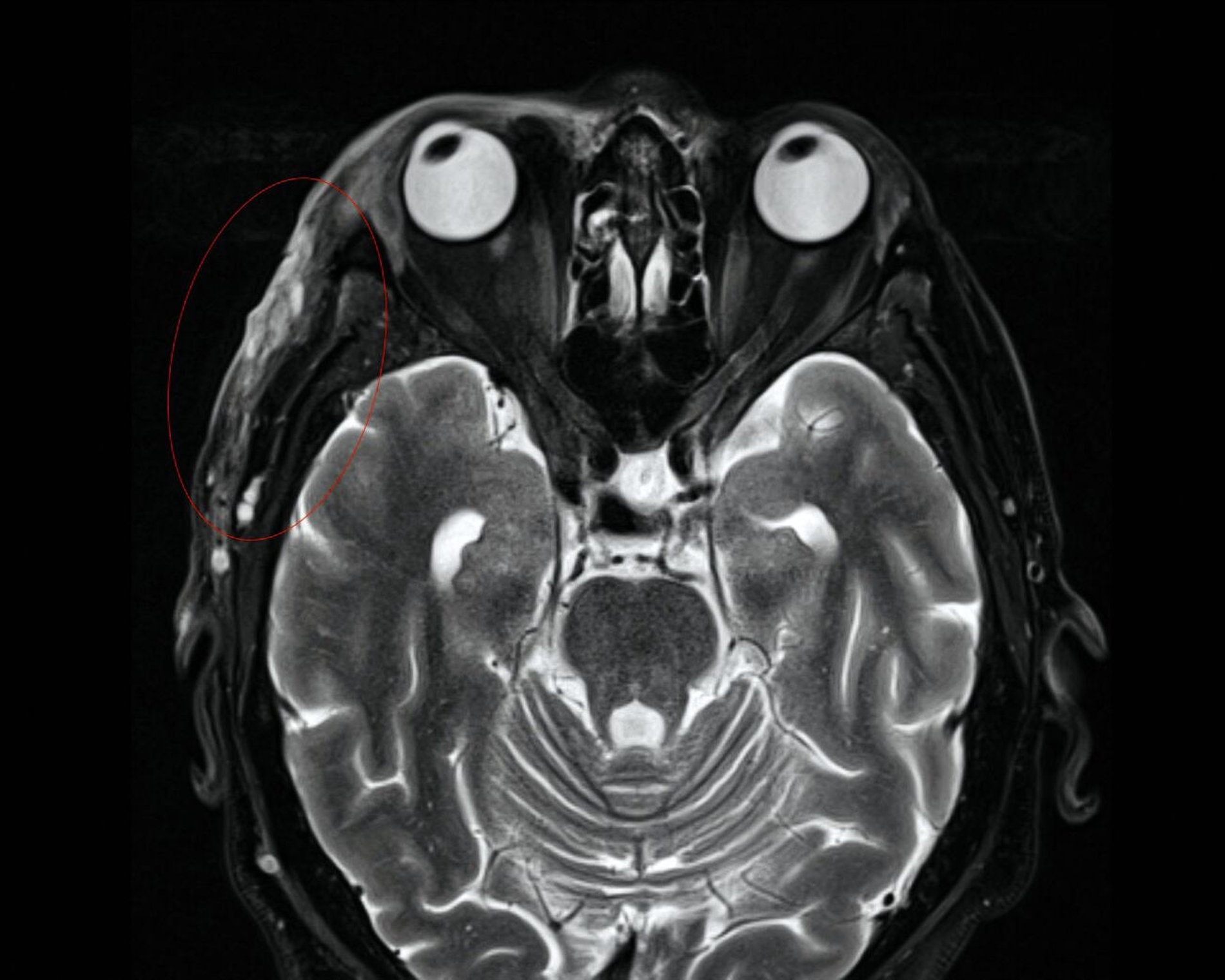
Aufgrund des klinisch-makroskopischen Bildes mit progressiver Gewebenekrose, fehlender segmentaler wasserklarer Bläschen wurde der Zoster durch PCR ausgeschlossen und die antivirale Therapie beendet. Ein maligner Tumor fand sich in der Probeexzision vom Aufnahmetag nicht. Ebenso wurde per Computertomografie (CT) und Magnetresonanztomografie (MRT) eine intrazerebrale und intraorbitale Beteiligung ausgeschlossen. Allerdings zeigten sich rechts temporoparietal eine zunehmende Dichteanhebung, paraseptale Lufteinschlüsse und eine Schwellung des Weichgewebes mit progredienter Ausweitung im Vergleich zu den Aufnahmen einen Monat zuvor (Abbildungen 2 und 3). In der Zusammenschau von Klinik, Bildgebung und dem positiven Befund eines Staphylococcus aureus in der zwischenzeitlich erfolgten mikrobiologischen Analyse wurde die Diagnose einer akut nekrotisierenden Fasziitis gestellt.
Auf erneute Nachfrage berichtete die Ehefrau nun über einen Mückenstich, der in der Vergangenheit von dem Patienten aufgekratzt worden war und den wir retrospektiv als Eintrittspforte bewerten.
Der Patient erhielt daraufhin über 21 Tage eine antibiotische Therapie mittels Piperacillin/Tazobactam 4,0 g / 0,5 g intravenös (1-1-1) und eine bedarfsangepasste analgetische Therapie. Auf ein klassisch-chirurgisches Wunddebridement wurde aufgrund der anatomisch engen Lagebeziehung zum Auge bei Befall von Ober- und Unterlid in diesem Fall verzichtet.
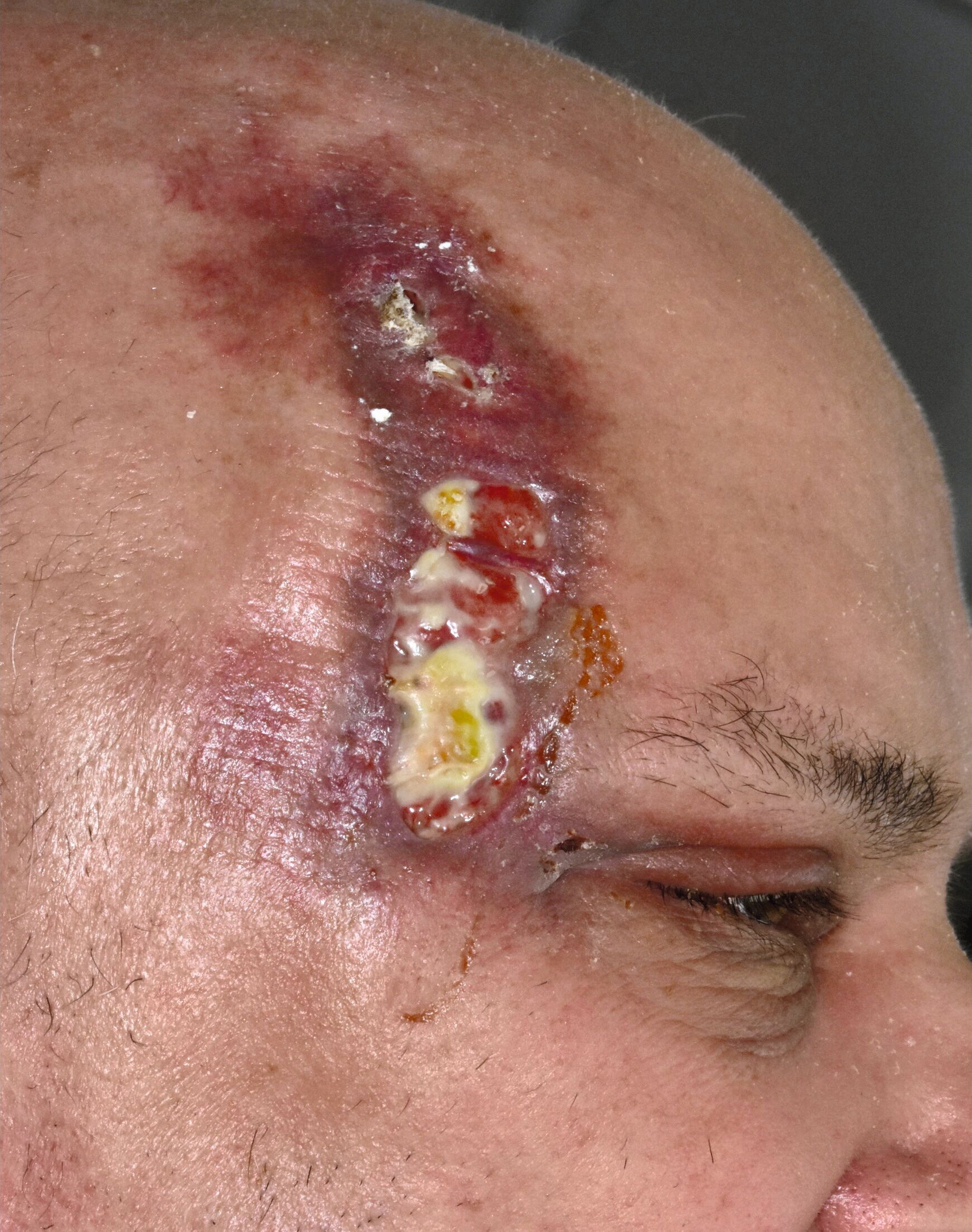
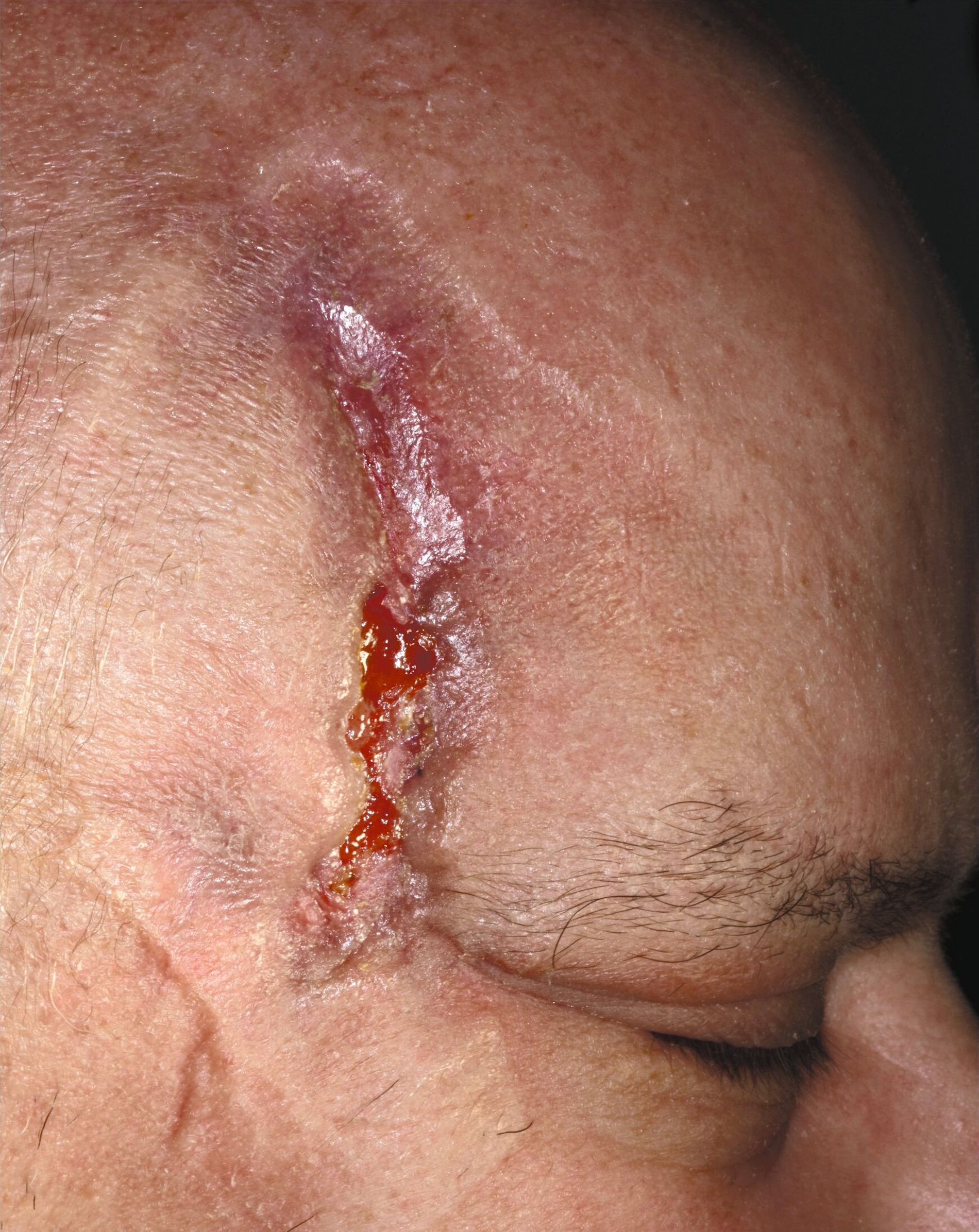
Stattdessen erfolgte das Wunddebridement mit einer Maden-Therapie der Goldfliege Lucilia sericata (BioBag®, BioMonde GmbH, Barsbüttel) über vier Zyklen, um nekrotisches Gewebe zu entfernen und die Wunde so zu desinfizieren (Abbildungen 4 und 5). Infolgedessen stabilisierten sich der Allgemeinzustand, die Schmerzsymptomatik und das makroskopische Wundbild rasch, so dass der Patient nach drei Wochen stationären Aufenthalts und unter Erhalt seiner Augenlider ohne mutilierende chirurgische Resektionen in die ambulante Nachsorge entlassen werden konnte (Abbildung 6).
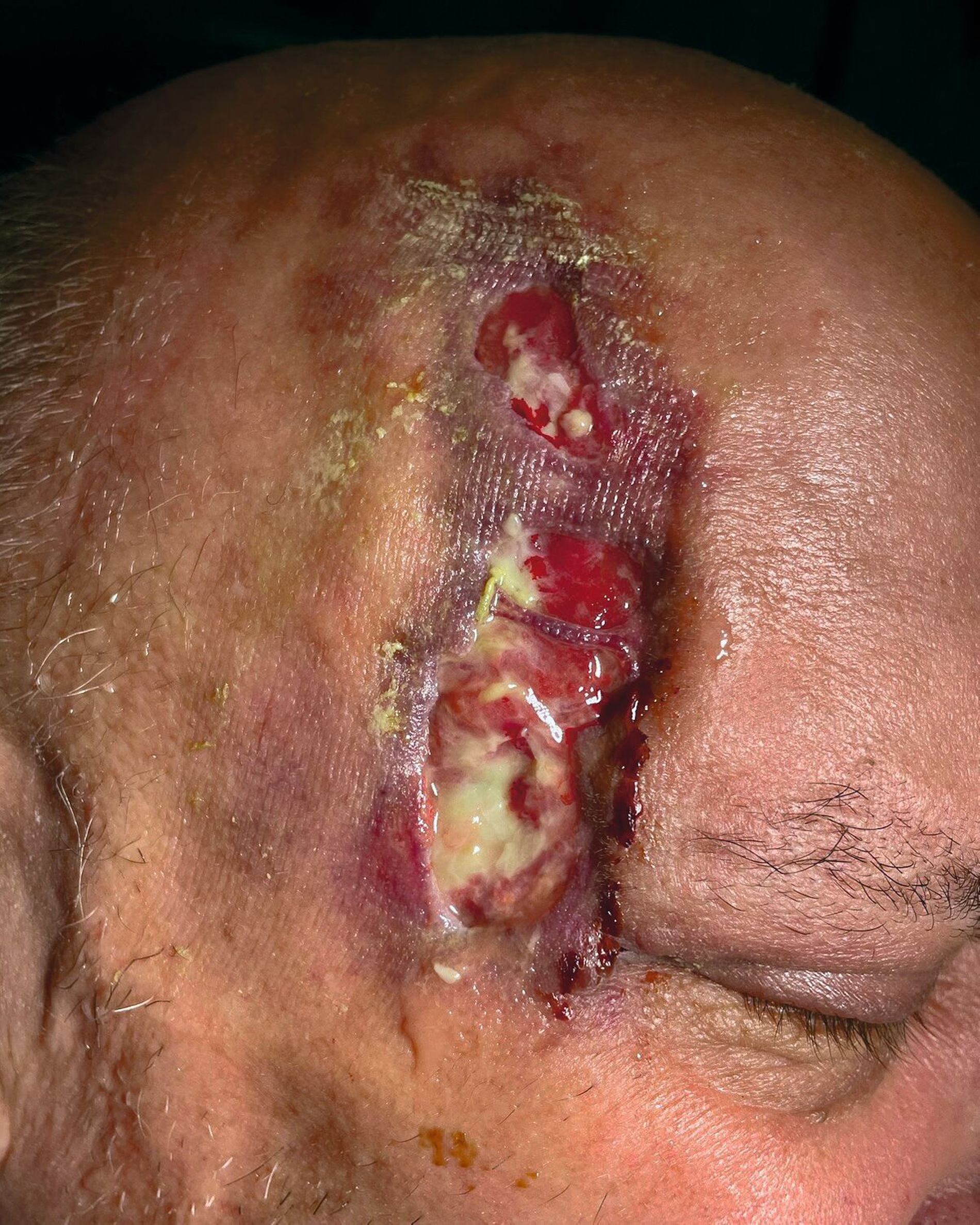
Im ambulanten Setting wurden die Maden-Therapie beendet und die weitere Wundnachsorge durch Chlorhexidin-Gel-Applikation 10mg/g (Chlorhexamed Mundgel, GlaxoSmithKline Consumer Healthcare GmbH & Co. KG, München) und superabsorbierende Silikonverbände fortgesetzt (Zetuvit® Plus Silicone Border, Paul Hartmann AG, Heidenheim). Aufgrund der eingeschränkten Compliance bei präseniler Demenz wurde ein ambulanter Pflegedienst für die Verbandswechsel organisiert, die wechselseitig durch uns und den Pflegedienst alle drei Tage erfolgten (Abbildung 7). Zudem wurde der Patient zur weiteren Therapie der Leberzirrhose und des Diabetes hausärztlich angebunden.
Definition und Ätiologie
Die nekrotisierende Fasziitis ist eine seltene und zugleich fulminant verlaufende Infektion der Subcutis, die fortgeleitet über die Faszien letztendlich zur Nekrose der oberflächlichen Haut führt und bereits im fünften Jahrhundert v. Chr. von Hippokrates beschrieben wurde. Aufgrund der hohen Durchblutung im Hals- und Kopfbereich ist das Krankheitsbild hier seltener und tritt vermehrt in der Lendenregion (Fournier-Gangrän) und an den Extremitäten auf [Descamps et al., 1994].
Gefürchtete Komplikationen wie Sepsis, Schock und Multiorganversagen lassen die Mortalität mit 10,0 bis 14,4 Prozent hoch ausfallen [Lazzeri et al., 2010]. Risikofaktoren sind Alkoholismus, Diabetes mellitus, Kollagen- und Gefäßerkrankungen, rheumatoide Arthritis, systemischer Lupus erythematodes, tiefe Venenthrombose und Immunsuppressiva [Scheepers et al., 2010].
Ursächlich für die Infektion sind in den meisten Fällen grampositive Gruppe-A beta-hämolytische Streptokokken (GABHS), gefolgt von Pseudomonas. In einem Review von Amrith et al. waren sieben von 20 untersuchten Fällen Mischinfektionen, die auf GABHS und Staphylococcus aureus zurückzuführen waren [Amrith et al., 2013].
Das M-Protein in der Zellwand der GABHS ist ein Superantigen, das für die Virulenz des Organismus verantwortlich ist, da es die Antikörper-vermittelte Phagozytose hemmt. Diese Stämme sezernieren auch die Exotoxine A und B, was zu einer Protease-induzierten Gewebezerstörung und einem toxischen Schock führt. Wie in unseren Fallbericht ist die Eintrittspforte für Bakterien meist ein Trauma, das so trivial sein kann, dass die Patienten oft nicht in der Lage sind, sich rückwirkend daran zu erinnern [Amrith et al., 2013; Gates et al., 2001].
Aufgrund der geringen Inzidenz von nur 0,24 pro 1.000.000 Einwohner pro Jahr kann die rasche Diagnosestellung dieser seltenen Erkrankung erschwert sein [Flavahan et al., 2014]. Da die Haut über der Schwellung erythematös erscheint und Bullae zusammen mit livider Verfärbung imponieren können, kann das klinische Bild mit einem Erysipel oder einer viralen Erkrankung wie dem Zoster verwechselt werden [Amrith et al., 2013]. Die massive Erhöhung der Leukozyten im Blutbild stellt hier ein deutliches Krankheitszeichen dar [Wong et al., 2004].
Im fortgeschrittenen Stadium lässt sich eine Krepitation der Weichteile vernehmen, die radiologisch als eingeschlossene Luftblasen verifizierbar ist. CT und MRT sind somit wichtige Hilfsmittel, um Differenzialdiagnosen auszuschließen und die Ausbreitung in den Weichteilen und auf Faszienebene abzuschätzen, lange bevor kutane Nekrosen sichtbar sind [Wysoki et al., 1997].
Durch Thromben der kleineren und kleinsten Blutgefäße ist die Bioverfügbarkeit der Antibiotika in den betroffenen Hautarealen stark reduziert. Daher muss die antibiotische Therapie zusätzlich mit einem unverzüglich begonnenen Wunddebridement kombiniert werden, das klassischerweise chirurgisch-resektiv erfolgt. Daneben sind mikrobiologische Untersuchungen für die Wahl der Antibiose entscheidend. Beta-Lactam-Antibiotika (wie Penicilline oder Cephalosporine) und Clindamycin sind hier der Standard. Benzyl-Penicillin ist besonders wirksam gegen GABHS [Amrith et al., 2013].
Ein wiederholtes Debridement kann notwendig werden, wenn das Ansprechen auf die Behandlung nicht adäquat ausfällt. Folgend müssen dann umfangreiche resektive Eingriffe durchgeführt werden, die eine rekonstruktive Wiederherstellungschirurgie zu einem späteren Zeitpunkt erforderlich machen. Die schwerwiegendste Komplikation stellt dabei die Entfernung des Augapfels – und damit konsekutiv der Verlust der Sehkraft – dar [Wysoki et al., 1997].
Hintergrund
Lange bevor moderne Antibiotika die Medizin revolutionierten, wurden Maden zur Reinigung von Wunden beim Ngemba-Stamm der Aborigines oder von den Maya eingesetzt. Im Mittelalter ging dieses Wissen teilweise verloren, so dass nur sporadische Berichte davon existieren. Beispielsweise bemerkte 1799 der französische Chirurg Baron Dominique Jean Larrey im Zuge der Ägypten-Expedition von Napoleon Bonaparte, dass „blaue Fliegen“ nekrotisches Gewebe aus Wunden selektiv entfernen [Wollina, 2019]. Sein Therapieansatz scheiterte allerdings, da er die französischen Soldaten von der unappetitlichen Anwendung nicht überzeugen konnte.
Erst als der US-amerikanische Chirurg William S. Baer durch seine gewonnenen Erkenntnisse aus dem Ersten Weltkrieg erfolgreich 21 Osteomyelitis-Patienten behandelte, hatte die Madentherapie in der modernen Medizin ihren Durchbruch [Courtenay, 1999; Remba et al., 2010]. In den 1930er-Jahren erschienen zu diesem Thema zahlreiche Publikationen. Als aber das 1928 von Alexander Fleming entdeckte Penicillin seinen Siegeszug antrat, brach das Interesse an dieser „Biochirurgie“ schlagartig ein [Sherman & Pechter, 1988; Wollina, 2019].
Im heutigen Kontext der weltweit vermehrt auftretenden Antibiotika-Resistenzen scheint die Madentherapie wieder neue Relevanz zu erhalten. Die unter sterilen Bedingungen gezüchteten Maden der Goldfliege Lucilia sericata eignen sich für die Therapie besonders gut. Dabei werden die Maden in einem geschlossenen Verband auf die Wunde aufgebracht. Da die Maden keine Zähne besitzen, sezernieren sie ihren proteolytisch wirkenden Speichel (Carboxypeptidase A und B, Leucin-Aminopeptidase, Kollagenase und Serin-Proteasen) auf die Wunde und verflüssigen hoch-selektiv das nekrotische Gewebe [Horobin et al., 2003; Prete, 1997].
Anschließend saugen sie ihre Nahrung auf, wodurch die Maden schnell wachsen und die Verbände alle drei bis vier Tage gewechselt werden müssen. Des Weiteren fördern die antiinfektiös wirkenden Substanzen Phenylacetat, Phenacetaldehyd und Allantoin aus dem Speichel der Maden den Heilprozess. Allantoin verstärkt die Zellproliferation und Epithelbildung, wobei nekrotisches Gewebe entfernt wird. Die mechanische Stimulation durch hakenförmige Mandibeln und Stacheln stimuliert zusätzlich die Wundheilung [Amrith et al., 2013; Dauros Singorenko et al., 2017].
Miss- oder Schmerzempfindungen werden nur selten während der Anwendung beschrieben und machen in der Regel keinen Therapieabbruch erforderlich. Erfolgt die Anwendung der Madentherapie geschlossen in einem Wundverband, erhöht dies die Akzeptanz der Patienten – die in unserer Erfahrung immer hoch war.
Diskussion
Die nekrotisierende Fasziitis stellt mit einer Inzidenz von 0,24 pro 1.000.000 Einwohnern pro Jahr ein äußert seltenes Krankheitsbild dar. Im September 2023 berichteten allerdings die augenärztlichen Kollegen der LMU München in einer Fallserie über ein stark gehäuftes Auftreten genau dieses Krankheitsbildes an ihrer Poliklinik [Schuh A et al., 2023]. Sie behandelten zwischen Januar und März 2023 fünf Patienten, die an einer nekrotisierenden Fasziitis litten. Alle Patienten waren männlich, einer litt an Diabetes, bei drei Männern waren Gaseinschlüsse radiologisch nachweisbar und vier entwickelten im Verlauf eine Sepsis. Mikrobiologisch waren in allen fünf Fällen – anders als im vorliegenden Fall – Gruppe-A-Streptokokken (GABHS) nachweisbar.
Am 15. Dezember 2022 berichtete die WHO zudem über ein vermehrtes Auftreten von Scharlach und GABHS [WHO, 2022]. Auch in Deutschland sind laut RKI A-Streptokokken vermehrt registriert worden [RKI, 2022]. Die während der COVID-19-Pandemie eingehaltenen weltweiten Quarantänemaßnahmen könnten das Immunsystem für diese Erreger anfälliger gemacht haben, so dass es nun zu einem vermehrten Auftreten kommt [Schuh A et al., 2023].
Im Unterschied zu den Kollegen in München führten wir kein klassisch-chirurgisches Wunddebridement durch, sondern erreichten die Entfernung des nekrotischen Gewebes und die Eindämmung der Progression mit der beschriebenen Madentherapie (bioablative Nekrektomie durch Lucilia sericata) in Kombination mit einer intensivierten intravenösen Antibiotikatherapie. Wir sahen einen Vorteil in der „Biochirurgie“ durch den minimalinvasiven Ansatz.
Aufgrund der ausgedehnten lividen Verfärbung durch die Mikrothromben und die Nähe sowohl zum Ober- als auch zum Unterlid, hätte ein primär chirurgisch-resektiver Ansatz zu einer deutlichen Mutilation des Patienten geführt. Wir befürchteten aufgrund des entgleisten Diabetes und der Leberzirrhose weitere Wundheilungsstörungen postoperativ.
Die Maden-Therapie stellt in unseren Augen jedoch einen besonderen Therapieansatz und nicht das Regelvorgehen dar. Sie sollte in unseren Augen bei der nekrotisierenden Fasziitis immer nur dann zur Anwendung kommen, wenn es die Ausdehnung des Befunds noch zulässt. In unserem Fall lag zwar ein ausgedehntes und mit kritischen anatomischen Strukturen beteiligtes Wundareal vor, die Infektion lag jedoch lediglich im Bereich der superfizialen, gut durchbluteten Gesichtsweichteile und war daher der Maden-Therapie zugänglich. Eine Beteiligung tieferer Strukturen (Orbita, Muskelnekrosen) war CT-morphologisch vorab ausgeschlossen worden.
Zudem sind engmaschige Visiten gerade zu Beginn obligat, um bei weiterem Progress unter Maden-Therapie die resektiv-chirurgische Standardtherapie zügig nachziehen zu können. Generell entscheidend sind daher die rasche Diagnosestellung und der unverzügliche Start des Wunddebridements, um die Bioverfügbarkeit der hochdosierten intravenösen Antibiotikatherapie im betroffenen Hautareal und das Gesamtergebnis für die betroffenen Patienten zu verbessern.
Aufgrund der aktuell vermehrt auftretenden Fälle und der Dringlichkeit in der Diagnosestellung wollen wir mit dem vorliegenden Fallbericht die Zahnärzteschaft für das ansonsten seltene Krankheitsbild der nekrotisierenden Fasziitis sensibilisieren. Zahnärzte übernehmen die wichtige ambulante Betreuung von Patienten vor Ort und sind meist erster Ansprechpartner für gesundheitliche Fragen im Kopf-Hals-Bereich, so dass dadurch die zeitnahe Vermittlung an Kliniken erfolgen kann.
Literaturliste
Amrith, S., Hosdurga Pai, V., & Ling, W. W. (2013). Periorbital necrotizing fasciitis - A review. In Acta Ophthalmologica (Vol. 91, Issue 7, pp. 596–603). doi.org/10.1111/j.1755-3768.2012.02420.x.
Courtenay, M. (1999). The use of larval therapy in wound management in the UK. Journal of Wound Care, 8(4), 177–179. doi.org/10.12968/JOWC.1999.8.4.25866.
Dauros Singorenko, P., Rosario, R., Windsor, J. A., Phillips, A. R., & Blenkiron, C. (2017). The transcriptional responses of cultured wound cells to the excretions and secretions of medicinal Lucilia sericata larvae. Wound Repair and Regeneration : Official Publication of the Wound Healing Society [and] the European Tissue Repair Society, 25(1), 51–61. doi.org/10.1111/WRR.12499.
Descamps, V., Aitken, J., & Lee, M. G. (1994). Hippocrates on necrotising fasciitis. Lancet (London, England), 344(8921), 556. doi.org/10.1016/S0140-6736(94)91956-9.
Flavahan, P. W., Cauchi, P., Gregory, M. E., Foot, B., & Drummond, S. R. (2014). Incidence of periorbital necrotising fasciitis in the UK population: a BOSU study. The British Journal of Ophthalmology, 98(9), 1177–1180. doi.org/10.1136/BJOPHTHALMOL-2013-304735.
Gates, R. L., Cocke, W. M., & Rushton, T. C. (2001). Invasive streptococcal infection of the periorbita and forehead. Annals of Plastic Surgery, 47(5), 565–567. doi.org/10.1097/00000637-200111000-00017.
Horobin, A. J., Shakesheff, K. M., Woodrow, S., Robinson, C., & Pritchard, D. I. (2003). Maggots and wound healing: an investigation of the effects of secretions from Lucilia sericata larvae upon interactions between human dermal fibroblasts and extracellular matrix components. The British Journal of Dermatology, 148(5), 923–933. doi.org/10.1046/J.1365-2133.2003.05314.X.
Lazzeri, D., Lazzeri, S., Figus, M., Tascini, C., Bocci, G., Colizzi, L., Giannotti, G., Lorenzetti, F., Gandini, D., Danesi, R., Menichetti, F., Del Tacca, M., Nardi, M., & Pantaloni, M. (2010). Periorbital necrotising fasciitis. The British Journal of Ophthalmology, 94(12), 1577–1585. doi.org/10.1136/BJO.2009.167486.
Prete, P. E. (1997). Growth effects of Phaenicia sericata larval extracts on fibroblasts: Mechanism for wound healing by maggot therapy. Life Sciences, 60(8), 505–510. doi.org/10.1016/S0024-3205(96)00688-1.
Remba, S. J., Varon, J., Rivera, A., & Sternbach, G. L. (2010). Dominique-Jean Larrey: The effects of therapeutic hypothermia and the first ambulance. Resuscitation, 81(3), 268–271. doi.org/10.1016/j.resuscitation.2009.11.010.
RKI. (2022). RKI - Streptococcus pyogenes (Scharlach) - Inzidenzanstieg von Gruppe-A-Streptokokken-Infektionen (z.B. Scharlach). www.rki.de/DE/Content/InfAZ/S/Scharlach/invasive_Gruppe-A-Streptokokken-Infektionen.html.
Scheepers, M. A., Keel, S., & Michaelides, M. (2010). Bilateral necrotising fasciitis of the ocular adnexa secondary to Pseudomonas aeruginosa septicaemia in a HIV-positive child. Orbit (Amsterdam, Netherlands), 29(1), 63–64. doi.org/10.3109/01676830903258847.
Schuh A, Keidel L, Siegmund B, Otto S, Priglinger S, & Hintschich C. (2023). Locally increased incidence of periorbital necrotizing fasciitis—a case series. Dtsch Arztebl Int , 35–36, 595–596.
Sherman, R. A., & Pechter, E. A. (1988). Maggot therapy: a review of the therapeutic applications of fly larvae in human medicine, especially for treating osteomyelitis. Medical and Veterinary Entomology, 2(3), 225–230. doi.org/10.1111/J.1365-2915.1988.TB00188.X.
Wollina, U. (2019). Biochirurgie - Geschichte, Wirkungsmechanismen und klinische Erfahrungen. (2019th ed.).
Wong, C. H., Khin, L. W., Heng, K. S., Tan, K. C., & Low, C. O. (2004). The LRINEC (Laboratory Risk Indicator for Necrotizing Fasciitis) score: a tool for distinguishing necrotizing fasciitis from other soft tissue infections. Critical Care Medicine, 32(7), 1535–1541. doi.org/10.1097/01.CCM.0000129486.35458.7D.
WHO. (2022). Increased incidence of scarlet fever and invasive Group A Streptococcus infection - multi-country. www.who.int/emergencies/disease-outbreak-news/item/2022-DON429.
Wysoki, M. G., Santora, T. A., Shah, R. M., & Friedman, A. C. (1997). Necrotizing fasciitis: CT characteristics. Radiology, 203(3), 859–863. doi.org/10.1148/RADIOLOGY.203.3.9169717.