Rezidivierendes multiples Myelom mit oraler Manifestation
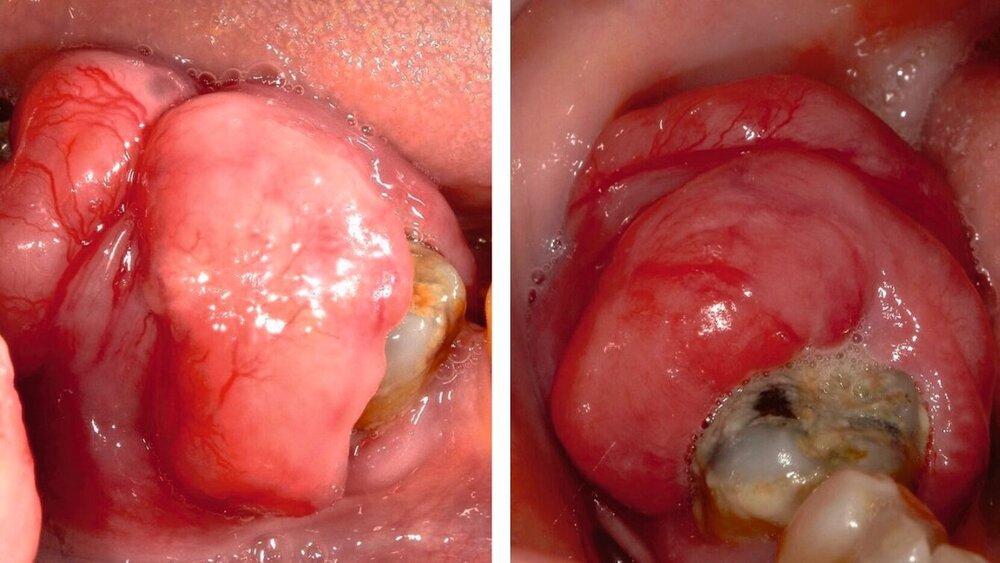
Eine 73-jährige Patientin stellte sich mit einer schmerzlosen Wucherung in Regio 46 bis 48 in der Klinik für Zahn-, Mund- und Kieferkrankheiten der Universitätsmedizin Mainz vor. Die Raumforderung hatte sich innerhalb von zehn Wochen entwickelt. In der überweisenden Zahnarztpraxis wurde der Verdacht auf ein Plattenepithelkarzinom gestellt. Es gab keine Anzeichen für Schmerzen, eine Zahnlockerung oder Blutungen.
Anamnestisch stellte sich heraus, dass bei der Patientin bereits vor 20 Jahren ein multiples Myelom mit ossärer Metastasierung diagnostiziert und behandelt worden war. Damals war eine Stammzelltransplantation durchgeführt worden, außerdem war eine medikamentöse Therapie durch Bisphosphonat-Gabe von 2004 bis 2006 erfolgt.
Diagnostik
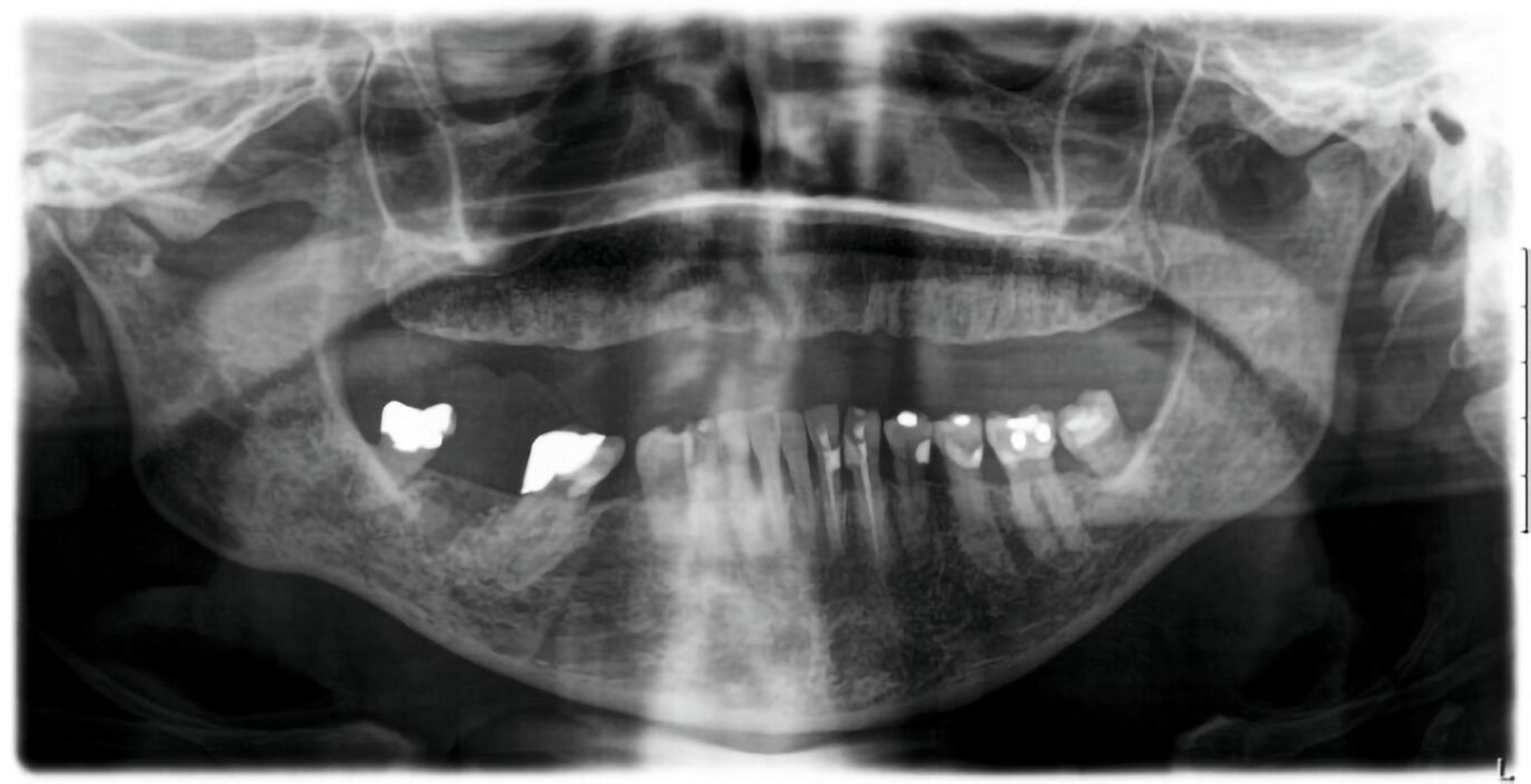
Klinisch waren zum Vorstellungszeitpunkt keine Beeinträchtigungen der Durchblutung, der Motorik oder der Sensibilität zu beobachten. Es zeigte sich eine weiche, nicht ulzerierte, schmerzlose Schwellung in Regio 46 bis 48 (Abbildung 1). Das OPTG ergab eine persistierende Extraktionsalveole, was zur Medikamenten-Anamnese (Z.n. Bisphosphonattherapie) passt (Abbildung 2).
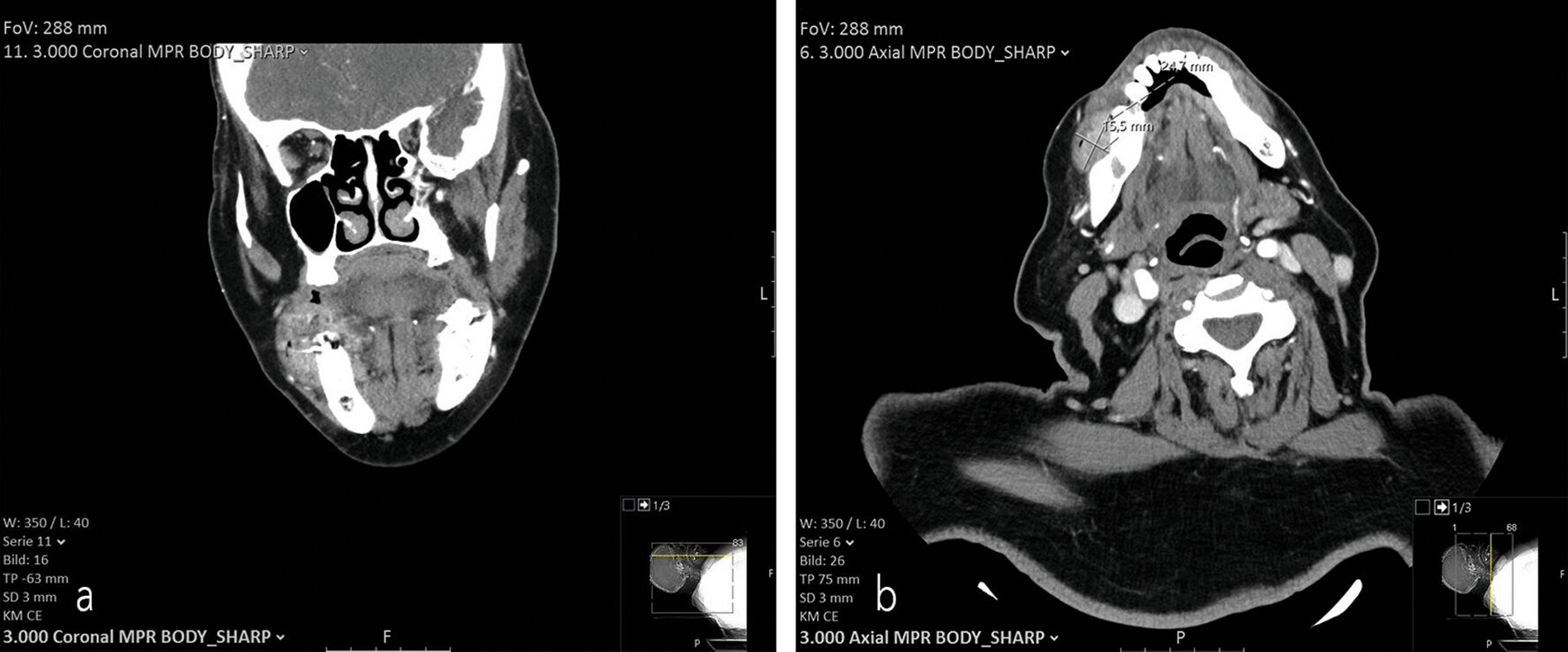
Zur weiteren Abklärung wurde eine CT-Untersuchung durchgeführt, um die Knochensituation im Bereich der Läsion detaillierter darzustellen (Abbildung 3). Das typische Bild eines multiplen Myeloms mit osteolytischen Läsionen, die als scharf abgegrenzte, dunkle Bereiche innerhalb des normalerweise dichteren Knochens sichtbar werden, zeigte sich nicht [Heimes & Kämmerer, 2022]. Stattdessen ist keine Knochenarrosion erkennbar, wie sie bei einem multiplen Myelom auftreten kann. Die CT-Aufnahme zeigt lediglich die klinisch sichtbare Weichteilvermehrung im Bereich der Läsion, die zusätzlich auf eine mögliche Tumorausdehnung ins umliegende Gewebe hinweist.
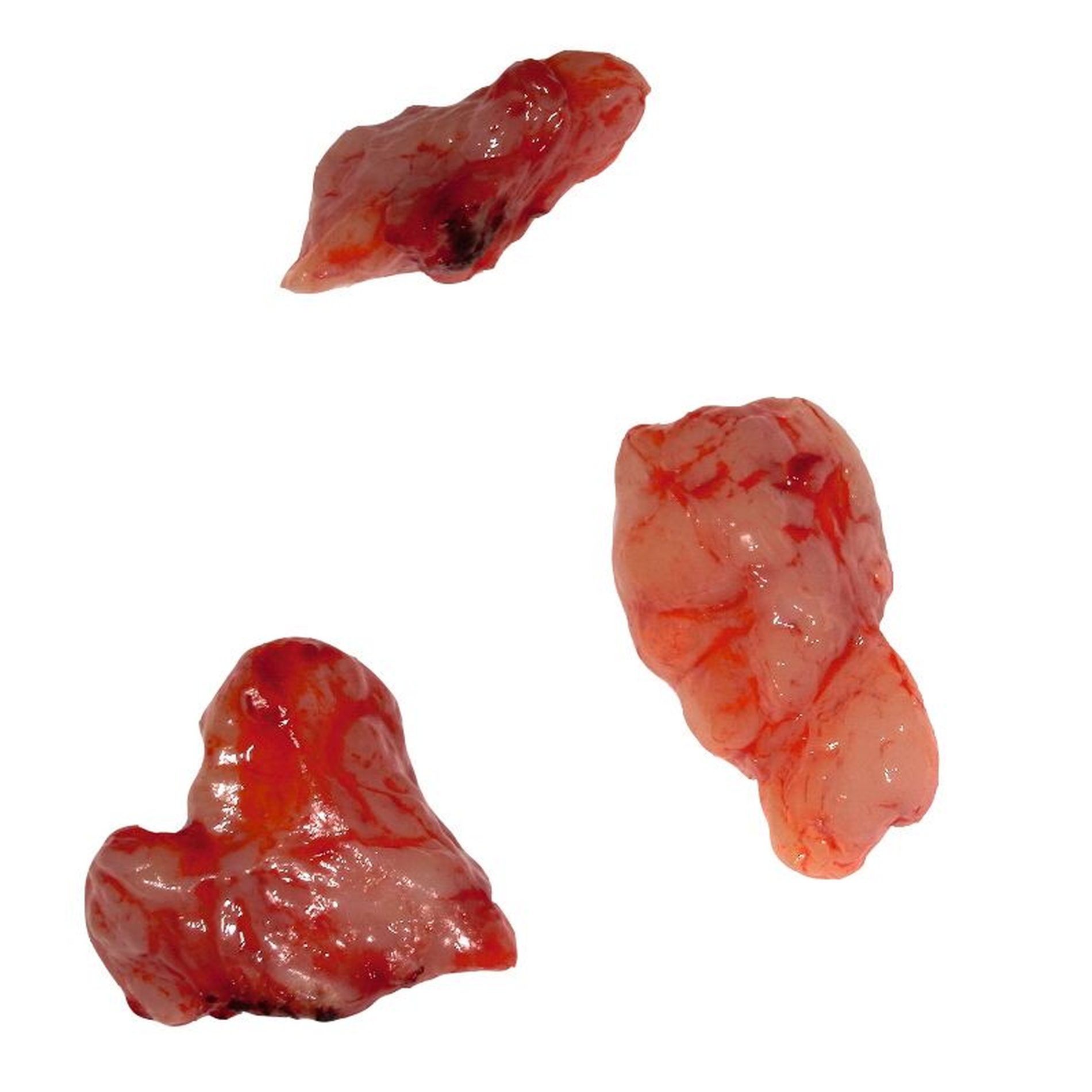
Nach der radiologischen und der klinischen Diagnostik wurde eine Probeexzision unter Lokalanästhesie durchgeführt. Die entnommene Gewebeprobe wurde zur histopathologischen Untersuchung ans zuständige pathologische Institut geschickt. So konnte die Diagnose multiples Myelom gestellt und eine entsprechende Therapie eingeleitet werden (Abbildung 4).
Therapie
Das multiple Myelom erfordert eine komplexe, auf den einzelnen Patienten zugeschnittene Behandlung. Anders als bei vielen Krebsarten steht nicht die chirurgische Entfernung des Tumors im Vordergrund, sondern eine Kombination aus medikamentösen Therapien, Immuntherapien und unterstützenden Maßnahmen. Diese zielen darauf ab, die Erkrankung unter Kontrolle zu bringen, die Symptome zu lindern und das Fortschreiten zu verlangsamen [Leitlinienprogramm Onkologie, 2022].
Die Behandlung beginnt typischerweise mit einer Induktionstherapie, bei der verschiedene Medikamente kombiniert werden. Dazu zählen Proteasom-Hemmer wie Bortezomib, die das „Recyclingsystem“ der Krebszellen blockieren, sowie Immunmodulatoren wie Lenalidomid, die das Immunsystem gegen die Myelomzellen aktivieren. Sie werden meist mit entzündungshemmenden Glukokortikoiden wie Dexamethason kombiniert, um die Wirkung der anderen Medikamente zu verstärken [Moreau et al., 2021]. Besonders bewährt hat sich die Dreifachkombination VRd (Bortezomib, Lenalidomid, Dexamethason), die bei vielen Patienten zu einer deutlichen Rückbildung der Erkrankung führt.
In den vergangenen Jahren haben zusätzliche Therapieoptionen wie der monoklonale Antikörper Daratumumab die Behandlungsergebnisse weiter verbessert, indem sie gezielt die Myelomzellen für das Immunsystem markieren [Soekojo und Chng, 2022]. Für jüngere Patienten in gutem Allgemeinzustand stellt die autologe Stammzelltransplantation nach der Induktionstherapie einen wichtigen Behandlungsschritt dar. Bei diesem Verfahren werden dem Patienten vor einer hochdosierten Chemotherapie eigene Stammzellen entnommen und später wieder zurückgegeben, um die Blutbildung zu beschleunigen.
Diese Methode kann die Zeit ohne Krankheitsfortschritt deutlich verlängern und gehört bei den geeigneten Patienten zum Standard [Attal et al., 2017; Rosiñol et al., 2019]. Besonders vielversprechend sind neuere immunbasierte Therapien wie bispezifische Antikörper (zum Beispiel Elranatamab) und CAR-T-Zelltherapien. Diese innovativen Ansätze sind selbst bei den Patientinnen und Patienten erfolgreich, bei denen andere Behandlungen nicht mehr wirken [Munshi et al., 2021].
Ein wesentlicher Bestandteil der Behandlung sind unterstützende Maßnahmen. Da das multiple Myelom häufig die Knochen angreift, kommen Bisphosphonate wie Zoledronat zum Einsatz, um Knochenbrüchen vorzubeugen. Bei stärkeren Knochenschäden können auch Strahlentherapien oder chirurgische Stabilisierungen notwendig werden [Rajkumar, 2022] – wie in diesem Patientenfall.
Die Zukunft der Myelombehandlung liegt in einer immer stärkeren Personalisierung der Therapie. Durch moderne Diagnoseverfahren und neue Medikamente können Behandlungen heute präziser auf den einzelnen Patienten abgestimmt werden als je zuvor. Dies ermöglicht vielen Betroffenen trotz der Erkrankung ein langes Leben mit guter Lebensqualität.
Die Patientin dieses Falls wurde mit Denosumab behandelt, dazu stellte sie sich vor der ersten Gabe erneut bei uns vor zur Fokussuche und Aufklärung über die Kautelen bei chirurgischen Interventionen unter antiresorptiver Therapie. Die Behandlung über die Hämatoonkologie konnte ambulant weitergeführt werden.
Diskussion
Das multiple Myelom ist eine maligne Erkrankung des Knochenmarks, die sich im oralen Bereich manifestieren kann. Die Neuerkrankungsrate liegt in Deutschland bei etwa 7,1/100.000 Frauen und 9/100.000 Männern und steigt mit dem Alter an [Zentrum für Krebsregisterdaten im Robert Koch-Institut, 2023]. Das multiple Myelom kann in verschiedene Subtypen unterteilt werden, ein Plasmozytom kann dabei – wie in diesem Fall – vorausgegangen sein.
Als Plasmozytom bezeichnet man eine solitäre Plasmazellvermehrung, die nicht mit systemischen Symptomen des multiplen Myeloms assoziiert ist, während das sekundäre Plasmozytom häufig als lokalisierte Manifestation eines bereits bestehenden multiplen Myeloms auftritt [Karunarathna et al., 2024]. Orale Plasmozytome, die als singuläre oder multiple Tumoren auftreten, sind meist asymptomatisch, was die Diagnose erschwert [Calloway et al., 2023; Karunarathna et al., 2024].
Das multiple Myelom ist eine klonale Plasmazellerkrankung, die durch die Produktion von monoklonalen Immunglobulinen gekennzeichnet ist und zu verschiedenen Endorganschäden führen kann, darunter Hyperkalzämie, Nierenfunktionsstörungen, Anämie und Knochenschmerzen mit lytischen Läsionen [Karunarathna et al., 2024]. Bei der Erkrankung breiten sich maligne transformierte Zellklone in den Knochen aus und verdrängen die für die Blutbildung verantwortlichen Stammzellen. Durch die Hemmung der Osteoblastenaktivität kann es zu Osteolysen um das Myelom kommen.
Orale Manifestationen des multiplen Myeloms treten bei bis zu 35 Prozent der Patienten auf. Sie betreffen meist den Kieferknochen, können aber auch das Weichgewebe einbeziehen oder singulär betreffen. Die orale Manifestation ist bei 14 Prozent der Betroffenen das erste Anzeichen der Erkrankung [Shah et al., 2010]. Im Kieferbereich können osteolytische Läsionen auftreten, die zu pathologischen Frakturen, Zahnverlust und/oder Schwellungen führen. Klinisch ähneln sie oft gutartigen Prozessen, was die Diagnosestellung erschwert. Besonders bei Patienten mit einer Vorgeschichte eines multiplen Myeloms sollte eine gründliche Untersuchung erfolgen, da eine orale Manifestation der erste Hinweis auf ein Rezidiv sein kann [Krishnan et al., 2024].
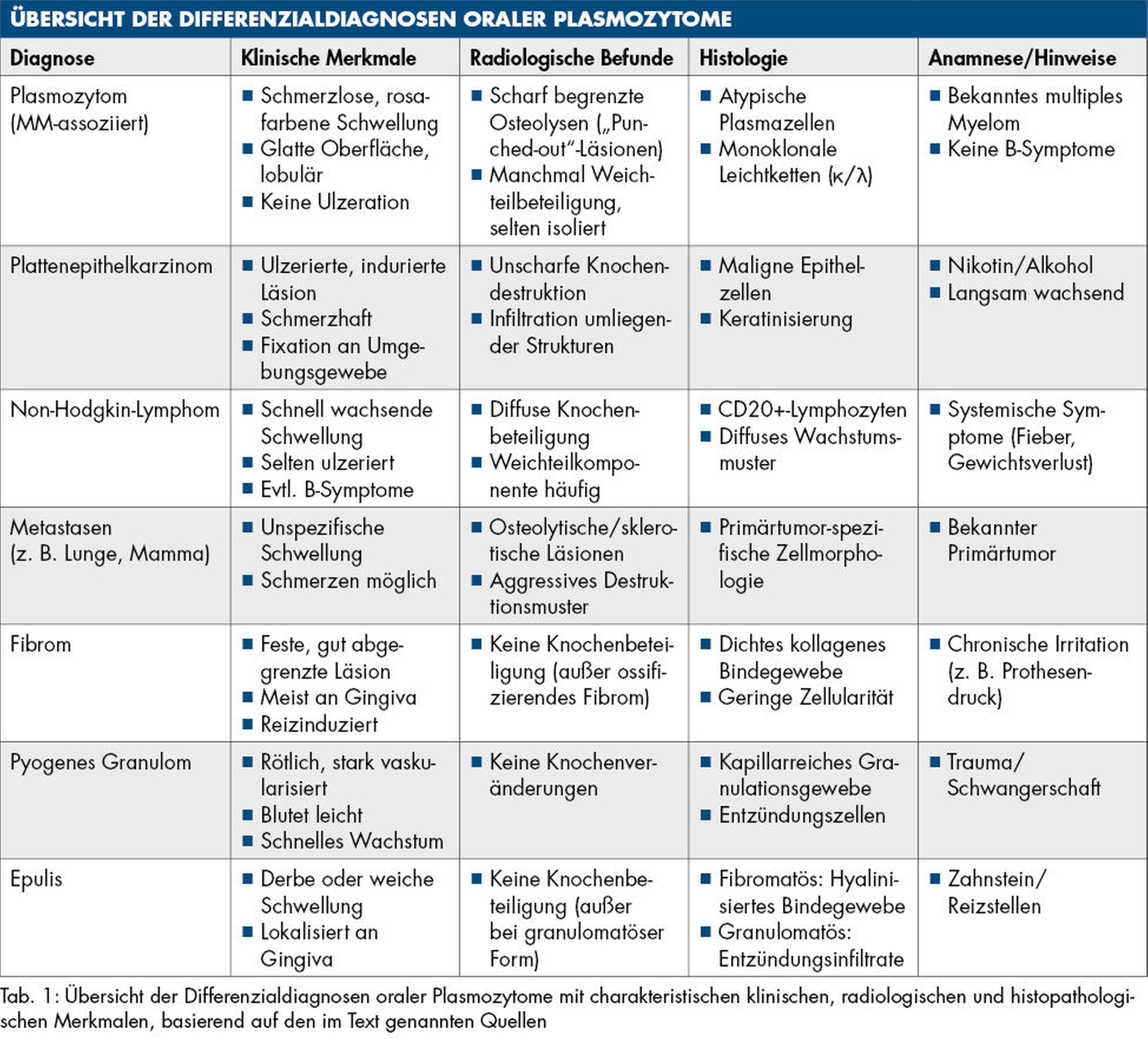
Aufgrund ihrer unspezifischen klinischen Erscheinung stellen Läsionen im oralen Bereich eine besondere diagnostische Herausforderung dar. Die Unterscheidung zwischen benignen und malignen Veränderungen erfordert eine sorgfältige Analyse verschiedener klinischer, radiologischer und anamnestischer Befunde. Für eine gesicherte Diagnosestellung ist in der Regel zusätzlich eine histopathologische Untersuchung erforderlich.
Maligne Differenzialdiagnosen
Mit einem Anteil von 90 Prozent ist das Plattenepithelkarzinom der häufigste maligne Tumor im oralen Bereich. Es tritt bevorzugt an der Zunge, am Mundboden oder am weichen Gaumen auf und präsentiert sich klinisch häufig als schmerzhafte, ulzerierte oder indurierte Läsion. Im Gegensatz zum meist asymptomatischen und nicht ulzerierten Plasmozytom weist das Plattenepithelkarzinom eine festere Konsistenz auf, infiltriert oftmals das umliegende Gewebe und kann in fortgeschrittenen Stadien mit Lymphknotenmetastasen einhergehen [Tan et al., 2023]. Radiologisch zeigt sich eine destruktive Knochenveränderung mit unscharf begrenzten Osteodestruktionen – ein wesentliches Unterscheidungsmerkmal zu den typischerweise scharf begrenzten Läsionen beim multiplen Myelom [Michcik et al., 2023; Straub et al., 2024]. In der Anamnese fallen beim Plattenepithelkarzinom häufig Risikofaktoren wie langjähriger Nikotin- und Alkoholkonsum auf, wohingegen beim Plasmozytom meist eine hämatologische Grunderkrankung oder ein bereits bekanntes multiples Myelom vorliegt.
Auch Non-Hodgkin-Lymphome (NHL), insbesondere diffuse großzellige B-Zell-Lymphome, können sich als orale Raumforderungen manifestieren. Sie sind meist schmerzlos und äußern sich typischerweise durch Schwellungen im Bereich der Gingiva oder des Kiefers [Faisal et al., 2023; Monteiro et al., 2024]. Ähnlich wie beim Plasmozytom kann auch hier eine Knochenbeteiligung vorliegen. Ein wichtiger Unterschied liegt jedoch in der möglichen systemischen Symptomatik (B-Symptome), die für das NHL typisch ist, beim Plasmozytom jedoch seltener beobachtet wird [von Baumgarten et al., 2018]. Die histopathologische Abgrenzung erfolgt durch den Nachweis lymphatischer Zellinfiltrate, während beim Plasmozytom atypische Plasmazellen dominieren [de Souza et al., 2023].
Trotz ihrer Seltenheit (Inzidenz < 1 Prozent) sind orale Metastasen von Mamma-, Lungen-, Nieren- und Prostatakarzinomen als Differenzialdiagnose obligat zu erwägen [Lopes et al., 2023]. Klinisch sind sie meist unspezifisch, zeigen jedoch radiologisch oft ein aggressives Zerstörungsmuster des Knochens, das dem beim multiplen Myelom ähneln kann. Ein entscheidender Hinweis ergibt sich meist aus der Anamnese: Patienten mit bekannten Primärtumoren weisen häufig eine bereits diagnostizierte Grunderkrankung auf. Histologisch lassen sich Metastasen durch den Nachweis von Tumorzellen des jeweiligen Primärtumors vom Plasmozytom unterscheiden. Die Therapie orientiert sich an der Grunderkrankung.
Benigne Differenzialdiagnosen
Zu den häufigsten gutartigen Veränderungen zählt das orale Fibrom. Es erscheint typischerweise als erhabene, feste Schwellung auf der Gingiva oder der Mundschleimhaut und ist zumeist durch chronisch-mechanische Reize wie Druckstellen von Prothesen bedingt. Klinisch kann ein Fibrom dem Plasmozytom ähneln, da beide Läsionen schmerzlos und gut abgegrenzt erscheinen. Radiologische Veränderungen sind nur bei der Sonderform des ossifizierenden Fibroms zu beobachten [Collins et al., 2023]. Histopathologisch zeigt sich beim Fibrom eine dichte fibröse Gewebematrix ohne das Vorhandensein atypischer Plasmazellen.
Ein weiterer benigner Befund ist das pyogene Granulom – eine reaktive, hyperplastische Läsion, die häufig durch eine lokale Irritation oder ein Trauma ausgelöst wird. Charakteristisch ist seine rötliche, stark vaskularisierte Erscheinung sowie eine ausgeprägte Blutungsneigung bei Berührung [Kamal et al., 2012]. Im Unterschied zum Plasmozytom ist das Granulom weicher, wächst schneller und zeigt sich radiologisch eher nicht mit Knochenveränderungen. Anamnestisch lässt sich häufig ein auslösender Faktor wie eine Zahnextraktion oder ein mechanisches Trauma feststellen. Histologisch imponiert es durch eine entzündlich-vaskuläre Gewebereaktion [Lomeli Martinez et al., 2023].
Epuliden – insbesondere fibromatöse und granulomatöse Formen – sind gutartige Wucherungen des Zahnfleischs, die typischerweise durch lokale Reize, beispielsweise Zahnstein oder schlechtsitzende Prothesen, verursacht werden [Sopiatin et al., 2023; Ünal et al., 2023]. Sie zeigen sich als erhabene, feste Massen und können klinisch einem Plasmozytom ähneln. Histologisch unterscheiden sich beide Formen deutlich: Die granulomatöse Variante weist eine entzündlich-fibröse Gewebshyperplasie auf, während die fibromatöse Form durch hyalinisiertes Fibrokollagen-Bindegewebe und ein lymphozytäres Infiltrat gekennzeichnet ist.
Folgen einer späten Diagnose
Das Erkennen eines Plasmozytoms als orale Manifestation des multiplen Myeloms ist entscheidend für die Prognose des Patienten. Eine verzögerte Diagnose kann zur Progression der Erkrankung und zu einer Verschlechterung der systemischen Kontrolle führen. Darüber hinaus können die Zerstörung des Knochens und die Ausbreitung des Tumors zu schwerwiegenden lokalen Komplikationen wie pathologischen Frakturen, schweren Infektionen oder ausgedehnten Weichteildefekten führen [Leitlinienprogramm Onkologie, 2022; Niels et al., 2014].
Fazit für die Praxis
Das multiple Myelom ist eine maligne Erkrankung des Knochenmarks, die sich bei etwa einem Drittel der Betroffenen auch im oralen Bereich manifestiert.
Therapeutisch steht – anders als bei vielen anderen Krebsarten – nicht die chirurgische Entfernung des Tumors im Vordergrund, sondern eine Kombination aus medikamentösen Therapien, Immuntherapien und unterstützenden Maßnahmen.
Bei etwa jedem siebten Betroffenen sind orale Manifestationen das erste Anzeichen der Erkrankung.
Bei unklaren oralen Befunden – insbesondere bei Patienten mit onkologischer Vorgeschichte – ist eine gründliche Diagnostik notwendig, die frühzeitige Diagnose des multiplen Myeloms kann die Prognose entscheidend verbessern.
Eine interdisziplinäre Zusammenarbeit sollte immer in Betracht gezogen werden, um potenziell lebensbedrohliche Erkrankungen frühzeitig zu erkennen.
Zur Therapie eines multiplen Myeloms werden häufig auch Bisphosphonate eingesetzt, weshalb die Medikamentenanamnese bei Patienten mit multiplem Myelom besonders wichtig ist.
In Fällen, in denen die Diagnose zu spät gestellt wird, kann die systemische Tumorlast zunehmen, was die Behandlung erschwert und die Überlebensrate reduziert. Eine frühzeitige Diagnose hingegen ermöglicht die schnelle Einleitung einer systemischen Therapie, die die Progression der Erkrankung verlangsamen und die Lebensqualität des Patienten deutlich verbessern kann [Engelhardt et al., 2024].
Literaturliste
Attal, M., Lauwers-Cances, V., Hulin, C., Leleu, X., Caillot, D., Escoffre, M., Arnulf, B., Macro, M., Belhadj, K., Garderet, L., Roussel, M., Payen, C., Mathiot, C., Fermand, J. P., Meuleman, N., Rollet, S., Maglio, M. E., Zeytoonjian, A. A., Weller, E. A., . . . Moreau, P. (2017). Lenalidomide, Bortezomib, and Dexamethasone with Transplantation for Myeloma. New England Journal of Medicine, 376(14), 1311-1320. doi.org/doi:10.1056/NEJMoa1611750.
Calloway, R., Westmark, N. L. W., & Ciarrocca, K. (2023). Plasmacytoma: A Rare Oral Complication of Multiple Myeloma. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 136(5), e161-e162. doi.orghttps://doi.org/10.1016/j.oooo.2023.07.025.
Collins, L., Zegalie, N., Sassoon, I., & Speight, P. (2023). A clinical, radiological and histopathological review of 74 ossifying fibromas. Head and neck pathology, 17(2), 433-446.
de Souza, L. L., Vargas, P. A., Andrade, B. A. B. D. E., Pires, F. R., Soares, C. D., Pontes, H. A. R., & Almeida, O. P. D. E. (2023). PLASMACYTOMA AND PLASMA CELL MYELOMA AFFECTING THE JAWS: A MULTI-INSTITUTIONAL COLLABORATIVE STUDY. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 136(1), e38. doi.orghttps://doi.org/10.1016/j.oooo.2023.03.093.
Engelhardt, M., Kortüm, K. M., Goldschmidt, H., & Merz, M. (2024). Functional cure and long-term survival in multiple myeloma: how to challenge the previously impossible. Haematologica, 109(8), 2420.
Faisal, M., Mariyam, R., Krishna, J., & Basheer, B. (2023). A rare case of high-grade non-Hodgkin’s lymphoma with oral and multiple extranodal manifestations. National Journal of Maxillofacial Surgery, 14(1), 147-151. doi.org/10.4103/njms.njms_497_21.
Heimes, D., & Kämmerer, P. W. (2022). Der osteolytische Prozess im Unterkiefer – Differenzialdiagnose Plasmozytom. zm-online, 01/2022. www.zm-online.de/artikel/2022/impfen-in-der-praxis/der-osteolytische-prozess-im-unterkiefer-differenzialdiagnose-plasmozytom.
Kamal, R., Dahiya, P., & Puri, A. (2012). Oral pyogenic granuloma: Various concepts of etiopathogenesis. Journal of oral and maxillofacial pathology, 16(1), 79-82.
Karunarathna, I., Gunawardana, K., Aluthge, P., & De Alvis, K. (2024). Understanding multiple myeloma: Diagnosis, clinical presentation, and management. In: ResearchGate. www. researchgate. net/publication/383271775.
Krishnan, P., Narayan, M., Divya, B., Dinesh Kumar, T., Ramesh Kumar, A., & Krishnan, R. (2024). Oral manifestations of multiple myeloma – A systematic review. Oral Oncology Reports, 10, 100485. doi.orghttps://doi.org/10.1016/j.oor.2024.100485.
Leitlinienprogramm Onkologie. (2022). Diagnostik, Therapie und Nach-sorge für Patienten mit monoklonaler Gammopathie unklarer Signifikanz (MGUS) oder Multiplem Myelom, Langversion 1.0, 2022, AWMF-Registernummer: 018/035OL www.leitlinienprogramm-onkologie.de/leitlinien/multiples-myelom/ Zugegriffen am 03.10.2024.
Lomeli Martinez, S. M., Carrillo Contreras, N. G., Gómez Sandoval, J. R., Zepeda Nuño, J. S., Gomez Mireles, J. C., Varela Hernández, J. J., Mercado-González, A. E., Bayardo González, R. A., & Gutiérrez-Maldonado, A. F. (2023). Oral Pyogenic Granuloma: A Narrative Review. International Journal of Molecular Sciences, 24(23), 16885. www.mdpi.com/1422-0067/24/23/16885.
Lopes, A. M., Freitas, F., Vilares, M., & Caramês, J. (2023). Metastasis of malignant tumors to the oral cavity: Systematic review of case reports and case series. Journal of Stomatology, Oral and Maxillofacial Surgery, 124(1, Supplement), 101330. doi.orghttps://doi.org/10.1016/j.jormas.2022.11.006.
Michcik, A., Polcyn, A., Garbacewicz, Ł., Wach, T., Sikora, M., Bień, M., & Drogoszewska, B. (2023). Efficacy of Computed Tomography and Magnetic Resonance Imaging in the Assessment of Depth of Invasion in Oral Squamous Cell Carcinoma: Analysis of 125 Clinical Cases. Diagnostics, 13(23), 3578. www.mdpi.com/2075-4418/13/23/3578.
Monteiro, B. L. K., Silva, M. C. P., Costa, G. L., Farias, J. S. d. H., Zanferrari, F. L., Schussel, J. L., & Sassi, L. M. (2024). ORAL MANIFESTATION OF NON-HODGKIN LYMPHOMA - THE ROLE OF THE DENTAL SURGEON IN DIAGNOSIS: A CASE REPORT. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 137(6), e260-e261. doi.orghttps://doi.org/10.1016/j.oooo.2023.12.543.
Moreau, P., Kumar, S. K., San Miguel, J., Davies, F., Zamagni, E., Bahlis, N., Ludwig, H., Mikhael, J., Terpos, E., Schjesvold, F., Martin, T., Yong, K., Durie, B. G. M., Facon, T., Jurczyszyn, A., Sidana, S., Raje, N., van de Donk, N., Lonial, S., . . . Richardson, P. G. (2021). Treatment of relapsed and refractory multiple myeloma: recommendations from the International Myeloma Working Group. The Lancet Oncology, 22(3), e105-e118. doi.org/10.1016/S1470-2045(20)30756-7.
Munshi, N. C., Anderson, L. D., Shah, N., Madduri, D., Berdeja, J., Lonial, S., Raje, N., Lin, Y., Siegel, D., Oriol, A., Moreau, P., Yakoub-Agha, I., Delforge, M., Cavo, M., Einsele, H., Goldschmidt, H., Weisel, K., Rambaldi, A., Reece, D., . . . San-Miguel, J. (2021). Idecabtagene Vicleucel in Relapsed and Refractory Multiple Myeloma. New England Journal of Medicine, 384(8), 705-716. doi.org/doi:10.1056/NEJMoa2024850.
Niels, W. C. J. v. d. D., Antonio, P., Hans Erik, J., Monika, E., Francesca, G., Henrik, G., Roman, H., Martina, K., Heinz, L., Gareth, M., Pellegrino, M., Torben, P., Orhan, S., Evangelos, T., Anders, W., Sonja, Z., Hermann, E., Pieter, S., & Henk, M. L. (2014). The clinical relevance and management of monoclonal gammopathy of undetermined significance and related disorders: recommendations from the European Myeloma Network. Haematologica, 99(6), 984-996. doi.org/10.3324/haematol.2013.100552.
Rajkumar, S. V. (2022). Multiple myeloma: 2022 update on diagnosis, risk stratification, and management. Am J Hematol, 97(8), 1086-1107. doi.org/10.1002/ajh.26590.
Rosiñol, L., Oriol, A., Rios, R., Sureda, A., Blanchard, M. J., Hernández, M. T., Martínez-Martínez, R., Moraleda, J. M., Jarque, I., Bargay, J., Gironella, M., de Arriba, F., Palomera, L., González-Montes, Y., Martí, J. M., Krsnik, I., Arguiñano, J. M., González, M. E., González, A. P., . . . Bladé, J. (2019). Bortezomib, lenalidomide, and dexamethasone as induction therapy prior to autologous transplant in multiple myeloma. Blood, 134(16), 1337-1345. doi.org/10.1182/blood.2019000241.
Shah, A., Ali, A., Latoo, S., & Ahmad, I. (2010). Multiple Myeloma presenting as Gingival mass. Journal of Maxillofacial and Oral Surgery, 9, 209-212.
Soekojo, C. Y., & Chng, W. J. (2022). Treatment horizon in multiple myeloma. Eur J Haematol, 109(5), 425-440. doi.org/10.1111/ejh.13840.
Sopiatin, S., Hendiani, I., Komara, I., Metta, P., Prasetyo, B. C., & Bawono, C. A. (2023). Removal of Fibromatous Epulis Around The Anterior Maxillary Teeth (Case Report). Cakradonya Dental Journal, 15(2), 93-97.
Straub, A., Linz, C., Lapa, C., Hartmann, S., Kübler, A. C., Müller-Richter, U. D., Faber, J., Bley, T., Brumberg, J., & Kertels, O. (2024). Performance of cone-beam computed tomography (CBCT) in comparison to conventional computed tomography (CT) and magnetic resonance imaging (MRI) for the detection of bone invasion in oral squamous cell cancer (OSCC): a prospective study. BMC Oral Health, 24(1), 341.
Tan, Y., Wang, Z., Xu, M., Li, B., Huang, Z., Qin, S., Nice, E. C., Tang, J., & Huang, C. (2023). Oral squamous cell carcinomas: state of the field and emerging directions. International Journal of Oral Science, 15(1), 44. doi.org/10.1038/s41368-023-00249-w.
Ünal, S. Y., Keser, G., Pekiner, F. M. N., & Olgaç, N. V. (2023). A case of epulis granulomatosa with clinical and radiological findings resembling langerhans cell histiocytosis. Eurasian Dental Research, 1(2), 47-50.
von Baumgarten, L., Illerhaus, G., Korfel, A., Schlegel, U., Deckert, M., & Dreyling, M. (2018). The Diagnosis and Treatment of Primary CNS Lymphoma. Dtsch Arztebl International, 115(25), 419-426. www.aerzteblatt.de/int/article.asp.
Zentrum für Krebsregisterdaten im Robert Koch-Institut (RKI). (2023). Krebs in Deutschland für 2019/2020. RKI und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V.