Mundschleimhautdiagnostik mit künstlicher Intelligenz
Mundschleimhautveränderungen sind ein häufiges klinisches Problem und reichen von spontanen und schnell abklingenden Befunden bis zu malignen Tumoren. Die Prävalenz von Mundschleimhautveränderungen wird in der Allgemeinbevölkerung auf 4,9 bis 21 Prozent geschätzt [Rokshad et al., 2024]. Relevant sind insbesondere Vorläuferläsionen von Mundhöhlenkarzinomen, zu denen vor allem Leukoplakien, Erythroplakien und oraler Lichen planus zählen. Je nach Entität variieren die Transformationsraten zwischen ein bis zwei Prozent bei Lichen planus und 30 bis 50 Prozent bei Erythroplakie [Warnakulasuriya, 2020].
Die präzise Diagnostik von Vorläuferläsionen und Mundhöhlenkarzinomen ist entscheidend für Patientinnen und Patienten, da die Fünf-Jahres-Überlebensrate bis zu 90 Prozent bei früher Diagnose und Therapie beträgt und oft unter 50 Prozent in späten Stadien fällt [Coca-Pelaz et al., 2017]. In Deutschland wird die Mehrzahl der Mundhöhlenkarzinome in späten Stadien diagnostiziert und behandelt [Robert Koch-Institut, 2023].
Neue zm-Serie „KI für die Zahnmedizin“
Der 2019 innerhalb der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde (DGZMK) gegründete Arbeitskreis „Artificial Intelligence in Dental Medicine“ (AIDM) beschäftigt sich mit den Chancen und Limitationen von KI in der zahnärztlichen Praxis. In unserer neuen Serie „KI für die Zahnmedizin“ beleuchten Mitglieder des AIDM die neuesten Ergebnisse und Erkenntnisse.
Wie läuft die Diagnose aktuell?
Die Diagnostik von Mundschleimhautveränderungen erfolgt primär durch die klinische Inspektion und Palpation. Auffällige Befunde werden zur Sicherung histopathologisch abgeklärt, was den Goldstandard darstellt [Speight et al., 2018]. Die diagnostische Genauigkeit der visuellen Inspektion ist begrenzt und die Unterscheidung von benignen und potenziell malignen Läsionen häufig nicht leicht. Spezialisten für orale Medizin erreichen höhere diagnostische Genauigkeiten, sind aber nicht flächendeckend verfügbar.
Die Herausforderung besteht darin, dass Vorläuferläsionen oft unspezifisch erscheinen, während sich entzündliche Läsionen visuell nur schwer von malignen Veränderungen differenzieren lassen. Der gezielte Einsatz von Biopsien und histopathologischen Untersuchungen wird dadurch erschwert. Deren präziser Einsatz durch eine klinische Vorselektion könnte die Früherkennung und damit den Krankheitsverlauf für Patienten verbessern.
Wie kann KI die Früherkennung unterstützen?
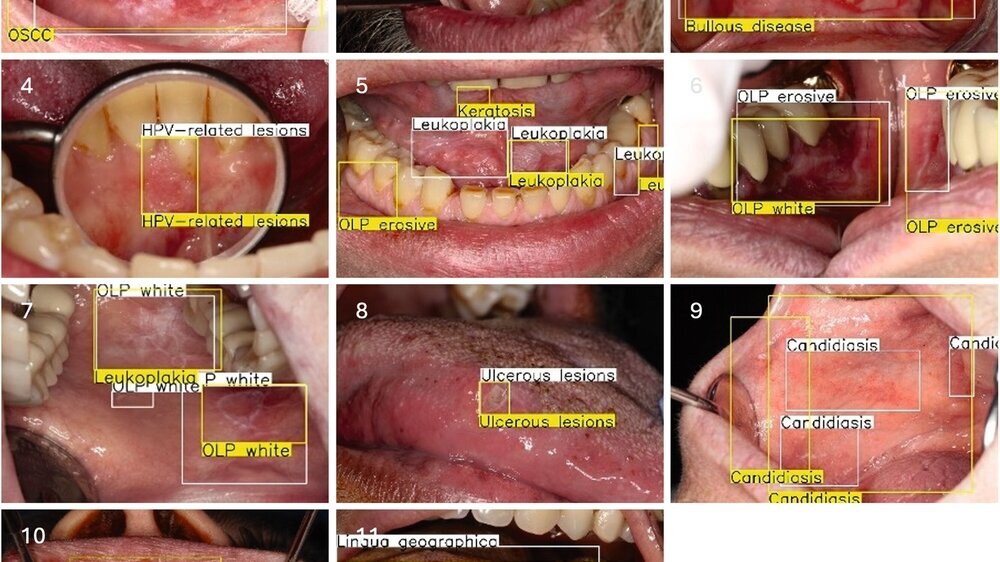
KI bietet die Möglichkeit, Zahnärztinnen und Zahnärzte bei der Früherkennung von Mundschleimhautveränderungen zu unterstützen. Insbesondere Deep-Learning-Ansätze, meist in Form von sogenannten Convolutional Neural Networks (CNN) oder Vision Transformer-basierten Modellen werden auf Fotografien der Mundschleimhaut angewandt [Rokshad et al., 2024; Vinayahalingam et al., 2024]. KI–Algorithmen übernehmen dabei folgende Aufgaben:
Klassifikation: Zuweisung eines Bildes zu einer Prädiktion
Objekterkennung: Lokalisierung einer Läsion in einem Bild
Segmentierung: Pixelgenaue Abgrenzung einer Läsion vom umgebenden Gewebe
Die meisten Systeme lernen anhand annotierter Datensätze, Muster in Bildern zu erkennen. Dieses Training erfordert sorgfältig selektierte Bilder und Befunde. Die Herausforderung der Erstellung zuverlässiger Bilddatensätze trifft auf die Anforderung, dass möglichst viele und vielfältige Trainingsdaten benötigt werden, um robuste Algorithmen zu trainieren. Das Potenzial der KI bei der Diagnostik von Mundschleimhauterkrankungen ist klar. Während Menschen bei der Diagnostik ermüden und einem subjektiven Bias unterliegen, liefern Algorithmen standardisierte Ergebnisse.
Wie genau diagnostiziert KI?
Eine aktuelle Übersichtsarbeit konnte 36 Studien berücksichtigen und zeigte in der gepoolten Metaanalyse folgende Ergebnisse [Rokhshad et al., 2024]:
Vorläuferläsionen: Sensitivität 91 Prozent, Spezifität 94 Prozent
Mundhöhlenkarzinome: Sensitivität 90 Prozent, Spezifität 92 Prozent
Im Vergleich dazu erreichen Zahnärzte ohne KI-Unterstützung eine Genauigkeit zwischen 61 und 98 Prozent. In diesem Zusammenhang muss allerdings erwähnt werden, dass die Ergebnisse sehr stark schwanken und von der Größe des Datensatzes, der Modellarchitektur und dem Referenzstandard abhängig sind.
Die meisten Systeme werden aktuell für die Aufgabe trainiert, eine oder mehrere klar definierte Mundschleimhautveränderungen zu detektieren. Im Unterschied zum Vorgehen der menschlichen Diagnostik, ist die Abgrenzung von Differenzialdiagnosen und deren Definition häufig noch nicht Teil der Aufgabe. Eine kürzlich veröffentlichte Studie, die diese Differenzialdiagnostik im Fokus hatte, demonstriert die Schwierigkeiten bei der Abgrenzung der verschiedenen Läsionen: Allgemeinzahnärzte erreichten bei der Einteilung der Läsionen in elf verschiedene Diagnoseklassen nur eine Genauigkeit von 41 Prozent, Spezialisten von 59 Prozent und die entwickelte KI von 62 Prozent [Schwärzler et al., 2025].
Was sind die offenen Fragen?
Externe Validierung: Die meisten Studien zu KI in der Mundschleimhautdiagnostik sind retrospektiv und basieren sowohl für das Training als auch für die Validierung auf ausgewählten Bilddatensätzen. Prospektive Studien unter Alltagsbedingungen fehlen weitgehend.
Bias und Standardisierung: Viele Studien haben ein hohes Risiko für systematische Verzerrungen. Unterschiedliche Referenzstandards (klinisch vs. histologisch) und geringe Transparenz bei der Datenerhebung erschweren die Vergleichbarkeit der Ergebnisse.
Integration in den klinischen Alltag: KI-Systeme sind aktuell noch nicht in den klinischen Alltag integriert. Diese Integration könnte zukünftig in einer Screening-App, als Telemedizinanwendung oder integriert in bildgebende Geräte verfügbar gemacht werden.
Auswirkungen auf Patienten: Bisher ist noch nicht nachgewiesen, dass der Einsatz von KI-Systemen die Überlebensraten von Patienten mit Mundhöhlenkarzinomen verbessert beziehungsweise die Anzahl unnötiger Biopsien senkt. Ein durch den Innovationsfonds des G-BA gefördertes Projekt geht diesen Fragen allerdings zurzeit nach. Mehr Informationen dazu unter innovationsfonds.g-ba.de/projekte/versorgungsforschung/kids.535.
Schlussfolgerungen
Die Diagnostik von Mundschleimhautveränderungen stellt Zahnärztinnen und Zahnärzte vor erhebliche Herausforderungen. Während Spezialisten relativ hohe diagnostische Genauigkeiten erzielen, ist die Diagnosesicherheit in der Breite begrenzt. KI-Systeme haben in Studien hohe Genauigkeiten erreicht und könnten Zahnärzte bei der frühzeitigen Erkennung von Vorläuferläsionen und malignen Veränderungen unterstützen.
Die bisherigen Ergebnisse sind überwiegend experimentell. Für eine klinische Implementierung sind prospektive, praxisnahe Studien erforderlich. Neben den diagnostischen Genauigkeiten sollten auch patientenrelevante Endpunkte wie Überlebensraten und die Lebensqualität erfasst werden.
Literaturliste
Coca-Pelaz, A. et al. Head and Neck Cancer: A Review of the Impact of Treatment Delay on Outcome. Adv. Ther. 35, 153–160 (2018).
Robert-Koch-Institut. Krebs in Deutschland. www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2023/kid_2023_c00_c14_mundhoehle_rachen.pdf.
Rokhshad, R. et al. Artificial intelligence for classification and detection of oral mucosa lesions on photographs: a systematic review and meta-analysis. Clin. Oral Investig. 28, 88 (2024).
Schwärzler, J. et al. Machine learning versus clinicians for detection and classification of oral mucosal lesions. J. Dent. 161, 105992 (2025).
Speight, P. M., Khurram, S. A. & Kujan, O. Oral potentially malignant disorders: risk of progression to malignancy. Oral Surg., Oral Med., Oral Pathol. Oral Radiol. 125, 612–627 (2018).
Vinayahalingam, S. et al. Advancements in diagnosing oral potentially malignant disorders: leveraging Vision transformers for multi-class detection. Clin. Oral Investig. 28, 364 (2024).
Warnakulasuriya, S. Oral potentially malignant disorders: A comprehensive review on clinical aspects and management. Oral Oncol 102, 104550 (2020).